不同氮和磷培养条件下等鞭金藻的生长、磷吸收和油脂品质的分析
2016-02-16余世金申晓菲曾建雄
余世金, 胡 昊, 申晓菲, 曾建雄,①
(1. 安庆师范大学资源环境学院, 安徽 安庆 246133; 2. 中国科学技术大学化学与材料科学学院, 安徽 合肥 230026)
不同氮和磷培养条件下等鞭金藻的生长、磷吸收和油脂品质的分析
余世金1,2, 胡 昊2, 申晓菲2, 曾建雄2,①
(1. 安庆师范大学资源环境学院, 安徽 安庆 246133; 2. 中国科学技术大学化学与材料科学学院, 安徽 合肥 230026)
为探索不同水平N和P对等鞭金藻(IsochrysisgalbanaParke)产量及油脂品质的影响,在富N(80.00 mg·L-1NO3--N)和无N(0.00 mg·L-1NO3--N)条件下设置富P、 限P和无P(20.00、0.25和0.00 mg·L-1PO43--P)共6组培养基,对培养10 d时等鞭金藻的藻体质量浓度、P吸收量、总脂肪酸质量分数和脂肪酸产率变化、13个脂肪酸组分及其质量分数以及EPA和DHA的相对含量和产量进行了比较分析。结果显示:在富N培养基中,等鞭金藻藻体质量浓度的增幅明显高于无N培养基且按培养基中P质量浓度从高到低依次降低。总体上看,随培养时间延长,等鞭金藻的总脂肪酸质量分数持续升高,且在富N培养基中总脂肪酸质量分数高于无N培养基;其中,富N限P和富N无P培养基中的总脂肪酸质量分数基本上均高于富N富P培养基。富N培养基中各脂肪酸组分的质量分数大体上高于无N培养基,且限P培养基中各脂肪酸组分的质量分数大体上高于富P和无P培养基。在富N富P培养基中1 L藻体的P吸收量最高(0.014 8 mg),并且吸收的P绝大部分被贮存在藻体中,而在无N富P培养基中P吸收量明显降低(0.009 8 mg)。在富N富P培养基中,饱和脂肪酸质量分数和相对含量及EPA相对含量和产量均最低,但DHA相对含量和产量则最高。在富N限P培养基中,等鞭金藻的EPA产量和脂肪酸产率均最高,其DHA产量也较高;5种优质脂肪酸组分(即C18∶1n9c、C16∶0、C14∶0、C18∶0和C16∶1n9)的总相对含量达到65.86%,尤其是C18∶1n9c,其相对含量高达28.19%。综合分析结果显示:富N培养基有利于等鞭金藻的生长、P吸收及脂肪酸积累,其中,富N限P培养基是等鞭金藻高产且产优质油脂的适宜培养基。此外,等鞭金藻不但是生产生物柴油的优质资源而且是生产DHA和清除废水中P的潜在生物资源。
等鞭金藻; 氮和磷水平; 微藻生长; 磷吸收; 油脂产量; 脂肪酸组分
生物油脂经过甲基化可转变成多种生物燃料[1],为世界公认的可再生能源。微藻广泛分布于陆地和海洋,部分微藻种类的油脂含量较高,是生产第三代生物柴油的资源之一[2]。为了提高生物柴油的产量并降低生产成本,应尽快筛选出油脂含量高的藻株并探索出提高微藻生物量和油脂含量的培养方法。
相关研究结果表明:在高温、强光、高盐、低氮(N)或低磷(P)条件下,微藻的油脂含量升高,但其生物量却明显下降,致使其产油率增幅不大甚至下降[3-6]。Chu等[7-8]的研究结果表明:在无N富P条件下培养14 d,小球藻(ChlorellavulgarisBeij.)的日均产油率是富N富P条件下的1.35倍;在无N富P条件下培养16 d,斜生栅藻(ScenedesmusobliquusKütz.)的日均产油率约是富N富P条件下的2.00倍,并据此认为“N缺乏-P充足”是这2种微藻油脂合成的真正“触发器”,与Khozin-Golberg等[9]的观点“N缺乏是微藻油脂合成的触发器”明显不同。此外,Chu等[7]的研究结果显示,无N富P条件下小球藻的日均P吸收量是富N富P条件下的3.82倍。采用富营养化水体培育小球藻,可以同时实现提高其产油率和去除废水中P的双重目的,对小球藻的资源开发和水体P污染修复均具有重要意义。然而,尽管目前已知小球藻的这些特性,但由于微藻种类众多,有关其他微藻种类对环境P的作用尚未明确。
等鞭金藻(IsochrysisgalbanaParke)隶属金藻门(Chrysophyta),油脂含量高达22%~42%[10-11],是生产生物柴油的备选藻种[12]。微藻油脂中的C20∶5n3(EPA)和C22∶6n3(DHA)对人类心血管疾病和大脑发育等具有重要作用[13-14],在保健、医药、营养等领域越来越受到关注[9,15];等鞭金藻的EPA和DHA含量较高,已被作为生产EPA和DHA的备选藻种[16-17]。
鉴于此,作者设置富N和无N及不同P水平的培养条件,分析等鞭金藻的藻体质量浓度变化,并对培养基中的P质量浓度及主要脂肪酸组成和含量的变化进行比较研究,探明富N和无N条件下不同P水平对等鞭金藻产油状况的影响,以期筛选出适宜于等鞭金藻的培养条件,并为优质生物柴油资源的相关研究提供基础数据。
1 材料和方法
1.1 材料及培养条件
供试等鞭金藻购自上海光语科技发展有限公司。基础培养基为用人工海水配制的f/2培养基[18],其中,NaNO3、NaH2PO4·H2O、Na2SiO3·9H2O和微量元素母液均需在121 ℃条件下灭菌20 min,冷却后置于4 ℃冰箱中保存、备用;人工海水在使用前需在121 ℃条件下灭菌20 min;维生素母液经孔径0.22 μm滤膜过滤后置于4 ℃冰箱中保存、备用。
用橡胶塞密封的2 L三角烧瓶(橡胶塞打孔并插入2根玻璃管以通气)进行藻体培养,每瓶装入1 900 mL液体培养基, 培养时输入混合气体 〔V(空气)∶V(CO2)=50∶1〕,输气量为500 mL·min-1,气体经孔径0.22 μm的聚四氟乙烯滤头过滤;以功率40 W的飞利浦日光灯组作为光源,三角烧瓶距离灯管20 cm,光照度3 000~3 300 lx,光照时间14 h·d-1,培养温度(20±1) ℃,培养基pH 6.2~pH 6.8。
1.2 方法
1.2.1 实验设计 共设置6组培养基:富N富P(T1)、富N限P(T2)、富N无P(T3)、无N富P(T4)、无N限P(T5)、无N无P(T6)。根据预实验结果,设置富N为80.00 mg·L-1NO3--N、无N为0.00 mg·L-1NO3--N;富P为20.00 mg·L-1PO43--P、限P为0.25 mg·L-1PO43--P、无P为0.00 mg·L-1PO43--P。每个处理组均设置3次重复。由于本实验只对富N和无N条件下不同P水平等鞭金藻的产油状况进行比较,因此未设置对照。
1.2.2 接种及取样方法 接种体为在完全培养条件下培养至指数生长期的藻细胞,将藻液在20 ℃条件下5 000 r·min-1离心6 min,藻泥用人工海水清洗1次后于上述条件下再离心1次;每升培养液中接种干质量为85 mg的藻体。
供试等鞭金藻共培养10 d,在每日相同时间取样并测定相应指标。其中,藻体质量浓度和P吸收量每天测定1次,共取样测定10次;每隔1 d取样制备藻粉用于脂肪酸测定,各处理组均取样测定5次。
1.2.3 藻体质量浓度测定 采用“差重法”测定藻体质量浓度。将孔径0.45 μm的乙酸纤维素滤膜置于105 ℃烘干至恒质量,记为m0;取10 mL藻液,用真空过滤器过滤并于105 ℃烘干至恒质量,记为m1,根据公式“ρ=(m1-m0)/0.01”计算藻体的质量浓度(ρ)。每处理各重复均测定3个平行样品,结果取平均值。
1.2.4 P吸收量测定 根据预实验结果,分别取富P组(富N富P组和无N富P组)藻液约5 mL、限P组(富N限P组和无N限P组)藻液约30 mL,用孔径0.22 μm的无机滤头进行过滤以去除藻细胞,保留滤液。分别取富P组滤液各200 μL,用去离子水定容至25 mL;限P组滤液则直接用去离子水定容至25 mL;以去离子水作为空白对照,采用钼锑抗分光光度法[19]测定培养基中的P质量浓度,每个处理组重复测定2次。按照公式“ρP=ρPt-ρP(t+1)”计算每日培养基中P质量浓度的降幅(ρP),式中,ρP为培养基中的P质量浓度;t为培养时间。并且,按照公式“mP=ρP/ρ”计算1 L藻体的P吸收量(mP)。
1.2.5 脂肪酸组成及含量分析 参照Rodríguez-Ruiz等[20]的方法完成藻体的脂肪酸提取及甲基化过程。 称取约20 mg冷冻的干藻粉, 加入转甲基试剂 〔V(甲醇)∶V(乙酰氯)=9∶1〕,置于80 ℃恒温水浴反应2.5 h,冷却并加入0.1 mol·L-1NaCl溶液1 mL,再加入含0.5 g·L-1苯甲酸甲酯(内标)的正己烷2 mL,充分混匀后于3 000 r·min-1离心3 min,将上清液移到安捷伦气相小瓶中用于气相色谱分析。
用Agilent 6890N气相色谱仪(美国Agilent公司)进行检测。色谱条件:使用氢火焰离子化检测器,色谱柱为Supelco DB-FFAP毛细管柱(30 m×0.25 mm,0.25 μm);采取程序升温,于140 ℃保温2 min,再以10 ℃·min-1的速率升温至 240 ℃并保持2 min;进样口温度250 ℃,检测器温度300 ℃;载气为高纯氮气,流速45 mL·min-1;氢气流速40 mL·min-1,空气流速450 mL·min-1,分流比1∶10;进样量1 μL。
通过与苯甲酸甲酯标准品(美国Sigma-Aldrich公司)的保留时间进行对比鉴别各脂肪酸组分,利用各脂肪酸组分与内标的峰面积比、内标量、标线方程和藻粉质量计算各脂肪酸组分的质量分数,计算公式为:脂肪酸质量分数=〔(标线系数×峰面积比×内标量)/藻粉质量〕×100%,式中,峰面积比为待定脂肪酸峰面积与内标峰面积的比值。脂肪酸产率为每天1 L藻液生产的脂肪酸量, 计算公式为: 脂肪酸产率=〔(培养结束时藻体质量浓度×培养结束时藻体脂肪酸质量分数)-(接种藻体质量浓度×接种藻体脂肪酸质量分数)〕/培养时间。
1.3 数据统计及分析
采用EXCEL 2010和SPSS 18.0统计分析软件进行数据统计和分析。
2 结果和分析
2.1 不同质量浓度N和P培养基中等鞭金藻藻体质量浓度的变化
检测结果(图1)表明:在不同质量浓度N和P的培养基中培养10 d,富N培养基中等鞭金藻藻体的质量浓度增幅明显高于无N培养基;其中,在富N富P(80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)、富N限P(80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和富N无P(80.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基中藻体的质量浓度分别较培养初期增加740、 655和415 mg·L-1, 而无N富P (0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)、无N限P(0.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和无N无P(0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基中藻体的质量浓度分别较培养初期增加185、190和180 mg·L-1。
由图1还可以看出:富N条件下,等鞭金藻的藻体质量浓度按培养基中P质量浓度从高到低依次降低,即富N富P、富N限P、富N无P培养基的藻体质量浓度依次降低;而在无N培养基中不论P质量浓度如何变化藻体的质量浓度几乎无差异。
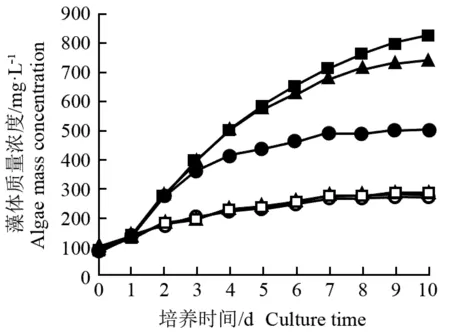
—■—: 富N富P培养基 N rich-P rich medium (80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); —▲—: 富N限P培养基 N rich-P limited medium (80.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); —●—: 富N无P培养基 N rich-P free medium (80.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P); —□—: 无N富P培养基 N free-P rich medium (0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); —△—: 无N限P培养基 N free-P limited medium (0.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); —○—: 无N无P培养基 N free-P free medium (0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P).
图1 不同质量浓度N和P培养基中等鞭金藻藻体质量浓度的变化
Fig. 1 Change in algae mass concentration ofIsochrysisgalbanaParke in media with different mass concentrations of N and P
2.2 富P和限P培养基中等鞭金藻P吸收量的变化
检测结果表明: 接种第1天, 富N限P (80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和无N限P(0.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)培养基中P质量浓度已低于检出限,说明培养基中的P已经全部被等鞭金藻吸收。然而,在富N富P(80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)和无N富P(0.00 mg·L-1NO3--N+20 mg·L-1PO43--P)培养基中培养10 d,培养基中P质量浓度降幅的变化趋势见图2。由图2可以看出:富N富P和无N富P培养基中P质量浓度的降幅持续增大,培养结束时富N富P和无N富P培养基中P质量浓度的降幅分别为12.20和2.65 mg·L-1, 并且前者极显著高于后者(P= 0.000 5)。根据上述藻体质量浓度计算出富N富P和无N富P培养基中1 L藻体的干质量分别为825和270 mg,据此计算出这2组培养基中1 L藻体的P吸收量分别为0.014 8和0.009 8 mg,且后者为前者的66.2%,可见无N条件下等鞭金藻对P的吸收能力明显下降。
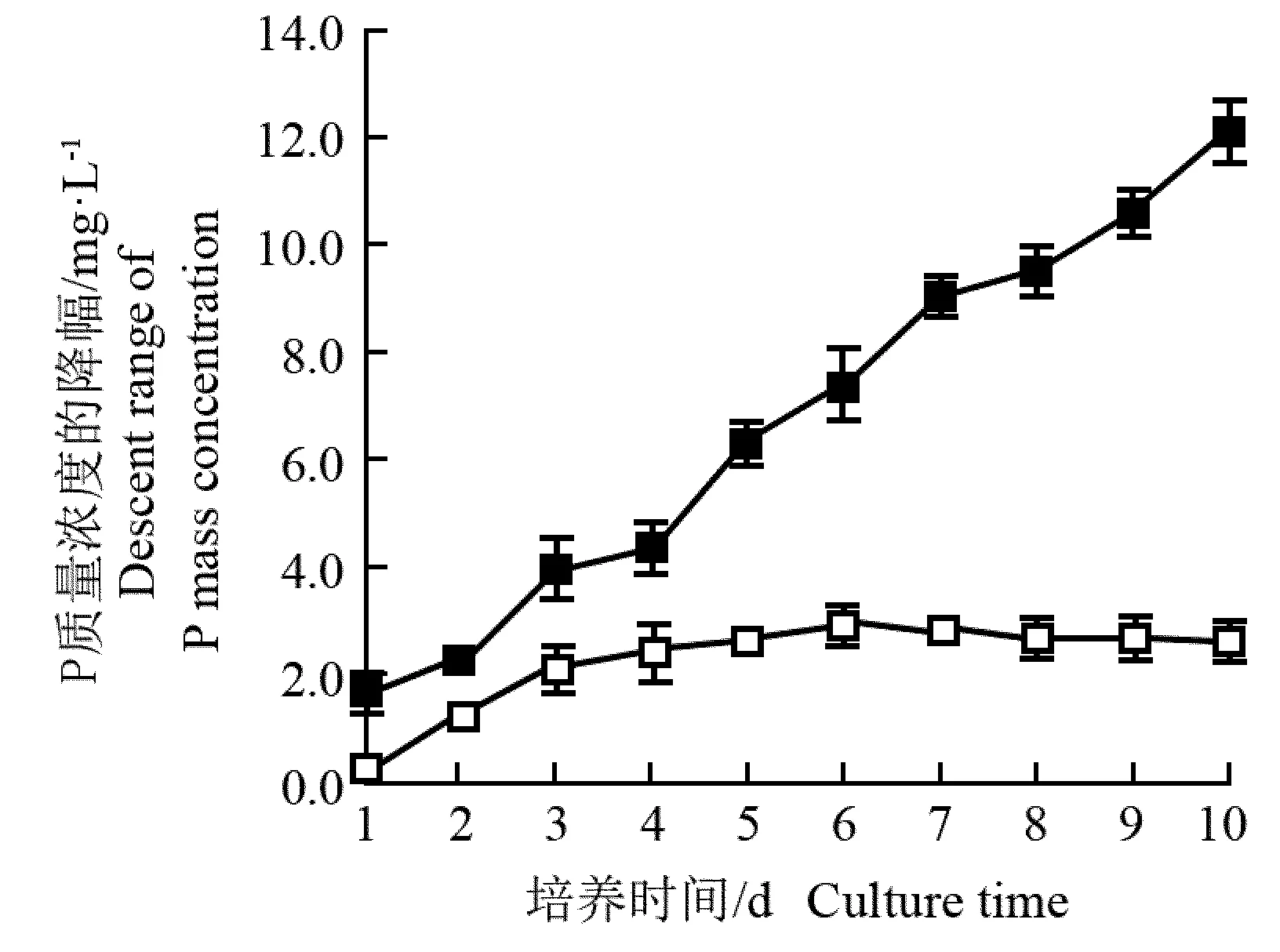
—■—: 富N富P培养基 N rich-P rich medium (80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); —□—: 无N富P培养基 N free-P rich medium (0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P).
图2 等鞭金藻培养期间富N富P和无N富P培养基中P质量浓度降幅的变化
Fig. 2 Change in descent range of P mass concentration in N rich-P rich and N free-P rich media during cultivation period ofIsochrysisgalbanaParke
2.3 在不同质量浓度N和P培养基中等鞭金藻脂肪酸质量分数的变化及其组成和产率的比较
2.3.1 总脂肪酸质量分数的变化 检测结果(图3)表明:在不同质量浓度N和P的培养基中培养10 d,随培养时间延长,除富N富P(80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)培养基外,其余5组培养基中等鞭金藻的总脂肪酸质量分数均呈持续升高的趋势;并且,培养6 d内,富N培养基中等鞭金藻的总脂肪酸质量分数高于无N培养基;培养6~10 d,富N限P(80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和富N无P(80.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基中等鞭金藻的总脂肪酸质量分数仍持续高于无N培养基,但富N富P培养基中等鞭金藻的总脂肪酸质量分数却降至无N培养基水平。

—■—: 富N富P培养基 N rich-P rich medium (80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); —▲—: 富N限P培养基 N rich-P limited medium (80.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); —●—: 富N无P培养基 N rich-P free medium (80.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P); —□—:无N富P培养基 N free-P rich medium (0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); —△—: 无N限P培养基 N free-P limited medium (0.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); —○—: 无N无P培养基 N free-P free medium (0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P).
图3 不同质量浓度N和P培养基中等鞭金藻总脂肪酸质量分数的变化
Fig. 3 Change in mass fraction of total fatty acids ofIsochrysisgalbanaParke in media with different mass concentrations of N and P
由图3还可以看出:在培养期内,在3组富N培养基中,限P和无P培养基中等鞭金藻的总脂肪酸质量分数总体上明显高于富P培养基,且以无P培养基为最高,各组培养基间差异较大;在3组无N培养基中,其总脂肪酸质量分数在限P培养基中最高、在无P培养基中最低,但在各组培养基间差异不明显。
2.3.2 脂肪酸组成及其质量分数的比较 检测结果(表1)表明:在不同质量浓度N和P培养基中培养10 d,不同处理组等鞭金藻藻体中13种常见脂肪酸(包括10种常见生物柴油脂肪酸和3种多不饱和脂肪酸)的质量分数存在明显差异;除C20∶0、C18∶3n3、C18∶4n3外,各处理组等鞭金藻藻体中其他10种脂肪酸的质量分数基本上均高于接种体。总体来看,在限P培养基中各脂肪酸组分的质量分数高于富P和无P培养基,且在富N培养基中各脂肪酸组分的质量分数大体上高于无N培养基。
由表1还可以看出:培养10 d时,除富N富P培养基外,其余5组培养基中质量分数较高的前3个脂肪酸组分均依次为C18∶1n9c、C16∶0、C14∶0,三者的总相对含量在富N限P培养基中最低(61.15%)、在富N无P培养基中最高(70.23%), 在无N富P、 无N限P和无N无P培养基中差异极小,分别为65.30%、 65.41%和65.24%。 限P条件下, 无N培养基中C18∶1n9c、C16∶0和C14∶0的总相对含量较富N培养基提高6.97%;而在无P条件下,无N培养基中三者的总相对含量则较富N培养基降低7.09%。
表1 在不同质量浓度N和P培养基中培养10 d等鞭金藻各脂肪酸组分质量分数的比较
Table 1 Comparison on mass fraction of different fatty acid compositions of Isochrysis galbana Parke cultured for 10 d in media with different mass concentrations of N and P
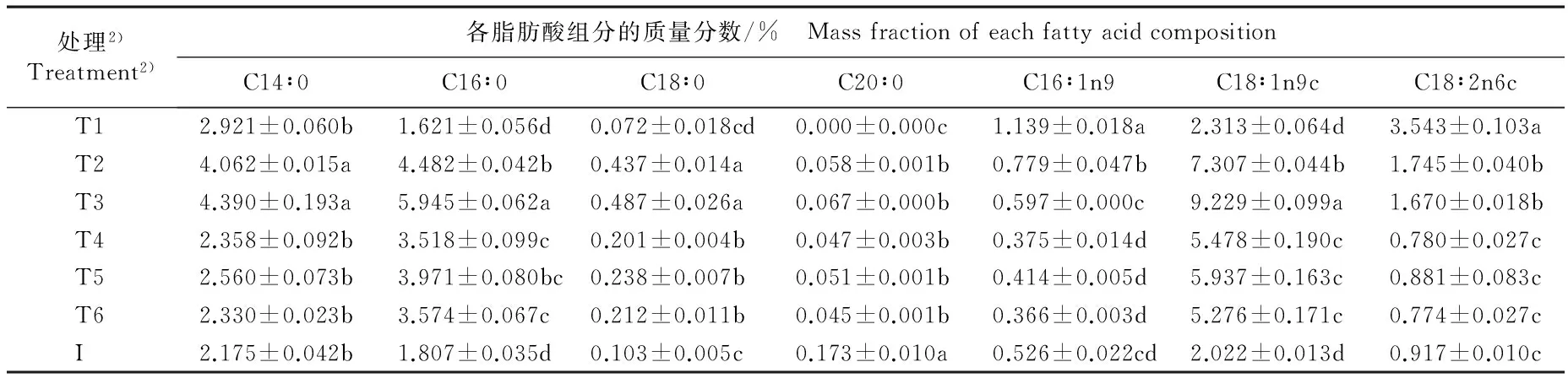
处理2)Treatment2)各脂肪酸组分的质量分数/% MassfractionofeachfattyacidcompositionC14∶0C16∶0C18∶0C20∶0C16∶1n9C18∶1n9cC18∶2n6c T12.921±0.060b1.621±0.056d0.072±0.018cd0.000±0.000c1.139±0.018a2.313±0.064d3.543±0.103a T24.062±0.015a4.482±0.042b0.437±0.014a0.058±0.001b0.779±0.047b7.307±0.044b1.745±0.040b T34.390±0.193a5.945±0.062a0.487±0.026a0.067±0.000b0.597±0.000c9.229±0.099a1.670±0.018b T42.358±0.092b3.518±0.099c0.201±0.004b0.047±0.003b0.375±0.014d5.478±0.190c0.780±0.027c T52.560±0.073b3.971±0.080bc0.238±0.007b0.051±0.001b0.414±0.005d5.937±0.163c0.881±0.083c T62.330±0.023b3.574±0.067c0.212±0.011b0.045±0.001b0.366±0.003d5.276±0.171c0.774±0.027c I2.175±0.042b1.807±0.035d0.103±0.005c0.173±0.010a0.526±0.022cd2.022±0.013d0.917±0.010c
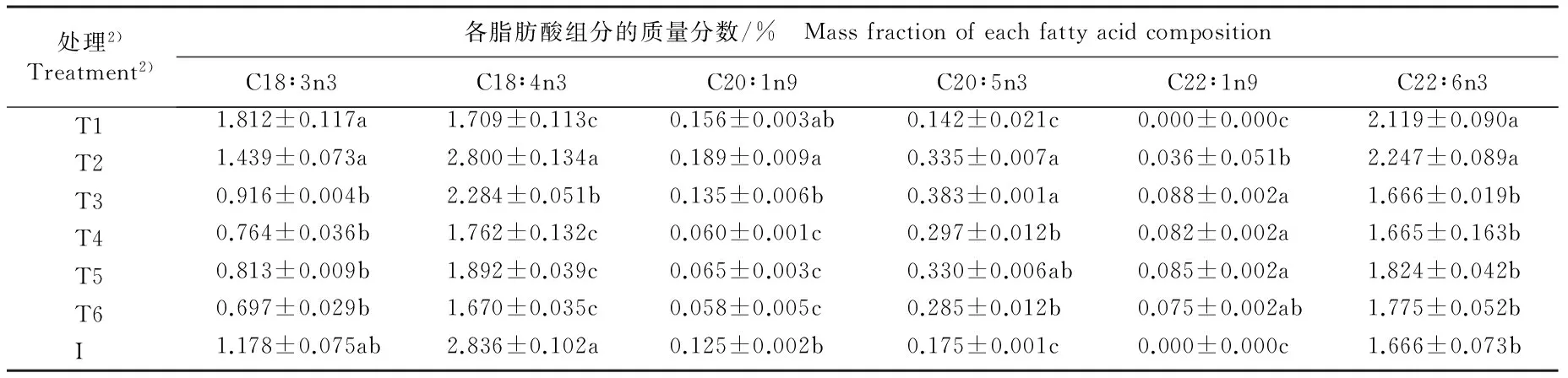
处理2)Treatment2)各脂肪酸组分的质量分数/% MassfractionofeachfattyacidcompositionC18∶3n3C18∶4n3C20∶1n9C20∶5n3C22∶1n9C22∶6n3 T11.812±0.117a1.709±0.113c0.156±0.003ab0.142±0.021c0.000±0.000c2.119±0.090a T21.439±0.073a2.800±0.134a0.189±0.009a0.335±0.007a0.036±0.051b2.247±0.089a T30.916±0.004b2.284±0.051b0.135±0.006b0.383±0.001a0.088±0.002a1.666±0.019b T40.764±0.036b1.762±0.132c0.060±0.001c0.297±0.012b0.082±0.002a1.665±0.163b T50.813±0.009b1.892±0.039c0.065±0.003c0.330±0.006ab0.085±0.002a1.824±0.042b T60.697±0.029b1.670±0.035c0.058±0.005c0.285±0.012b0.075±0.002ab1.775±0.052b I1.178±0.075ab2.836±0.102a0.125±0.002b0.175±0.001c0.000±0.000c1.666±0.073b
1)同列中不同的小写字母表示差异显著(P<0.05) Different small letters in the same column indicate the significant difference (P<0.05).
2)T1: 富N富P培养基 N rich-P rich medium (80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); T2: 富N限P培养基 N rich-P limited medium (80.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); T3: 无N限P培养基 N rich-P free medium (80.00 mg·L-1NO3--N + 0.00 mg·L-1PO43--P); T4: 无N富P培养基 N free-P rich medium (0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P); T5: 无N限P培养基 N free-P limited medium (0.00 mg·L-1NO3--N + 0.25 mg·L-1PO43--P); T6: 无N无P培养基 N free-P free medium (0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P); I: 接种体Inoculum.
2.3.3 不同类型脂肪酸质量分数的比较 检测结果(表2)表明:在不同质量浓度N和P培养基中培养10 d,各处理组等鞭金藻藻体的总饱和脂肪酸、总不饱和脂肪酸和总脂肪酸的质量分数及总饱和脂肪酸的相对含量大多显著高于接种体;在3组富N培养基中,这4项指标在富P、限P和无P培养基中依次递增;而在3组无N培养基中,这4项指标则在限P培养基中最高、在富P和无P培养基中相对较低,且各处理组间无显著差异。其中,在富N富P、富N限P和富N无P培养基中,等鞭金藻藻体的总脂肪酸质量分数分别较无N富P、无N限P和无N无P培养基升高〗0.92%、35.96%和62.55%。总体上看,在富P条件下富N与无N培养基间上述4项指标无明显差异,而在限P和无P条件下富N与无N培养基间上述4项指标差异明显。
表2 在不同质量浓度N和P培养基中培养10 d等鞭金藻不同类型脂肪酸含量的比较
Table 2 Comparison on content of different types of fatty acids of Isochrysis galbana Parke cultured for 10 d in media with different mass concentrations of N and P
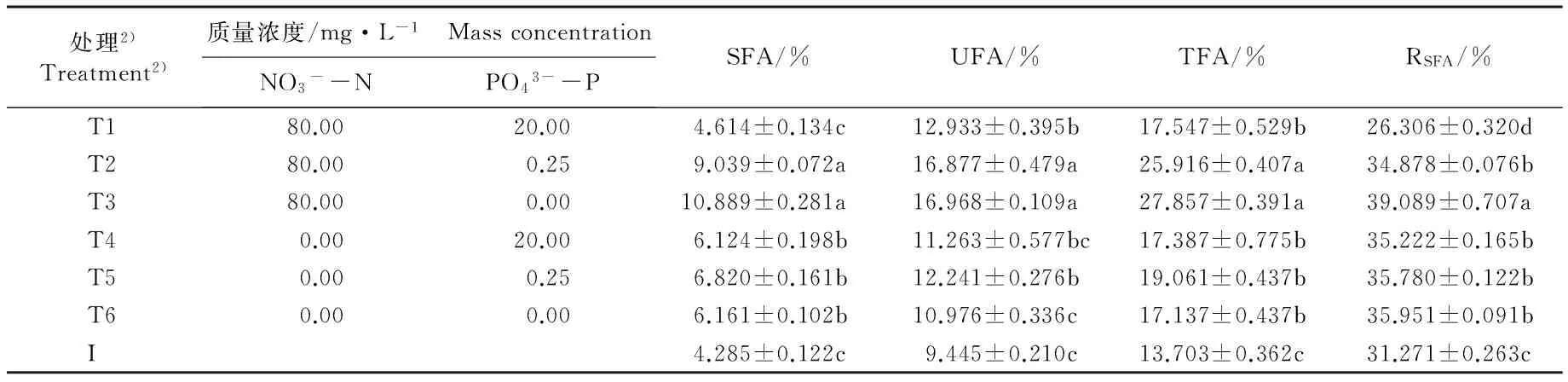
处理2)Treatment2)质量浓度/mg·L-1 MassconcentrationNO3--NPO43--PSFA/%UFA/%TFA/%RSFA/% T180.0020.004.614±0.134c12.933±0.395b17.547±0.529b26.306±0.320d T280.000.259.039±0.072a16.877±0.479a25.916±0.407a34.878±0.076b T380.000.0010.889±0.281a16.968±0.109a27.857±0.391a39.089±0.707a T40.0020.006.124±0.198b11.263±0.577bc17.387±0.775b35.222±0.165b T50.000.256.820±0.161b12.241±0.276b19.061±0.437b35.780±0.122b T60.000.006.161±0.102b10.976±0.336c17.137±0.437b35.951±0.091b I4.285±0.122c9.445±0.210c13.703±0.362c31.271±0.263c
1)SFA: 总饱和脂肪酸的质量分数Mass fraction of total saturated fatty acids; UFA: 总不饱和脂肪酸的质量分数 Mass fraction of total unsaturated fatty acids; TFA: 总脂肪酸的质量分数 Mass fraction of total fatty acids; RSFA: 总饱和脂肪酸的相对含量 Relative content of total saturated fatty acids. 同列中不同的小写字母表示差异显著(P<0.05) Different small letters in the same column indicate the significant difference (P<0.05).
2)T1: 富N富P培养基 N rich-P rich medium; T2: 富N限P培养基 N rich-P limited medium; T3: 富N无P培养基 N rich-P free medium; T4: 无N富P培养基 N free-P rich medium; T5: 无N限P培养基 N free-P limited medium; T6: 无N无P培养基 N free-P free medium; I: 接种体Inoculum.
由表2还可以看出:培养10 d时,各处理组等鞭金藻的总饱和脂肪酸相对含量(RSFA)为26.30%~39.09%。在3组富N培养基中,富P、限P和无P培养基间藻体的RSFA值差异较大, 分别为26.30%、 34.88%和39.09%,表明富N条件下限P和无P培养基可使等鞭金藻藻体的RSFA值显著提高,且以无P培养基中藻体的RSFA值为最高。在3组无N培养基中,富P、限P和无P培养基中藻体的RSFA值差异很小,分别为35.22%、35.78%和35.95%。在富P和限P培养基中,无N培养基中藻体的RSFA值分别较富N培养基提高33.92%和2.58%;而在无P培养基中,无N培养基中藻体的RSFA值则较富N培养基降低8.03%。
2.3.4 脂肪酸产率变化的比较 检测结果(表3)表明:在不同质量浓度N和P培养基中培养10 d,随培养时间延长,在富N富P和富N限P培养基中等鞭金藻的脂肪酸产率均呈现先升高后降低的变化趋势,并均在培养4 d时达到最高,而在另4组培养基中则总体上呈现持续下降的变化趋势。其脂肪酸产率在富N培养基中显著高于无N培养基,且在培养4 d时以富N限P培养基中脂肪酸产率为最高,达到21.15 mg·L-1·d-1。总体来看,富N和无N条件下,限P培养基中等鞭金藻脂肪酸产率高于富P和无P培养基,但无N条件下限P培养基中脂肪酸产率与富P和无P培养基无显著差异。
2.4 不同质量浓度N和P培养基中等鞭金藻EPA和DHA相对含量和产量的比较
在不同质量浓度N和P培养基中培养10 d,等鞭金藻中EPA(C20∶5n3)和DHA(C22∶6n3)的相对含量和产量见表4。由表4可以看出: 在无N富P(0.00mg·L-1NO3--N+20.00 mg·L-1PO43--P)、无N限P(0.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和无N无P(0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基中等鞭金藻的EPA相对含量均显著高于富N富P (80.00 mg·L-1NO3--N + 20.00 mg·L-1PO43--P)、富N限P(80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和富N无P(80.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基;而在前3组培养基中,等鞭金藻的DHA相对含量高于富N限P和富N无P培养基,但低于富N富P培养基。富N条件下,等鞭金藻的EPA相对含量在富P、限P和无P培养基中依次递增,且在后2组培养基间无显著差异;而其DHA的相对含量则依次递减,且各组间无显著差异。在无N条件下,等鞭金藻的EPA相对含量在限P培养基中最高、在无P培养基中最低;而其DHA的相对含量则在无P培养基中最高、在限P培养基中最低。
表3 不同质量浓度N和P培养基中等鞭金藻脂肪酸产率的变化
Table 3 Change in productivity of fatty acids of Isochrysis galbana Parke in media with different mass concentrations of N and P
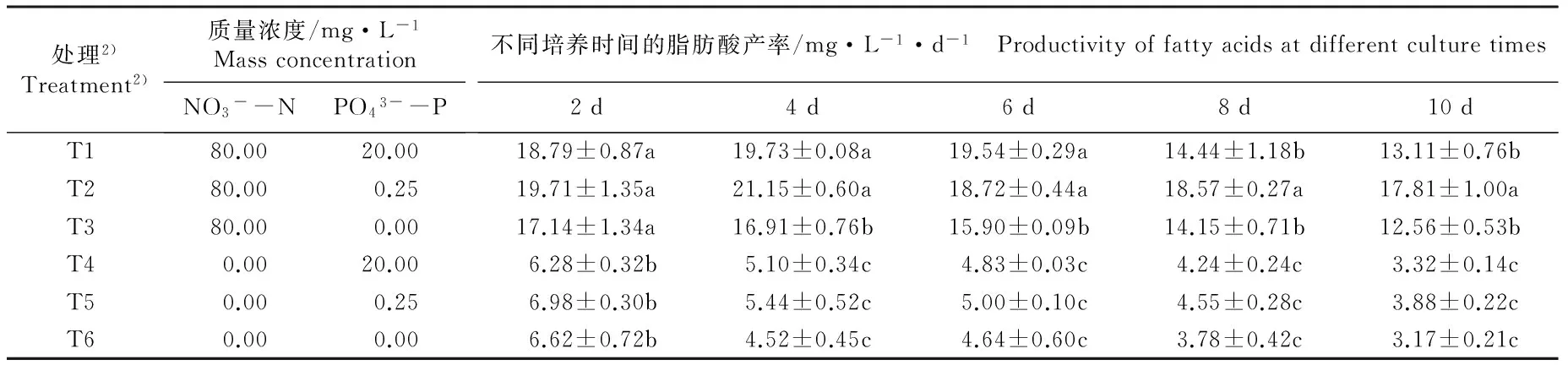
处理2)Treatment2)质量浓度/mg·L-1MassconcentrationNO3--NPO43--P不同培养时间的脂肪酸产率/mg·L-1·d-1 Productivityoffattyacidsatdifferentculturetimes2d4d6d8d10d T180.0020.0018.79±0.87a19.73±0.08a19.54±0.29a14.44±1.18b13.11±0.76b T280.000.2519.71±1.35a21.15±0.60a18.72±0.44a18.57±0.27a17.81±1.00a T380.000.0017.14±1.34a16.91±0.76b15.90±0.09b14.15±0.71b12.56±0.53b T40.0020.006.28±0.32b5.10±0.34c4.83±0.03c4.24±0.24c3.32±0.14c T50.000.256.98±0.30b5.44±0.52c5.00±0.10c4.55±0.28c3.88±0.22c T60.000.006.62±0.72b4.52±0.45c4.64±0.60c3.78±0.42c3.17±0.21c
1)同列中不同的小写字母表示差异显著(P<0.05) Different small letters in the same column indicate the significant difference (P<0.05).
2)T1: 富N富P培养基 N rich-P rich medium; T2: 富N限P培养基 N rich-P limited medium; T3: 富N无P培养基 N rich-P free medium; T4: 无N富P培养基 N free-P rich medium; T5: 无N限P培养基 N free-P limited medium; T6: 无N无P培养基 N free-P free medium.
表4 不同质量浓度N和P培养基中等鞭金藻EPA和DHA相对含量及产量的比较
Table 4 Comparison on relative content and yield of EPA and DHA in Isochrysis galbana Parke in media with different mass concentrations of N and P

处理2)Treatment2)质量浓度/mg·L-1MassconcentrationNO3--NPO43--P相对含量/% RelativecontentEPADHA产量/mg YieldEPADHA T180.0020.000.809±0.021c12.076±0.090a1.049±0.158c15.681±0.663a T280.000.251.293±0.007b8.670±0.089b2.192±0.046a14.718±0.582a T380.000.001.375±0.001b5.981±0.019c1.591±0.004b6.913±0.081b T40.0020.001.708±0.012a9.576±0.163b0.550±0.022d3.081±0.301c T50.000.251.731±0.006a9.569±0.042b0.627±0.011d3.466±0.080c T60.000.001.663±0.012a10.358±0.052ab0.574±0.022d3.195±0.094c
1)同列中不同的小写字母表示差异显著(P<0.05) Different small letters in the same column indicate the significant difference (P<0.05).
2)T1: 富N富P培养基 N rich-P rich medium; T2: 富N限P培养基 N rich-P limited medium; T3: 富N无P培养基 N rich-P free medium; T4: 无N富P培养基 N free-P rich medium; T5: 无N限P培养基 N free-P limited medium; T6: 无N无P培养基 N free-P free medium.
由表4还可见:在无N培养基中,等鞭金藻的EPA和DHA产量显著低于富N培养基。在富N条件下,其EPA产量在限P培养基中最高、在富P培养基中最低,且在各培养基间差异显著;而其DHA产量则在富P培养基中最高、在无P培养基中最低,且在无P培养基中与富P和限P培养基间有显著差异。无N条件下,二者的产量均在限P培养基中最高、在富P培养基中最低,且在各培养基间无显著差异。
3 讨论和结论
3.1 等鞭金藻生长量与培养基中N和P浓度的关系
相关研究结果表明:在缺N条件下微藻的生物量甚少增加[21-22];Qian等[23]的研究结果表明:缺N条件下,三角褐指藻(PhaeodactylumtricornutumBohlin)的细胞分裂停止,细胞密度增加甚微;本研究中,在缺N培养基中等鞭金藻藻体的质量浓度仅略有提高,说明N对微藻的生长具有重要作用。磷酸盐是微藻细胞内磷脂及核酸等物质合成的必需原料[24],同时在微藻ATP和NADP的产生和转化过程中发挥重要作用[25],可见,P是微藻细胞生长和分裂的必需营养元素,在其他环境条件正常时,P缺乏必然会影响微藻细胞的生长和繁殖。本研究中,等鞭金藻藻体的质量浓度在富N富P(80.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)培养基中最高、在富N限P(80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)培养基中居中、在富N无P (80.00 mg·L-1NO3--N + 0.00 mg·L-1PO43--P)培养基中最低,说明富N条件下等鞭金藻的生长和繁殖随培养基中P质量浓度降低而下降;在无N富P(0.00 mg·L-1NO3--N+20.00 mg·L-1PO43--P)、无N限P(0.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)和无N无P(0.00 mg·L-1NO3--N+0.00 mg·L-1PO43--P)培养基中等鞭金藻藻体的质量浓度差异很小,说明N严重缺乏时,P浓度对等鞭金藻生长和繁殖的影响减弱。
3.2 等鞭金藻对P的吸收和贮存能力分析
研究结果表明:无N富P条件下小球藻单位藻体质量的P吸收量为富N富P条件下的3.95倍[7];而无N富P条件下斜生栅藻单位藻体质量的P吸收量则为富N富P条件下的1.33倍[8]。然而,等鞭金藻在富N富P和无N富P条件下的P吸收量变化与小球藻和斜生栅藻并不一致,表现为在无N富P培养基中低于富N富P培养基。说明在无N富P条件下不同藻种的P吸收能力差异较大。
不同藻种对P需求量的差别也很大[26]。等鞭金藻的比生长速率在P含量高于常规f/2培养基1/4以上的f/2培养基中无明显变化[27],说明常规f/2培养基中近3/4的P对于等鞭金藻的生长和繁殖是多余的;而且等鞭金藻细胞中的P贮存量是其正常生长需求量的6倍。本研究中,富N限P培养基的P质量浓度为0.25 mg·L-1,略高于常规f/2培养基P浓度的1/4,从藻体质量浓度的增长情况看,该培养基与富N富P培养基中等鞭金藻藻体的质量浓度在培养前5 d基本一致,培养5 d后开始逐渐低于富N富P培养基,但2组培养基间无明显差异,说明0.25 mg·L-1P基本可以满足等鞭金藻生长过程中对P的需求。然而,培养10 d时富N富P培养基中P质量浓度的降幅高达12.20 mg·L-1,据此推测培养基中的P少部分用于等鞭金藻生长,绝大部分被贮存在藻体内,据此可将等鞭金藻用于含P废水的生物处理。
3.3 等鞭金藻的脂肪酸生产与培养基中N和P浓度的关系
通常情况下,在缺N条件下,微藻的总脂肪酸含量增加[28];而Fidalgo等[29]的研究结果却表明等鞭金藻可在N丰富的条件下积累脂肪酸。本研究中,在整个实验期间(培养10 d),在富N限P和富N无P培养基中等鞭金藻的总脂肪酸质量分数明显高于无N培养基,说明无N条件下等鞭金藻的脂肪酸含量并没有提高。在富N富P培养基中等鞭金藻的总脂肪酸质量分数表现为在培养1~6 d高于无N培养基,但在培养6~10 d却低于无N培养基,这是否与藻体内积累的大量P有关,尚待深入研究。
相关研究表明:缺P对微藻总脂肪酸含量的影响与藻种和生长环境有关。缺P能够促进单胞藻(MonodussubterraneusJ. B. Petersen)和三角褐指藻等藻类脂肪酸含量提高[30],却使小绿球藻(NannochlorisatomusButcher)和融合微藻(Tetraselmissp.)等藻类脂肪酸含量降低[31];Chu等[7]认为,无N条件下缺P可使小球藻中脂肪酸含量提高,而在富N条件下缺P却无这一作用。本研究中,富N条件下等鞭金藻的总脂肪酸质量分数在无P培养基中最高、在限P培养基中居中、在富P培养基中最低;无N条件下,则表现为在限P培养基中略高,但与富P和无P培养基无明显差异,说明富N条件下缺P可以促进等鞭金藻藻体内脂肪酸的合成,而无N条件下P浓度对等鞭金藻藻体内脂肪酸合成的影响却很小。
脂肪酸产率是衡量微藻产油能力的重要指标之一,主要由藻体质量浓度和总脂肪酸质量分数共同决定。Chu等[7-8]的研究结果表明,在无N富P培养基中小球藻和斜生栅藻的产油率均最高,其中,在无N富P培养基培养14 d小球藻的产油率为富N富P培养基的1.35倍,在无N富P培养基培养16 d斜生栅藻的产油率为富N富P培养基的2.00倍。本研究中,在整个实验期间(培养10 d),富N限P培养基中等鞭金藻的脂肪酸产率一直最高,而无N富P、无N限P和无N无P培养基中等鞭金藻的脂肪酸产率却一直很低,结合富N富P培养基中等鞭金藻P吸收量最高这一结果,可以认为在同一条件下无法同时达到获得最大脂肪酸产率和废水除P的目标。另外,由于在富N限P条件下等鞭金藻脂肪酸产率最高,建议在利用等鞭金藻生产生物柴油的培养过程中减少P的投放,以降低养殖和生产成本。
3.4 等鞭金藻的油脂品质与培养基中N和P浓度的关系
生物柴油的品质与脂肪酸链的长度和不饱和度均有关,由于长链和低不饱和度脂肪酸具有良好的低温特性和氧化稳定性,因此长链和低不饱和度脂肪酸含量越高,生物柴油的品质越好[32-33]。单不饱和脂肪酸C16∶1和C18∶1具有较好的氧化稳定性和抗冷变形性,也是理想的生物柴油成分[33-34]。可见,饱和脂肪酸及单不饱和脂肪酸的总相对含量能决定微藻生产的生物柴油的品质。
本研究中,等鞭金藻的总饱和脂肪酸相对含量及含量较高的前3种脂肪酸C18∶1n9c、C16∶0和C14∶0的质量分数均在富N无P培养基中最高,在富N限P和富N富P培养基中也较高,且组间差异较大,而在3组无N培养基中却十分接近,说明富N条件下P缺乏可以提高等鞭金藻油脂的品质,而无N条件下P浓度变化对其油脂品质的影响却极小。然而,在富N无P培养基中等鞭金藻的脂肪酸产率却低于富N限P和富N富P培养基,因此,虽然在富N无P培养基中等鞭金藻的油脂品质较好,但在实际生产过程中其应用价值却极低。在富N限P培养基中,等鞭金藻的脂肪酸产率最高,C18∶1n9c、C16∶0和C14∶0以及长链饱和及单不饱和脂肪酸C18∶0和C16∶1n9的总相对含量为65.86%, 虽然仍低于富N无P培养基, 但C18∶1n9c的相对含量却高达28.19%,因此在该培养基中等鞭金藻的油脂品质良好。综合考虑脂肪酸产率与生物柴油品质,认为富N限P(80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P)培养基是等鞭金藻生产高产优质生物油脂的适宜培养条件。
3.5 等鞭金藻的EPA和DHA含量与培养基中N和P浓度的关系
生物体内的脂肪酸合成通常以C16或C18饱和脂肪酸为终点,并通过去饱和及碳链延长形成不饱和脂肪酸及多不饱和脂肪酸[35],在N缺乏条件下生物体内的多不饱和脂肪酸水平大多下降[36]。本研究中,等鞭金藻的EPA和DHA产量在无N培养基中显著低于富N培养基;在富N条件下,EPA相对含量随培养基中P质量浓度的下降而升高,而DHA相对含量则随着P质量浓度的下降而降低,说明在富N条件下,缺P可以提高等鞭金藻的EPA相对含量,但却使其DHA的相对含量下降。然而,Reitan等[31]的研究结果显示:随缺P程度加剧,微藻中C18∶4n3、EPA和DHA的相对含量均下降。可见,不同P水平对各种微藻EPA相对含量的影响存在一定差异。本研究中,在富N富P培养基中等鞭金藻的DHA相对含量和产量均最高,并且其P吸收量也很高,据此认为等鞭金藻具有同时清除废水中P和生产DHA的潜力。在富N限P培养基中等鞭金藻的EPA产量最高,较其次的富N富P培养基高108.96%,而其DHA产量仅比DHA产量最高的富N富P培养基低6.14%,说明在富N限P培养基中等鞭金藻不仅EPA产量最高,DHA产量也较高,因此,采用富N限P培养基培养等鞭金藻可以同时生产EPA和DHA。
综上所述,80.00 mg·L-1NO3--N+0.25 mg·L-1PO43--P培养基是等鞭金藻生产生物柴油及EPA和DHA的最佳培养基。
[1] KRÖGERM,MÜLLER-LANGERF.Review on possible algal-biofuel production processes[J]. Biofuels, 2012, 3: 333-349.
[2] CHISTI Y. Biodiesel from microalgae[J]. Biotechnology Advances, 2007, 25: 294-306.
[3] WAGENEN J V, MILLER T W, HOBBS S, et al. Effects of light and temperature on fatty acid production inNannochloropsissalina[J]. Energies, 2012, 5: 731-740.
[4] HU Q, SOMMERFELD M, JARVIS E, et al. Microalgal triacyl-glycerols as feedstocks for biofuel production: perspectives and advances[J]. The Plant Journal, 2008, 54: 621-639.
[5] RODOLFI L, ZITTELLI G C, BASSI N, et al. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor[J]. Biotechnology and Bioengineering, 2009, 102: 100-112.
[6] EL-SHEEKH M, ABOMOHRA E F, HANELT D. Optimization of biomass and fatty acid productivity ofScenedesmusobliquusas a promising microalga for biodiesel production[J].World Journal of Microbiology and Biotechnology, 2013, 29: 915-922.
[7] CHU F F, CHU P N, CAI P J, et al. Phosphorus plays an important role in enhancing biodiesel productivity ofChlorellavulgarisunder nitrogen deficiency[J]. Bioresource Technology, 2013, 134: 341-346.
[8] CHU F F, CHU P N, SHEN X F, et al. Effect of phosphorus on biodiesel production fromScenedesmusobliquusunder nitrogen-deficiency stress[J]. Bioresource Technology, 2014, 152: 241-246.
[9] KHOZIN-GOLBERG I, ISKANDAROV U, COHEN Z. LC-PUFA from photosynthetic microalgae: occurrence, biosynthesis, and prospects in biotechnology[J]. Applied Microbiology and Biotechnology, 2011, 91: 905-915.
[10] FIDALGO J P, CID A, TORRES E, et al. Effects of nitrogen source and growth phase on proximate biochemical composition, lipid classes and fatty acid profile of the marine microalgaIsochrysisgalbana[J]. Aquaculture, 1998, 166: 105-116.
[11] BARBARRO J M F, REIRIZ M J F, LABARTA U. Influence of preservation techniques and freezing storage time on biochemical composition and spectrum of fatty acids ofIsochrysisgalbanaclone T-ISO[J]. Aquaculture Research, 2001, 32: 565-572.
[13] FUNK C D. Prostaglandins and leukotrienes: advances in eicosa-noid biology[J]. Science, 2001, 294: 1871-1875.
[14] HORROCKS L A, YEO Y K. Health benefits of docosahexaenoic acid (DHA)[J]. Pharmacological Research, 1999, 40: 211-225.
[16] FRADIQUE M, BATISTA A P, NUNES M C, et al.IsochrysisgalbanaandDiacronemavlkianumbiomass incorporation in pasta products as PUFA’s source[J]. LWT-Food Science and Technology, 2013, 50: 312-319.
[17] YONGMANITCHAI W, WARD O P. Omega-3 fatty acids: alter-native sources of production[J]. Process Biochemistry, 1989, 24: 117-125.
[18] GUILLARD R R L. Culture of phytoplankton for feeding marine invertebrates[M]∥SMITH W L, CHANLEY M H. Culture of MarineInvertebrateAnimals. NewYork: PlenumPress,1975: 26-60.
[19] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 246-248.
[21] FALKOWSKI P G, BARBER R T, SMETACEK V V. Biogeo-chemical controls and feedbacks on ocean primary production[J]. Science, 1998, 281: 200-206.
[22] LARSON T R, REES T A V. Changes in cell composition and lipid metabolism mediated by sodium and nitrogen availability in the marine diatomPhaeodactylumtricornutum(Bacillariophyceae)[J]. Journal of Phycology, 1996, 32: 388-393.
[23] QIANKX,BOROWITZKA M A.Light and nitrogen deficiency effects on the growth and composition ofPhaeodactylumtricornutum[J]. Applied Biochemistry and Biotechnology, 1993, 38: 93-103.
[24] SOUTH G R, WHITTICK A. Introduction to Phycology: Vol. 1[M]. London: Blackwell Science Publishing, 1987: 178-179.
[25] EL-SHEEK M M, RADY A A. Effect of phosphorus starvation on growth, photosynthesis and some metabolic processes in the unicellulargreenalgaChlorellakessleri[J]. Phyton,1995, 35: 139-151.
[26] METTING B. Algal Biomass: production and use[J]. Phycologia, 1982, 21: 422-423.
[27] ROOPNARAIN A, GRAY V M, SYM S D. Phosphorus limitation and starvation effects on cell growth and lipid accumulation inIsochrysisgalbanaU4 for biodiesel production[J]. Bioresource Technology, 2014, 156: 408-411.
[28] SHEEHAN J, DUNAHAY T, BENEMANN J, et al. A look back at the U.S. department of energy’s aquatic species program: biodiesel from algae[R]. [S.l.: s.n.], 1998.
[29] FIDALGO J P, CID A, TORRES E, et al. Effects of nitrogen source and growth phase on proximate biochemical composition, lipid classes and fatty acid profile of the marine microalgaIsochrysisgalbana[J]. Aquaculture, 1998, 166: 105-116.
[30] KHOZIN-GOLDBERG I, COHEN Z. The effect of phosphate starvation on the lipid and fatty acid composition of the fresh water eustigmatophyteMonodussubterraneus[J]. Phytochemistry, 2006, 67: 696-701.
[31] REITAN K I, RAINUZZO J R, OLSEN Y. Effect of nutrient limitation on fatty acid and lipid content of marine microalgae[J]. Journal of Phycology, 2004, 30: 972-979.
[32] FRANCISCO E C, NEVES D B, JACOB-LOPES E, et al. Microalgaes feedstock for biodiesel production: carbon dioxide sequestration, lipid production and biofuel quality[J]. Journal of Chemical Technology and Biotechnology, 2010, 85: 395-403.
[33] HOEKMAN S K, BROCH A, ROBBINS C, et al. Review of biodiesel composition, properties, and specifications[J]. Renewable and Sustainable Energy Reviews, 2012, 16: 143-169.
[34] KNOTHE G. Improving biodiesel fuel properties by modifying fatty ester composition[J]. Energy and Environment Science, 2009, 2: 759-766.
[35] RATLEDGE C. Fatty acid biosynthesis in microorganisms being usedforsinglecelloilproduction[J]. Biochimie, 2004, 86: 807-815.
[36] ALONSO D L, BELARBI E-H, FERNNDEZ-SEVILLA J M, et al. Acyl lipid composition variation related to culture age and nitrogen concentration in continuous culture of the microalgaPhaeodactylumtricornutum[J]. Phytochemistry, 2000, 54: 461-471.
(责任编辑: 佟金凤)
Analyses on growth, phosphorus absorption and oil quality of Isochrysis galbana under different nitrogen and phosphorus culture conditions
YU Shijin1,2, HU Hao2, SHEN Xiaofei2, ZENG Jianxiong2,①
(1. School of Resources and Environment, Anqing Normal University, Anqing 246133, China; 2. School of Chemistry and Materials Science, University of Science and Technology of China, Hefei 230026, China),J.PlantResour. &Environ., 2016, 25(4): 8-17
In order to explore the effects of phosphorus (P) and nitrogen (N) with different levels in medium on yield and oil quality ofIsochrysisgalbanaParke, six groups of media with P rich, P limited and P free (20.00, 0.25 and 0.00 mg·L-1PO43--P) under N rich (80.00 mg·L-1NO3--N) and N free (0.00 mg·L-1NO3--N) conditions were set up, changes in algae mass concentration, P absorption, mass fraction of total fatty acids and productivity of fatty acids, thirteen fatty acid compositions and their mass fraction, and relative content and yield of EPA and DHA ofI.galbanaculturing for 10 d were compared and analyzed. The results show that in N rich medium, increasing range of algae mass concentration ofI.galbanais obviously higher than that in N free medium, and decreases successively according to P mass concentration in medium from high to low. Overall, with prolonging of culture time, mass fraction of total fatty acids ofI.galbanaincreases continuously, and that in N rich medium is higher than that in N free medium. In which, mass fraction of total fatty acids in N rich-P limited and N rich-P free media is basically higher than that in N rich-P rich medium. Mass fraction of different fatty acid compositions in N rich medium is generally higher than that in N free medium, and that in P limited medium is generally higher than that in P rich and P free media. P absorption of 1 L algae in N rich-P rich medium is the highest (0.014 8 mg), and most of the absorbed P is stored in algae, while P absorption in N free-P rich medium decreases obviously (0.009 8 mg). In N rich-P rich medium, mass fraction and relative content of saturated fatty acids and relative content and yield of EPA all are the lowest, but relative content and yield of DHA are the highest. In N rich-P limited medium, yield of EPA and productivity of fatty acids ofI.galbanaare the highest, its DHA yield is also high; total relative contentof fivehighqualityfattyacidcompositionsincludingC18∶1n9c, C16∶0, C14∶0, C18∶0 and C16∶1n9 reaches 65.86%, especially C18∶1n9c, its relative content is up to 28.19%. The comprehensive analysis result indicates that N rich medium is beneficial to growth, P absorption and fatty acid accumulation ofI.galbana, in which, N rich-P limited medium is the suitable medium for high yield and high quality oil ofI.galbana. Otherwise,I.galbanais not only high quality resources for producing biodiesel but also potential biological resources for producing DHA and removing P in wastewater.
IsochrysisgalbanaParke; levels of nitrogen and phosphorus; microalgae growth; P absorption; oil yield; fatty acid composition
2015-11-26
国家自然科学基金资助项目(51478447)
余世金(1962—),男,安徽岳西人,博士,副教授,主要从事环境生态学方面的研究工作。
①通信作者E-mail: rzeng@ustc.edu.cn
Q948.112+.9; S565.9; TK63
A
1674-7895(2016)04-0008-10
10.3969/j.issn.1674-7895.2016.04.02
