脑卒中治疗靶点和药物研究
2016-02-15缪朝玉
缪朝玉
(第二军医大学药理学教研室,上海 200433)
脑卒中治疗靶点和药物研究
缪朝玉
(第二军医大学药理学教研室,上海 200433)

缪朝玉,第二军医大学国家重点学科药理学教研室主任,教授,博士生导师,兼任中国药理学会心血管药理专业委员会主任委员。国家杰出青年科学基金获得者,全国优秀博士学位论文获得者,国家药效学平台负责人,国家药理学精品课程负责人,全国优秀科技工作者,全国巾帼建功标兵。承担心脑血管和代谢领域国家重大重点项目等20余项,完成新药评价20余项。主编专著教材10部,3本SCI药理学期刊编委。在Trends Pharmacol Sci,Ann Neurol和Autophagy等发表论文160余篇,被Lancet和Nat Med等专题评论或引用3600余次,入选ESI全球高被引论文3篇,得到编辑部评论6篇。发明专利12项,新药证书1项,国家自然科学二等奖等成果奖励5项。培养研究生33名,其中1名博士获国家优秀青年科学基金。
脑卒中作为我国人口第一大致死原因,已成为严重影响国计民生的公共卫生问题,但仅3%~5%患者可接受唯一获准的缺血性脑卒中药物组织型纤溶酶原激活剂治疗,出血性脑卒中更是无药可用。因此,脑卒中药物治疗迫切需要解决。尽管目前已认识到神经保护剂可作为缺血性脑卒中和出血性脑卒中治疗的共性策略,但大量神经保护剂在临床试验中的转化失败,使得脑卒中药物研究成为世界性难题。本文将结合当前脑卒中治疗策略和药物研发现状,阐述靶向兴奋毒性、氧化和硝化应激、炎症反应的脑卒中损伤机制及相应药物的临床试验进展,并从新的视角提出增强机体内在防御机制作为脑卒中治疗的新策略,重点阐述本课题组研究的烟酰胺磷酸核糖转移酶(Nampt)-烟酰胺腺嘌呤二核苷酸防御系统及其抗脑卒中新靶点Nampt,以及在研新药烟酰胺单核苷酸。希望通过不懈努力,能够破解脑卒中治疗的瓶颈问题,减轻社会和家庭的经济负担和精神压力,造福于人类。
脑卒中;治疗靶点;药物研究;神经保护剂;烟酰胺磷酸核糖转移酶;分泌蛋白
脑卒中属脑血管疾病,具有发病率高、死亡率高、致残率高、复发率高和医疗费高等特点,是非常严重的健康和社会问题。在中国和全球,脑卒中分别为第一和第二致死以及主要致残原因,目前缺少有效治疗。FDA唯一获准的药物只有组织型纤溶酶原激活剂(tissue plasminogen ativator,tPA),该溶栓治疗用于缺血性脑卒中。但是,由于tPA治疗时间窗狭窄,禁忌证限制,并发症危险,仅3%~5%患者获得治疗[1];又因tPA治疗的血管再通率较低,使得这一疗法的总体有效性较低[2](表1)。最近证明,在较大动脉阻塞引起的缺血性脑卒中患者,血管内血栓切除术(endovascular thrombectomy)可提高血管再通率,其有效性优于tPA[2-3]。但是,仅少数患者接受这一手术介入治疗,其治疗有效率也很有限(表1)。至于更加险恶、死亡率更高的出血性脑卒中,仅特定部位的脑出血手术治疗显示一定有效性(表1),目前尚无治疗药物。因此,脑卒中治疗药物研发迫在眉睫。
理论上,神经保护是治疗缺血性和出血性脑卒中的共性策略。因此,神经保护剂研发一直是这一领域的关注焦点。然而,大量神经保护剂在经过上千项实验研究和上百项临床试验之后,最终被证明转化失败,使得脑卒中治疗药物研发成为世界性难题。
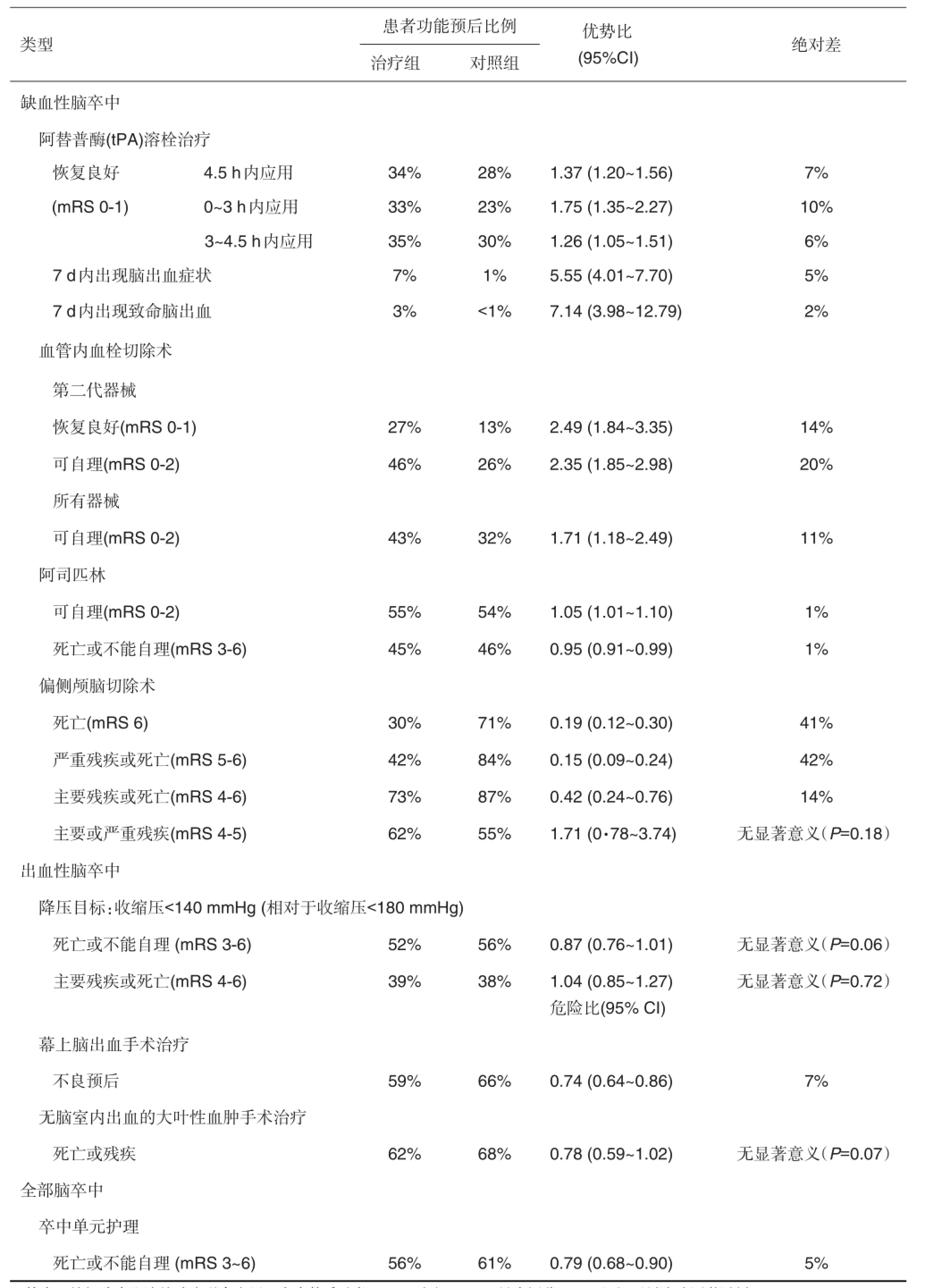
表1 各种治疗对脑卒中功能预后的影响
本文针对脑卒中损伤机制的主要环节,综述2010年以来报道的新药临床试验进展[3](表2);同时介绍本课题组近10年以来的研究成果,从新的视角瞄准机体内在防御机制,开展新靶点发现和新药研究。
1 靶向兴奋毒性的药物研发
20世纪80年代,发现谷氨酸和钙离子在缺血性神经元死亡中发挥重要作用,被称为神经兴奋毒性(excitotoxicity)。兴奋毒性主要是指脑缺血后,兴奋性氨基酸谷氨酸快速大量释放,而其重摄取受到抑制,造成谷氨酸堆积,过分激活多条下游信号通路,引起钙内流和细胞内钙超载,最终导致能量耗竭,细胞死亡。这是最早被确认、获得广泛认同的脑卒中损伤分子机制。然而,针对谷氨酸引起的兴奋毒性所研发的一系列作用于谷氨酸受体的药物,在临床试验均显示无效。2010年以来报道的临床试验依然不太乐观。例如,硫酸镁治疗缺血性脑卒中,早期(2 h内)开始应用,无论单用还是与tPA合用,均无疗效。再如,突触后致密蛋白95(post⁃synaptic density protein 95,PSD-95)是谷氨酸N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)受体的连接蛋白,可介导神经毒性信号通路;PSD-95抑制剂NA-1在非人灵长类猴脑缺血模型上,可阻断谷氨酸兴奋毒性、缩小脑梗体积和改善神经功能。在最近完成的临床试验中,NA-1应用于颅内动脉瘤血管内修复术后,仅观察到脑梗个数略少于安慰剂对照组,而脑梗体积没有差别[4]。NA-1尚在进一步临床试验,观察其对缺血性脑卒中的疗效。
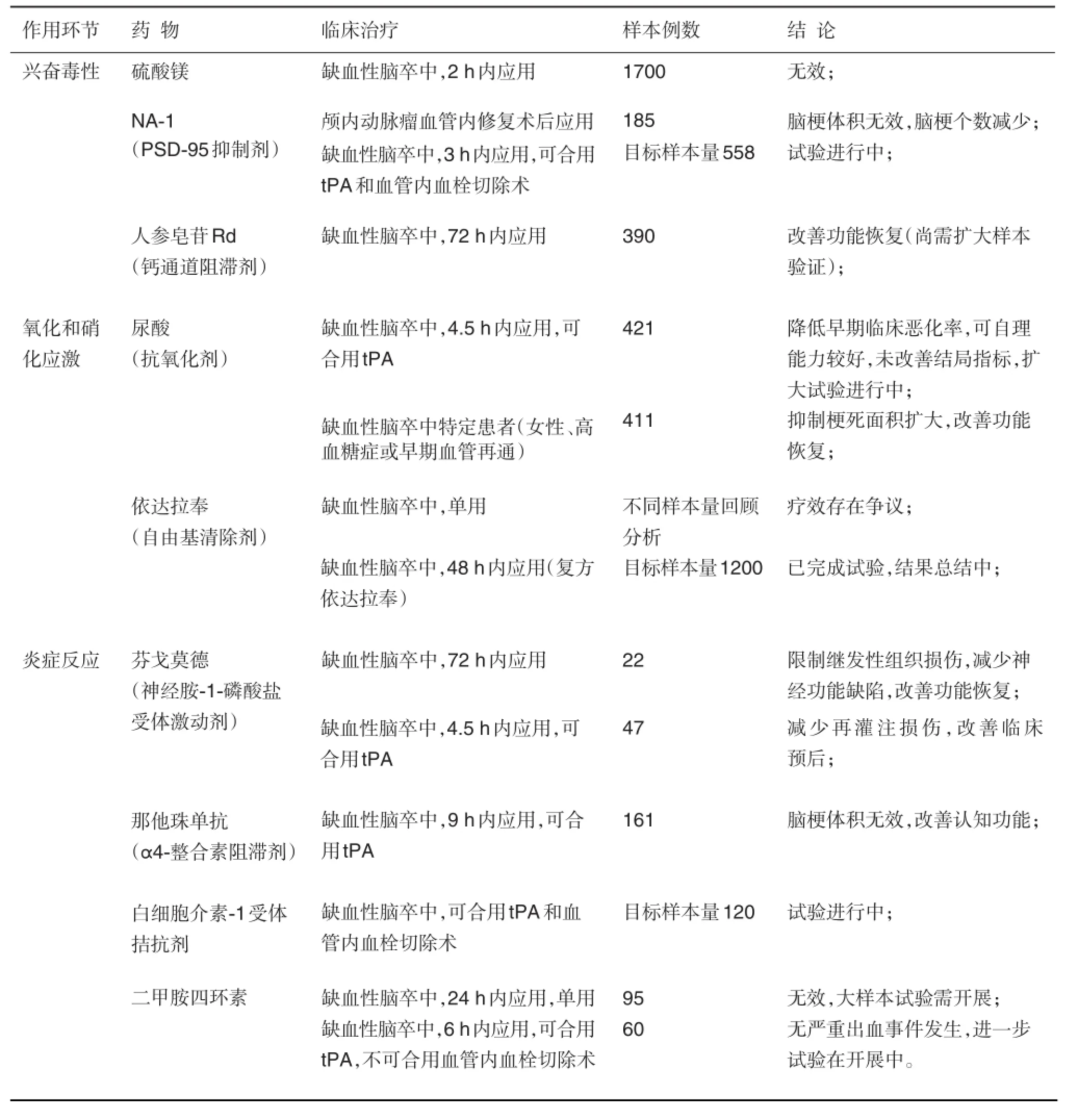
表2 2010年以来神经保护剂的临床试验结果
钙通道拮抗药可阻断谷氨酸下游信号通路钙内流,被认为可作为脑卒中治疗药物,而且尼莫地平被用于临床治疗脑卒中,还被作为临床前药效学试验的阳性对照药。但是,迄今为止,大量临床试验循证医学证明,钙通道阻滞药治疗脑卒中未能获得治疗效果。值得关注的是,一项中国脑卒中临床试验发现,受体门控钙通道阻滞药人参皂苷Rd在急性缺血性脑卒中72 h内应用,可促进神经功能恢复[5]。研究者认为,人参皂苷Rd未引起明显血压下降,可能是药物发挥有效性的主要原因。钙通道拮抗药阻断神经兴奋毒性的有益作用,以及降低血压的不利作用,值得进一步扩大临床试验验证。也可能人参皂苷Rd还有未被阐明的对脑卒中治疗有益的药理作用。
2 靶向氧化和硝化应激的药物研发
氧化和硝化应激在缺血性脑损伤病理过程中扮演重要角色。脑缺血后,半影区超氧阴离子、过氧化氢、羟自由基和过氧亚硝基阴离子(peroxynitrite)等产生增加,再灌时尤甚。羟自由基和过氧亚硝基阴离子可促进蛋白质硝化和氧化、脂质过氧化、线粒体和DNA损伤、炎症激活、细胞坏死和凋亡,从而引起脑损伤。活性氧物质(reactive oxygen species,ROS)和活性氮物质(reactive nitrogen species,RNS)被认为主要产生于半影区,且研究表明,阻断ROS/RNS引起的氧化和硝化应激可有效限制缺血损伤扩展。因此,中和氧化和硝化应激可作为潜在的脑卒中治疗策略,业内尤其对过氧亚硝基阴离子这一靶点感兴趣。但是2006年,当时被认为非常有希望的过氧亚硝基阴离子清除剂NXY-059,在次年的扩大临床试验中宣布失败。
依达拉奉(edaravone)是日本2001年批准上市的自由基清除剂,可清除超氧阴离子、过氧化氢和羟自由基。该药也在我国被批准上市,广泛用于治疗缺血性脑卒中。针对8项临床试验的系统性回顾表明,依达拉奉在脑卒中患者治疗中的有效性无确凿证据。近年一项回顾研究称,依达拉奉联合脑卒中标准治疗,似乎可改善脑卒中患者的神经功能[6],这一结果是否存有偏见或样本量较小仍需考虑。目前,我国研发的复方依达拉奉已完成Ⅲ期临床试验,在缺血性脑卒中48 h内应用,试验结果尚在总结中。
尿酸是人嘌呤分解代谢的最终氧化产物,占血浆抗氧化能力的2/3。临床前研究表明,尿酸可减少谷氨酸诱导的细胞死亡,抑制脑卒中动物的ROS/RNS,进而降低脑梗体积,促进功能恢复。在血栓栓塞性脑卒中啮齿类动物模型中,尿酸与tPA联合用药表现出协同作用。尿酸治疗对脑卒中患者的安全性和有效性已进行到Ⅱb/Ⅲ期临床试验阶段。结果表明,无论是否联用tPA,对结局指标均无影响,但给予尿酸治疗可减少脑卒中患者早期临床恶化的发生率,使较多患者获得完全可自理能力。值得注意的是,在特定的脑卒中患者(如女性、高血糖症预处理患者或早期血管再通患者),尿酸治疗可抑制梗死扩大、改善功能预后,这一结果可能与女性内源性抗氧化能力低、高血糖症脑卒中患者自由基增加等有关。因此,进一步的大规模临床试验需要在包含更多并发症的男女同龄人群中开展。
3 靶向炎症损伤的药物研发
脑缺血后会释放许多损伤相关模式分子,进而触发无菌的免疫应答,通过免疫细胞精确地浸润脑实质。脑内小胶质细胞和中性粒细胞先后应答,加剧脑缺血后的氧化应激和血脑屏障损伤。缺血和再灌注也会触发补体系统,介导免疫病理损伤反应。尽管研究者对免疫系统在脑卒中病理生理中的意义尚了解不足,但脑卒中后免疫介导的炎症反应已作为脑卒中治疗的研究靶点。目前已有多项随机对照试验,测试临床使用的各种免疫调节剂对脑卒中患者的治疗效果。
芬戈莫德(fingolimod)是用于治疗多发性硬化症的新型免疫抑制剂。芬戈莫德是几种神经胺-1-磷酸盐受体的高亲和受体激动剂,阻止淋巴细胞从淋巴结外出,限制淋巴细胞浸润到脑,抑制小胶质细胞和巨噬细胞的局部激活。临床前研究表明,芬戈莫德可通过血脑屏障,维持内皮功能,降低脑梗体积,改善神经功能,减轻水肿,减少缺血区细胞死亡数量,但其是否直接作用于神经元备受争议[7-11]。在临床试验中,脑卒中发生72 h内给予芬戈莫德治疗,无严重有害事件发生,可限制继发性脑组织损伤,提高功能恢复;脑卒中发生4.5 h内联合tPA用药可减少神经功能缺陷。由于芬戈莫德可隔绝淋巴组织中的淋巴细胞,进而发生淋巴细胞减少症,因此其效果很可能是血管和免疫介导的,不仅仅局限于中枢神经系统。芬戈莫德是一个前药,必须磷酸化后才能作用于神经胺-1-磷酸盐受体,但一些证据又表明其作用不依赖于这些受体。因此,进一步的实验需要探究芬戈莫德与脑卒中多个靶点的关系,以了解该药发挥疗效的作用靶点和机制,以及避免该药潜在的不良反应。
那他珠单抗(natalizumab)是一个人源化的CD49d抗体,可阻断α4-整合素,被批准用于多发性硬化症的治疗。临床前研究表明,该药可以阻滞α4-整合素介导的白细胞迁移,但未发现对神经缺陷的保护功能,仅减少轻微脑卒中动物的梗死面积,对严重脑卒中动物无效[12]。临床试验中,该药联合应用tPA,对脑梗体积无影响,但可改善认知功能。
白细胞介素1受体拮抗剂(interleukin-1 recep⁃tor antagonist,IL-1ra)是促炎因子IL-1的竞争性拮抗剂,重组IL-1ra被广泛用于治疗炎症性疾病,如类风湿关节炎,具有很好的抗炎效果和安全特性。在啮齿类脑卒中动物模型中,内源性IL-1ra上调,给予重组IL-1ra治疗可减少细胞死亡和损伤体积。重组IL-1ra联合tPA或血管内血栓切除术治疗的临床研究进行到Ⅱ期。急性脑卒中后血浆中IL-1ra升高被证明与高感染风险有关。因此,该药的治疗护理需要格外小心。
二甲胺四环素(minocycline)是一个四环素衍生物抗生素,可减少动物脑卒中后的细胞凋亡,抑制聚腺苷二磷酸核糖聚合酶1和基质金属蛋白酶的表达,进而表现出抗炎效果。临床试验表明,二甲胺四环素具有较好的安全特性,治疗窗时间较长,单独用药达4 h,联合应用tPA可达6 h;联合tPA用药时,不仅提供血管保护作用,而且减少tPA治疗引发的出血事件。但一项小型临床试验发现,脑卒中发生24 h内静脉给予二甲胺四环素治疗对患者的致残率无改善作用。二甲胺四环素和溶栓治疗的进一步临床随机对照试验正在开展中。
4 基于烟酰胺磷酸核糖转移酶(nicotinamide phosphoribosyltransferase,Nampt)-烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)防御系统的新靶点发现和新药研究
脑卒中发生时,一方面引起损伤反应,导致细胞死亡、功能受损;另一方面,调动防御反应,企图使细胞存活、再生、功能恢复,以对抗脑卒中损伤带来的危害。以往多数靶点和药物针对脑卒中损伤机制,迄今为止临床转化未获成功。本课题组希望从新的视角,通过瞄准机体内在防御机制,挖掘抗脑卒中新靶点。脑卒中虽然是脑局部疾病,但可引起全身反应,而且脑局部与全身可相互作用。因此,本课题组提出利用机体内在防御机制发现脑局部和全身来源的神经保护因子。
4.1 Nampt-NAD系统
本课题组从2005年开始研究脂肪因子Visfatin,除了脂肪组织可分泌该蛋白外,肝等组织也可分泌。本课题组及其他研究者研究均证明,该蛋白无论在细胞内还是细胞外,均具有Nampt活性。而且研究证明,Nampt从脂肪细胞分泌后,其活性的增加与Lys53位点去乙酰化有关。Nampt是NAD生物合成的限速酶(图1),NAD是生成能量物质三磷酸腺苷和发生数百个氧化还原反应的重要辅酶。近年大量研究表明,NAD又是重要的信号分子,介导SIRT等信号传导通路。通过研究,本课题组进一步验证了Nampt是机体重要的防御蛋白,Nampt-NAD系统可决定细胞生死存亡[1,13-27]。
4.2 Nampt可作为脑卒中治疗新靶点
本课题组获得的一系列实验证据有[1,13-27]:①给予遗传性脑卒中易发大鼠终身服用Nampt特异性抑制剂,可加速脑卒中发生和死亡。②脑组织有较高Nampt表达,神经细胞可释放Nampt。在整体和离体脑缺血模型急性期,Nampt上调。Nampt重组蛋白、Nampt过表达、Nampt酶产物烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)和NAD可对抗整体和离体脑缺血损伤,而Nampt抑制剂和Nampt敲减则加重脑缺血损伤。SIRT1敲除、AMPKα2敲除和AMPK抑制剂可阻断Nampt对脑缺血的保护作用(抗坏死和凋亡),阐明了神经存活新途径Nampt-SIRT1-AMPK。还发现Nampt可由Nampt-SIRT1-mTOR途径介导,促进脑缺血早期细胞自噬,发挥神经保护作用。通过制备Nampt转基因过表达小鼠(Tg)和Nampt氨基酸突变酶失活转基因过表达小鼠(ΔTg),发现Nampt在脑缺血亚急性和慢性期可发挥组织修复作用,促进功能恢复,涉及内皮祖细胞Nampt-SIRT1-Notch通路促进血管新生,以及神经干细胞Nampt-SIRT1,2,6途径促进神经再生。而且Tg小鼠脑缺血后死亡率较低,体质量恢复较快。脑缺血后1个月,脑的大体形态明显不同,Tg小鼠恢复到接近正常;而ΔTg小鼠脑较小,缺损明显。
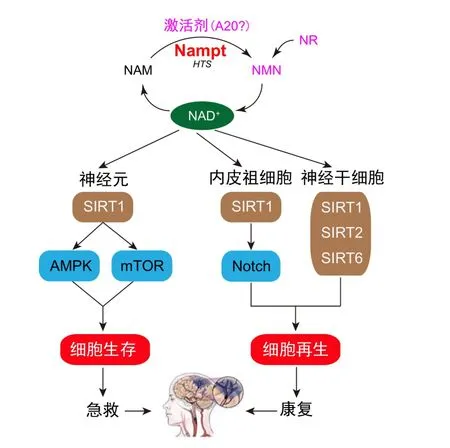
图1 抗脑卒中烟酰胺磷酸核糖转移酶(Nampt)-烟酰胺腺嘌呤二核苷酸(NAD)防御系统及新药研发.A20:氨丙基咔唑类衍生物;HTS:高通量筛选;NAM:烟酰胺;NMN:烟酰胺单核苷酸;NR:烟酰胺核糖.
4.3 基于Nampt-NAD系统的新药研究
在发现Nampt新靶点同时,本课题组提出了新药研发策略并进行了具体实施[1,14,22-25]:①证明了Nampt直接酶产物NMN可作为抗脑卒中治疗新药,对脑缺血具有多重保护作用,对脑出血也有神经保护作用,且不影响血肿大小,已进入临床前研究阶段。②测试到烟酰胺核糖(nicotinamide ribo⁃side,NR)(生成NMN的前体)具有抗脑卒中活性。③发展Nampt激活剂作为抗脑卒中治疗新药。为此,本课题组首次创建了基于Nampt靶点的高通量筛选系统,完成了5.5万个小分子筛选,获得348个可明显抑制Nampt酶活性的化合物,确认了结构多样的新型Nampt抑制剂可作为研究工具和(或)抗肿瘤先导药物;发现了首个Nampt荧光探针化合物,对分子影像生物学研究具有潜在价值。同时,获得495个潜在的Nampt激活剂,测试并证实了一个潜在的Nampt激活剂A20具有抗脑卒中活性。
上述研究表明,Nampt可通过新的多重作用机制发挥抗脑卒中作用(图1)。在缺血性脑卒中急性期,该蛋白可通过激活早期细胞自噬和对抗细胞凋亡(坏死),促进神经存活;在脑卒中慢性期,该蛋白可通过促进血管新生和增强神经细胞再生,改善脑卒中后功能恢复。上述研究同时阐明了该蛋白在神经元、血管平滑肌、内皮祖细胞和神经干细胞上的新的信号转导途径。由此提出,增强该蛋白活性或相应酶代谢通路,有望成为脑卒中急救和康复的新策略。本课题组经大量研究确定了Nampt天然酶产物NMN可作为抗脑卒中研发新药,其他候选系列新药包括NR和A20,有待后续深入研究。
本课题组关于Nampt作为抗脑卒中新靶点的报道已被许多实验室研究证实,并得到广泛引用,3篇代表性工作[13,15,17]被SCI期刊引用均超过百次,为ESI全球高被引论文,其中在2011年Ann Neurol[15]和2012年Autophagy[17]分别发表的2篇有关Nampt两条神经保护新途径的研究结果得到Nat Med两项研究证实和引用。由于本课题组首次确认了抗脑卒中靶点Nampt,并开展了一系列作用、机制及化合物发现等后续研究,迄今为止在这一研究方向发表了23篇SCI论文,拥有5项专利,笔者应邀为药理学领域顶级期刊Trends Pharmacol Sci撰写了专家综述[1]。
5 结语
近30年来,脑卒中治疗研究者一直热切期盼“血管再通+神经保护”治疗模式的早日实现。但是,由于神经保护剂临床试验屡屡失败,使得不可接受tPA治疗的95%~97%脑卒中患者仍处于无药可用的境地。在这种情况下,高收入发达国家开展了“卒中单元(stroke-unit care)”综合性治疗,取得一定疗效,有效率为5%。特别是近年,第二代器械血管内血栓切除术治疗被确认优于tPA治疗,这毫无疑问是脑卒中治疗的一大进步。但这些治疗在中低收入国家实施起来依然困难,而且现有治疗的总体有效性均不高。因此,在脑卒中治疗领域,人们并没有放弃对神经保护剂的寻找。最近,国家重点研发计划设立急性脑缺血损伤神经保护剂研发,包括对临床常用神经保护剂的疗效再验证,充分说明我国对这一领域的重视。
2010年以来,又有多项神经保护剂如胞磷胆碱(citicoline)、高剂量白蛋白和硫酸镁等临床试验失败[2-3],但尿酸和芬戈莫德等与tPA合用也取得一些令人鼓舞的结果[3]。其中,尿酸是内源性抗氧化和(或)硝化物质,实际上属于增强机体内在防御机制的治疗策略。另外,研究发现,缺血适应具有明确的神经保护作用,是机体内在的防御机制。当前,远隔适应神经保护器械疗法已进入临床试验阶段。这些证据支持了本课题组正在研发的脑卒中治疗新药NMN。本课题组从一开始就将靶点研究瞄准了机体内在防御机制。从现有临床前实验证据看,无论是Nampt靶点还是在研新药NMN,均显示对脑缺血具有多重保护作用。NMN对脑出血无害有益(也有神经保护作用),提示NMN使用时不需考虑脑卒中类型,可以尽早用药,避免脑细胞死亡;NMN对血管新生、神经再生具有促进作用,有利于脑卒中后功能恢复,这些优点和特点使得NMN被寄予更高的研发期望。本课题组还将在人源化脑卒中模型、非人灵长类脑卒中猴模型上测试NMN的疗效,希望能最终获得成功。
[1]Wang P,Miao CY.NAMPT as a therapeutic target against stroke[J].Trends Pharmacol Sci,2015,36(12):891-905.
[2]Hankey GJ.Stroke[J].Lancet, 2016,doi:10.1016/S0140-6736(16)30962-X.
[3] Chamorro A,Dirnagl U,Urra X,Planas AM. Neuroprotection in acute stroke:targeting excitotoxicity,oxidative and nitrosative stress,and inflammation[J].Lancet Neurol,2016,15(8):869-881.
[4]Hill MD,Martin RH,Mikulis D,Wong JH,Silver FL,Terbrugge KG,et al.Safety and efficacy of NA-1 in patients with iatrogenic stroke after endovascular aneurysm repair(ENACT):a phase 2,randomised,double-blind,placebo-controlled trial[J].Lancet Neurol,2012,11(11):942-950.
[5]Liu X,Wang L,Wen A,Yang J,Yan Y,Song Y,et al.Ginsenoside-Rd improves outcome of acute ischaemic stroke-a randomized,double-blind,placebo-controlled,multicenter trial[J].Eur J Neurol,2012,19(6):855-863.
[6]Feng S,Yang Q,Liu M,Li W,Yuan W,Zhang S,et al.Edaravone for acute ischaemic stroke[J].CochraneDatabaseSystRev, 2011,(12):CD007230.
[7]Di Menna L,Molinaro G,Di Nuzzo L,Riozzi B,Zappulla C,Pozzilli C,et al.Fingolimod protects cultured cortical neurons against excitotoxic death[J].Pharmacol Res,2013,67(1):1-9.
[8] Camerer E,Regard JB,Cornelissen I,Srinivasan Y,Duong DN,Palmer D,et al.Sphingosine-1-phosphate in the plasma compartment regulates basal and inflammation-induced vascular leak in mice[J].J Clin Invest,2009,119(7):1871-1879.
[9]Wei Y,Yemisci M,Kim HH,Yung LM,Shin HK,Hwang SK,et al.Fingolimod provides long-term protection in rodent models of cerebral ischemia[J].Ann Neurol,2011,69(1):119-129.
[10] Liu J,Zhang C,Tao W,Liu M.Systematic review and meta-analysis of the efficacy of sphingosine-1-phosphate(S1P) receptoragonistFTY720(fingolimod)in animal models of stroke[J].Int J Neurosci,2013,123(3):163-169.
[11] Cipriani R,Chara JC,Rodriguez-Antiguedad A,Matute C.FTY720 attenuates excitotoxicity and neuroinflammation[J].J Neuroinflammation,2015,12:86.
[12]Llovera G,Hofmann K,Roth S,Salas-Perdomo A,Ferrer-Ferrer M,Perego C,et al.Results of a preclinicalrandomized controlled multicenter trial(pRCT):Anti-CD49d treatment for acute brain ischemia[J].Sci Transl Med,2015,7(299):299ra121.
[13]Wang P,Xu TY,Guan YF,Su DF,Fan GR,Miao CY.Perivascular adipose tissue-derived visfatin is a vascular smooth muscle cell growth factor:role of nicotinamide mononucleotide[J].Cardiovasc Res,2009,81(2):370-380.
[14]Zhang RY,Qin Y,Lv XQ,Wang P,Xu TY,Zhang L,et al.A fluorometric assay for highthroughput screening targeting nicotinamide phosphoribosyltransferase[J].Anal Biochem,2011,412(1):18-25.
[15]Wang P,Xu TY,Guan YF,Tian WW,Viollet B,Rui YC,et al.Nicotinamide phosphoribosyltransferase protects against ischemic stroke through SIRT1-dependent adenosine monophosphate-activated kinase pathway[J].Ann Neurol,2011,69(2):360-374.
[16]Wang P,Vanhoutte PM,Miao CY.Visfatin and cardio-cerebro-vascular disease[J].J Cardiovasc Pharmacol,2012,59(1):1-9.
[17]Wang P,Guan YF,Du H,Zhai QW,Su DF,Miao CY.Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia[J].Autophagy,2012,8(1):77-87.
[18]Song J,Ke SF,Zhou CC,Zhang SL,Guan YF,Xu TY,et al.Nicotinamide phosphoribosyltransferase is required for the calorie restriction-mediated improvements in oxidative stress,mitochondrial biogenesis,and metabolic adaptation[J].J Gerontol A Biol Sci Med Sci,2014,69(1):44-57.
[19]Zhao Y,Liu XZ,Tian WW,Guan YF,Wang P,Miao CY.Extracellular visfatin has nicotinamide phosphoribosyltransferase enzymatic activity and is neuroprotective against ischemic injury[J].CNS Neurosci Ther,2014,20(6):539-547.
[20]Wang P,Du H,Zhou CC,Song J,Liu X,Cao X,et al.Intracellular NAMPT-NAD+-SIRT1 cascade improves post-ischaemic vascular repair by modulating Notch signalling in endothelial progenitors[J].Cardiovasc Res,2014,104(3):477-488.
[21]Wang P,Guan YF,Li WL,Lu GC,Liu JM,Miao CY.Nicotinamide phosphoribosyltransferase facilitates post-stroke angiogenesis[J].CNS Neurosci Ther,2015,21(5):475-477.
[22]Zhao Y,Guan YF,Zhou XM,Li GQ,Li ZY,Zhou CC,et al.Regenerative neurogenesis after ischemic stroke promoted by nicotinamide phosphoribosyltransferase-nicotinamide adenine dinucleotide cascade[J].Stroke, 2015,46(7):1966-1974.
[23]Wang X,Xu TY,Liu XZ,Zhang SL,Wang P,Li ZY,et al.Discovery of Novel Inhibitors and Fluorescent Probe Targeting NAMPT[J].Sci Rep,2015,5:12657.
[24]Xu TY,Zhang SL,Dong GQ,Liu XZ,Wang X,Lv XQ,et al.Discovery and characterization of novel small-molecule inhibitors targeting nicotinamide phosphoribosyltransferase[J].Sci Rep,2015,5:10043.
[25]Wang SN,Xu TY,Wang X,Guan YF,Zhang SL,Wang P,et al.Neuroprotective efficacy of an aminopropyl carbazole derivative P7C3-A20 in ischemic stroke[J].CNS Neurosci Ther,2016,22(9):782-788.
[26]Wang P,Li WL,Liu JM,Miao CY.NAMPT and NAMPT-controlled NAD metabolism in vascular repair[J].J Cardiovasc Pharmacol,2016,67(6):474-481.
[27]Wang SN,Xu TY,Li WL,Miao CY.Targeting nicotinamide phosphoribosyltransferase as a potential therapeutic strategy to restore adult neurogenesis[J].CNS Neurosci Ther,2016,22(6):431-439.
Target and drug research for stroke treatment
MIAO Chao-yu
(Department of Pharmacology,Second Military Medical University,Shanghai 200433,China)
As the first most common cause of death in China,stroke has become a public health problem that seriously affects national economy and people′s livelihood.Unfortunately,only 3%to 5%of stroke patients receive tissue plasminogen activator(tPA)treatment,the only pharmacological therapy ap⁃proved for ischemic stroke,and no drug is available for hemorrhagic stroke.Therefore,there is an ur⁃gent need to develop new drugs for stroke therapy.Despite the awareness that neuroprotective agents could be a common strategy for the treatment of both ischemic and hemorrhagic stroke,numerous neu⁃roprotective agents have showed failure in clinical trials.Combined with the current therapeutic strategies and drug development of stroke,this paper elaborated the stroke injury mechanisms and corresponding clinical drug research targeting excitotoxicity,oxidative and nitrosative stress,and inflammation.From a new perspective,this paper has proposed a novel therapeutic strategy targeting inherent defense mechanisms against stroke,with nicotinamide phosphoribosyltransferase(Nampt)-nicotinamide ade⁃nine dinucleotide defense system as an example to present our experimental evidence that Nampt can serve as an anti-stroke target and nicotinamide mononucleotide as an anti-stroke agent under development. It is hoped that the bottleneck of stroke therapy can be overcome with unremitting efforts so as to reduce the financial burden and mental stress,and bring benefits to people around the world.
stroke;therapeutic target;drug research;neuroprotective agent;Nampt;secreted protein
MIAO Chao-yu,E-mail:cymiao@smmu.edu.cn
R966
A
1000-3002-(2016)12-1264-09
10.3867/j.issn.1000-3002.2016.12.005
Foundation item:The project supported by National Natural Science Foundation of China(81373414);National Natural Science Foundation of China(81130061);National Natural Science Foundation of China(30525045);National Science and Technology Major Project of China(2009ZX09303-002);National Basic Research Program of China(973 Program)(2009CB521902);Military Medicine Major Project of PLA(16CXZ009);and Science and Technology Supporting Program of Shanghai City(16431901400)
2016-12-02接受日期:2016-12-22)
(本文编辑:齐春会)
国家自然科学基金(81373414);国家自然科学基金(81130061);国家自然科学基金(30525045);国家重大新药创制专项(2009ZX09303-002);国家973计划(2009CB521902);军事医学创新工程专项(16CXZ009);上海市科技支撑项目(16431901400)
缪朝玉,E-mail:cymiao@smmu.edu.cn
