顺铂损伤后幼年斑马鱼侧线毛细胞STAT3的表达及意义
2016-02-15翁宇航陈飒周金章刘惠刚龙孝斌
翁宇航陈飒周金章刘惠刚龙孝斌
1南方医科大学珠江医院(广州510280)
2佛山市顺德区第一人民医院(佛山528300)
·基础研究·
顺铂损伤后幼年斑马鱼侧线毛细胞STAT3的表达及意义
翁宇航1陈飒1周金章2刘惠刚1龙孝斌1
1南方医科大学珠江医院(广州510280)
2佛山市顺德区第一人民医院(佛山528300)
目的建立斑马鱼侧线神经丘的顺铂损伤模型,检测STAT3基因的表达情况,探讨其在毛细胞顺铂损伤过程中所发挥的作用,为抗顺铂耳毒性的研究提供理论依据。方法将受精后5天的斑马鱼幼鱼利用250 μM顺铂溶液浸泡3小时建模,通过Yo-pro-1荧光染色、TUNEL染色了解毛细胞损伤情况,利用RT-qPCR、原位杂交等技术检测STAT3基因的表达改变。结果使用250 μM顺铂溶液浸泡斑马鱼幼鱼3小时,可使其侧线神经丘毛细胞数降低(P<0.001),可诱导侧线神经丘出现细胞凋亡(P<0.001),且在此过程中,STAT3基因的表达出现上升(P<0.001)。结论STAT3在顺铂对斑马鱼侧线神经丘毛细胞的损伤过程中可能与毛细胞凋亡相关并扮演一定角色。STAT3表达的升高与细胞凋亡的升高同时发生,表明STAT3在一定条件下可能存在促凋亡的作用。
顺铂;斑马鱼;毛细胞;损伤;STAT3
顺铂(cisplatin,CDDP)作为临床常用化疗药物,其应用一直因其耳毒性及肾毒性而受到极大限制,如何克服顺铂的毒副作用一直是学者们研究的焦点。顺铂的耳毒性可造成感音神经性耳聋,感音神经性耳聋治疗的根本方法,是内耳感觉细胞的修复或再生[1];而对于有明确耳毒性的药物,通过阻断其耳毒相关通路,预防耳毒性的发生,无疑是最佳应对方法。顺铂耳毒性机制仍不明确,目前认为主要有氧化应激学说与细胞凋亡学说[2];此外,顺铂的耳毒性还与毛细胞成熟度、力学信号传导因素、细胞内环境pH值等因素相关[3]。斑马鱼的侧线系统由大量的神经丘组成,神经丘内含感觉毛细胞,由于其结构及功能与内耳毛细胞极为相似且便于活体观察及干预,现已广泛用于毛细胞损伤与再生、遗传性聋、药物筛查、行为学研究等[4]。
目前已经证实信号转导与转录激活因子家族(STATs)中的STAT1和STAT6在顺铂毛细胞损伤中起到促进作用[5,6]。最近的实验证据表明,敲除STAT1后可减少毛细胞死亡数量[5]。STATs家族的另一个成员——STAT3对细胞凋亡的作用却仍存在争议。本文主要采用荧光定量聚合酶链式反应(RT-qPCR)法及整体原位杂交技术检测斑马鱼侧线神经丘毛细胞顺铂损伤前后STAT3的表达变化,探讨其在毛细胞顺铂损伤过程中所发挥的作用,为抗顺铂耳毒性的研究提供理论依据。
1 材料与方法
1.1 实验对象
野生型AB品系斑马鱼成鱼由南方医科大学基础医学院基因工程研究所发育生物学教研室提供,养殖于28.5℃系统水中(盐浓度为0.03%-0.04%,PH7.4-7.5,人工光源控制斑马鱼生活环境光照周期,照明14h/黑暗10h交替),养殖系统为北京爱生公司净水系统。饵料选用孵育的盐水虾,每天上下午各饲喂1次。实验所用幼鱼由成鱼配卵孵育所得,收集鱼卵前一天挑选1年龄左右的同种品系成年斑马鱼数对(雄性:雌性1:2),放置于安装有挡板的小培育缸中,雌雄斑马鱼用挡板隔开。收集鱼卵当天早晨8:30打开光源,撤除培育缸内的挡板,斑马鱼受光照刺激会出现“追尾”现象,随后雌鱼产卵。将雌雄斑马鱼交配后半小时内产生的受精卵吸出,系统水清洗干净后放入盛有系统水(加美蓝)的培养皿中,置于28.5℃孵箱中,每天更换培养液并移除坏死的鱼卵,直至胚胎发育至5 dpf(days-post-fertilization,受精后5天)。
1.2 实验试剂与实验仪器
1.2.1 主要实验试剂
顺铂粉剂(P4394-25MG,Sigma),三卡因(MS-222,Sigma),多聚甲醛粉剂(PFA,Sigma),荧光活性染料Yo-pro-1(life),TUNEL试剂盒(Takara),To⁃tal RNA Isolation Kit试剂盒(TaKaRa)、T7聚合酶(thermo)、DEPC Water(TaKaRa)、6×DNA Lodding Buf⁃fer、Taq DNA聚合酶(TaKaRa)、RNase Inhibitor(TaKa⁃Ra)、T4 DNA连接酶(TaKaRa)、HindⅢ限制性内切酶(TaKaRa)、BamhⅠ限制性内切酶(TaKaRa)、质粒提取试剂盒(thermo)、DNA片段纯化试剂盒(thermo)、磷酸盐缓冲液(PBS,南方医科大学试剂中心)
1.2.2 主要实验仪器
斑马鱼养殖单元及反渗透净水机(北京爱生科技),ZSD-A1160A光照培养箱(上海智城分析仪器),BX51正置荧光显微镜(Olympus),SZX10体式显微镜(Olympus公司),PE9600PCR扩增仪(北京东胜创新生物科技),LightCycler®Nano qPCR仪(Roche)
1.3 实验方法
1.3.1 模型建立方法
下述同一实验所用斑马鱼均为同一批次产。将发育至5dpf野生AB型斑马鱼幼鱼随机分为顺铂处理组和对照组。顺铂处理组幼鱼使用250 μM顺铂溶液避光处理3小时;对照组幼鱼使用系统水避光处理相同时间。干预后,弃去顺铂溶液或系统水,并用系统水清洗3次,每次5分钟。
1.3.2 斑马鱼侧线毛细胞活体染色计数
取顺铂处理组(CDDP)和对照组(Control)斑马鱼各10条,分别按照上述建模方法干预、清洗后,加入2 μM Yo-Prp-1活体染液,避光染色1小时后,系统水清洗3次,每次5分钟。随后将斑马鱼置于0.02%MS-222(三卡因)溶液中进行麻醉,再移至凹面载玻片上,加4%甲基纤维素于载玻片上并调整其体位为右侧卧位。荧光显微镜下观察毛细胞形态并拍照,取SO1、SO2、O1、OC1四个神经丘进行毛细胞计数,神经丘命名方法参考该文献[7]。
1.3.3 斑马鱼侧线神经丘凋亡染色
取顺铂处理组及对照组斑马鱼各10条。分别按照上述建模方法干预、清洗后,使用4%多聚甲醛溶液固定斑马鱼,再将斑马鱼移入TUNEL染液中37℃避光处理1小时,弃掉染液,用系统水清洗3次,每次5分钟。移至凹面载玻片上,加4%甲基纤维素并调整至右侧卧位,在荧光显微镜下观察侧线神经丘凋亡信号点、拍照并计数P1-P6六个神经丘的阳性细胞数。1.3.4 实时荧光定量检测
取顺铂处理组及对照组,每组10条。经过顺铂或系统水干预处理后,直接将幼鱼置入RNA提取液中,使用1ml注射器抽吸获得组织匀浆,根据TaKaRa公司的操作手册进行总RNA的提取。使用TaKaRa反转录试剂盒进行cDNA的合成。按照下列组成配置PCR反应液:总量10μl,SYBR Premix Ex Taq II (Tli RNaseH Plus)5μl,Reverse Primer(10 μM)0.5μl, Forward Primer(10 μM)0.5μl,cDNA 1μl,ddH2O 3μl。反应条件:94℃维持300秒,然后按94℃30秒,57℃30秒,72℃30秒在荧光定量PCR仪上进行32个循环。所用引物根据基因库核苷酸序列,STAT3引物参考文献[8],用Primer5.0引物设计软件设计(具体引物序列见表1)。
1.3.5 原位杂交技术
取顺铂处理组及对照组斑马鱼,经过顺铂或系统水干预处理后用多聚甲醛固定,然后使用梯度甲醇脱水、蛋白酶K消化,漂洗后加入预杂交液,再加入地高辛标记的探针,60℃环境中过夜。移除探针,用缓冲液在60℃环境下洗涤6次,室温下将斑马鱼置于封闭液中封闭1小时,加入抗体阻断液4℃过夜。取出样本,移除抗体后用PBST洗涤6次,染色并再次用PBST洗涤。4%多聚甲醛再固定后,将斑马鱼放入70%甘油中,4℃保存。观察前经过梯度脱水、梯度复水、甘油脱水,最后用100%甘油处理2小时,显微镜下观察并拍照,观察在斑马鱼幼鱼侧线上STAT3基因mRNA的表达情况。
1.3.6 统计学方法
资料分析采用SPSS 20.0统计分析软件,数据以均值±标准差(±s)表示。两组间比较采用两独立样本t检验,方差齐性检验采取Levene检验。设P<0.05差异有统计学意义。
2 实验结果
2.1 顺铂对斑马鱼侧线毛细胞造成损伤
经过顺铂或生理盐水干预3小时并染色后,荧光显微镜下计数斑马鱼侧线SO1、SO2、O1、OC1四个神经丘之毛细胞,以其平均值代表斑马鱼侧线神经丘的毛细胞数。统计结果显示:顺铂处理组斑马鱼侧线神经丘毛细胞数均数为5.03±0.59,对照组斑马鱼侧线神经丘毛细胞数均数为10.78±0.65,二者经t检验差异有统计学意义(图1,t=20.636,P<0.01)。这表明经过250 μM顺铂溶液处理3小时后,斑马鱼侧线神经丘的毛细胞数较正常水平出现下降,即顺铂可造成斑马鱼侧线神经丘毛细胞的损伤。此外,笔者在预实验中发现,斑马鱼侧线神经丘毛细胞数量随干预的顺铂溶液浓度增加而减少,且顺铂作用时间越长,侧线毛细胞数量减少越明显(数据未显示),说明顺铂对斑马鱼侧线毛细胞的损伤具有浓度以及时间依赖性。
2.2 顺铂诱导斑马鱼侧线毛细胞凋亡
用250 μM顺铂处理5dpf斑马鱼3小时后,检测斑马鱼侧线P1-P6六个神经丘凋亡信号,以该6个神经丘凋亡细胞计数平均值代表斑马鱼侧线神经丘的细胞凋亡水平,检测结果见图2。顺铂处理组平均凋亡细胞数为0.833±0.11,对照组平均凋亡细胞数为0.033±0.07,两组差异有统计学意义(t=19.243,P<0.01)。这说明顺铂处理组斑马鱼侧线神经丘凋亡细胞较对照组增多,提示顺铂处理后斑马鱼侧线神经丘毛细胞出现细胞凋亡,顺铂的促凋亡作用是造成斑马鱼神经丘毛细胞损伤的重要原因。2.3顺铂干预后STAT3 mRNA的表达增加
采用RT-qPCR的方法分析斑马鱼STAT3 mRNA在顺铂处理前后的表达变化情况,结果如图3C所示。顺铂处理组斑马鱼的STAT3 mRNA的表达较对照组上升,二者差距有统计学意义(t=14.316,P<0.01)。这说明,顺铂的干预能促进斑马鱼STAT3基因mRNA的表达。
2.4 原位杂交结果
经过原位杂交后,STAT3 mRNA富集的细胞会被抗体标记,镜下表现为蓝紫色(图3A、B)。通过显微照片可以看出,顺铂处理组斑马鱼的侧线神经丘上,STAT3基因表达比对照组明显增多。
3 讨论
斑马鱼作为近年新兴的一种脊椎动物模式生物,其易于饲养、生殖周期短、繁殖能力强、基因同源性高等诸多优点使其成为越来越多的研究者青睐的研究对象。侧线系统作为鱼类及两栖类动物的远距触觉器官,其功能是探测局部水流及压力变化,调节诸如学习及逃避扑食之类的行为。斑马鱼体表侧线系统由大量单个神经丘组成,每个神经丘中央包含一簇由传入及传出神经支配的毛细胞,而毛细胞周围为支持细胞所包绕。侧线神经丘位于体表、易于观察、可定量分析,是研究毛细胞损伤及再生的理想模型。与内耳毛细胞不同,神经丘内毛细胞可简单地用活体染料染色观察。此外,侧线毛细胞与其它毛细胞一样来自始基,并具相似的发育和分化方式,且在结构、功能及分子基础上与内耳毛细胞极为相似。受精后5天斑马鱼侧线系统与受精后4天之前相比已经成熟,且与受精后7天在数量上没有明显差异;而受精后7天以后由于鱼体发育过快、色素生长等原因不利于给药及观察。因此既往研究多选用受精后5天斑马鱼作为实验对象,并且已经证明可以利用受精后5天的斑马鱼建立不同的药物毒性模型及进行药物筛选。本实验验证了用顺铂浸泡的方法可以造成幼年斑马鱼侧线神经丘的毛细胞损伤,并且这种损伤具有时间和浓度依赖性。由此可快速建立顺铂毛细胞毒性模型,并且此种模型既省去了解剖的繁琐过程,又可以对观察对象进行活体在体实时观察,这是目前其他动物模型所不具备的。
毛细胞的损伤主要有两种形式:坏死和凋亡。在其他物种的实验中,与普遍认为的氨基糖苷类抗生素可引起两种形式的死亡不同,顺铂主要是诱导毛细胞凋亡[9,10]。顺铂对肿瘤细胞的细胞毒性作用主要依赖于其与细胞核DNA建立的烷基化样链接[11]。随后高迁移率族(high mobility group,HMG)蛋白与此链接结合,形成顺铂-DNA-HMGB1复合体,起到阻断转录因子的作用,从而抑制肿瘤细胞的转录及增值[9]。而对于顺铂损伤毛细胞,既往在各种动物实验中,包括大鼠、小鼠、几内亚猪及斑马鱼,均有证据提示顺铂通过细胞凋亡途径诱导毛细胞损害[12-15]。本研究发现,在顺铂组斑马鱼TUNEL阳性细胞较对照组明显增高,说明顺铂能诱导其毛细胞产生凋亡,顺铂干预后毛细胞的缺失与其发生的细胞凋亡有关,这与其他实验的结论是一致的[9,12,13,15]。
STAT3作为STATs中重要的一员,是JAK-STAT信号通路的重要环节。正常组织细胞中,STAT3主要参与细胞的增殖、分化和凋亡等过程。生长因子、细胞因子等多肽类配体在细胞表面与相应的受体结合,受体在胞浆内与受体型酪氨酸蛋白激酶JAKs相结合,受体上的酪氨酸残基磷酸化并使JAKs活化;活化的JAKs和受体募集细胞浆内的STAT3,最终激活STAT3。正常情况下,STAT3的激活非常迅速,且持续时间短暂;若STAT3蛋白持续表达,则可以导致细胞过度增殖、分化,促进肿瘤细胞的发生,并且促进肿瘤细胞侵袭、转移和免疫逃避[16]。已有报道显示,在鼻咽癌和喉癌组织中,癌症组STAT3的表达量要明显高于阴性对照组,并且与肿瘤淋巴结转移正相关;而在甲状腺肿瘤中,STAT3的表达却与肿瘤的大小和转移呈负相关[17]。目前关于STAT3促进细胞凋亡的研究认为STAT3在大鼠脑缺血再灌注模型中表达上调,并且与细胞凋亡水平呈正相关[18,19],亦有研究发现STAT3在大鼠重症急性胰腺炎模型肺损伤过程中高表达,提示其与细胞急性坏死有关[20]。同时亦有研究发现,顺铂能降低大鼠的耳蜗组织STAT3蛋白表达[21],提示STAT3并未在顺铂的毛细胞毒性中发挥积极的促凋亡作用。另有研究认为STAT3的激活可以促进抗凋亡蛋白如Bcl2及IAP家族蛋白的表达[22],即发挥抗凋亡作用。本研究在原位杂交实验中发现,经过顺铂处理后幼年斑马鱼侧线神经丘STAT3 mRNA表达升高,且RT-qPCR的结果显示与原位杂交结果相符合,提示STAT3在顺铂对斑马鱼侧线神经丘毛细胞的损伤过程中可能与毛细胞凋亡相关并扮演一定角色。STAT3表达的升高与细胞凋亡的升高同时发生,提示STAT3在一定条件下可能存在促凋亡的作用。
4 展望
STAT3表达升高伴随细胞凋亡升高并不一定就说明其具备促细胞凋亡的作用。后续实验中,计划采用STAT3的抑制剂或基因敲除的方法,抑制STAT3的表达,通过观察抑制后STAT3的表达水平与毛细胞计数、毛细胞凋亡计数以及原位杂交的结果,进一步研究STAT3在顺铂对幼年斑马鱼侧线神经丘毛细胞的损伤过程中所发挥的作用。
附录:
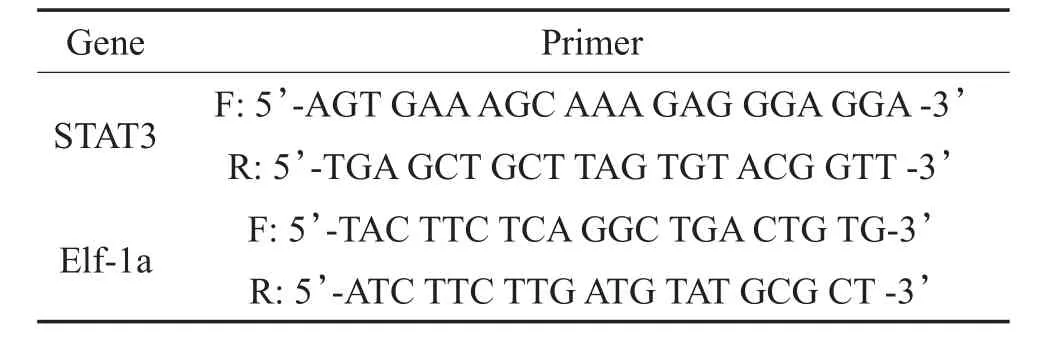
表1 RT-qPCR所用引物序列Table 1 The primers for RT-qPCR
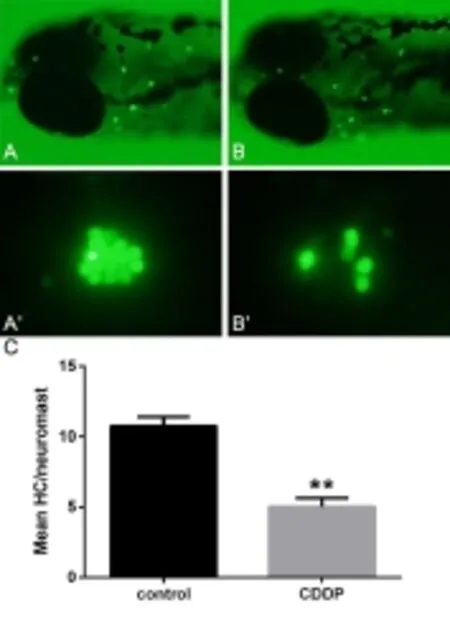
图1 顺铂处理前后斑马鱼侧线神经丘毛细胞数量变化Fig.1 HC in the neuromasts of zebrafish decreased after cisplatin injectionsA Neuromasts of zebrafish in the control group(100X),B Neuro⁃masts of zebrafish in the CDDP group,A’OC1 of zebrafish in the control group(400X),B’OC1 of zebrafish in the control group,C Mean HC/neuromast,n=20,**P<0.001
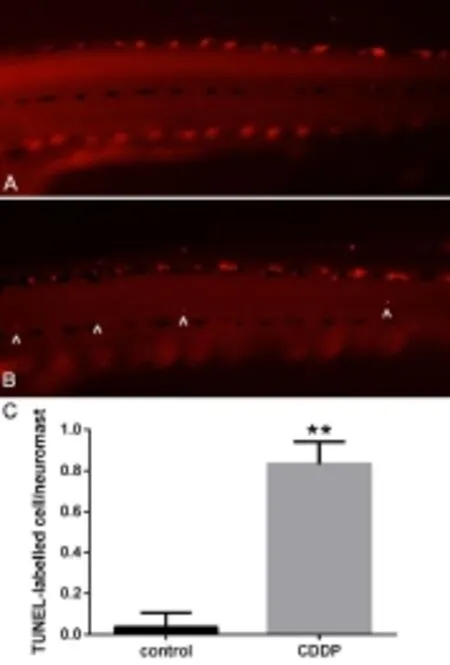
图2 顺铂损伤后斑马鱼侧线神经丘凋亡信号检测Fig.2 TUNEL-labeled cells in zebrafish lateral line neuromast after cisplatin injections
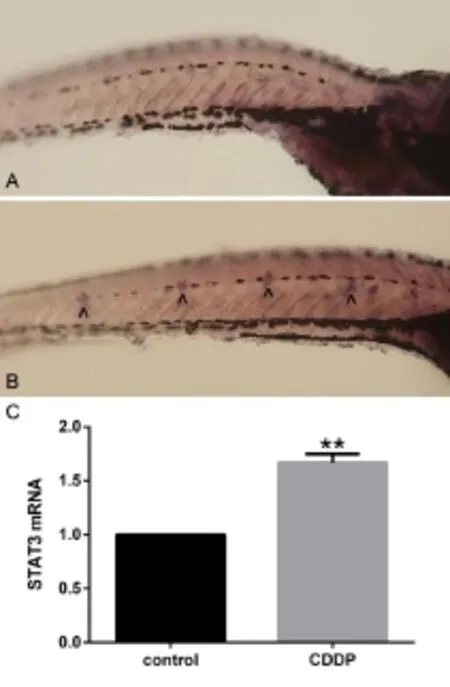
图3 斑马鱼侧线神经丘STAT3基因的表达检测Fig.3 STAT3 expression in the neuromasts of zebrafish lateral lineA In situ hybridization of zebrafish in the control group(100X), B In situ hybridization of zebrafish in the CDDP group,C STAT3 mRNAexpression,n=20,^STAT3+cell,**P<0.001
1 杨仕明,吴南.攻克感音神经性耳聋治疗难题的基础研究[J].中华耳科学杂志,2013,11(3):329-334.
Yang SM,Wu N.Basic Research for a Cure for Challenging Sensori⁃neural Deafness[J].Chinese Journal of Otology,2013,11(3): 329-334.
2 丁大连,亓卫东,张梅,等.顺铂及其耳毒性[J].中华耳科学杂志, 2008,(02):125-133.
Ding DL,Qi WD,Zhang M,et al.Cisplatin and its Ototoxicity [J].Chinese Journal of Otology,2008,(02):125-133.
3 翁宇航,龙孝斌.斑马鱼毛细胞损伤及再生研究进展[J].中华耳科学杂志,2015,(01):83-86.
Weng YH,Long XB.Injury and Regeneration of Zebrafish Hair Cells[J].Chinese Journal of Otology,2015,(01):83-86.
4 周金章,龙孝斌.脊柱模式生物斑马鱼用于内耳科学领域研究的进展[J].听力学及言语疾病杂志,2014,(06):658-661.
Zhou JZ,Long XB.Recent Advance on the Application of Zebrafish in Inner Ear Study[J].Journal of Audiology and Speech Pathology, 2014,(06):658-661.
5 Schmitt NC,Rubel EW,Nathanson NM.Cisplatin-induced hair cell death requires STAT1 and is attenuated by epigallocatechin gallate [J].J Neurosci,2009,29(12):3843-3851.
6 Lee JE,Nakagawa T,Kim TS,et al.Role of reactive radicals in de⁃generation of the auditory system of mice following cisplatin treat⁃ment[J].Acta Otolaryngol,2004,124(10):1131-1135.
7 Harris JA,Cheng AG,Cunningham LL,et al.Neomycin-induced hair cell death and rapid regeneration in the lateral line of zebrafish (Danio rerio)[J].J Assoc Res Otolaryngol,2003,4(2):219-234.
8 Liang J,Wang D,Renaud G,et al.The stat3/socs3a pathway is a key regulator of hair cell regeneration in zebrafish[J].J Neurosci, 2012,32(31):10662-10673.
9 Schacht J,Talaska AE,Rybak LP.Cisplatin and aminoglycoside an⁃tibiotics:hearing loss and its prevention[J].Anat Rec(Hoboken), 2012,295(11):1837-1850.
10 Liang F,Schulte BA,Qu C,et al.Inhibition of the calcium-and volt⁃age-dependent big conductance potassium channel ameliorates cis⁃platin-induced apoptosis in spiral ligament fibrocytes of the cochlea [J].Neuroscience,2005,135(1):263-271.
11 Wang D,Lippard SJ.Cellular processing of platinum anticancer drugs[J].Nat Rev Drug Discov,2005,4(4):307-320.
12 Mukherjea D,Jajoo S,Kaur T,et al.Transtympanic administration of short interfering(si)RNA for the NOX3 isoform of NADPH oxi⁃dase protects against cisplatin-induced hearing loss in the rat[J]. Antioxid Redox Signal,2010,13(5):589-598.
13 Lim DJ,Moon SK,Park R,et al.Dexmedetomidine preconditioning attenuates Cisplatin-induced ototoxicity in zebrafish[J].Exp Mol Med,2014,7(4):275-280.
14 Lee CK,Shin JI,Cho YS.Protective Effect of Minocycline Against Cisplatin-induced Ototoxicity[J].Clin Exp Otorhinolaryngol,2011, 4(2):77-82.
15 Kim SJ,Ho Hur J,Park C,et al.Bucillamine prevents cisplatin-in⁃duced ototoxicity through induction of glutathione and antioxidant genes[J].2015,47:e142.
16 Frank DA.STAT3 as a central mediator of neoplastic cellular trans⁃formation.Cancer Lett[J],2007,251(2):199-210.
17 张伟,何晓松.STAT3与头颈肿瘤的研究进展[J].临床医学工程, 2014,(02):256-257.
Zhang W,He XS.Recent Advance on STAT3 in Head and Neck Can⁃cer[J].Clinical Medical&Engineering,2014,(02):256-257
18 范少华,张轶超,袁晓东,等.全脑缺血大鼠脑组织MiR210和stat3的表达与HIF-1α的相关性[J].山东大学学报(医学版), 2015,(03):1-5+11.
Fan SH,Zhang YC,Yuan SD,et al.Expressions of MiR2 1 0 and stat3 following global ischemia in rats and the potential relationship among MiR2 1 0,stat3 and HIF-1α[J].Journal of Shandong Univer⁃sity(Health Science),2015,(03):1-5+11.
19 谢惠芳,徐如祥,魏继鹏,等.大鼠脑缺血再灌注损伤后磷酸化JAK2、STAT3蛋白表达及细胞凋亡[J].南方医科大学学报,2007, (02):208-211+218.
Xie HF,Xu RX,Wei JP,et al.P-JAK2 and P-STAT3 protein ex⁃pression and cell apoptosis following focal cerebral ischemia-reper⁃fusion injury in rats[J].JOURNAL OF SOUTHERN MEDICAL UNI⁃VERSITY,2007,(02):208-211+218.
20 李敏利,朱人敏,张晓华,等.JAK2/STAT3信号通路在重症急性胰腺炎大鼠肺损伤中的作用[J].解放军医学杂志,2011,(06): 611-613.
Li ML,Zhu RM,Zhang XH,et al.The role of JAK2/STST 3 signal⁃ing pathway in the lung injury rat with severe acute pancreatitis[J]. MEDICAL JOURNAL OF CHINESE PEOPLE'S LIBERATION AR⁃MY,2011,(06):611-613.
21 Jamesdaniel S.Downstream targets of Lmo4 are modulated by cispla⁃tin in the inner ear of Wistar rats[J].PLoS One,2014,9(12): e115263.
22 Bhattacharya S,Ray RM,Johnson LR.STAT3-mediated transcrip⁃tion of Bcl-2,Mcl-1 and c-IAP2 prevents apoptosis in poly⁃amine-depleted cells[J].Biochem J,2005,392(Pt 2):335-344.
STAT3 Expression during Cisplatin-induced Hair Cell Injury in the Lateral Line in Zebrafish Larvae
WENG Yuhang1,CHEN Sa1,ZHOU Jinzhang2,LIU Huigang1,LONG Xiaobin1
1 Zhujiang Hospital of Southern Medical University,Guangzhou,510280
2 Shunde First People’s Hospital Affliated to Southern Medical University,Foshan,528300
ObjectiveTo develop a cisplatin-induced hair cell injury model using the lateral line system of zebrafish larvae and to detect the expression of STAT3 mRNA before and after cisplatin exposure.MethodsZebrafish larvae which were 5 days-post-fertilization were exposed to 250 μM cisplatin for 3 hours.Yo-pro-1-and Terminal dUTP Nick-End-Labeling(TUNEL-labeling)were used to examine hair cell densities and apoptosis,respectively.RT-qPCR and in situ hybridization were used to examine the expression level of STAT3.ResultsAfter being exposed to 250 μM cisplatin for 3 hours,hair cell densities of the neuromast in the lateral line of zebrafish larvae were significantly decreased(P<0.001),and the number of apoptotic cells significantly increased(P<0.001).Meanwhile,STAT3 expression was up-regulated(P<0.001).Conclusion STAT3 may be involved in hair cell apoptosis during hair cell injury induced by cisplatin.While apoptosis is activated at the same time,it indicates that STAT3 may be able to induce apoptosis.
cisplatin;zebrafish;hair cell;injury;STAT3
R764
A
1672-2922(2016)06-808-5
2016-08-09审核人:郭维维)
10.3969/j.issn.1672-2922.2016.06.021
翁宇航,硕士,研究方向:耳科学基础和临床
龙孝斌,Email:longfengxb@126.com
