SFE和AMD对光周期诱导菊花成花期芽和叶片蔗糖含量及其相关酶活性的影响
2016-02-10王文莉王秀峰孙宪芝郑成淑
王文莉,王秀峰,孙宪芝,郑成淑
山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,园艺作物生物学农业部重点开放实验室,山东泰安271018
SFE和AMD对光周期诱导菊花成花期芽和叶片蔗糖含量及其相关酶活性的影响
王文莉,王秀峰,孙宪芝,郑成淑*
山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,园艺作物生物学农业部重点开放实验室,山东泰安271018
以切花菊品种‘神马’为试材,研究了蔗糖合成酶促进剂SFE和抑制剂AMD对光周期诱导菊花成花过程芽和叶片中蔗糖含量及蔗糖代谢关键酶——蔗糖合成酶(SS)和蔗糖磷酸合成酶(SPS)活性的的影响。结果表明,SFE和AMD处理及对照叶片和芽中蔗糖含量在花芽分化启动期(II)均显著升高,分化启动后降低,其中AMD处理的上升幅度明显小于其它二者;SFE处理的叶片蔗糖含量在花瓣分化之前高于对照,AMD处理的则比对照及SFE处理的减少;芽中蔗糖含量始终低于叶片,但整个分化过程特别是中后期对照和SFE处理的芽中增幅高于叶中。SFE处理与对照叶片和芽中SPS和SS活性均随花芽分化启动有所增强,以叶片中SPS活性增幅最大,高达80.6%,比同期对照高26.8%;叶中SPS和SS活性高于芽中;分化启动后逐渐降低,但整个分化过程始终高于处理前水平;不同分化阶段SPS和SS活性变化与对照不尽相同,SS活性从处理至总苞鳞片分化期(III)持续升高达到峰值,而后下降在小花原基分化后期(V)与对照接近。AMD处理植株叶片和芽中SPS和SS活性自处理开始均有所下降,在花芽分化启动期(II)叶片SPS活性下降最多,达29.6%,芽中SS活性在III期降至最低,为分化前的33.7%,之后缓慢回升,至花瓣分化后期(VII)与其它二者接近。SFE和AMD处理对菊花花芽分化进程有影响,SFE处理的植株花芽分化启动和结束时间分别比对照提前1 d和2 d,AMD处理的则分别比对照推迟3 d和6 d。分析表明,AMD和SFE通过调节SPS和SS活性影响蔗糖合成进而影响菊花花芽分化进行.
菊花;花芽分化;SFE和AMD;蔗糖;蔗糖酶
蔗糖是植物光合作用的终产物之一,也是植物体内碳水化合物运输的主要形式,早在20世纪初研究者们通过大量实验证明,植物体内碳水化合物的积累达到一定水平才能引起植物开花,并提出C/N假说[1]。李兴军等[2]研究发现,杨梅花芽发端期叶片中蔗糖含量迅速增加,用GA3处理降低叶片蔗糖水平可抑制花芽分化;蔗糖合成受SPS(蔗糖磷酸合成酶,EC2.4.1.14)和SS(蔗糖合成酶,EC2.4.2.13)调节[3];蔗糖脂肪酸酯(SFE)能提高蔗糖酶的活性,而转录抑制剂(AMD)又可降低蔗糖酶活性[4]。已有研究证明,蔗糖是一种植物体内长距离信号传递的重要的胞间信使分子[5,6],并在植物进行光合作用、新陈代谢、逆境防御反应中起着长距离信息传递的作用[7,8]。Benier等[9]早期对长日植物白芥(Sinapis alba)进行长日照和黑夜打破处理诱导其花芽分化时,发现叶片和茎尖的蔗糖含量迅速增加,后相继有研究发现蔗糖参与光周期刺激信号的传递[10,11]。
菊花是我国传统名花,也是世界四大切花之一,目前通过光周期调节技术,可以周年生产切花菊,从而满足人们常年对菊花的消费需求。菊花花期调控的关键是花芽分化,但关于光周期诱导菊花花芽分化过程中蔗糖及其代谢相关酶方面的研究未见报道。本试验以国内栽培面积和产量最大的切花菊品种‘神马’为材料,利用光周期诱导其成花并用蔗糖合成酶促进剂SFE及抑制剂AMD进行处理,研究光周期诱导菊花花芽分化过程叶片和芽中蔗糖含量以及SPS、SS活性的变化特点,探讨蔗糖及其相关酶的活性变化与菊花花芽分化的关系,进一步揭示菊花花芽分化的生理机制,为菊花花期调控栽培提供理论依据。
1 材料与方法
1.1 试材
试验于2010年3月~2012年6月在山东农业大学园艺实验站及山东农业大学实验中心进行。供试材料为切花菊品种‘神马’(Dendranthema grandiflorium‘Shenma’)。3月把扦插生根的菊花苗(高10 cm左右)定植于直径为16 cm的花盆中(1盆1株),在自然光条件下培养45 d,完成正常营养生长后,挑选长势均匀、健壮的植株(高45 cm左右),放进人工气候室进行处理和采样。
1.2 试验设计
试验中光周期条件设置为9 h(昼)/15 h(夜),昼温23℃~25℃,夜温18℃~20℃;相对湿度为60%~70%;光照强度370 μmol·m-2·s-1。将供试菊花苗360株平均分成3组:Ⅰ,喷洒清水(对照);Ⅱ,喷施0.5 mmol·L-1SFE(sigma产品);Ⅲ,喷施0.2 mmol·L-1AMD。各处理均采用喷雾器全株叶面喷布法,以不滴液为度。
1.3 花芽分化进程的确定
处理后,每隔2~3 d切取顶芽,在解剖镜下剖芽观察并结合徒手切片,用生物倒置显微镜观察花芽形态分化进程。由于个体间花芽形态分化差异,每次取5个芽观察,以出现频率3次以上的形态作为该阶段某一个花芽形态分化时期。花芽分化开始(生长点肥厚变圆)所需天数是从处理到花序原基分化期(生长点扩大,呈半球形)所需天数。花芽分化完成所需天数是从处理到花瓣分化期(小花先端出现放射性开裂)所需天数。将花芽分化期分为7个时期(图1):未分化期(I)、花芽分化启动期(II)、总苞鳞片分化期(III)、小花原基分化前期(IV)、小花原基分化后期(V)、花瓣分化前期(VI)和花瓣分化后期(VII)。
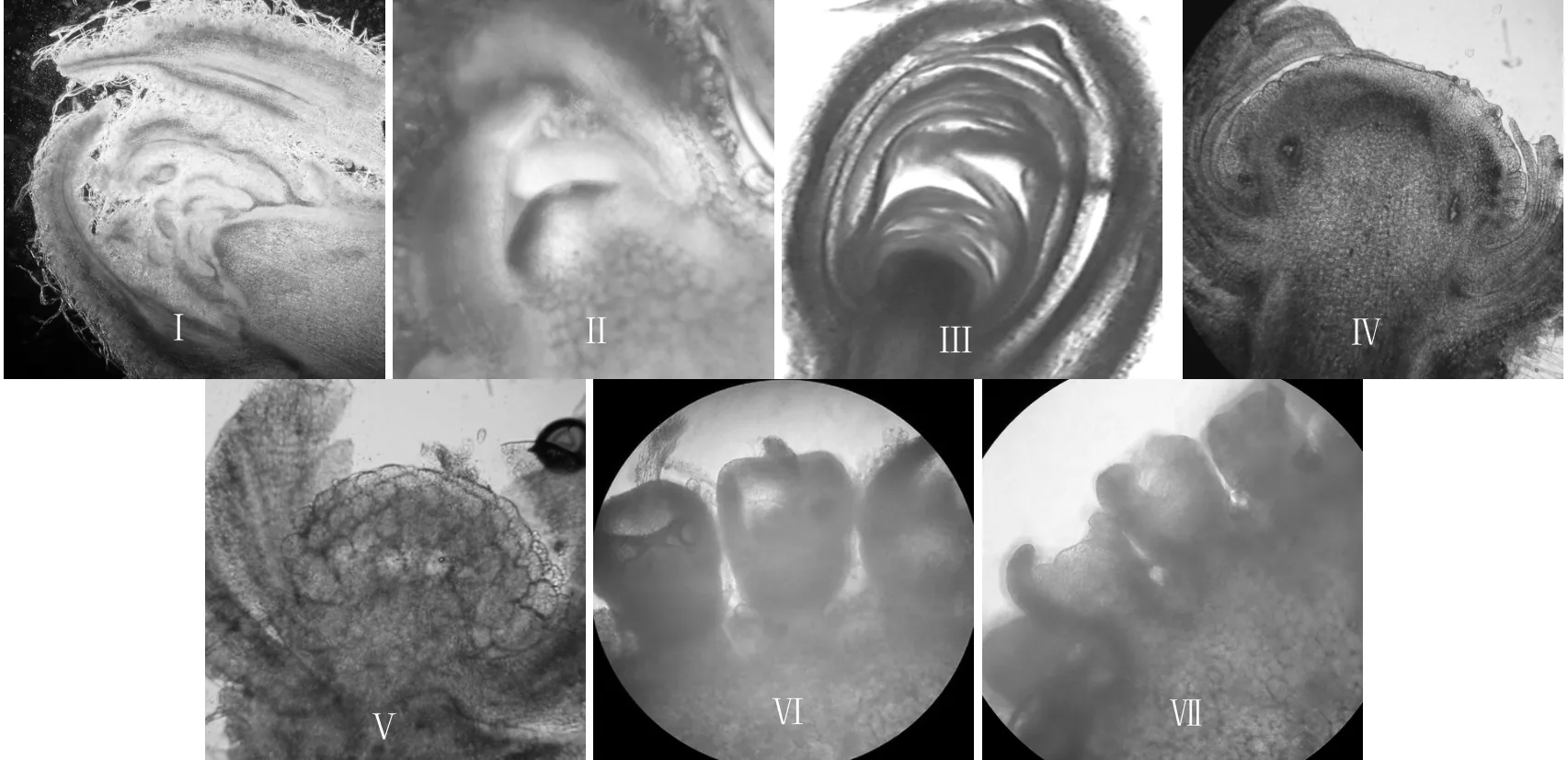
图1 光周期诱导菊花花芽分化各阶段Fig.1 Stages of floral differentiation of chrysanthemum under the photoperiodic induction.
1.4 采样及测定
光周期诱导前采样1次,以后结合花芽分化进程取不同处理及对照植株的完整成熟叶片(自顶端向下6~7节位叶片)和顶芽(2 cm左右),每次3个重复。于9:00左右取样,然后迅速用蒸馏水漂洗干净。一部分经105℃杀青15 min,70℃烘干至恒量,干样用研钵研碎,装入塑料袋中,在干燥器中保存,用于蔗糖分析测定。另一部分经液氮速冻后,放入-80℃的超低温冰箱中保存待测蔗糖酶活性。
1.4.1 蔗糖测定方法采用间苯二酚法[12]:取0.4 mL酒精提取液,加入200mL 2 mol·L-1NaOH,100℃煮沸5 min,冷却后加入2.8 mL 30%HCl,0.8 mL 0.1%间苯二酚,80℃水浴待10 min,冷却后在480 nm处比色测定。
1.4.2 酶提取及酶活性测定参照於新建[13]等人的方法,有改动。
酶的提取:取1 g组织在冰浴中研磨,加少量石英砂和10 mL HEPES缓冲液研磨匀浆,四层纱布过滤。弃沉淀,上清液逐渐加(NH4)2SO4至80%溶解度(8g/管),静置15 min,12000 rpm,4℃,20 min。弃上清夜,用2.5 mL提取液溶解沉淀,再用稀释10倍的提取缓冲液(不含PVPP)透析20 h。
蔗糖合成酶(SS)测定:0.1 mL 0.05 mol·L-1果糖+0.1 mL 3 mmol·L-1UDPG(尿苷二磷酸葡萄糖)+0.1 mL 0.1 mol·L-1Tris+0.05 mL 10 mmol·L-1MgCl2+0.2 mL酶液,37℃,30 min,沸水浴1 min,定容至1 mL,加0.1 mL 2 mol·L-1NaOH,沸水浴10 min,流水冲冷,加3.5 mL 30%HCl和1 mL 0.1%间苯二酚(用95%乙醇配置),摇匀,80℃水浴10 min,480 nm下比色。
蔗糖磷酸合成酶(SPS)测定:0.1 mL 0.05 mol·L-1F-6-P(6-磷酸果糖)+0.1 mL UDPG+0.1 mL 0.1 mol·L-1Tris+0.05 mL 10 m mol·L-1MgCl2+0.2 mL酶液,37℃,30 min,沸水浴1 min,定容至1 mL,加0.1 mL 2 mol·L-1NaOH,沸水浴10 min,加3.5 mL 30%HCl和1 mL 0.1%间苯二酚,80℃水浴10 min后480 nm下比色。
1.4 数据处理
采用Microsoft Excel软件对数据进行处理和绘图,利用SPSS17.0统计分析软件进行方差分析,并运用Duncan检验法对显著性差异进行多重比较。
2 结果与分析
2.1 SFE和AMD处理对菊花花芽分化进程的影响
由表1可以看出,对照菊花(CK)在短日照条件下,处理4 d后可诱导花芽分化启动,8 d总苞鳞片分化完成,12 d小花原基开始分化,15 d时小花原基分化结束,18 d进入花瓣分化前期,23 d时花瓣分化完成,即整个花芽分化过程结束。同样短日条件下,SFE处理的菊花花芽分化启动和结束时间分别比对照提前1 d和2 d;而AMD处理的则花芽分化启动时间晚,分化进程慢,启动和结束时间分别比对照推迟3 d和6 d。

表1 SFE和AMD处理对菊花花芽分化进程的影响Table 1 Effects of SFE and AMD treatments on the floral differentiation process of chrysanthemum
2.2 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖含量的影响
从图2可以看出,三处理叶片蔗糖含量在花芽分化过程中均出现先上升后下降的趋势,尤其是在花芽分化启动期(II)迅速上升,与未分化期(I)相比,分别增加了50.6%(CK)、77.3%(SFE)和28.9%(AMD),AMD处理增幅最小,花芽分化启动之后下降。Duncan多重比较分析表明,花芽分化启动期(II),对照及SFE处理植株叶片蔗糖含量与未分化期含量差异达极显著水平(P<0.01),AMD处理植株蔗糖含量与未分化期含量差异显著(P<0.05)。对照叶片在小花原基分化前期(Ⅳ)又出现一小的峰值后逐渐下降,SFE处理的叶片蔗糖含量自分化启动后持续下降,但在花瓣分化之前始终比对照的蔗糖含量高,AMD处理的蔗糖含量比对照和SFE处理的减少,而且在总苞鳞片分化期(III)有较大减少外基本保持稳定不变的状态。芽中蔗糖含量变化趋势与叶片蔗糖变化趋势基本一致。从整个分化过程看,芽中的蔗糖含量始终比叶片的蔗糖含量低,但分化启动后对照和SFE处理的植株芽中增幅高于叶中,尤其是分化启动期(II),与未分化期(I)相比,分别增加了63.7%(CK)、87.6%(SFE)和55.4%(AMD),SFE处理植株芽中蔗糖含量比对照增加27.0%,叶中仅增加10.3%;三处理芽中蔗糖含量分化启动期与处理前(I)含量差异均达极显著水平(P<0.01)。SFE处理植株将高水平保持至总苞鳞片分化期(III),后逐渐下降;AMD处理的蔗糖含量始终保持较低的水平。由此说明蔗糖合成激活剂SFE可以促进蔗糖在菊花叶片和芽中大量积累,而随着花芽分化的进行叶中蔗糖向花芽转移,为花芽分化提供物质和能量[14]。
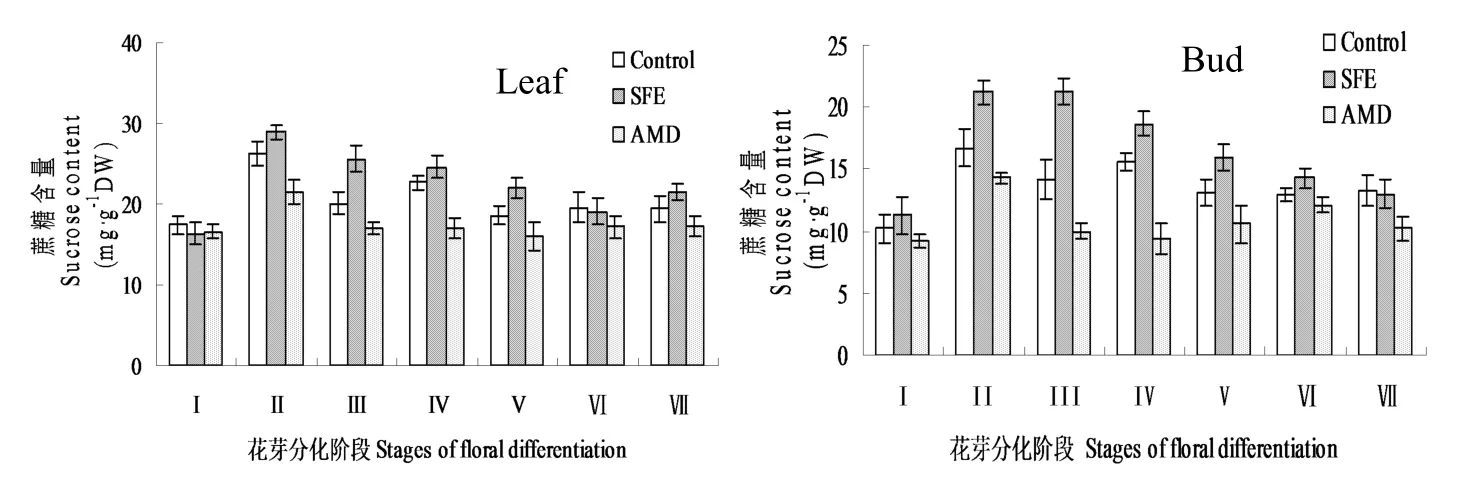
图2 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖含量的影响Fig.2EffectsofSFEandAMDtreatmentsonsucrosecontentsofleavesandbudsduringchrysanthemumdifferentiation
2.3 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖磷酸合成酶活性的影响
从图3可以看出,对照叶片蔗糖磷酸合成酶(SPS)活性在分化启动期(II)迅速上升并维持到小花原基分化前期(Ⅳ),之后下降;SFE处理植株的SPS活性比处理前(I)增加80.6%,且与同期(II)对照相比增加26.8%,分化启动后缓慢降低,至小花原基分化后期(Ⅴ)有较大幅度降低,此后与对照含量接近,至分化结束始终保持高于处理前水平;AMD处理植株叶片的SPS比处理前(I)降低29.6%,与对照相比减少57.1%,自处理开始一直保持较低水平,在小花原基分化后期有所回升至花瓣分化后期(Ⅶ)略高于Ⅰ期,与其它两处理含量接近。对照芽的SPS活性在未分化期含量较低,随着分化的进行,在分化启动期上升,之后逐渐回落,在略高于未分化期的水平上波动不大;SFE处理的芽中SPS活性高于对照,比对照增加13.5%,且从处理持续升高至总苞鳞片分化期(III)达峰值,后逐渐下降,在小花原基分化后期与对照接近;而AMD处理的SPS活性则低于对照,比对照降低30.1%,至花瓣分化期有所回升。芽中活性明显低于叶片,说明蔗糖合成以叶片中SPS作用为主。

图3 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖磷酸合成酶活性的影响Fig.3 Effects of SFE and AMD treatments on SPS activities of leaves and buds during chrysanthemum differentiation
2.4 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖合成酶活性的影响
从图4可以看出,对照叶片蔗糖合成酶(SS)活性在未分化期(I)含量较低,在花芽分化期(II)迅速上升,比I期增加68.5%,然后呈逐渐下降的趋势;SFE处理的SS活性与对照相比始终保持较高的水平,将高含量保持至总苞鳞片分化期(III)之后与对照的变化趋势一致;AMD处理的SS活性与对照相比减少18.5%,且在花瓣分化期升高至略高于处理前水平,花瓣分化后期(Ⅶ)与其它两处理接近。对照芽中SS活性在花芽分化启动期(II)迅速上升,之后出现逐渐下降的趋势,SFE处理的与对照变化趋势相似,但活性高于对照;AMD处理的芽中SS活性变化自处理开始至总苞鳞片分化期(III)持续下降,此期活性比对照降低33.7%,之后缓慢回升,至Ⅶ期与其它2处理含量接近。

图4 SFE和AMD处理对菊花花芽分化过程叶片和芽中蔗糖合成酶活性的影响Fig.4 Effects of SFE and AMD treatments on SS activities of leaves and buds during chrysanthemum differentiation
3 讨论
植物开花需要充足的碳水化合物的供应和开花信使分子对开花信号的传递。蔗糖是植物光合作用的终产物之一,是植物体内碳水化合物运输的主要形式,也是“库”代谢的主要基质[15]。本研究表明,蔗糖作为营养成分和信使分子的双重身份在菊花开花过程中起着重要的作用。本试验中,对照菊花在光周期诱导4 d开始花芽分化,而SFE处理的提早1 d,AMD处理的延迟3 d出现;之后的各个时期SFE处理的始终比对照提前出现,而AMD处理的比对照延迟出现。这说明菊花花芽分化与蔗糖含量密切相关[16]。李兴军等[2]发现,杨梅花芽发端期叶片中蔗糖含量迅速增加,而用GA3处理降低叶片蔗糖水平可抑制花芽分化,与本研究结论一致,Saeid对草莓花芽分化过程的研究也有相似结果[17]。蔗糖合成受SPS(蔗糖磷酸合成酶)和SS(蔗糖合成酶)的调节[3],Ye&Li研究发现,蔗糖脂肪酸酯(SFE)能显著地提高大豆蔗糖酶的活力,而蔗糖合成酶转录抑制剂(AMD)可在短时间内大幅度降低蔗糖酶活力,二者影响了大豆开花期和结荚期的蔗糖酶生物合成量[4]。本试验中,SFE和AMD处理在菊花花芽分化启动期虽然叶片和芽中蔗糖含量均达到峰值,但达到峰值的时间不同,说明不同处理间蔗糖积累有差异,这是和不同处理下的蔗糖酶活性变化相一致的(图2~4)。
蔗糖磷酸合成酶(SPS)是植物调控蔗糖合成的关键酶之一。一般认为,在植物叶片等光合器官中SPS/Suc-6-Pase系统催化的蔗糖合成过程是叶片蔗糖合成的主要途径[8],SPS活性大小和蔗糖含量成正相关[18],本研究中对照叶片SPS活性大小与蔗糖含量亦成正相关(r=0.824)。本试验结果表明,对照叶片SPS活性在未分化期较低,从生长点膨大的分化启动期迅速上升,高活性持续至小花原基分化前期才逐渐下降;芽中SPS活性在分化启动期上升到峰值,之后逐渐下降;叶中活性明显高于芽中。这说明菊花花芽分化过程中叶片中需要大量的蔗糖,因此激活SPS活性,从而合成充足的蔗糖,使其转移到需要蔗糖的花芽的作用位点,而芽中本身合成蔗糖的量应该很少。
蔗糖合成酶(SS)也是蔗糖代谢关键酶中极其重要的一种可溶性酶,SS催化如下反应:蔗糖+ UDP果糖+UDPG,此反应是可逆的,SS具有分解和合成蔗糖的双重属性,在不同植物及不同环境条件下起不同的作用[19,20]。有研究认为SS在植物组织中主要作用是在分解方向催化蔗糖的降解[8],其依据主要基于以下两点:其一,SS主要分布在消耗蔗糖的组织中;其二,在许多植物叶片中催化淀粉合成的UDPGPPase的活性较高,而该酶的底物UDPG正是SS催化蔗糖降解的产物。但是也有研究证明,蔗糖含量与SS之间存在很明显的正相关[21,22],有试验表明,SS在许多植物叶片的蔗糖合成中起重要作用,而且SS和SPS催化蔗糖合成的活性随着叶龄而变化,成年叶片中二者的活性相近[23]。本研究中叶片SPS与SS活性接近,试验材料为发育成熟的功能叶。本试验测定了SS合成方向的活性,结果表明,菊花花芽分化过程中,叶和芽中SS活性在生长点肥大的分化启动期比未分化期增加64.6%(叶片)和37.1%(芽),出现先上升后下降的趋势,说明菊花花芽分化需要积累高水平的蔗糖,因此,叶片和芽中SS活性被激活。菊花叶片SPS从分化启动期之后保持持续下降的趋势,而SS活性却从在生长点肥大期到总苞鳞片形成期有所上升,这可能是因为SPS的下降,使得SPS/Suc-6-Pase催化的蔗糖合成途径可能难以满足花芽对叶片蔗糖的调集,因此,此时叶片中SS表现为催化蔗糖合成的活性升高,与SPS协同完成合成蔗糖来完成提供花芽分化所需蔗糖的需求[24],AMD处理植株的SS活性下降也应是蔗糖含量下降的因素,这与宿越等[25]研究一定浓度的NaCl胁迫使番茄幼苗叶片中SS和SPS活性降低从而减缓蔗糖的形成是一致的。
本研究中,SFE处理的菊花花芽分化启动提前,并加快了花芽分化进程,这应与蔗糖磷酸合成酶和蔗糖合成酶活性增强,叶片与芽中蔗糖含量快速增加,加速了细胞间的信号传递,使相应生理生化反应得以快速进行是一致的。AMD处理的菊花,前期由于蔗糖酶活性的降低,造成蔗糖合成受影响,尤其叶片蔗糖含量不足,其信号作用减弱,因此延缓了花芽分化的启动和进程。本试验仅在前期喷施SFE和AMD,因此随着光周期诱导的继续进行,蔗糖合成酶活性逐渐恢复,蔗糖浓度重新积累,AMD处理的植株在处理7 d后蔗糖含量才达到峰值,花芽分化启动,而且各分化阶段及花芽分化完成也相应推迟。这也说明了蔗糖对花芽分化的作用。蔗糖含量在整个花芽分化期均处于较高水平(高于处理前),也说明其对整个花芽分化期均有影响,参与整个花芽分化进程。
与蔗糖代谢和积累密切相关的主要的酶除蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)外,还有酸性转化酶(AI)和中性转化酶(NI),二者是分解蔗糖的酶[26]。李兴军等[2]研究发现杨梅花芽孕育期间叶片酸性转化酶活性变化与蔗糖水平呈负相关,用GA3处理提高酸性转化酶活性使蔗糖水平降低而抑制花芽分化;蒋欣梅等[27]则认为青花菜花芽分化要求较高活性的转化酶,认为转化酶活性增高为细胞的可溶性糖类提供可利用的六碳糖,为花芽分化的顺利进行提供物质和能量;Melo等[28]认为桃叶内存在酸性转化酶、中性转化酶、蔗糖磷酸合成酶和蔗糖合成酶等酶类共同调节蔗糖水平;本研究认为在菊花叶片内蔗糖水平应该也受多种酶调节,有待进一步研究。
本试验结果表明,蔗糖合成抑制剂AMD和激活剂SFE通过调节SPS和SS活性来影响蔗糖合成从而影响菊花花芽分化进行。至于AMD和SFE对蔗糖合成相关酶活性的调节作用是通过直接调控其活性还是通过对一些保护酶的作用间接调控还有待进一步研究。
[1]王忠.植物生理学[M].第四版.北京:中国农业出版社,2002
[2]李兴军,李三玉,汪国云,等.杨梅花芽孕育期间叶片酸性蔗糖酶活性及糖类含量的变化[J].四川农业大学学报,2000,18(2):164-166
[3]刘娜,周芹,于海彬.不同氮、磷施用量对甜菜叶片中蔗糖代谢有关酶活性的影响[J].中国糖料,2006(1):30-33
[4]Ye X,Li X.Mechanism of sucrose fatty acid ester promoting invertase biosynthesis in soybean leaves[J].Soyb Sci. 2005(24):95-99
[5]ChiouTJ,BushDR.Sucroseisa signalmoleculeinassimilatepartitioning[J].ProcNatlAcadSciUSA,1998(95):4784-4788
[6]Alok KS,Markus GH,Ulrike R,et al.Metabolizable and non-metabolizable sugars activate different signal transduction pathways in tomato[J].Plant Physiology,2002,128:1480-1489
[7]Smeekens S.Sugar regulation of gene expression in plants[J].Curr Opin Plant Biol.,1998(1):230-234
[8]Roitsch T,Ehness R,Goetz M,et al.Regulation and function of extracellular invertase from higher plants in relation to assimilate partitioning,stress responses and sugur signaling[J].Aust J Plant Physiol,2000,27:815-825
[9]Bernier G,Havelange A,Houssa C.Physiological signals that induce flowering[J].Plant Cell,1993(5):1147-1155
[10]Smeekens S,Rook F.Sugar sensing and sugar-mediated signal transduction in plants[J].Plant Physiology,1997,115:7-13
[11]Smykal P,Gleissner R,Corbesier L,et al.Modulation of flowering responses in different Nicotiana varieties[J].Plant Mol Biol.,2004,55:253-262
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000
[13]於新建.植物生理学实验手册[M].上海:上海科学技术出版社,1985
[14]梁芳,郑成淑,张翠华,等.菊花花芽分化过程中芽和叶片碳水化合物含量的变化[J].山东农业科学,2008(1):40-42
[15]Farrar J,Pollock C,Gallagher J.Sucrose and the integration of metabolism in vascular plants[J].Plant Sci,2000, 154:1-11
[16]王文莉,王秀峰,郑成淑,等.A23187和EGTA对光周期诱导菊花成化及其过程中叶片Ca2+分布和碳水化合物的影响[J].应用生态学报,2010,21(3):675–682
[17]Saeid E,Shahram D,Enayatollah T,et al.Changes in carbohydrate contents in shoot tips,leaves and roots of strawberry(Fragaria×ananassa Duch.)during flower-bud differentiation[J].Scientia Horticulturae,2007,113:255-260
[18]姜东,于振文,李永庚,等.施氮水平对高产小麦蔗糖含量和光合产物分配及籽粒淀粉积累的影响[J].中国农业科学,2002,35(2):157-162
[19]程智慧,高芸,孟焕文.盐胁迫对番茄幼苗转化酶表达及糖代谢的影响[J].西北农林科技大学学报,2007,35(1):184-188
[20]赵智中,张上隆,徐昌杰,等.蔗糖代谢相关酶在温州蜜柑果实糖积累中的作用[J].园艺学报,2001,28(2):112-118
[21]王永章,张大鹏.‘红富士’苹果果实蔗糖代谢与酸性转化酶和蔗糖合成酶关系的研究[J].园艺学报,2001,28(3):259-261
[22]Beruter J,Studer Feusi ME.The effects of girdling on carbon hydrate partitioning in the growing apple fruit[J].Plant Physiol,1997,151:227-285
[23]Rufty TW,Huber SC.Changes in starch formation and activities of sucrose phosphate synthase and cytoplasmic fructose,bisphosphatase in response to source sink alteration[J].Plant Physiol,1983,72:474-480
[24]潘庆民,于振文,王月福.小麦开花后旗叶中蔗糖合成与籽粒中蔗糖降解[J].植物生理与分子生物学学报,2002,28(3):235-24
[25]宿越,李天来,李楠,等.外源水杨酸对氯化钠胁迫下番茄幼苗糖代谢的影响[J].应用生态学报,2009,20(6):1525-1528
[26]张明方,李志凌.高等植物中与蔗糖代谢相关的酶[J].植物生理学通讯,2002,38(3):289-295
[27]蒋欣梅,马红,于锡宏.青花菜花芽分化前后内源激素含量及酶活性的变化[J].东北农业大学学报,2005,36(2):156-160
[28]Merlo L,Passera C.Changes in carbohydrate and enzyme levels during development of leaves of Prunus persica[J]. Physiol.Plant,1991,73:621-626
Effects of SFE and AMD on Sucrose Content and its Relative Enzymes Activities in the Buds and Leaves During Floral Differentiation Under Photoperiodic Induction
WANG Wen-li,WANG Xiu-feng,SUN Xian-zhi,ZHENG Cheng-shu*
Agriculture Ministry Key Laboratory of Horticultural Crop Biolog,State Key Laboratory of Crop Biology,College of Horticulture Science and Engineering/Shandong Agricultural University,Tai’an 271018,China
Effects of SFE and AMD on the sucrose content and the activities of sucrose metabolizing enzymes---sucrose phosphate synthase(SPS)and sucrose synthase(SS)in the buds and leaves of cut flower chrysanthemum(Dendranthema grandiflorium‘Shenma’)were studied during floral differentiation under photoperiodic inducement.The results showed that the contents of sucrose in the buds and leaves of SFE and AMD treated plants together with control plants were increased significantly at the stage of initial differentiation(II),while the increase of AMD treated plants was lower than the other two. The sucrose contents decreased after differentiation,but which were always higher than that of before treatment.The sucrose content in leaves of SFE treated plants was higher than that of the control before the stage of petal differentiation,while it decreased in AMD treated plants compare with the control and SFE treated plants.Sucrose content in buds was always lower than that in leaves,but the increase in buds is bigger than that in leaves through the whole differentiation process especially the midanaphase in the control and SFE treated plants.The activities of sucrose phosphate synthase(SPS)and sucrose synthase(SS)in leaves and buds of the control and SFE treated plants were increased slightly after initial differentiation.The largest increase in leaves is up to 80.6%and it was 26.8%higher than the control at same stage.The activities of SPS and SS in leaves is higher than that in bud,then they decreased gradually after differentiation,but which was always higher than that of before treatment during the whole floral differentiation stage.The activities of SPS and SS are not the same as the control in different stages of differentiation.The activity of SS increased constantly from the beginning to the stage of involucre primordial differentiation(III)and reached a peak,then decreased and approached to the control at the later stage of floretprimordium differentiation(V).The activities of SPS and SS in leaves and buds of the AMD treated plants decreased slightly after treatment,the activity of SPS in leaves is the lowest decrease at the stage II,which down to 29.6%.The activity of SS in buds is the lowest decrease at the stage III,which down to 33.7%,then increase slowly and approached to the other two at the later stage of petal differentiation(VII).SFE and AMD influenced the process of bud differentiation,the days of initiation and ending of floral differentiation shortened by 1 day and 2 days respectively in SFE treated plants compared with those of controls.On the other hand,days of initiation and ending of floral differentiation were delayed for 3 days and 6 days respectively in plants treated with AMD compared with those of controls.Analysis shows that SFE and AMD influenced sucrose sysnthesis and bud differentiation by changing activities of SPS and SS.
Chrysanthemum;floral differentiation;SFE andAMD;sucrose;sucrase
S682.1+1
A
1000-2324(2016)06-0807-07
2016-05-10
2016-06-02
教育部留学回国人员科研启动基金(33206)
王文莉(1968-),女,副教授,主要从事观赏植物栽培生理与生物技术的研究.E-mail:wangwenli169@163.com
*通讯作者:Author for correspondence.E-mail:zcs@sdau.edu.cn
