辣椒疫霉RxLR19781效应分子原核表达纯化及晶体生长条件的研选
2016-02-10方海珍赵立朱春原
方海珍,赵立,朱春原
1.山东农业大学植物保护学院,山东泰安271018
2.山东农业大学生命科学学院,山东泰安271018
辣椒疫霉RxLR19781效应分子原核表达纯化及晶体生长条件的研选
方海珍1,赵立1,朱春原2*
1.山东农业大学植物保护学院,山东泰安271018
2.山东农业大学生命科学学院,山东泰安271018
辣椒疫霉(Phytophthora capsici)侵染寄主细胞常分泌RxLR效应蛋白分子,效应蛋白对寄主细胞具干扰或破坏作用。为了深入开展辣椒疫霉RxLR效应蛋白分子功能特性机制的研究,本文利用PCR技术分离鉴定了辣椒疫霉效应分子RxLR19781,以质粒pET28a(+)为表达载体、大肠杆菌Rosetta(DE3)为宿主,利用IPTG诱导RxLR19781蛋白表达,通过亲和层析、离子交换层析及分子筛层析纯化获得高纯度蛋白,借助坐滴法培养优化获得RxLR19781蛋白晶体,X射线衍射获得2.76Å的蛋白晶体数据,以便解析RxLR19781蛋白三级结构,有助立足RxLR19781蛋白三级结构探索效应分子RxLR19781功能机制特性,为构建新型病害防控策略和培育持久抗病辣椒品种提供理论研究。
辣椒疫霉菌;RxLR;原核表达;纯化;晶体生长
植物病原卵菌主要包括疫霉菌、霜霉菌及腐霉菌,其中疫霉菌有80多种,多数为重要植物病原菌,侵染寄主植物引起疫霉病发生与危害,常给农业、林业和自然生态造成毁灭性破坏[1]。早期研究发现,致病疫霉(Phytophthora infestans)[2]和大豆疫霉(Phytophthora sojae)[3]为毁灭性病菌,常引起马铃薯晚疫病或大豆疫病爆发与流行,严重影响了马铃薯和大豆的产量与效益。近10余年研究发现,辣椒疫霉菌(Phytophthora capsici)也是一种重要的植物病原卵菌,能侵染茄科(辣椒、番茄)、葫芦科(黄瓜、南瓜)及豆类等多种农作物,引起多种农作物疫霉病的发生与危害,其中辣椒疫霉病频繁爆发与流行常给全世界辣椒生产造成巨大的的经济损失[4]。此外,辣椒疫霉菌可侵染模式植物拟南芥和本氏烟,由此使辣椒疫霉菌成为研究卵菌与寄主互作的重要模式菌[5]。因此,以辣椒疫霉菌为材料,充分利用生物学、分子遗传学和蛋白结构生物学技术,深入开展辣椒疫霉菌致病流行机制研究,为研制作物疫病农业防治技术、化学防治技术和培育抗疫病作物新品种提供理论依据。
近年来,基于若干植物抗病基因及其病菌无毒基因定位与克隆推动了寄主植物-病原菌识别机理的认识与理解[6]。随着对植物病原菌无毒基因作用机制的深入研究发现,无毒基因编码的蛋白质易被寄主植物相应的抗病基因识别,表现无毒性能,但当寄主植物缺乏相应抗病基因,使其不被寄主植物予以识别,表现为毒性性能。
研究发现,疫霉菌基因组含大量的RxLRs和CRNs效应分子,RxLRs和CRNs是植物病原卵菌含有的两类胞内效应因子[7-9]。目前,已分离鉴定的植物病原卵菌无毒基因多数归于RxLR效应蛋白家族,这类蛋白家族成员数量繁多、氨基酸序列变化多样[6]。RxLR效应因子N-端多为保守的RxLR基序,该基序负责将效应蛋白转运于宿主细胞[10,11],RxLR基序两侧的30~60个氨基酸具明显的保守性,而C-端区域氨基酸变异性较大,后来的研究发现该区域具一定的W、Y、L保守域[12]。随着更多的植物病原菌全基因组测序,将会有越来越多的效应因子被预测与鉴定。近年来,植物病原菌效应蛋白三级结构解析及其蛋白结构功能生物学研究已成为分子植物病理学研究的热点科学问题,解析具重要功能特性的效应蛋白分子三级结构,利于探明效应分子对寄主细胞破坏作用或产生免疫防卫反应的分子机制,为病害防控或抗病育种提供理论依据。
近来,除开展有关植物病原菌效应蛋白结构解析其调控寄主细胞生理变化及其致病分子机制的信息积累外,还解析了7个卵菌RxLR效应分子结构,分别是AVR3a4、PexRD2、AVR3a11、PexRD54、ATR1、ATR13和Avh5[13-18],有关植物病原卵菌效应蛋白分子结构生物学研究信息积累较少。
辣椒疫霉菌全基因组测序分析发现,辣椒疫霉菌中含350余个候选RxLR效应分子[19],然而以辣椒疫霉菌RxLR效应分子为研究对象,立足基因遗传操作技术和蛋白结构生物学技术,开展RxLR效应分子对于辣椒疫霉菌与寄主互作中发挥调控作用的研究积累甚少。本研究从辣椒疫霉SD33菌株中克隆鉴定了1个辣椒疫霉效应分子RxLR19781,基于生物信息学比对分析,正确预测了RxLR19781结构特征,然后立足基因蛋白表达纯化技术,获得了高纯度蛋白,借助坐滴法优化培养获得RxLR19781蛋白晶体,经X-ray衍射收集了一套2.76Å的数据,为后续解析该效应分子三维结构及其揭示其致病分子机理奠定了基础。
1 材料与方法
1.1 菌株和载体
供试辣椒疫霉(P.capsici)SD33菌株为材料(实验室保存);大肠杆菌菌株(Escherichia coli)Rosetta(DE3)购买自北京全式金生物技术有限公司;表达载体pET-28a(+)为Novagen公司产品。
1.2 辣椒疫霉RxLR效应分子基因克隆
1.2.1 引物设计根据RXLR19781基因去信号肽序列和pET-28a特点,采用NCOI和XHOI酶切位点,设计一对特异性引物RxLR19781-F:5’-CATGCCATGGGCCTGTCGACACAAGCTGAC-3’;RxLR1978 1-R:5’-ATAAGAATGCGGCCGCGTAAGGAAGTCCTTTCTTGT-3’,另在下游引物酶切位点后面去掉目的基因终止密码子以产生融合his标签融合蛋白,引物由上海铂尚生物有限公司合成。利用Signa lP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)数据库预测基因信号肽及其结构特征。
1.2.2 RxLR19781基因PCR扩增利用CTAB法提取SD33菌株总DNA[20],以SD33总DNA为模板,以RxLR19781-F和RxLR19781-R为引物扩增RxLR19781基因开放读码框。PCR反应体系:50mL,含10x EasyTaq Buffer 5mL,dNTP 4mL,引物(10mmol/L)各1mL,模板DNA 2mL,EasyTaq酶0.5mL,无菌水36.5mL。PCR反应条件:94℃预变性4 min,按94℃30 s,58℃30 s,72℃30 s进行30个循环,72℃延伸10 min。
1.3 表达载体构建及鉴定
将上述PCR扩增产物进行琼脂糖凝胶电泳,用凝胶回收试剂盒回收目的条带,分别用NcoI和NotI双酶切,回收PCR产物和pET-28a表达载体,酶切产物经纯化回收后,用Solution I连接酶连接,连接产物转化E.coli菌株(DH5α),通过Kana抗性筛选和菌液PCR鉴定后,将阳性重组质粒命名为19781-pET28a,并送铂尚公司测序,将测定序列与JGI上下游基因组中序列进行比对,并分析融合基因表达的完整性。
1.4 RxLR19781基因原核表达和蛋白纯化
1.4.1 重组质粒在宿主菌中表达将测序正确的重组质粒19781-pET28a转化Rosetta(DE3)感受态细胞,挑取单菌落接种于5 mL含Kana的LB培养基中,于37℃条件下180 r/min振荡培养6 h,然后取1 mL培养液接种于5 mL新鲜的含Kana的LB培养基中培养4 h,用终浓度为1 mmol/L的IPTG诱导表达,持续振荡培养3 h。将1 mL培养液12000 r/min离心1 min,弃掉上清,然后加入40mL的5x样品缓冲液混匀,100℃加热5 min变性,12000 r/min离心1 min,取20mL进行SDS-PAGE凝胶电泳检测。
1.4.2 蛋白表达条件优化在37℃条件下,将含19781-pET28a重组质粒的Rosetta(DE3)培养至OD600约为0.6,分别用终浓度为0、0.1、0.3、0.5、0.7、0.9和1 mmol/L的IPTG诱导目的蛋白表达3 h后取样,经SDS-PAGE电泳测定重组蛋白表达量,确定最佳表达条件,样品制备方法同1.4.1.
1.4.3 目的蛋白的大量表达将含有重组质粒19781-pET28a的宿主菌于37℃下振荡培养5 h,然后按1:100接种至1 L含Kana的LB培养基,37℃振荡培养至OD600=0.6~0.8,按上述最佳优化条件表达,冷却至16℃,添加IPTG至最适浓度,培养20 h,8000 r/min离心5 min收集菌体用于蛋白纯化。
1.4.4 融合蛋白的纯化将菌体重悬于50 mL裂解缓冲液(20 mmol/L Tris-Hcl pH8.5,150 mmol/L Nacl)中,加入10%甘油和0.5%吐温-20,超声破碎细胞,4℃14000 r/min离心30 min后,去除细胞碎片。将上清液转至一个烧杯中挂柱。镍柱预先用bufferA(20 mmol/L Tris-Hcl pH8.5,150 mmol/L Nacl,40 mmol/L咪唑)平衡,挂完柱后,用400 mL bufferA洗杂蛋白,再用buffer B(20 mmol/L Tris-Hcl pH8.5,150 mmol/L Nacl,200 mmol/L咪唑)洗脱目的蛋白,然后用10KD截留量浓缩管,浓缩至50 mL以内。离子交换柱预先用buffer C(20 mmol/L Tris-Hcl pH8.5,150 mmol/L Nacl)和buffer D(20 mmol/L Tris-Hcl pH8.5,600 mmol/L Nacl)平衡,浓缩的蛋白上样,收集主要目标蛋白峰,将收集的蛋白继续浓缩至1 mL以内,分子筛预先用buffer C平衡,将再次浓缩的蛋白上样,收集主要目标峰蛋白,SDS-PAGE检测纯度,并将蛋白用液氮保存于-80℃下保存,以备培养晶体使用。
1.5 蛋白晶体培养
蛋白晶体生长条件筛选,采用坐滴气象扩散法,初次筛选采用Hampton Research Crystal ScreenⅠ、Crystal ScreenⅡ、Salt RxTM1、PEG/lon Screen TM、PEG/lon 2 Screen TM、Index TM和Natrix TM蛋白晶体生长试剂盒进行蛋白晶体筛选。采用48孔培养板,池液180mL,蛋白液和池液以1:1比例混合,用胶带密封,置于16℃晶体培养箱,1周后于显微镜下观察晶体生长情况,挑取已有的目的蛋白晶体,用液氮冻存,进行初步的X射线衍射分析。
2 结果与分析
2.1 辣椒疫霉RxLR19781基因克隆及基因序列结构分析
辣椒疫霉RxLR19781基因序列分析如(图1),该基因全长366 bp,编码121个氨基酸,预测分子量为13.8KD。生物信息学分析表明,该基因氨基酸序列信号肽长度为20个氨基酸,其后为保守的RxLR-dEER序列。以基因组DNA为模板,用引物RxLR19781-F和RxLR19781-R扩增该基因去信号肽部分编码区序列,电泳检测结果(图2),表明扩增产物为303 bp,与基因组中RxLR19781基因去信号肽部分大小一致。
2.2 RxLR19781蛋白表达
将PCR产物回收,用Nco I和Not I双酶切并克隆到原核表达载体pET-28a,阳性克隆命名为19781-pET28a。以RxLR19781-F和RxLR19781-R为引物,用含有19781-pET28a重组质粒菌落PCR扩增约303 bp的特异性条带(图3),进行测序鉴定。利用DNAman软件进行序列比对,表明测序结果正确,原核表达载体构建成功。
重组质粒19781-pET28a转化大肠杆菌Rosetta(DE3),通过对不同诱导剂浓度等表达条件优化,结果显示在16℃条件下,经0.5 mmol/L的IPTG诱导宿主菌于11 KD处有大量蛋白表达(图4)。


图1 辣椒疫霉效应分子RxLR19781氨基酸序列Fig.1 Amino-acid sequence of Phytophthora capsici effector RxLR19781
图2 RxLR19781基因PCR扩增结果Fig.2 PCR amplification of RxLR19781
图3 菌落PCR鉴定重组质粒Fig.3 PCR analysis of recombinant plasmid 19781-pET28a
2.2 RxLR19781融合蛋白纯化及SDS-PAGE检测
RxLR19781融合蛋白大量表达后收集菌体,按方法1.4.4进行镍柱亲和层析,各个阶段分别取样并进行SDS-PAGE电泳检测(图5)。蛋白经层析柱Q柱层析后形成1个峰(图6),经层析柱Superdex 200 Increase 10/300 GL层析后形成一个单峰(图7),收集单峰蛋白并浓缩至10 mg/mL,用于检测和晶体优化生长。离子柱和分子筛层析后,分部收集的蛋白用SDS-PAGE检测,结果显示蛋白分子量为13 KD(图8),与理论分子量基本一致,其纯度为95%。

图4 重组蛋白19781-His在Rosetta(DE3)中的表达Fig.4 SDS-PAGE analysis for the expression of 19781-His in Rosetta(DE3)
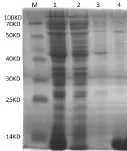
图5 RxLR19781蛋白经镍柱纯化后的SDS-PAGE电泳Fig.5 SDS-PAGE of the purification of the protein RxLR19781 using the Ni-column
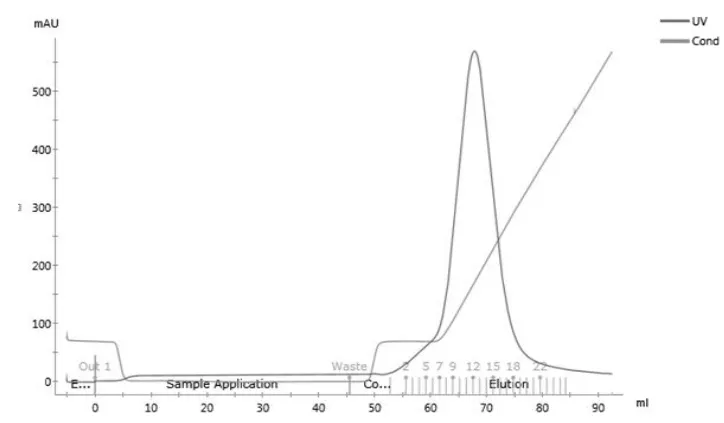
图6 RxLR19781蛋白离子交换层析纯化Fig.6 Purification of RxLR19781protein with Ion exchange exclusion chromatography

图7 RxLR19781蛋白分子筛层析纯化 chromatography Fig.7 Purification of RxLR19781 by size
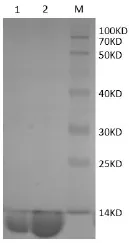
图8 RxLR19781蛋白经Q柱、分子筛纯化后的SDS-PAGE电泳Fig.8 SDS-PAGE of the purification of the protein RxLR19781 using the Q column and size exclusion chromatography
2.3 RxLR19781蛋白晶体筛选及衍射数据收集
收集分子筛层析洗脱获得的目的蛋白,浓缩并进行晶体初筛,采用坐滴法16℃生长1周后,可观察到晶体生长(图9),晶体生长条件:0.03 M Citric acid,0.07 M BIS-TRIS propane/pH 7.6,20% PEG3350。然后将晶体送上海同步辐射光源进行了X衍射及数据收集和初步处理(图10)。目前由于还缺乏该蛋白晶体的相位信息,后续正在试图进行该蛋白的硒代衍生物制备,以期获得衍射效果好的硒代蛋白晶体,并有望最终解析其三维结构。

图9 RxLR19781蛋白晶体Fig.9 The crystals of the protein RxLR19781
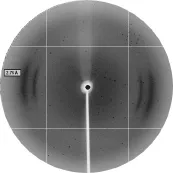
图10 RxLR19781晶体X射线衍射图Fig.10 X-ray diffraction of the RxLR19781 crystals
3 讨论
本研究选取了辣椒疫霉全基因组1个RxLR效应蛋白分子,该基因在辣椒疫霉全基因组中序列号为19781,由此将其命名为RxLR19781。本研究从参试辣椒疫霉菌SD33克隆鉴定了RxLR19781基因,然后进行蛋白表达纯化,获得高纯度蛋白,晶体优化培养,获得高质量的晶体,综合分析本研究实验技术发现,目的蛋白纯度大于90%以上,适宜进行晶体筛选,并利于成功获得蛋白晶体。本研究结果对后续开展硒代蛋白晶体培养,以及X射线衍射分析提供了可靠的实验技术准备。在此基础上,进一步的晶体优化和硒代培养,有望解析其全长三维结构,预期利于立足RxLR19781蛋白三维结构,深入探讨辣椒疫霉效应分子蛋白与辣椒寄主互作的分子机制,从而为设计植物抗疫病策略奠定理论基础。
尽管辣椒疫霉常危害茄科、葫芦科等多种作物,给农业生产造成重大损失,并且已有若干相关研究积累,但目前对其致病分子机制了解甚少。普遍认为,在侵染过程中,疫霉通过表达一系列的效应分子(如CRN、RxLR等)对寄主防卫机制进行调控,以成功侵染和定殖[21],但目前关于这些效应分子的表达模式、功能和作用机制的研究尚待深入。
近年来卵菌RxLR效应蛋白与植物互作机理研究,已逐渐成为分子植物病理学研究热点科学问题,通过解析RxLR蛋白三维结构,立足蛋白三维结构特性,深入开展其功能机制研究,预期有望探明辣椒疫霉与植物互作的分子机制。因此,针对性的开展卵菌效应蛋白表达、纯化,获得高纯度蛋白及其晶体培养,获得高较高质量的晶体,为真正意义上解析其三级结构提供重要的技术准备,预期结果对于深入开展效应蛋白结构生物学具有重要的意义。
[1]Dou DL,Kale SD,Wang XL,et al.Conserved C-Terminal Motifs Required for Avirulence and Suppression of Cell Death by Phytophthora sojae effectorAvr1b[J].Plant Cell,2008,20:1118-1133
[2]Ristaino JB,Groves CT,Parra GR.PCR amplification of the Irish potato famine pathogen from historic specimens[J]. Nature,2001,411(6838):695-697
[3]Tyler BM.Genetics and genomics of the oomycete host interface[J].Trends in Genetics,2001,17(11):611-614
[4]Lamour KH,Stam R,Jupe J,et al.The oomycete broad-host-range pathogen Phytophthora capsici[J].Molecular plant Pathology,2012,13(4):329-337
[5]Wang Y,Bouwmeester K,Van de Mortel JE,et al.A novel Arabidopsis-oomycete pathosystem:differential interactions with Phytophthora capisici reveal a role for camalexin,indole glucosinolates and salicylic acid in defence[J].Plant Cell and Environment,2013,36(6):1192-1203
[6]顾彪.植物病原卵菌和真菌效应蛋白转运机制研究[D].杨凌:西北农林科技大学,2012
[7]Tyler BM,Tripathy S,Zhang XM,et al.Phytophthora genome sequences uncover evolutionary origins and mechanisms of pathogenesis[J].Science,2006,313:1261–1266
[8]Haas BJ,Kamoun S,Zody MC,et al.Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans[J].Nature,2009,461:393-398
[9]Lamour KH,Mudge J,Gobena D,et al.Genome sequencing and mapping reveal loss of heterozygosity as a mechanism for rapid adaptation in the vegetable pathogen Phytophthora capsici[J].Mol Plant Microbe Interact,2012,25:1350-1360
[10]Dou DL,Kale SD,Wang X,et al.RXLRmediated entry of Phytophthora sojae effector Avr1b into soybean cells does not require pathogen-encoded machinery[J].Plant Cell,2008,20:1930-1947
[11]Whisson SC,Boevink PC,Moleleki L,et al.A translocation signal for delivery of oomycete effector proteins into host plant cells[J].Nature,2007,450:115-118
[12]Win J,Morgan W,Bos J,et al.Adaptive evolution has targeted the C terminal domain of the RxLR effectors of plant pathogenic Oomycetes[J].Plant Cell,2007(19):2349-2369
[13]Boutemy LS,King SR,Win J,et al.Structures of Phytophthora RXLR Effector Proteins:a conserved but adaptable fold underpins functional diversity[J].J Biol Chem 2011,286:35834-35842
[14]Yaeno T,Li H,Chaparro-Garcia A,et al.Phosphatidy linositol monophosphate-binding interface in the oomycete RXLR effector AVR3a is required for its stability in host cells to modulate plant immunity[J].Proc Natl Acad Sci USA, 2011,108:14682-14687
[15]Maqbool A,Hughes RK,Dagdas YF,et al.Abbas Maqbool Structural Basis of HostAutophagy-related Protein 8(ATG8) Binding by the Irish Potato Famine Pathogen Effector Protein PexRD54[J].J Biol Chem,2016,291(38):20270-20282
[16]Chou S,Krasileva KV,Holton JM,et al.Hyaloperonospora arabidopsidis ATR1 effector is a repeat protein with distributed recognition surfaces[J].Proc Natl Acad Sci USA,2011,108:13323-13328
[17]Leonelli L,Pelton J,Schoeffler A,et al.Structural elucidation and functional characterization of the Hyaloperonospora arabidopsidis effector protein ATR13[J].PLoS Pathog,2011,7:e1002428
[18]Sun FR,Kale SD,Azurmendi HF,et al.Structural basis for interactions of the Phytophthora sojae RxLR effector Avh5 with phosphatidylinositol 3-phosphate and for host cell entry[J].Mol.Plant-Microbe Interact,2013,26(3):330-344
[19]Lamour KH,Mudge J,Gobena D,et al.Genome sequencing and mapping reveal loss of heterozygosity as a mechanism for rapid adaptation in the vegetable pathogen Phytophthora capsici[J].Mol.Plant-Microbe Interact,2012,25:1350-1360
[20]Feng BZ,Li PQ.Molecular characterization and functional analysis of Nep1-like protein-encoding gene from Phytophthora capsici[J].Genetics and Molecular Research,2013,12(2):1468-1478
[21]Kamoun S.A catalogue of the effector secretome of plant pathogenic oomycetes[J].Annual Review of Phytopathology, 2006,44:41-60
Study on the Expression,Purification and Crystal Growth of RxLR19781 from Phytophthora capsici
FANG Hai-zhen1,ZHAO Li1,ZHU Chun-yuan2*
1.College of Plant Protection/Shandong Agricultural University,Taian 271018,China
2.College of Life Sciences/Shandong Agricultural University,Taian 271018,China
Phytophthora capsici secrete large amounts of RxLR effectors to interfere with host plant cell physiology. However,their functions and molecular mechanisms in the interactions of oomycetes with host plants remain obscure.To understand the roles of these RxLR effectors in the interactions between P.capsici and its host plants,the gene RxLR19781 was cloned into pET-28a and expressed with IPTG in Rosetta(DE3).The target protein was purified through using a three-steps purification strategy including nicked affinity,Ion exchange chromatography(IEC)and size exclusion chromatography(SEC).The high purify protein and well-diffracted crystals were obtained,which laid a foundation for the analysis of the structure.The crystals were obtained by sitting drop method and we obtained 2.7 6Å diffraction data using X-ray.Elucidation of the structure of oomycete and fungal effector proteins and their roles in disease development will offer novel opportunities to understand how the pathogens manipulate host cells to establish a parasitic relationship and how to develop durable disease control measures.
Phytophthora capsici;RxLR;expression;purification;crystal growth
S436.418.1+2
A
1000-2324(2016)06-0801-06
2016-05-11
2016-08-20
国家自然科学基金青年基金(31500121);山东省优秀中青年科学家科研奖励基金(BS2015SW009)
方海珍(1992-),女,在读硕士研究生,研究方向:植物病原真菌学和真菌资源利用.E-mail:934955400@qq.com
*通讯作者:Author for correspondence.E-mail:zhuchunyuan@sdau.edu.cn
