斜带石斑鱼牛磺酸转运蛋白基因的克隆及饲料牛磺酸含量对其表达的影响
2016-02-07李家旭叶继丹
李家旭,叶继丹
(1.集美大学水产学院,福建 厦门 361021;
2.农业部东海海水健康养殖重点实验室,福建 厦门 361021)
斜带石斑鱼牛磺酸转运蛋白基因的克隆及饲料牛磺酸含量对其表达的影响
李家旭1,2,叶继丹1,2
(1.集美大学水产学院,福建 厦门 361021;
2.农业部东海海水健康养殖重点实验室,福建 厦门 361021)
牛磺酸转运蛋白(Taurine transporter,TauT)是牛磺酸跨膜转运的重要载体,在鱼类的生长、代谢及性成熟过程中发挥重要作用。本文采用RT-PCR和RACE技术,克隆体质量(12.85±0.46)g的斜带石斑鱼Epinephelus coioides TauT cDNA蛋白质编码区序列。结果表明:斜带石斑鱼TauT cDNA蛋白质编码区为1 881bp,编码626个氨基酸,分子量为70 126.80Da,与已克隆的其他鱼类的同源性很高,而与鸟类和哺乳动物的同源性较低。在水温(27±2)℃下,给斜带石斑鱼投喂含牛磺酸0%、0.5%、1%和1.5%的饲料28d后,用Realtime PCR法检测不同组织中TauTmRNA的相对表达量,结果表明:TauTmRNA在所测的各组织中均有表达,但肝脏、心脏、脑表达水平最高,肾脏、鳃、脾脏次之,肠道、肌肉、脂肪组织最低。牛磺酸添加组中组织TauT mRNA的表达量均高于对照组,1.0%和1.5%两组间差异不明显,但均高于0.5%组。饲料中添加牛磺酸能促进斜带石斑鱼组织中TauTmRNA的表达。
斜带石斑鱼;牛磺酸转运蛋白;同源性分析;基因表达
牛磺酸(2-氨基乙磺酸)又称牛胆碱或牛胆素,广泛存在于动物可兴奋组织细胞内,是一种含量丰富的游离β-氨基酸[1],具有保护生物膜[2,3]、参与胆汁酸合成[4]、调节渗透压[5]、神经中枢、抗氧化与免疫、解毒、促进营养物质代谢[6]和发育繁殖[7]等生物学功能。跨膜转运是牛磺酸发挥生物学效应的基础,缺血、缺氧及组织损伤时细胞内牛磺酸大量漏出,促进了组织损伤发展[8]。在饲料中补充适量牛磺酸可以显著提高大菱鲆Scophthalmus maximus、真鲷Pagrosomus major、褐牙鲆Paralichthys olivaceus等鱼类的生长性能,而饲料中缺乏牛磺酸时鲥Tenualosa reevesii生长迟缓,出现绿肝综合症[7]。研究发现,哺乳动物细胞内牛磺酸的浓度是10mmol/kg,而在血浆中高达20~100μmol/L[1],这表明牛磺酸是从血浆逆梯度主动跨膜转运至细胞内[9]。
鱼类牛磺酸的跨膜转运都是依靠细胞膜上的牛磺酸转运蛋白(TauT)[10,11]。Roig-pérez等[12]发现,牛磺酸通过TauT转运进入人肠上皮Caco-2细胞,抑制产生脂质过氧化物;敲除TauT基因后,血清中丙二醛、一氧化氮和过氧化氢的水平升高,使肠道产生严重氧化应激反应。Ito等[13]报道,敲除TauT基因增加了细胞炎症和氧化应激反应,使许多肌肉组织严重病变。这些研究表明:TauT对运输牛磺酸以及调节机体稳态具有重要作用。目前有关牛磺酸与哺乳动物TauT关系的研究较多,而对鱼类的相关研究较少,仅对大西洋鲑Salmo salar、莫桑比克罗非鱼Oreochromis mossambicus、斑马鱼Danio rerio、鲤Cyprinus carpio、花鲈Lateolabrax japonicus等鱼类的TauT基因进行克隆及表达研究。有关在饲料中添加牛磺酸的水平对石斑鱼TauT mRNA表达的影响尚未见报道。本实验利用RT-PCR方法和RACE方法克隆并测定斜带石斑鱼Epinephelus coioides TauT基因,应用Real-time PCR方法测定摄食含不同水平牛磺酸饲料的斜带石斑鱼TauT mRNA在不同组织中的表达水平,进一步研究TauT的性质和作用,可为牛磺酸在水产养殖业中的合理应用提供基础。
1 材料与方法
1.1 实验动物
实验用斜带石斑鱼购自厦门一家石斑鱼养殖场,体质量为(12.85±0.46)g。
1.2 总RNA提取与cDNA第一条链合成
参照Trizol Reaget(Invitrogen)说明书提取斜带石斑鱼各组织总RNA;参照Thermo试剂盒使用方法合成cDNA第一条链。实验在无菌低温下进行。
1.3 扩增同源序列
根据 NCBI GenBank中已克隆的 鲈(JN897395)、大西洋(NP-001117102)、罗非鱼(AB033497.1)序列,设计简并引物(LY-TauT-F,LY-TauT-R),以 cDNA第一条链为模板,以LY-TauT-F和LY-TauT-R为引物进行同源序列扩增。反应条件为95℃3min;30个循环(95℃30s;50℃60s;72℃30s);72℃8min。将PCR产物进行胶回收,连接载体转化测序。引物序列见表1。
1.4 全长cDNA克隆
根据所得同源序列,设计 RACE引物(TauT-3F1、TauT-3F2、TauT-5R1和TauT-5R2)。引物序列见表1。
3’末端的扩增:20μL反应体系中有10×Taq buffer 2μL、dNTP(3.2mM)1.6μL、TauT-3F1和AOLP各0.5μL、模板cDNA 1μL、Taq DNA聚合酶0.2μL,用双蒸水补充到20μL。反应条件:94℃5min;94℃45s,60℃30s,72℃45s,30个循环。第一轮PCR扩增后,在20μL反应体系中加入第一轮稀释50倍的PCR产物1μL、引物AP和TauT-3F2进行第二轮扩增。反应条件:94℃5min;94℃45s,60℃30s,72℃30s,30个循环。PCR产物胶回收、连接、转化、测序。
5’末端的模板:以Random引物为反转录引物启动逆转录,将合成的cDNA经纯化试剂盒纯化后,用末端转移酶在cDNA 3’末端加上poly C尾(0.2mL PCR管中加入如下反应体系:6.5μL灭菌双蒸水,5μL 5×TdT Buffer,2.5μL dCTP(2mM),10μL纯化的cDNA第一条链。94℃3min,短暂离心后冰上放置2min,加入1μL末端转移酶(TdT),终体积25μL,混匀后离心37℃15min,65℃10min灭活末端转移酶。以加过尾的dC-cDNA为模板,运用接头引物和基因特异性引物进行扩增。
5’末端的扩增:在20μL反应体系中加入10× Taq buffer 2μL、dNTP(3.2mM)1.6μL、引物AAP和TauT-5R1各0.5μL、模板1μL,Taq DNA聚合酶0.2μL。 反 应 条 件 :94℃ 5min;94℃ 45s,68℃30s,72℃2min 30s,15个循环,每个循环退火温度下降1℃;最后94℃45s,53℃30s,72℃2min 30s,24个循环。第一轮PCR扩增后,在20μL体系中加入第一轮稀释50倍的PCR产物1μL、引物AP和TauT-5R2进行第二轮扩增。反应条件:94℃5min;94℃45s,60℃30s,72℃2min,30个循环。将PCR结果进行胶回收、连接、转化、测序。
1.5 氨基酸序列比较与同源性分析
采用NCBI网站的BLAST(http://blast.ncbi.nlm. nih.gov/Blast.cgi)工具比对序列同源,分析相似性;采用SeqMan和EDitSeq软件进行序列的拼接及编码序列分析等;采用CLUSTALW程序(http://www.ebi.ac.uk/Tools/msa/clustalw2/)进行多序列比对;经在线软件 http://www.cbs.dtu.Dk/services/TMHMM/对TauT蛋白跨膜区域进行预测;采用MEGA 6软件用邻位相接法(NJ法)构建系统进化树,用Bootstrap法进行1 000次评估。
1.6 TauT mRNA组织表达差异分析
从暂养缸中随机取石斑鱼,麻醉后置于冰盘上,在无菌操作台中解剖采集心脏、脑、鳃、肝脏、肠、脾脏、肾脏、脂肪和肌肉等样品,置于液氮中保存,用于提取总RNA以及合成cDNA第一条链。根据所得到的序列设计荧光定量引物F1和R1,通过引物检测,进行荧光定量实验。采用SYBRGreen I嵌合荧光法,使用SYBRGreen Master Mix试剂(AceQqPCR,南京诺唯赞生物科技有限公司),在Thermal cycler仪(ABI StepOne PlusTM)上进行操作。引物序列见表1。
1.7 摄食含不同水平牛磺酸饲料的石斑鱼组织表达差异的测定
以玉米淀粉为淀粉源,明胶和酪蛋白作为蛋白源,鱼油、大豆油以及大豆卵磷脂作为脂肪源,结晶纤维素作为填充剂,分别配制牛磺酸添加量为0(D1)、0.5%(D2)、1%(D3)和1.5%(D4)的4组实验饲料。斜带石斑鱼暂养10d后,选取400尾规格相近且体况良好的幼鱼,初始体质量为(13.85±0.25)g,随机分配到16个体积为120L的循环水族箱中,每箱25尾,每4个水族箱一组,分别饱食投喂实验饲料28d。养殖期间水温为(27±2)℃,溶解氧(6.15±0.45)mg/L,硝酸盐氮(0.248±0.15)mg/L。
饲养实验结束时,按前述操作方法采集、检测各组织样品中TauT mRNA的相对表达量,参照1.6分析TauTmRNA组织表达差异。
1.8 数据统计与分析
按下式计算增重率(WGR,%):
WGR(%)=100×(Wt-W0)/W0,
公式中:W0和Wt分别为实验开始和结束时每尾鱼的平均体质量(g);t为养殖实验天数。
采用2-△△CT法计算目的基因的相对表达量[14]。在不同组织表达差异分析中,以脂肪表达量为对照,设其基因的相对表达量为1。饲料牛磺酸诱导实验的基因表达分析中,以牛磺酸添加量0(D1)的表达量为对照,设其基因的相对表达量为1。用SPSS 17对实验结果进行单因素方差分析(One-way ANOVA)。所有实验数据均以平均值±标准误(Mean±SE)表示,若存在显著差异时,采用Student-Newmnan-Keuls法进行多重比较,显著性差异水平表示为P<0.05。

表1 本文所用引物序列Tab.1 Sequence of the primers used in this study
2 结果与分析
2.1 斜带石斑鱼TauT cDNA序列分析
本实验克隆了斜带石斑鱼TauT基因ORF区域全长(Gene Bank登录号KX226453)为1 881bp,全部编码626aa,预测的分子质量为70 126.80Da,理论等电点约为7.834。该核苷酸及氨基酸序列提交GenBank经Blast比对显示,该序列与其他物种的TauT均具有较高的同源性,故推断本实验获得的ORF区域序列为编码斜带石斑鱼TauT的ORF区域序列。
2.2 斜带石斑鱼TauT氨基酸序列分析
斜带石斑鱼TauT氨基酸序列与已经登陆NCBI的鲈(AFC36524.1)、斑马鱼(NP_001032750.1)、大西洋鲑(NP_001117102.1)、鲤(BAA89537.1)、罗非鱼(BAB18038.1)、鸡(NP_001025771.2)、人(NP_003034.2)、牛(NP_777035.1)、大鼠(NP_058902.1)和小鼠(NP_033346.2)等的TauT氨基酸结构进行比较发现,它们都有12个跨膜区域,在第三跨膜区域与第四跨膜区域之间有一个亲水基环。这个环含有三个潜在的N-糖基化位点,分别为N-179、N-187和N-190。斜带石斑鱼TauT蛋白12个跨膜区域的位置如图1所示,并与上述物种所在位置大致相同,且第三跨膜区(122~144)与第四跨膜区(218~236)之间有一个大亲水环。这表明不同物种TauT的结构相似性很高。
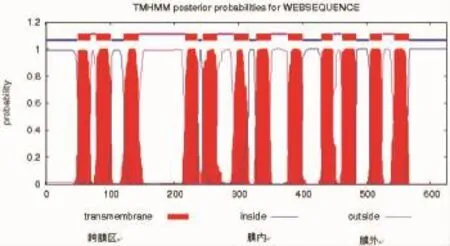
图1 斜带石斑鱼TauT蛋白的膜结构预测Fig.1 Prediction of TauT protein membrane structure in grouper
2.3 斜带石斑鱼TauT同源性分析和系统进化树的构建
图2系统进化树主要分为2支:一支为鱼类,另一支为鸟类和哺乳类。本研究选择的物种主要分为3个单系类群:斜带石斑鱼和鲈、斑马鱼、大西洋鲑、鲤、罗非鱼等鱼类聚为一支,为第一类群,其中斜带石斑鱼和鲈优先聚为一支,表明它们的亲缘关系最近;鸟类为第二类群;人、牛、大鼠、小鼠等哺乳动物组成第三类群。由表2可知,斜带石斑鱼TauT与鲈同源性最高,达到92.69%,与其他鱼类的同源性相似,均在80%以上。尽管斜带石斑鱼与鸟类和哺乳类同源性较低,但也都在75%以上,这说明斜带石斑鱼TauT基因在鱼类、鸟类、哺乳类动物之间具有较高的保守性。

图2 斜带石斑鱼TauT氨基酸序列系统进化树Fig.2 Phylogenetic analysis of TauT based on amino acid sequences in grouper and other species
2.4 斜带石斑鱼正常组织TauT mRNA表达的差异
由图3可知,TauT基因在所有测组织中均有表达,表达水平差异明显。TauT基因在9个组织中的相对表达量由高至低依次为:肝脏、心脏、脑、肾脏、鳃、脾脏、肠道、肌肉、脂肪。
2.5 牛磺酸处理后斜带石斑鱼TauT mRNA表达的差异
由表3可知,各实验组斜带石斑鱼的增重率均随着牛磺酸水平的增加呈先升高后降低的趋势,牛磺酸添加量1%(D3)组的增重率最高,其次为牛磺酸添加量1.5%(D4)组,D3和D4组增重率显著高于对照组(P<0.05)。
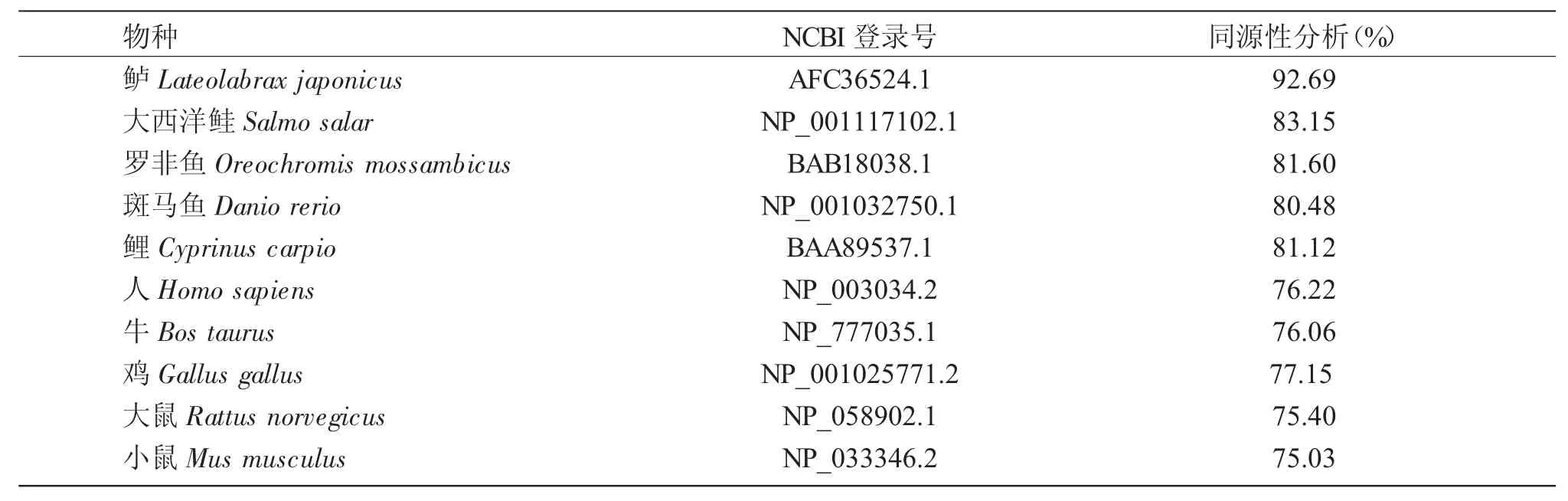
表2 斜带石斑鱼TauT氨基酸序列的同源性分析Tab.2 Homology analysis of TauT amino acid sequences in grouper and other species

图3 斜带石斑鱼TauT mRNA的组织表达水平Fig.3 Expression of TauT mRNA in various tissues in grouper
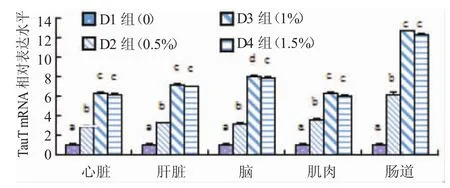
图4 不同饲料牛磺酸添加水平下斜带石斑鱼心脏、肝脏、脑、肌肉、肠道TauT mRNA相对表达水平Fig.4 TauT mRNA expression in heart,liver,brain,muscle and intestine of the grouper fed the diets containing different levels of taurine

图5 不同饲料牛磺酸添加水平下斜带石斑鱼鳃、脾脏、肾脏、脂肪TauT mRNA相对表达水平Fig.5 TauT mRNA expression in gill,spleen,kidney and fat tissue of the grouper fed the diets containing different levels of taurine
由图4、图5可知,斜带石斑鱼各个组织中TauT mRNA的相对表达量随饲料牛磺酸水平的变化趋势与增重率的变化趋势基本一致,即斜带石斑鱼的增重率随饲料牛磺酸水平的增加而升高。

表3 饲料中不同水平牛磺酸对斜带石斑鱼生长性能的影响Tab.3 Effect of dietary taurine level on the growth rate of grouper
3 讨论
本文首次从斜带石斑鱼肝组织中分离和分析了TauT基因结构功能区的保守序列全长。与已知鱼类TauT基因一样,斜带石斑鱼TauT跨膜区域为12个,在第三与第四跨膜区域之间有一个亲水基环。这个环在N-179、N-187和N-190有三个潜在的N-糖基化位点。哺乳类动物TauT的跨膜区域为12个,其中在第三跨膜区域与第四跨膜区域之间存在着一个亲水环,该环存在3个潜在的N-糖基化位点。这与已经发现的Na+和Cl-依赖性的转运蛋白-神经递质转运体的结构具有极高的相似性。由此推测,斜带石斑鱼TauT是Na+、Cl-依赖型的转运蛋白。哺乳动物的TauT对底物具有选择性,如它只转运牛磺酸、亚牛磺酸和β-丙氨酸等β-氨基酸类的氨基酸;与底物的亲和力比较高;具有较高的离子依赖性[15]。本实验通过基因克隆得到的TauT基因也具有这些特点,且分子量相近,由此可推断斜带石斑鱼TauT也具有与底物结合的功能。
将斜带石斑鱼TauTORF区域的核苷酸和氨基酸序列同鲈、斑马鱼、大西洋鲑、鲤、罗非鱼、鸡、人、牛、大鼠、小鼠的进行比对发现,不同物种TauTORF区域的核苷酸序列差异较大,但氨基酸序列却具有极高的保守性。这是由于密码子具有简并性,进行沉默替代,所以氨基酸序列没有发生变化。虽然基因中碱基序列不同,但沉默替代对编码的蛋白及其功能无影响。但沉默现象有限制[16],碱基序列的保守区也不随机,推测这些保守区与保持基因的结构和功能密切相关。聚类分析与同源性分析显示,斜带石斑鱼与鱼类的亲缘关系比较近,其中与鲈的亲缘关系最近,但与哺乳类和鸟类的亲缘关系较远,这与传统分类学一致。比对分析发现,亲缘关系较近的物种同源性较高,在系统发育树上比较靠近。
TauTmRNA在哺乳动物组织中都有表达,但其表达特征因物种而异。犬类心脏中,TauTmRNA的表达量最高[17];牡蛎鳃、肝、肠等组织中TauTmRNA表达较高[18];斑马鱼视网膜、心脏、大脑、肾脏中TauTmRNA的表达量高[19];大西洋鲑的鳃、肾、心脏等组织中的TauT mRNA表达量较高[20];鲈脑、鳃、肠、肾、脾的TauT mRNA表达量较高,而肌、心、肝、脂肪等组织表达量较低[21];大菱鲆肝脏、肠道、肌肉、心脏中的TauT mRNA表达量较高,脑、眼睛、鳃和胃中表达量较低[22]。本实验中,斜带石斑鱼TauT mRNA在肝脏、心脏、脑中表达量最高,肾脏、鳃、脾脏次之,肠道、肌肉、脂肪最低。不同组织TauT mRNA表达的差异反映了不同组织TauT参与牛磺酸转运的程度,可能与不同组织对牛磺酸的代谢强度和生理需要有关。
牛磺酸能够促进TauT mRNA的表达。腹腔注射牛磺酸的鲈肠道、心脏、肝脏、鳃、肾脏等组织中TauTmRNA表达量显著增高[21]。用牛磺酸处理高糖应激大鼠,其Mǜller细胞中TauT mRNA表达量明显增加[23],但牛磺酸的处理剂量过高反而抑制了TauT mRNA的表达[22]。离体条件下,100mmol/L牛磺酸降低了NIH3T3细胞中TauT mRNA的表达水平[24,25]。增加原代培养的星形胶质细胞中牛磺酸含量可以抑制高渗诱导的TauT mRNA表达[26]。本实验中,斜带石斑鱼摄食缺乏牛磺酸的饲料后,TauT mRNA表达水平明显降低,1.0%牛磺酸饲料组中TauT mRNA表达水平最高,1.5%牛磺酸饲料组次之。这种变化趋势与生长状况一致,说明缺乏牛磺酸不利于斜带石斑鱼幼鱼的生长发育,需要从饲料供给较高含量的牛磺酸,增加饲料中牛磺酸水平能大量诱导TauT mRNA表达,以适应牛磺酸的大量需求。敲除TauT基因的小鼠减重,组织内的牛磺酸含量明显下降,心脏检测不出牛磺酸,骨骼肌牛磺酸含量下降了96%[27]。由此可知TauT对牛磺酸的转运起关键作用,这也从侧面反映了牛磺酸是通过TauT的跨膜运转来实现其维持正常生长发育的功能。
[1]HuxtableR J.Physiologicalactionsoftaurine[J].Physiological Reviews,1992,72(1):101-163.
[2 Huxtable R and Bressler R.Effect of taurine on a muscle intracellular membrane[J].Biochimica Et Biophysica Acta,1973,323(4):573-583.
[3]Kuzmina VV,Gavrovskaya LKand Ryzhova O V.Taurine. Effect on exotrophia and metabolism in mammals and fish[J].Journal of Evolutionary Biochemistry&Physiology, 2010,46(1):19-27.
[4]Petrosian A Mand Haroutounian J E.Taurine as a universal carrier oflipid soluble vitamins:a hypothesis[J].Amino Acids,2000,19(2):409-421.
[5 Hegab S A and Hanke W.The significance of the amino acids during osmotic adjustment in teleost fish-II.Changes in the stenohaline Cyprinus carpio[J].Comparative Biochemistry&Physiology Part A Physiology,1983,74(3): 537-544.
[6]Park G S,Takeuchi T,Seikai T,et al.The Effects of dietary taurine on growth and taurine levels in whole body of juvenile Japanese flounder Paralichthys olivaceus[J].Nippon Suisan Gakkaishi,2001,67(2):238-243.
[7]Matsunari H,Hamada K,Mushiake K,et al.Effects of taurine levels in broodstock diet on reproductive performance of yellowtail Seriola quinqueradiata[J].Fisheries Science, 2006,72(5):955-960.
[8 Gurujeyalakshmi G,Wang Y and Giri S N.Taurine and niacin block lung injury and fibrosis by down-regulating bleomycin-induced activation of transcription nuclear factor-κB in mice[J].Journal of Pharmacology&Experimental Therapeutics,2000,293(1):82-90.
[9]Reymond I,Bitoun M,Levillain O,et al.Regional expression and histological localization of cysteine sulfinate decarboxylase mRNA in the rat kidney[J].Journal of Histochemistry&Cytochemistry,2000,48(11):1461-1468.
[10]ChowS C,Ching L Y,Wong A M,et al.Cloning and regulation of expression of the Na+-Cl--taurine transporter in gill cells offreshwater Japanese eels[J].Journal ofExperimental Biology,2009,212(Pt 20):3205-3210.
[11]Pinto W,R Ø nnestad I,Jordal A E O,et al.Cloning,tissue and ontogenetic expression of the taurine transporter in the flatfish Senegalese sole(Solea senegalensis)[J]. AminoAcids,2012,42(4):1317-1327.
[12 Roig-Pérez S,Ferrer C,Rafecas M,et al.Correlation of taurine transport with membrane lipid composition and peroxidation in DHA-enriched Caco-2 cells[J].Journal ofMembrane Biology,2009,228(3):141-150.
[13]Ito T,Oishi S,Takai M,et al.Cardiac and skeletal muscle abnormality in taurine transporter-knockout mice[J].Journal of Biomedical Science,2010,17(Suppl 1): 325-332.
[14 Livak K J and Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[15]Pasantes-Morales H,Quesada O and Morán J.Taurine: an osmolyte in mammalian tissues[J].Advances in Experimental Medicine&Biology,1998,442:209-217.
[16]Winter P C,Hickey G I and Fletcher H L.Instant notes in genetics[M].北京:科学出版社,1999.
[17 Uchida S,Kwon H M,Yamauchi A,et al.Molecular cloning of the cDNA for an MDCK cell Na(+)-and Cl(-)-dependent taurine transporter that is regulated by hypertonicity[J].Proceedings ofthe National Academy of Sciences of the United States of America,1993,90(15): 8230-8234.
[18]Hosoi M,Shinzato C,Takagi M,et al.Taurine transporter from the giant Pacific oyster Crassostrea gigas:function and expression in response to hyper-and hypo-osmotic stress[J].Fisheries Science,2007,73(2):385-394.
[19]Kozlowski D J,Chen Z,Zhuang L,et al.Molecular characterization and expression pattern of taurine transporter in zebrafish duringembryogenesis[J].Life Sciences,2008, 82(19-20):1004-1011.
[20]Zarate J Mand Bradley T M.Molecular cloning and characterization of the taurine transporter of Atlantic salmon[J].Aquaculture,2007,273(2-3):209-217.
[21]郑伟贤.鲈鱼TauT基因的cDNA克隆及组织表达[D].宁波:宁波大学硕士学位论文,2012.
[22 Wang X,He G,Mai K,et al.Molecular cloning and characterization of taurine transporter from turbot(Psetta maxima)and its expression analysis regulated by taurine in vitro[J].Aquaculture Research,2016.DOI: 10.1111/are.13009
[23]曾凯宏,许红霞,糜漫天.牛磺酸对高糖刺激Mǜller细胞VEGF和TauT表达的影响[J].成都医学院学报, 2009,4(3):167-172.
[24]Voss J W,Pedersen S F,Christensen S T,et al.Regulation of the expression and subcellular localization of the taurine transporter TauT in mouse NIH3T3 fibroblasts[J]. European Journal of Biochemistry,2004,271(23-24): 4646-4658.
[25 Kang Y S,Ohtsuki S,Takanaga H,et al.Regulation of taurine transport at the blood-brain barrier by tumor necrosis factor-α,taurine and hypertonicity[J].Journal ofNeurochemistry,2002,83(5):1188-1195.
[26 Bitoun M and Tappaz M.Taurine down-regulates basal and osmolarity-induced gene expression ofits transporter, but not the gene expression ofits biosynthetic enzymes,in astrocyte primary cultures[J].Journal of Neurochemistry, 2000,75(3):919-924.
[27]张煜,赵刚,刘耀川.敲除牛磺酸转运体的小鼠心肌及骨骼肌异常表现[J].现代畜牧兽医,2012(4):72-73.
Cloning and Expression of Taurine Transporter(TauT)Gene and Effect Dietary Taurine Level on Expression of TauT Gene in Orange-spotted Grouper(Epinephelus coioides)
LI Jia-xu1,2,YE Ji-dan1,2
(1.Fisheries College,Jimei University,Xiamen 361021,China; 2.Key Laboratory of Healthy Mariculture for the East China Sea,Ministry of Agriculture,Xiamen 361021,China)
Taurine transporter(TauT)is a key carrier in the transmembrane transport of taurine and plays an important role in growth, metabolism,and maturity in fish.The reverse transcription-ploymerase chain reaction(RT-PCR)and rapid amplification of cDNA ends(RACE)were applied to clone the sequence of TauT coding amino acids in orange-spotted grouper(Epinephelus coioides)with body weight of(12.85±0.46)g.The protein sequence of TauT appeared to have 1 881bp coding 626 amino acids with a molecular weight of 70 126.80 Da.The TauT was shown to share a high homology with other species of fish,and low homology with mammalian and birds through multi-sequence alignments and phylogenetic analysis.The grouper were fed the diets containing 0%,0.5%,1%and 1.5%taurine at water temperature of(27±2)℃for 28 d,and then the TauT mRNA was expressed in various tissues by using real-time PCR method.It was found that TauT mRNA was expressed in all the tissues detected,with higher expression levels in liver,heart and brain,followed by in kidney,gills and spleen,and the lower in gut,muscle and adipose tissues.The higher expression level of TauT mRNA was observed in the fish fed the diets containing taurine compared with that in the fish fed the basal diet.There was significantly higher expression level of TauT mRNA in the fish fed diets containing 1.0%and 1.5%taurine than that in fish fed 0.5%taurine diet. The findings indicate that dietary taurine supplementation could improve the TauT mRNA expression in tissues of orange-spotted grouper.
Epinephelus coioides;taurine transporter;homology analysis;gene expression
S917.4
A
1005-3832(2016)05-0048-07
2016-05-13
国家自然科学基金(31372546).
李家旭(1989-),男,硕士研究生,从事动物营养与饲料研究.E-mail:973464720@qq.com
叶继丹(1966-),研究员.E-mail:yjdwk@sina.com
