饲料粗脂肪水平对大泷六线鱼Hexagrammos otakii消化酶活性的影响
2016-02-07陈飞司滨暴宁姜晨
陈飞,司滨,暴宁,姜晨
(大连海洋大学辽宁省北方鱼类应用生物学与增养殖重点实验室,农业部北方海水增养殖重点实验室,辽宁 大连 116023)
饲料粗脂肪水平对大泷六线鱼Hexagrammos otakii消化酶活性的影响
陈飞,司滨,暴宁,姜晨
(大连海洋大学辽宁省北方鱼类应用生物学与增养殖重点实验室,农业部北方海水增养殖重点实验室,辽宁 大连 116023)
在水温(19±0.5)℃下,将体质量(66.5±1.1)g的大泷六线鱼Hexagrammos otakii饲养在实际水量为60L的水槽中,投喂粗蛋白为50%左右,脂肪水平分别为4.17%(L1)、6.73%(L2)、10.33%(L3)、12.85%(L4),及15.72%(L5)的5种饲料,研究饲料中脂肪水平对大泷六线鱼消化酶活性的影响。7周的饲养结果表明:随着饲料脂肪水平的增加,大泷六线鱼各消化组织中蛋白酶活性无显著性差异(P>0.05),但淀粉酶活性却随着脂肪水平的增加而降低(P<0.05)。L1组鱼胃、幽门盲囊和肠的淀粉酶活性最大,显著高于L4和L5组(P<0.05),但与L2和L3组没有显著性差异(P>0.05);L1组肝胰脏淀粉酶活性最大,与L3、L4和L5组有显著性差异(P<0.05)。脂肪酶活性随着饲料脂肪水平的增加呈先升高后降低的趋势。L3组鱼胃和肠的脂肪酶活性最大,显著高于其他组(P<0.05);L3组鱼幽门盲囊脂肪酶活性最高,与L1、L2和L5组有显著性差异(P<0.05),但与L4组差异不显著(P>0.05)。综上所述,大泷六线鱼饲料中最适脂肪添加水平为10.33%。
大泷六线鱼;脂肪水平;饲料;消化酶活性
大泷六线鱼Hexagrammos otakii(又名欧氏六线鱼)主要分布于我国山东和辽宁及日本、朝鲜等国等近海多岩礁海区[1],是中国北方网箱养殖的重要种类,也是开拓礁湾增殖和发展游钓业的理想种类,具有广阔的推广前景[2]。
目前有关大泷六线鱼的研究主要集中在人工繁育、仔鱼生长、生物学、营养成分分析等方面[2-8]。随着天然资源日渐匮乏,大泷六线鱼人工养殖已悄然兴起。为了适应大规模养殖的需求,研究大泷六线鱼的营养需求及配合饲料迫在眉睫。脂肪是生长过程中所需能量和必须脂肪酸的重要来源,可以促进脂溶性维生素的吸收和运输,也是某些激素和维生素的合成原料[9,10]。因此,探讨消化酶与饲料脂肪水平之间的关系对开发大泷六线鱼配合饲料有积极指导作用。
1 材料与方法
1.1 材料
试验鱼为取自大连长海县网箱养殖的海捕大泷六线鱼,试验前暂养于控温水槽,水温(19±0.5)℃。试验鱼经3周的驯化后,选取大小基本一致、体质健康的鱼90尾,体质量(66.5±1.1)g。
以鱼油为脂肪源制成五种脂肪水平的颗粒饲料,脂肪含量水平分别为4.17%、6.73%、10.33%、12.85%和15.72%。总能相近(平均值为(20.43± 1.17)kJ/g),试验饲料的原料组成和营养成分见表1。
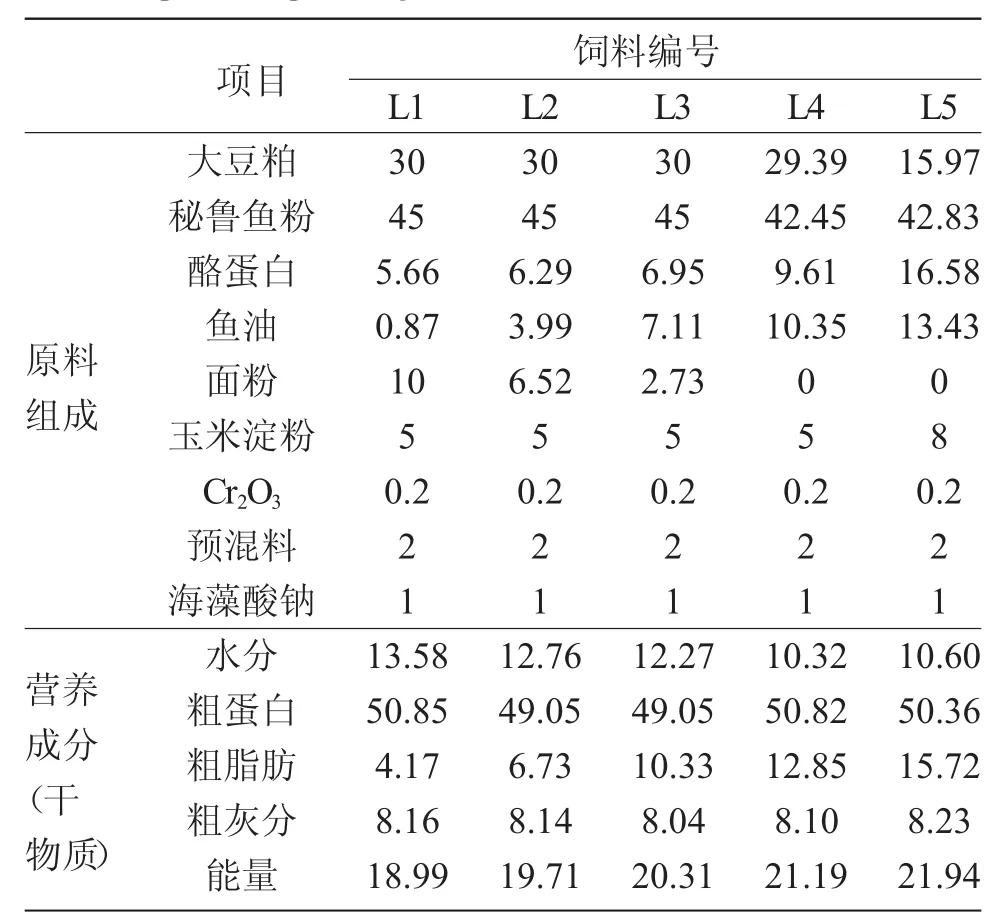
表1 大泷六线鱼试验饲料原料组成和营养成分(干物质)Tab.1 Ingredient(%)and approximate composition(in dry matrial) of the experimental diets for fat greenling Hexagrammos otakii
1.2 方法
按饲料脂肪水平由低至高,将试验鱼随机分别记为L1、L2、L3、L4、L5五个处理组,每个处理组3个重复,共15个水量60L的水槽,每个水槽随机放置鱼6尾。海水经过滤、加热调温后使用,每日换水量为1/2,水槽内24h连续充气。试验期间,每天早7点投喂一次,投喂前1h前收集粪便,投喂1h后收集残饵。水温控制在(19±0.5)℃,pH为7.8~8.0,盐度为30~32。经方差检验,各组间试验鱼的初始体质量无显著差异(P>0.05)。试验7周结束时,检测各组试验鱼消化部位的主要消化酶活性。
饲养结束时,将试验鱼饥饿24h后,每个水槽随机取2尾鱼,置于冰盘内解剖。取出胃、幽门盲囊、肠和肝胰脏,剥除各部位多余的脂肪和结缔组织,去离子水(4℃)冲净消化道内容物,滤纸吸干水分后分别称重。将称重后的各组消化部位在冰盘上剪碎,用5倍去离子水(4℃)匀浆,匀浆液于4℃冰箱中静置1h后,4℃下6 000r/min离心20min,取上清液保存在4℃冰箱中。
各消化部位的胃蛋白酶、淀粉酶和脂肪酶活性分别在pH 2.0、7.6和8.0条件下测定。
1.3 数据处理
数据用Mean±SE的形式表示,使用SPSS13.0软件处理,进行Duncan多重比较。使用Excel 2003软件制作图表。
2 结果与分析
2.1 不同脂肪水平饲料对大泷六线鱼蛋白酶活性的影响
大泷六线鱼摄食不同脂肪含量的饲料后,各消化部位蛋白酶活性呈不规律变化,组间差异不显著(P>0.05)。各组织蛋白酶活性由高到低依次为:胃>幽门盲囊>肝胰脏>肠,胃和幽门盲囊蛋白酶活性明显高于肠和肝胰脏;肝胰脏和肠蛋白酶活性差异不显著(表2)。
2.2 不同脂肪水平饲料对大泷六线鱼淀粉酶活性的影响
由表3可知,各消化部位淀粉酶活性随着饲料脂肪水平增加而降低。L1、L2和L3组大泷六线鱼胃、幽门盲囊和肠淀粉酶的活性差异不显著(P>0.05)。L3、L4和L5组大泷六线鱼胃淀粉酶活性差异不显著(P>0.05),但L1、L2与L4、L5组之间的差异显著(P<0.05);L2、L3、L4、L5组幽门盲囊的淀粉酶活性差异不显著(P>0.05),但L1与L4、L5之间差异显著;L2、L3、L4、L5组肠淀粉酶活性在相邻组间的差异不显著(P>0.05);相邻组肝胰脏淀粉酶活性的差异不显著(P>0.05)。L1组中各组织的淀粉酶活性最高,从高到低依次为:幽门盲囊>肠>肝胰脏>胃。
2.3 不同脂肪水平饲料对大泷六线鱼脂肪酶比活性的影响
由表4可知:随着饲料脂肪水平的增加,各消化部位脂肪酶活性均呈先升高后下降的趋势。当饲料脂肪水平从L1组升至L3组时,胃、幽门盲囊和肠脂肪酶活性均上升。当饲料脂肪水平继续升至L4组、L5组时,胃、幽门盲囊和肠脂肪酶活性则不同程度下降。当饲料脂肪水平从L1组升至L4组时,肝胰脏脂肪酶活性逐渐增强;但脂肪水平继续升至L5组时,肝胰脏脂肪酶活性则急剧下降。可见,L3组胃、幽门盲囊和肠脂肪酶活性最大,且L3组胃肠脂肪酶活性均显著高于其他组(P<0.05),L3组幽门盲囊脂肪酶活性显著高于L1、L5组(P<0.05),但与L2、L4组差异不显著(P>0.05)。L4组肝胰脏脂肪酶活性最高,且显著高于其他组(P<0.05)。在各消化部位处于最适脂肪浓度时,幽门盲囊和肝胰脏的脂肪酶活性明显高于其他组织,而胃和肠之间的脂肪酶活性差异较小。

表2 不同脂肪水平对大泷六线鱼蛋白酶比活力的影响Tab.2 Effects of dietary lipid level on protease specific activity(U/mgprot)in fat greenling Hexagrammos otakii
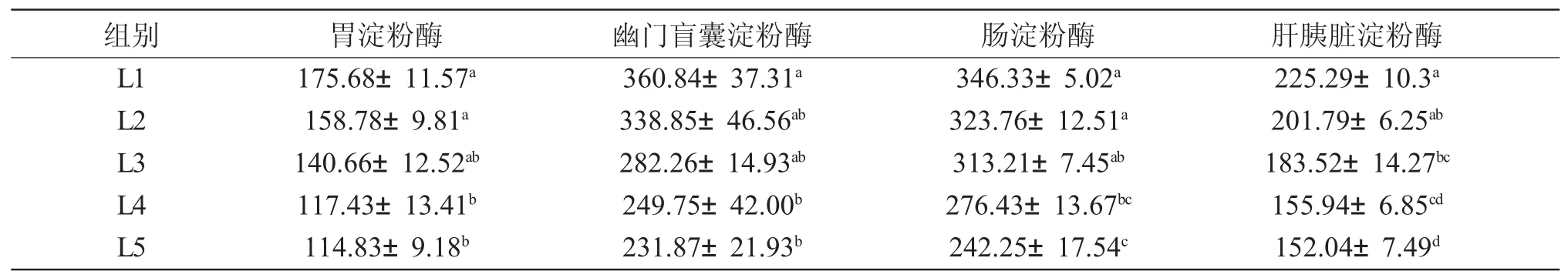
表3 不同脂肪水平对大泷六线鱼淀粉酶比活力的影响Tab.3 Effects of different dietary lipid levels on amylase specific activity(U/gprot)in fat greenling Hexagrammos otakii

表4 不同脂肪水平对大泷六线鱼脂肪酶比活力的影响Tab.4 Effects of dietary lipid levels on lipase specific activity(U/gprot)in fat greenling Hexagrammos otakii
3 讨论
3.1 饲料脂肪水平与蛋白酶活力的关系
大泷六线鱼不同组织的蛋白酶活性随饲料脂肪水平的增加呈不规律变化,各组织的蛋白酶比活力由高到低依次为:胃>幽门盲囊>肝胰脏>肠。胃蛋白酶的比活力明显高于其他组织,说明胃是蛋白质消化吸收的主要器官;而幽门盲囊次之,但也明显高于肠蛋白酶和肝胰脏蛋白酶,说明在胃中未完全消化吸收的蛋白质可以在幽门盲囊再次消化吸收,提高了机体对蛋白质的利用率。韩光明[11]等研究表明,随着饲料中脂肪水平的增加,吉富罗非鱼胃及肠道蛋白酶活性无显著性差异,这一结论与大泷六线鱼的试验结论相同。饲料中能量与蛋白质的适宜比例对鱼具有重要意义。因此,在鱼类饲料中添加脂肪,可以产生节约蛋白质效应[12]。当饲料中脂肪含量不足时,鱼类代谢紊乱,蛋白质被消耗于供能,造成脂溶性维生素和必需脂肪酸缺乏症[10];而当饲料中脂肪含量过高时,鱼体脂肪沉积过多,抑制鱼体生长,影响鱼体健康[13-15]。在饲料中添加适宜水平的脂肪对鱼类生长发育有重要影响,饲料中的成分配比应与鱼体的消化能力相适应。根据刘洋等[16]的研究结果,大泷六线鱼饲料的最适蛋白质含量为51%。本试验分析表明:饲料中添加的蛋白质含量约为50%,接近于大泷六线鱼最适蛋白质需要,这可能是各消化器官蛋白酶活性无显著性差异的原因。
3.2 饲料脂肪水平与淀粉酶活力的关系
一般认为,肉食性鱼类淀粉酶活力普遍低于杂食性和草食性鱼类。邹陈海等[17]对白甲鱼幼鱼的研究表明,饲料中不同脂肪含量对肠和肝胰脏淀粉酶活性无显著影响。章龙珍等[18]报道点篮子鱼摄食不同脂肪水平的饲料后,幽门盲囊、前肠、中肠和肝脏的淀粉酶活性有显著性差异,但后肠和胃的淀粉酶活性无显著性差异。在本试验中,大泷六线鱼摄食不同脂肪水平饲料后,淀粉酶活力随脂肪水平的升高一直呈较为平缓的下降趋势;不同组织之间淀粉酶活性存在一定的差异性,幽门盲囊淀粉酶活性最强,肠淀粉酶次之,说明幽门盲囊和肠是淀粉消化的主要场所,而胃和肝胰脏则为辅助消化吸收糖类的器官。有资料报道,鱼类淀粉酶的适应性[19]依赖饵料的营养组成[20]。因此,试验中淀粉酶活性降低的原因其一可能是与饲料成分中糖类物质的减少有关,这一点与刘洋等[16]对大泷六线鱼的最适蛋白质的研究得出的观点一致;其二可能是与鱼体本身利用的脂肪增加有关。随着饲料脂肪水平的增加,鱼体利用脂肪作为能量的比例增加,利用糖类的比例减少,降低了淀粉酶活性。这也是鱼类对饲料环境适应性的表现。
3.3 饲料脂肪水平与脂肪酶活力的关系
脂肪是鱼类生长所必需的一类营养物质。脂类能提供能量资源、必需脂肪酸、磷脂、固醇等物质,是脂溶性维生素(A、D、E等)的溶解介质[21]。虽然脂类物质在鱼类营养需求中有重要作用,但在鱼类饲料中添加该营养成分时还必须要考虑到鱼类的消化能力,即饲料配方的组成要与鱼类消化酶水平相适应[22]。
Zhou等[9]对方斑东风螺Babylonia areolate的研究表明,随着饲料脂肪水平的增加(1.83%~11.73%),软体部分脂肪酶活力升高。Almeida等[23]报道大盖巨脂鲤Colossoma macropomum摄食不同饲料后,胃脂肪酶活性最高,但随饲料脂肪水平增加无显著变化;前肠脂肪酶活性与饲料脂肪水平呈正相关。Manjappa等[24]在对鲤肠道脂肪酶的研究中,却没有发现类似前面提到的脂肪酶活性与饲料脂肪水平呈正相关的情况。本试验中,当饲料脂肪水平从L1组上升到L3组时,脂肪酶活性呈上升趋势,然而当饲料脂肪水平从L3水平升至L5水平时,除L4组鱼肝胰脏脂肪酶达到最高酶活性外,其他部位的脂肪酶活性都随着饲料水平的继续升高而呈现不同程度的降低。整体来看,在饲料脂肪水平为10.33%时(L3组),试验鱼消化道脂肪酶活性最高,幽门盲囊脂肪酶活性显著高于其他消化组织。饲料脂肪水平高于10.33%表明超过了鱼体的需要量,降低了鱼体消化脂肪的能力,引起脂肪酶活力下降。
3.4 饲料适宜脂肪水平的探讨
关于鱼类饲料最适脂肪水平的报道很多[25-30],且大多以生长为指标。Watanabe等对鲤的研究表明,当饲料蛋白水平为33%时,脂肪适宜量为5%~8%。王贵英等[27]根据鳜SGR、PER和FCR指标,结合脂肪含量过高的不利因素,综合分析认为鳜饲料适宜的脂肪含量为7%~12%。梁友光[31]认为,饲料脂肪水平在15%~18%时,长吻鮠Leiocassis longirostris Gunther生长率高,饵料系数低。本试验中,虽然大泷六线鱼胃蛋白酶活性在脂肪水平为6.73%(L2组)时达最大值,且在6.73%(L2组)与10.33%(L3组)之间无显著性差异(P>0.05),但当饲料脂肪含量为4.17%(L1组)时,幽门盲囊和肠的淀粉酶活性最高,但均与10.33%(L3组)无显著性差异(P>0.05)。幽门盲囊的脂肪酶活性在脂肪水平为10.33%(L3组)时达到最大值。综上所述,当饲料中脂肪水平为10.33%时,各主要消化组织的消化酶活性较高,各种营养物质能够合理并充分地应用到生长、发育及繁殖等生理活动中。因此,大泷六线鱼饲料脂肪水平的最适添加量可以控制在10.33%。这与其他鱼类的饲料脂肪添加量有差异,可能是种类差异、饲养环境及饲养方式不同等因素造成。
[1]刘蝉馨,秦克静.辽宁动物志,鱼类[M].沈阳:辽宁科学技术出版社,1987:394-396.
[2]潘雷,胡发文,高凤祥,等.大泷六线鱼人工繁殖及育苗技术初步研究[J].海洋科学,2012,36(12):39-44.
[3]吴立新,秦克静,姜志强,等.大泷六线鱼(Hexagrammos otakii)人工育苗初步试验[J].海洋科学,1996,20(4): 32-34.
[4]胡发文,郭文,潘雷,等.大泷六线鱼仔稚幼鱼形态发育与生长特性[J].渔业科学进展,2012,33(6):16-22.
[5]胡发文,潘雷,高凤祥,等.温度和盐度变化对大泷六线鱼幼鱼存活与生长的影响[J].海洋科学,2012,36(7): 44-48.
[6]邱丽华,秦克静,吴立新,等.光照对大泷六线鱼仔鱼摄食量的影响[J].动物学杂志,1999,34(5):1-7.
[7]刘奇,王亮,高天翔,等.北黄海大泷六线鱼主要生物特征比较研究[J].中国海洋大学学报,2009,39(增刊):13-18.
[8]康斌,武云飞.大泷六线鱼的营养成分分析[J].海洋科学,1999,68(6):23-25.
[9 Zhou Q C,Zhou J B,Chi S Y,et al.Effect of dietary lipid level on growth performance,feed utilization and digestive enzyme of juvenile ivory shell,Babylonia areolate[J]. Aquaculture,2007,272(1-4):535-540.
[10]李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1998:36-46.
[11]韩光明,王爱民,徐跑,等.饲料中脂肪水平对吉富罗非鱼幼鱼成活率、肌肉成分及消化酶活性的影响[J].上海海洋大学学报,2010,19(4):469-474.
[12]付世建,谢小军,张文兵,等.南方鲇的营养学研究:Ⅲ.饲料脂肪对蛋白质的节约效应[J].水生生物学报, 2001,25(1):70-75.
[13 Du Z Y,Liu Y J,Tian L X,et al.Effect of dietary lipid level on growth,feed utilization and body composition by juvenile grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition,2005,11(2):139-146.
[14 Regost C,Arzel J,Cardinal M,et al.Dietary lipid level, hepatic lipogenesis and flesh quality in turbot(Psetta maxima)[J].Aquaculture,2001,193(3-4):291-309.
[15]Borges P,Oliveira B,Casal S,et al.Dietary lipid level affects growth performance and nutrient utilization of Senegalese sole(Solea senegalensis)juveniles[J].British Journal ofNutrition,2009,102(7):1007-1014.
[16]刘洋,姜志强,王福强,等.大泷六线鱼对蛋白质的最适需要量[J].大连水产学院学报,2008,23(5):387-390.
[17]邹陈海,向枭,王天值,等.饲料脂肪水平对白甲鱼幼鱼消化酶活性的影响[J].渔业现代化,2013,40(2):39-44.
[18]章龙珍,朱卫,王妤,等.饲料脂肪水平对点篮子鱼消化酶活性和血液主要生化指标的影响[J].海洋渔业, 2014,36(2):170-176.
[19]Lundstedt L M,Melo J F B and Moraes G.Digestive enzymes and metabolic profile of Pseudoplatystoma corruscans(Teleostei:Siluriformes)in response to diet composition[J].Comparative Biochemistry and Physiology,Part B:Biochemistry and Molecular Biology,2004,137(3): 331-339.
[20]Reimer G.The influence of diet on the digestive enzymes of the Amazon fish Matrinchã,Brycon cf.melanopterus[J].Journal ofFish Biology,1982,21(6):637-642.
[21]Watanabe T.Lipid nutrition in fish[J].Comparative Biochemistry and Physiology,Part B:Comparative Biochemistry,1982,73(1):3-15.
[22]Chakrabarti I,Gani MA,Chaki K K,et al.Digestive enzymes in 11 freshwater teleost fish species in relation to food habit and niche segregation[J].Comparative Biochemistry and Physiology,Part A:Physiology,1995,112(1):167-177.
[23]Almeida L C D,Lundstedt L M and Moraes G.Digestive enzyme responses of tambaqui(Colossoma macropomum)fed on different levels of protein and lipid[J]. Aquaculture Nutrition,2006,12(6):443-450.
[24 Manjappa K,Keshavanath P and Gangadhara B.Growth performance ofcommon carp,Cyprinus carpio fed varying lipid levels through low protein diet,with a note on carcass composition and digestive enzyme activity[J].Acta Ichthyologica Et Piscatoria.2002,32(2):145-155.
[25 Bromley P J.Effect of dietary protein,lipid and energy content on the growth of turbot(Scophthalmus maximus L.)[J].Aquaculture,1980,19(80):359-369.
[26 Cowey C B,Adron J W and Brown D A.Studies on the nutrition of marine flatfish.The metabolism of glucose by plaice(Pleuronectes platessa)and the effect of dietary energy source on protein utilization in plaice[J].The British Journal ofNutrition,1975,33(2):219-231.
[27]王贵英,曾可为,郑翠华,等.饲料脂肪水平对鳜鱼生长的影响[J].饲料研究,2003(4):38-39.
[28]刘梅珍,石文雷,朱晨炜,等.饲料中脂肪的含量对团头鲂鱼种生长的影响[J].水产学报,1992,16(4):330-336.
[29]张春暖,王爱民,刘文斌,等.饲料脂肪水平对梭鱼脂肪沉积、脂肪代谢酶及抗氧化酶活性的影响[J].中国水产科学,2013,20(1):108-115.
[30]向枭,周兴华,陈建,等.饲料脂肪水平对白甲鱼幼鱼生长性能、体组成和血清生化指标的影响[J].动物营养学报,2013,25(8):1805-1816.
[31]梁友光.饲料脂肪水平对长吻鮠生长的影响[J].水利渔业,1999(1):45-46.
Effects of Dietary Crude Lipid Levels on Digestive Enzyme Activityin of Fat Greenling Hexagrammos otakii
CHEN Fei,SI Bin,BAO Ning,JIANG Chen
(Key Laboratory of Fish Applied Biology and Aquaculture in North China,Liaoning Province,Key Laboratory of Mari Culture &Stock Enhancement in North China’s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023,China)
A feeding trial was conducted to study the effect of dietary lipid levels on digestive enzyme activities in fat greenling Hexagrammos otakii.Fat greenling juveniles with body weight of(66.5±1.1)g were reared in a 60 L tank and fed five diets containing lipid levels of 4.17%(L1),6.73%(L2),10.33%(L3),12.85%(L4),and 15.72%(L5)for 7 weeks at water temperature of(19±0.5)℃. The results showed that there was no significant difference in the protease activity in the fish fed different diets with increasing dietary lipid level(P>0.05).However,the amylase activities were shown to be significant decreased with increasing of dietary lipid levels(P<0.05),the maximal amylase activity in stomach,pyloric caeca and intestine in group L1,significantly higher than that in group L4 and group L5(P<0.05)and without significantly different from those in group L2 and group L3(P>0.05).The maximal amylase activity was observed in hepatopancreas in group L1,significantly higher than those in group L3,group L4 and group L5(P<0.05). The activities of lipase were found to be increased first and then decreased in the fish fed the diets containing increasing lipid,significantly higher in stomach and intestine in group L3 than in other groups(P<0.05).The maximal lipase activity was found in pyloric caeca in group L3,significantly higher than those in group Ll,group L2,and group L5(P<0.05),without significantly different from that in group L4(P>0.05).From the above,it is recommended that the optimal lipid requirement be 10.33%in fat greenling.
Hexagrammos otakii;lipid level;feed;digestive enzyme activity
S963.72
A
1005-3832(2016)05-0043-05
2016-04-21
陈飞(1990-),女,硕士,研究方向:水生生物学.E-mail:714411463@qq.com
姜晨(1988-),女,博士.E-mail:87111960@qq.com
