虹鳟IL-17多克隆抗体的制备及初步鉴定
2016-02-07曹永生徐黎明赵景壮刘淼卢彤岩
曹永生,徐黎明,赵景壮,刘淼,卢彤岩
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
虹鳟IL-17多克隆抗体的制备及初步鉴定
曹永生,徐黎明,赵景壮,刘淼,卢彤岩
(中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070)
本研究根据NCBI已发表序列设计引物,提取经植物血凝素刺激后的虹鳟Oncorhynchus mykiss头肾细胞总RNA,采用RT-PCR方法扩增IL-17成熟肽基因,测序结果表明所获得的序列与发表序列相一致。将该基因重组至原核表达载体pET32a中,并转化大肠杆菌Escherichia coli Rosetta,进行诱导表达。SDS-PAGE电泳结果表明:目的蛋白以包涵体形式表达,大小约为32kDa,重组蛋白经Ni-NTA系统纯化、复性后纯度达90%以上,以其免疫小鼠制备虹鳟IL-17多克隆抗体。ELISA结果显示其效价为1∶25 600,而间接免疫荧光结果显示所制备的多克隆抗体能够特异性地识别真核细胞中瞬时表达的虹鳟IL-17。本研究成功制备虹鳟IL-17多克隆抗体,为下一步IL-17在虹鳟黏膜免疫中的作用及其佐剂效应研究奠定基础。
虹鳟;IL-17;多克隆抗体
虹鳟是典型的冷水鱼,生长较快,因富含蛋白、无肌间刺、富含EPA和DHA等不饱合脂肪酸而备受全世界消费者的青睐[1]。近年来,随着养殖密度的加大和养殖环境的恶化,虹鳟病害时常发生,影响了我国虹鳟产业的发展[2]。我国学者在虹鳟流行病学、疫苗制备和药物防治等方面已取得一定的成果[3-5],但认知免疫机理对虹鳟病害致病机制的掌握及其防治体系的建立更具有积极的意义。
IL-17是由Th17细胞分泌的细胞因子,具有抵抗细菌、真菌、病毒和寄生虫感染的作用[6-9]。更为重要的是,IL-17受体在黏膜多种细胞中均有表达,IL-17A、IL-17C、IL-17F可直接作用于上皮细胞而诱导多种免疫反应,而IL-17E可作用于白细胞和诱导Th2型免疫反应[10]。2013年Monte等[11]首次克隆了虹鳟IL-17,发现IL-17在健康鱼的黏膜组织中可持续的高水平表达,而当细菌、寄生虫和病毒感染时IL-17在虹鳟头肾中可显著被诱导表达,同时重组IL-17可影响脾细胞中抗菌肽和促炎症细胞因子的表达水平,这意味着虹鳟IL-17在病原体感染所诱导的黏膜免疫中发挥重要作用。
本研究利用原核表达系统获得重组虹鳟IL-17蛋白,并制备多克隆抗体,为进一步从蛋白水平研究虹鳟黏膜免疫中IL-17的作用及其佐剂效应提供关键材料。
1 材料与方法
1.1 材料
实验用健康虹鳟由黑龙江水产研究所渤海冷水性鱼类试验站提供,体质量约5g。雌性BALB/c小鼠购自哈尔滨医科大学第二附属医院实验动物中心。
鲑胚胎细胞系CHSE-214、大肠杆菌DH5α、Rosetta均为本实验室保存。
RNA提取试剂盒和质粒小量提取试剂盒为天根生化科技(北京)有限公司产品;弗氏完全佐剂、弗氏不完全佐剂购自Sigma公司;DNA转染试剂为Invitrogen公司产品;辣根过氧化物酶标记的抗鼠二抗和FITC标记的抗鼠二抗为Abcam公司产品;DNA琼脂糖凝胶回收试剂盒、DNA Marker、M-MLV反转录酶、rTaq DNA聚合酶、pMD18-T simple载体、限制性内切酶购自宝生物工程(大连)有限公司。
1.2 目的基因的克隆及质粒的构建
虹鳟被处死后,迅速于冰上无菌条件下剥取头肾,经PBS洗涤后加入适量的含10%FBS的MEM培养基,分离单核细胞,经5μg/mL的植物血凝素刺激4h后利用RNA提取试剂盒提取总RNA,以引物Oligo(dT)18进行反转录,获得cDNA第一条链。参考已发表的虹鳟IL-17序列(Genbank:NM_001124619),设计引物以扩增IL-17成熟蛋白基因。上游引物:5'-ATCGGATCCAAAGGAATGAAGGTGACAAAGG-3'(下划线所示为BamH I酶切位点),下游引物:5'-GACAAGCTTTTATCAAGTAGTCCTTGCCCA-3'(下划线所示为HindⅢ酶切位点)。PCR反应条件为:94℃预变性 7min;94℃变性 30s,55℃退火30s,72℃延伸24s,25个循环;72℃终延伸10min。琼脂糖凝胶回收目的基因片段,与pMD18-T simple载体连接后转化大肠杆菌DH5α,将鉴定正确的样品送往博仕公司进行测序。利用限制性内切酶BamH I和HindⅢ切割阳性质粒,胶回收获得目的片段,并与切割好的pET32a载体在16℃下连接过夜,转化大肠杆菌DH5α。利用PCR、限制性内切酶切割法鉴定重组质粒。而后,设计引物扩增IL-17基因用于构建真核表达质粒,上游引物:5'-CGGAAT TCGCCACCATGAAAGGAATGAAGGTGACAAAGG-3'(下划线所示为EcoR I酶切位点,加粗所示为Kozark序列用于增强目标基因的翻译效率,斜体所示为起始密码子),下游引物:5'-CCGCTCGAGTCAA GTAGTCCTTGCCCA-3'(下划线所示为Xho I酶切位点),以鉴定为正确的阳性质粒为模板进行PCR扩增,将目的片段连入pCDNA3.1载体,对构建的重组质粒进行同样的酶切鉴定和测序分析。
1.3 虹鳟IL-17多克隆抗体免疫原的制备
将鉴定正确的阳性原核表达质粒转化至大肠杆菌 Rosetta中,自平板上挑取单菌落于含100μg/mL AMP的5mL LB培养基中,37℃220r/min震荡培养过夜。次日将过夜培养物以1∶100比例接种于100mL LB培养基中,220r/min震荡培养至OD600达到0.6~0.8,加入1mMIPTG诱导表达,每隔1h收集1mL培养物至5h,4℃4 000r/min离心收集菌体。以1/10初始培养基体积的PBS重悬菌体,超声裂解破碎后分为上清和沉淀,用SDS-PAGE分析目的蛋白存在形式。在明确重组蛋白表达形式之后,依照QIAGEN公司的《含组氨酸标签重组蛋白的纯化手册》,采取相应的方案纯化目标蛋白。将纯化后的蛋白放入透析袋中,分别在含6mol/L、4mol/L、2mol/L、0mol/L的尿素PBS溶液中透析4h,测定蛋白浓度后保存于-80℃冰箱中备用。
1.4 重组虹鳟IL-17多克隆抗体的制备与效价测定
免疫前自尾静脉采集三只小鼠血液,制备阴性对照血清。以纯化的重组虹鳟IL-17免疫小鼠,免疫策略为:首次以弗氏完全佐剂乳化的重组蛋白免疫,1周和2周后采用弗氏不完全佐剂乳化的重组蛋白腹腔多点注射加强免疫,剂量均为100μg/只。当多抗效价达到要求后,摘取眼球方式采集小鼠血液、分离血清,-20℃保存备用。
多抗效价的测定:以碳酸盐包被液将稀释纯化的重组IL-17蛋白包被于ELISA板中,以5%脱脂乳封闭,将倍比稀释的多克隆抗血清加于ELISA板中,以辣根过氧化物酶标记的抗鼠抗体为二抗进行TMB显色,终止反应后在酶标仪中读取OD450结果。
1.5 多克隆抗体活性的初步鉴定
采用碱裂解法大量提取所构建的重组IL-17真核表达质粒和pcDNA3.1质粒(阴性对照),测定浓度后与转染试剂混合后,以1μg剂量转染于CHSE-214细胞,培养72h,弃细胞上清,以4%多聚甲醛固定细胞,加入1∶500稀释的多克隆抗体,以FITC标记的抗鼠抗体为二抗进行间接免疫荧光鉴定。
2 结果与分析
2.1 重组质粒的鉴定
琼脂糖凝胶电泳结果显示:在预期位置387bp左右出现目标条带(图1),经测定所克隆的序列与参考序列完全一致。以限制性内切酶BamH I和HindⅢ切割重组原核表达质粒pET32a-IL-17,以限制性内切酶EcoR I和Xho I切割重组真核表达质粒pcDNA3.1-IL-17,琼脂糖凝胶电泳结果均可见载体片段和目的基因片段,证实已构建包含目的基因IL-17的重组原核/真核表达质粒(图1)。

图1 目的基因的扩增和重组质粒的构建Fig.1 Gene cloning and the construction of recombinant plasmids
2.2 虹鳟IL-17多克隆抗体免疫原的制备
SDS-PAGE结果显示:诱导2h后的含有阳性重组质粒的Rosetta在预期位置32kDa左右处出现目标蛋白条带(图2,泳道2),但未诱导的未出现此条带(图2,泳道1),证实重组IL-17在原核表达系统中已成功表达。此外结合BandScan软件分析结果,发现在诱导后4h目的蛋白占全菌蛋白中的比例最高(图2,泳道3),因此确定收集菌体的时间为诱导后4h。蛋白表达形式分析结果显示:目标蛋白主要是以包涵体形式表达(图3,泳道4)。因此,以QIAGEN His纯化试剂盒,采用变性蛋白纯化策略纯化了目的蛋白,经BandScan软件分析结果显示:透析后的目的蛋白纯度达到90%以上(图3,泳道5),可以用于多克隆抗体的制备。

图2 诱导后不同时间包含重组质粒的Rosetta的表达产物分析Fig.2 The expressed products in the Rosetta containing the recombinant plasmids induced for different hours

图3 重组虹鳟IL-17免疫原的制备Fig.3 The generation of recombinant IL-17 in rainbow trout
2.3 虹鳟IL-17多克隆抗体的制备
免疫3次后,对所制备的多克隆抗血清进行自1∶100~1∶204 800的倍比稀释,利用间接ELISA测定效价。结果表明,当(阳性血清OD450-空白OD450)/(阴性血清OD450-空白OD450)>2.1时,血清最大稀释倍数为1∶25 600,即所制备的多克隆抗体效价为1∶25 600(图4)。这表明虹鳟IL-17多克隆抗体已成功制备,且其效价可以满足今后的实验需求。
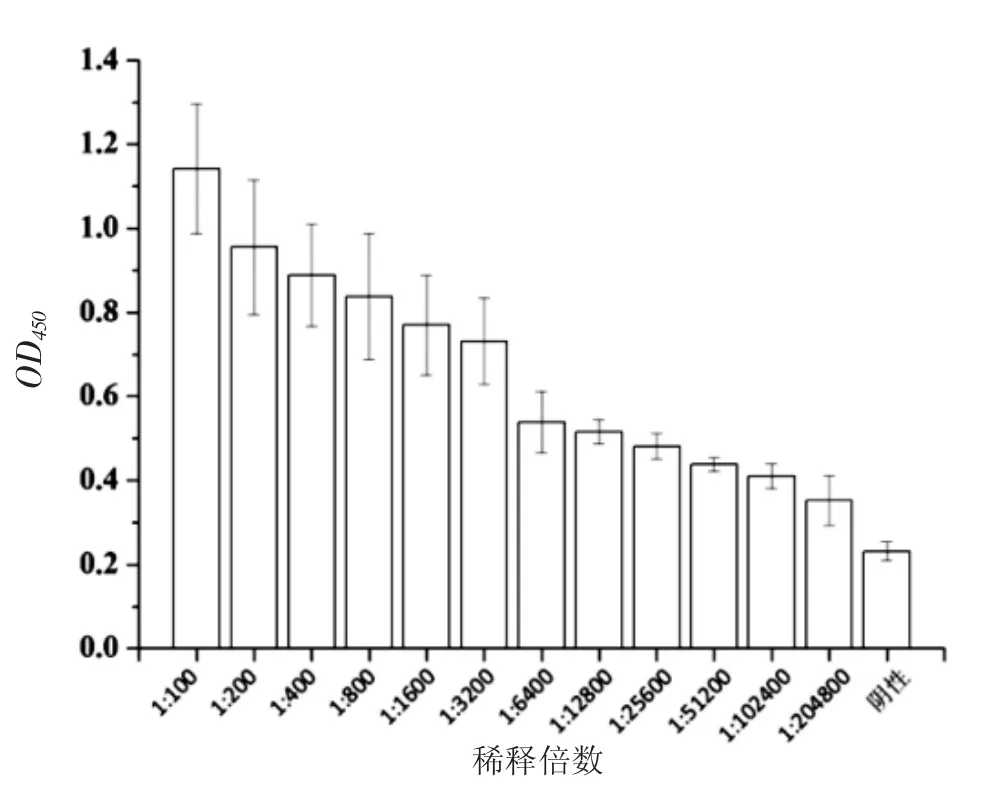
图4 虹鳟IL-17多克隆抗体效价的测定Fig.4 The titer of the IL-17 polyclonal antibody in rainbow trout
2.4 虹鳟IL-17多克隆抗体活性的初步鉴定
间接免疫荧光法鉴定所制备的虹鳟IL-17多克隆抗的活性结果显示:经4%多聚甲醛固定后的细胞形态较为完整(图5-A),所制备的多克隆抗体能够特异性地识别真核细胞中瞬时表达的虹鳟IL-17(图5-B),而瞬时转染pcDNA3.1的对照中无特异性荧光出现(图5-C),说明制备的虹鳟IL-17多克隆抗体具备理想的效价和良好的反应原性。

图5 间接免疫荧光鉴定虹鳟IL-17多克隆抗体活性Fig.5 Identification of the IL-17 polyclonal antibody in rainbow trout by indirect immunofluorescence
3 讨论
黏膜作为鱼类的第一道防线,能敏锐地区分水体中大量的无害微生物和病原微生物,保证快速有效地激发免疫反应而抵抗病原菌的侵入,因此与陆生动物相比,鱼类的黏膜免疫系统更为复杂[12]。 IL-17可诱导产生巨噬细胞炎症蛋白-2、G-CSF和趋化因子等而招募中性粒细胞,也可在IL-22的协同下诱导产生抗菌肽,清除黏膜处的肺炎克雷伯氏菌K.peneumoniae[13,14]。虹鳟IL-17在黏膜免疫反应的作用已在基因表达水平得到证实,而刘爽等利用制备的日本七鳃鳗Lampetra japonica IL-17多克隆抗体成功检测到了表达IL-17的淋巴细胞[15]。因此,以虹鳟IL-17多克隆抗体为材料可分析病原体感染时虹鳟黏膜组织中IL-17蛋白水平的变化和表达IL-17的细胞类群,为揭示虹鳟IL-17在黏膜免疫中的作用提供更为直接的证据。
疫苗是鱼类病害防控的有效手段之一。注射免疫效果虽好,但耗时、耗力,不适合小规格鱼;浸泡免疫和口服免疫操作简单,适合批量免疫,但需要克服抗原需要量大和抗原摄入后不可控的问题[16]。而佐剂的使用可提高疫苗的免疫效果,为间接解决上述问题提供了可能。现已证实,IL-17具有诱导炎症因子和招募中性粒细胞的生物学特性,可有效地作为疫苗分子的佐剂[17]。同时,Th17细胞和IL-17对发挥霍乱毒素的黏膜免疫佐剂效应具有重要作用[18]。因此,虹鳟IL-17是否对疫苗免疫效果具有辅助作用是值得探索的。
本研究利用高效、低成本的原核表达系统成功制备了32kDa的重组虹鳟IL-17,虽然生物信息软件分析显示目的基因在大肠杆菌中的CAI仅为0.29(http://www.jcat.de/),但并未影响目的蛋白在大肠杆菌中的有效表达。通过优化诱导剂浓度和诱导温度未获得可溶性表达的虹鳟IL-17(结果未显示),推测这与其为异源蛋白而表达水平又较高有关[19]。但本研究以提纯的包涵体为样品,利用Ni-NTA纯化系统成功获得了纯度较高的重组虹鳟IL-17,以其为免疫原制备了效价较高的多克隆抗体。间接免疫荧光实验一方面说明了所制备的多克隆抗体能够特异性结合真核细胞中瞬时表达的虹鳟IL-17,同时也证实了所制备的真核表达质粒可在鲑细胞中有效表达,为其进一步作为核酸佐剂的应用奠定了基础。
综上所述,本研究利用原核表达系统表达了重组虹鳟IL-17,并成功制备能够特异性识别真核细胞中瞬时表达的虹鳟IL-17,为后续IL-17在虹鳟黏膜免疫中的作用研究或作为佐剂的应用提供关键的物质材料。
[1]王炳谦.中国鲑鳟鱼养殖[M].北京:中国农业出版社, 2015.
[2]纪锋,王炳谦,孙大江,等.我国冷水性鱼类产业现状及发展趋势探讨[J].水产学杂志,2012,25(3):63-68.
[3]赵羽涵,徐黎明,刘淼,等.传染性造血器官坏死病毒新疆株的分离与鉴定[J].水产学杂志,2016,29(1):12-16.
[4]李绍戊,王荻,刘红柏,等.嗜水气单胞菌菌蜕系统的构建及其免疫效果研究[J].西北农林科技大学学报:自然科学版,2016,44(4):17-23.
[5]卢彤岩,王荻,李绍戊.氟苯尼考对鲁氏耶尔森氏菌体外药效研究[J].水产学杂志,2012,25(4):19-23.
[6]Shellito J E,Quan Z M,Ye P,et al.Effect of alcohol consumption on host release of interleukin-17 during pulmonary infection with Klebsiella pneumoniae[J].Alcohol Clin Exp Res,2001,25(6):872-881.
[7]Huang W,Na L,Fidel P L,et al.Requirement of interleukin-17A for systemic anti-Candida albicans host defense in mice[J].J Infect Dis,2004,190(3):624-631.
[8]Patera AC,Pesnicak L,Bertin J,et al.Interleukin 17 modulates the immune response to vaccinia virus infection[J]. Virology,2002,299(1):56-63.
[9]Kelly MN,Kolls J K,Happel K,et al.Interleukin-17/interleukin-17 receptor-mediated signaling is important for generation of an optimal polymorphonuclear response against Toxoplasma gondii infection[J].Infect Immun, 2005,73(1):617-621.
[10]郭风,刘禹,付志玲,等.IL-17细胞因子家族调节黏膜免疫的研究进展[J].中国畜牧兽医,2013,40(5):140-143.
[11]Monte M M,Wang T,Holland J W,et al.Cloning and characterization of rainbow trout interleukin-17A/F2(IL-17A/F2)and IL-17 receptor A:expression during infection and bioactivity of recombinant IL-17A/F2[J]. Infect Immun,2013,81(1):340-353.
[12]Salinas I.The mucosal immune system of teleost fish[J]. Biology(Basel),2015,4(3):525-539.
[13]Ye P,GarveyP B,ZhangP,et al.Interleukin-17 and lung host defense against Klebsiella pneumoniae infection[J]. AmJ Respir Cell Mol Biol,2001,25(3):335-340.
[14]Aujla S J,Chan Y R,ZhengM,et al.IL-22 mediates mucosal host defense against Gram-negative bacterial pneumonia[J].Nat Med,2008,14(3):275-281.
[15]刘爽,唐玉林,逄越,等.日本七鳃鳗IL-17基因原核表达、蛋白纯化及多抗制备与鉴定[J].免疫学杂志,2014,30(7):636-640.
[16]王荻,李绍戊,师东方,等.渔用疫苗递送途径研究进展[J].水产学杂志,2016,29(2):55-60.
[17]楼曜宪,邹强,靳津,等.IL-17作为分子佐剂增强蛋白疫苗细胞免疫应答的研究[J].中国生物工程杂志,2011, 31(7):20-26.
[18]Datta S K,Sabet M,Nguyen K P,et al.Mucosal adjuvant activity of cholera toxin requires Th17 cells and protects against inhalation anthrax[J].Proc Natl Acad Sci U S A, 2010,107(23):10638-10643.
[19]Palmer I and Wingfield P T.Preparation and extraction of insoluble(inclusion body)proteins from Escherichia coli[M].In:Coligan JE,Dunn BM,Ploegh HL,Speicher DW, Wingfield PT(eds)Current protocols in protein science. Wiley,NewYork,1995:1-15.
Preparation and Identification of Polyclonal Antibody of IL-17 in Rainbow Trout(Oncorhynchus mykiss)
CAO Yong-sheng,XU Li-ming,ZHAO Jing-zhuang,LIU Miao,LU Tong-yan
(Heilongjiang Fisheries Research Institute,Chinese Academy of Fishery Sciences,Harbin 150070,China)
RT-PCR was carried out to amplify IL-17 gene encoding the mature peptide using the primers designed based on the NCBI reference sequence to prepare the polyclonal antibody of IL-17 in rainbow trout(Oncorhynchus mykiss).The head kidney leucocyte cultures in rainbow trout stimulated by PHA were used as a template.The results showed that IL-17 was successfully amplified and the sequence was the same with the reference sequence.Then,the gene fragment was inserted into the pET32a vector and expressed in Escherichia coli Rosetta.SDS-PAGE revealed that the recombinant protein with molecular weight of about 32 kDa was expressed in the inclusion bodies,and was purified using the Ni-NTA system with purity of over 90%.The purified proteins were inoculated into mice to prepare the polyclonal antibody which had titer of 1:25 600 by ELISA.Finally the indirect immunofluorescence proved that the polyclonal antibody specifically recognized the IL-17 which was transiently expressed in the CHSE-214 cells.In conclusion,the polyclonal antibody of IL-17 is successfully prepared and will contribute to the further study on the roles of IL-17 in the mucosal immunity and application in an adjuvant for rainbow trout(Oncorhynchus mykiss).
rainbow trout(Oncorhynchus mykiss);IL-17;polyclonal antibody
S942.5
A
1005-3832(2016)06-0001-05
2016-05-11
国家科技支撑计划(2012BAD25B02);黑龙江省应用技术研究项与开发计划(GA13B401);中央级公益性科研院所基本科研业务费专项(HSY201411);新疆维吾尔自治区区域协调创新专项(2016E02052).
曹永生(1987-),男,助理研究员,从事水产免疫学与病害控制研究.E-mail:caoyongsheng@hrfri.ac.cn
卢彤岩.E-mail:lutongyan@hotmail.com
