鸡源大肠埃希菌的耐药性与分子分型研究
2016-02-07钱晓璐商军董栋张浩然田恺
钱晓璐,商军*,董栋,张浩然,田恺
(1.上海市兽药饲料检测所,上海 201103;2.复旦大学附属华山医院,上海 200040)
鸡源大肠埃希菌的耐药性与分子分型研究
钱晓璐1,商军1*,董栋2,张浩然1,田恺1
(1.上海市兽药饲料检测所,上海 201103;2.复旦大学附属华山医院,上海 200040)
为了解规模化养殖厂鸡源大肠埃希菌的耐药性以及分子流行规律和特征,为该菌的分子溯源及风险评估提供依据,本研究收集2013-2014 年上海地区养殖场分离的鸡源大肠埃希菌共计741株,采用微量稀释肉汤法分别对常用的9 类13 种抗菌药物进行药物敏感性测定,以了解大肠埃希菌的耐药表型。在筛选出多重耐药严重的菌株后,同时采用脉冲场凝胶电泳(PFGE)分型方法及核糖体(RP)分型方法进行分子分型分析。结果显示,2013-2014年所分离的鸡源大肠埃希菌对氨苄西林、阿莫西林/克拉维酸、大观霉素、四环素、多西环素、氟苯尼考、磺胺异噁唑、复方新诺明、氧氟沙星和恩诺沙星的耐药率较高,在50 %以上,且主要为多重耐药菌株。用XbaⅠ酶切后进行PFGE分析,结果表明,29株鸡源大肠埃希菌可分为22个带型;EcoRⅠ酶切后的RP聚类分析结果表明,鸡源大肠埃希菌分为14个带型。鸡源大肠埃希菌耐药率较高,同一分型菌株的耐药谱型并非完全一致,菌株基因型呈多态性。
大肠埃希菌;耐药性;PFGE;RP分型;分子分型
大肠埃希菌(Escherichiacoli,E.coli)是人和动物体内的肠道常驻菌、条件性致病菌,分布十分广泛。大肠埃希菌病是畜禽常见的一种细菌性疾病,多与病毒性疾病及其他细菌性疾病并发,给畜牧养殖业造成严重的经济损失。使用抗菌药物一直是控制大肠埃希菌病的主要措施。而近年来,随着养殖业预防用药的增多,多重耐药大肠埃希菌菌株(对三类或三类以上的抗菌药物耐药)的出现已对养殖业的发展构成威胁[1-3]。由于大肠埃希菌是表示抗菌药物耐药性水平的一种革兰氏阴性指示菌[4-6],可通过食物链或者其他方式将其携带的耐药基因传播扩散,因此监测动物源大肠埃希菌的耐药性、探究其基因分型情况不仅有利于畜牧业的发展,还具有十分重要的公共卫生意义。为此,本研究收集2013-2014年上海地区养殖场分离的鸡源大肠埃希菌进行研究,分别对常用的9 类13 种抗菌药物进行药物敏感性测定,以了解大肠埃希菌的耐药表型,并筛选出典型的重要耐药表型及多重耐药严重的多重耐菌株,同时采用脉冲场凝胶电泳(PFGE)分型方法[7-8]及核糖体(RP)分型方法[9]对这些多重耐药菌株进行基因分型分析,以探究鸡源大肠埃希菌分离株的耐药性及分子分型的现状。
1 材料与方法
1.1 菌株来源 2013年从上海地区养殖场成鸡肛门拭子采样分离到的233株大肠埃希菌;2014年从上海地区养殖场成鸡肛门拭子采样分离到的508株大肠埃希菌;药敏质控菌株,大肠埃希菌ATCC25922,脉冲场凝胶电泳参考菌株,沙门氏菌H9812,美国标准菌种保藏中心。
1.2 仪器与试剂 Sensititre AIM全自动菌液接种仪,美国赛默飞公司;COMPACT VITEK2微生物鉴定仪,麦氏比浊仪,法国梅里埃公司;CHEF Mapper脉冲场凝胶电泳仪,Gel Doc成像仪,美国Bio-Rad公司;微生物基因指纹鉴定系统,Heat Treatment Station,美国DuPont公司。BPH-92电热恒温培养箱,上海一恒科技有限公司;SterilgardⅢ-SG403型生物安全柜,美国Baker公司;冻干型药敏检测板,肉汤培养基,天津市金章科技发展有限公司;SeaKem Gold Agarose,十二烷基硫酸钠(SDS),美国Bio-Rad公司;10 ×TBE,美国Bio-Rad公司;三羟甲基氨基甲烷盐酸(Tris-HCl),乙二胺四乙酸(EDTA),生工生物工程有限公司;蛋白酶K,XbaⅠ酶,美国Bio-Rad公司;EcoRⅠ酶,美国DuPont公司。
1.3 方法
1.3.1 采样 从上海地区养殖场采集成鸡的棉拭子样本,置于运送培养基中,保存时间不超过24 h。每个养殖场随机采样,至少采30~50份样品。
1.3.2 细菌分离与鉴定 将棉拭子样本直接接种于麦康凯显色培养基上,36±1 ℃培养18~24 h,挑取典型单菌落,在麦康凯显色培养基上纯化一代。挑取单菌落接种于普通营养琼脂平板,36±1 ℃培养18~24 h。菌落经VITEK2微生物鉴定仪鉴定,于20 %甘油保存于-70 ℃。
1.3.3 药敏试验 根据美国临床检验标准委员会(CLSI)[10-12]推荐的微量肉汤稀释法进行药敏试验与结果判读。从过夜不超过24 h培养的平板上挑取适量菌落,均匀悬浮于1.5 mL细菌稀释管中,将菌悬液调整为0.5麦氏浓度,使细菌含量为1×108CFU/mL,然后稀释为1×105~2×105CFU/mL左右,接种于含有不同浓度药物的96孔冻干型细菌药敏检测板中,36±1 ℃培养16~18 h,按同法做ATCC25922的质量控制,观察并记录结果,以无菌生长的最低抗菌药物溶液的浓度为最低抑菌浓度(MIC)。对所测得的MIC结果经统计学处理,测定结果按上述标准规定的临界值判定为敏感(S)、中介(I)和耐药(R)。药敏试验结果的临界值判定值和质控范围见表1。
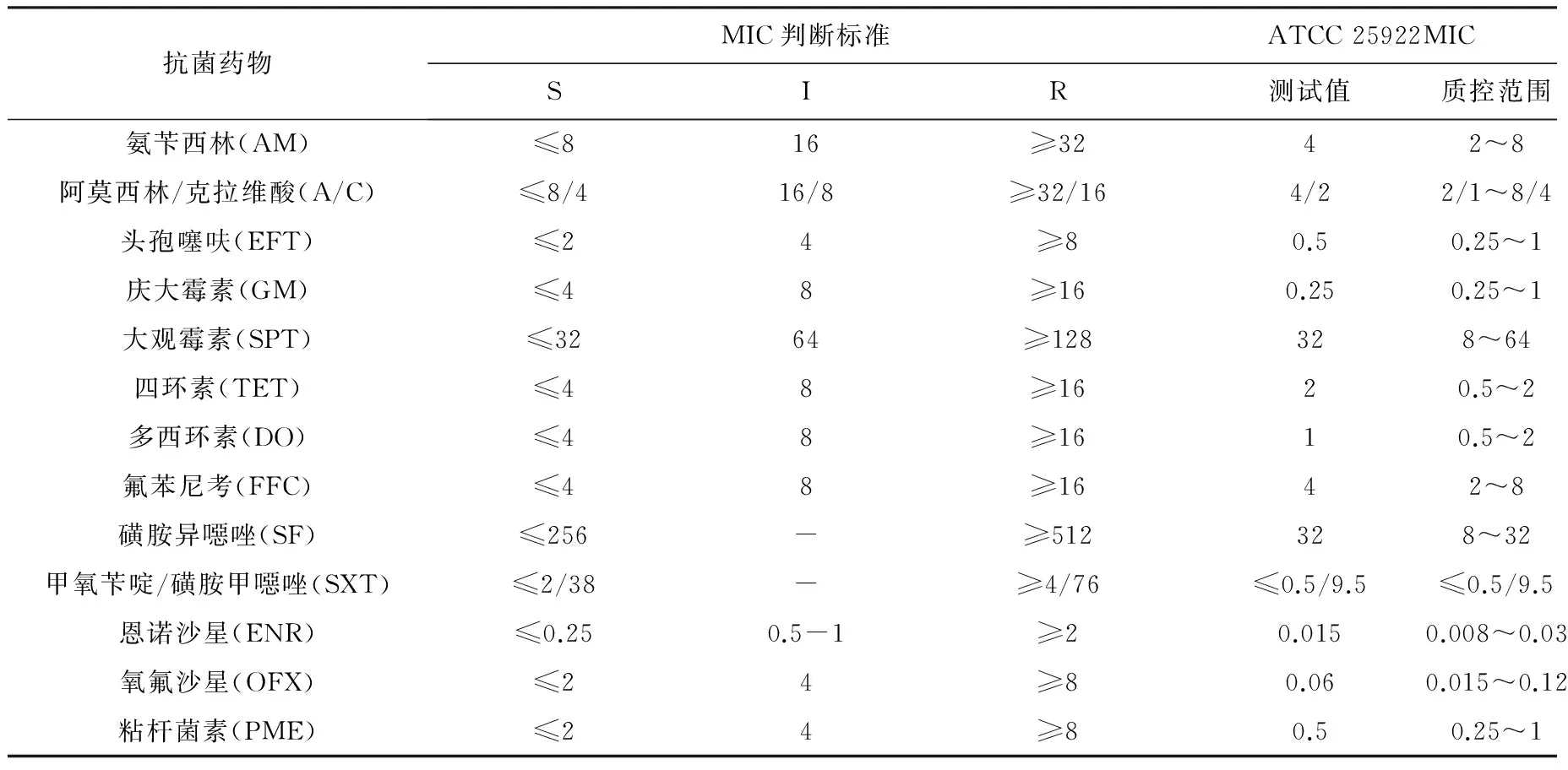
表1 肠道杆菌对13种抗菌药物药敏试验的MIC判定标准和质控范围 mg/L
1.3.3 PFGE试验 筛选耐药菌株进行复壮,调节菌液浊度至4.0~4.5,吸取400 μL到1.5 mL的离心管,加20 μL蛋白酶 K,与50 ℃预热的SeaKem Gold Agarose 400 μL混合后注模。将胶块放入5 mL含25 μL蛋白酶 K的细胞裂解液中,54 ℃水浴摇床裂解2 h。10~15 mL 50 ℃的水清洗4次,10~15 mL 50 ℃的TE清洗2次,每次10~15 min。洗好的胶块浸于TE,4 ℃保存。切取胶块2 mm,浸入含XbaⅠ酶 3 μL的200 μL酶切体系中,37 ℃水浴至少2 h。酶切后的胶块置于梳齿,Marker位于1、5、10、15泳道,其余泳道放试验菌株。倒入冷至50 ℃ 1%的琼脂糖,冷却15 min,放入电泳仪电泳。电泳条件:电压6 V,脉冲参数:6.76~35.38 s,电泳温度14 ℃,电泳时间18 h。电泳结束后取出胶块,1∶10000的溴化乙啶溶液染色20~30 min,纯水脱色30 min。用Gel Doc成像。
1.3.4 Riboprinter全自动指纹鉴定系统 采用Riboprinter微生物基因指纹鉴定系统,通过EcoRⅠ内切酶酶切,根据仪器生产商提供的说明书操作,得到微生物DNA 杂交指纹图谱,进行16SrRNA条带分析。
1.3.5 统计学分析使用 将试验获取的电泳图谱用BioNumerics软件(Version 6.0版本)进行聚类分析,识别图形条带。聚类图和矩阵图使用非加权配对算数平均法(UPGMA)构建,在限制性内切酶的作用下,不同菌株会呈现不同的条带数和片段大小,聚类相似性系数(距离)采用的是基于条带比较的Dice。
2 结果
2.1 药敏试验 药敏试验结果表明,2013-2014年所分离的鸡源大肠埃希菌对氨苄西林、阿莫西林/克拉维酸、大观霉素、四环素、多西环素、氟苯尼考、磺胺异噁唑、复方新诺明、氧氟沙星和恩诺沙星的耐药率较高,在50%以上。2014年较2013年,鸡源大肠埃希菌除对头孢噻呋的耐药率有所提高以外,对其他12种药物的耐药率均有所下降。鸡源大肠埃希菌多重耐药现象严重,80 %以上的为多重耐药菌株(即对三类或三类以上的抗菌药物耐药),表现出较为严重的耐药性。具体结果见表2和表3。
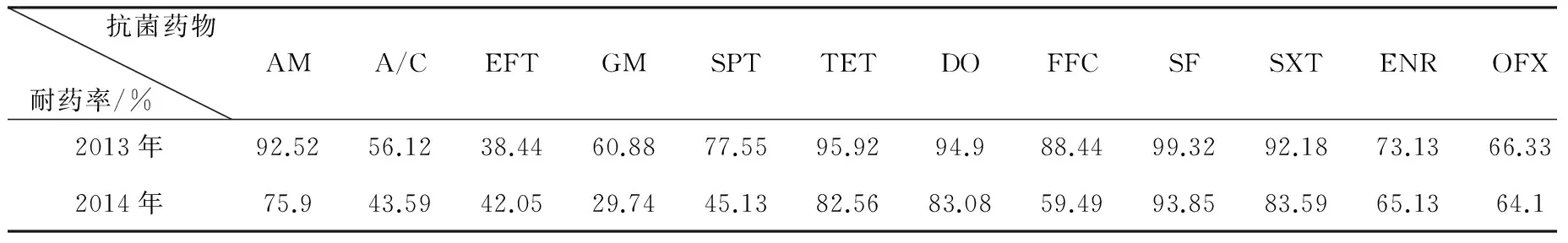
表2 大肠埃希菌对9类13种抗菌药物的药敏试验结果

表3 大肠埃希菌对9类13种抗菌药物多的多重耐药率
2.2 PFGE分型 筛选出典型的重要耐药表型及多重耐严重的28株菌株(耐药谱型见表4),按“1.3.3”项下方法进行细菌PFGE分子分型后,采用Quantity One软件获得PFGE电泳图谱,用BioNumerics软件对PFGE带型进行分析,聚类分析结果见图1(耐药谱见表4)。结果表明28株大肠埃希菌经XbaI 酶切,PFGE 分型后,每个菌株产生11~18 条电泳条带,大约在50~400 kb之间,以85%相似度为标准,可分为22 个不同的带型,菌株之间的相似系数为22.5 %~94.6 %之间,带型比较分散,未发现绝对优势带型,说明菌株在基因水平上具有多态性。
2.3 RP分型 筛选出典型的重要耐药表型及多重耐严重的菌株27株(表2),按“1.3.3”项下方法进行细菌RP分子分型后,用BioNumerics软件对RP带型进行分析,聚类结果见图1(耐药谱见表4)。结果表明,用EcoRⅠ酶切之后,鸡源大肠埃希菌RP带型的相似度在54.3 % ~ 100 %之间。以90 %相似度为标准,鸡源大肠埃希菌分为14个RP带型。结果与PFGE分型的结果基本一致,RP带型比较分散,未发现绝对优势带型,说明菌株在基因水平上具有多态性。
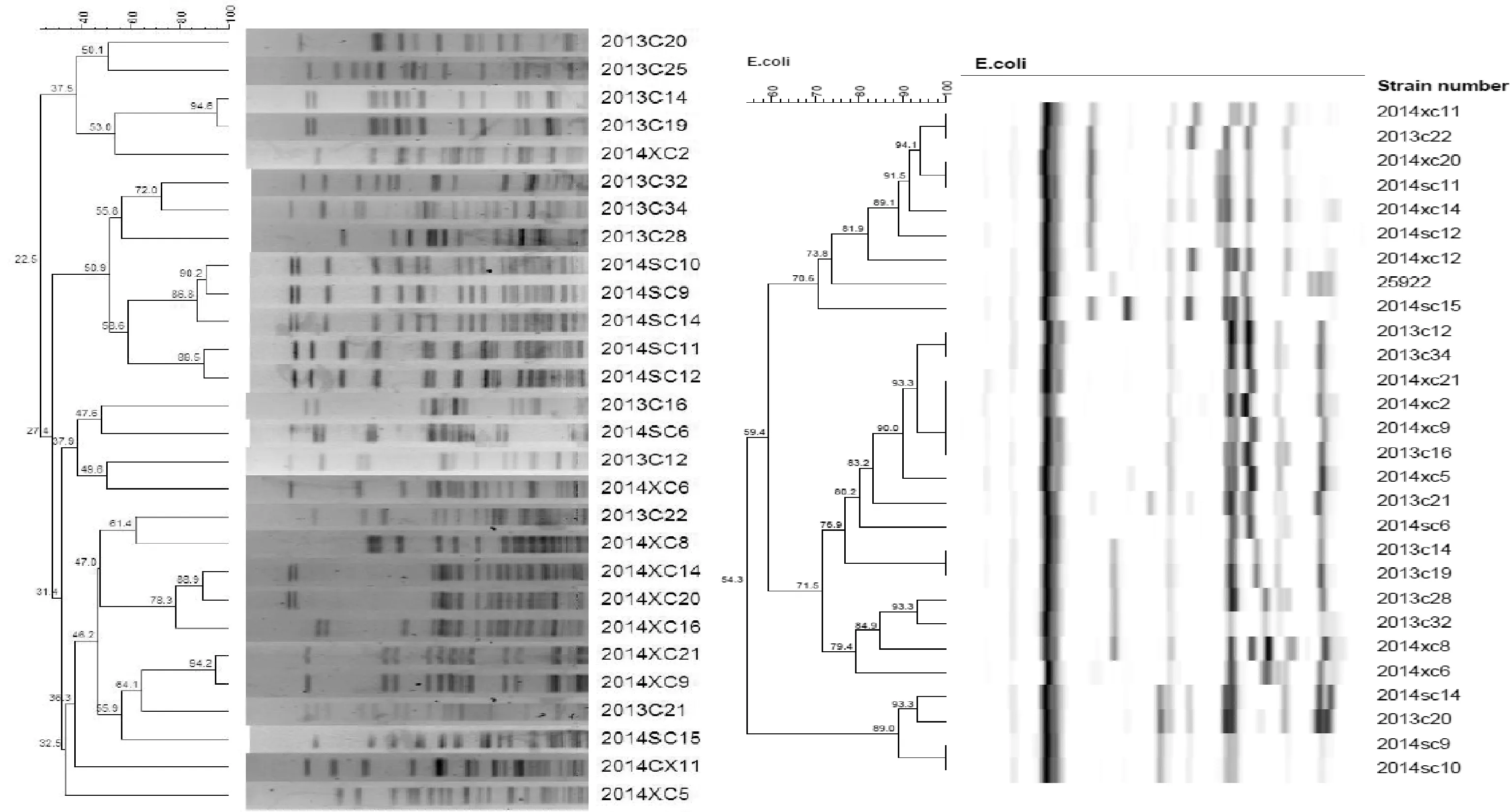
图1 鸡源大肠埃希菌PFGE与RP聚类分析图
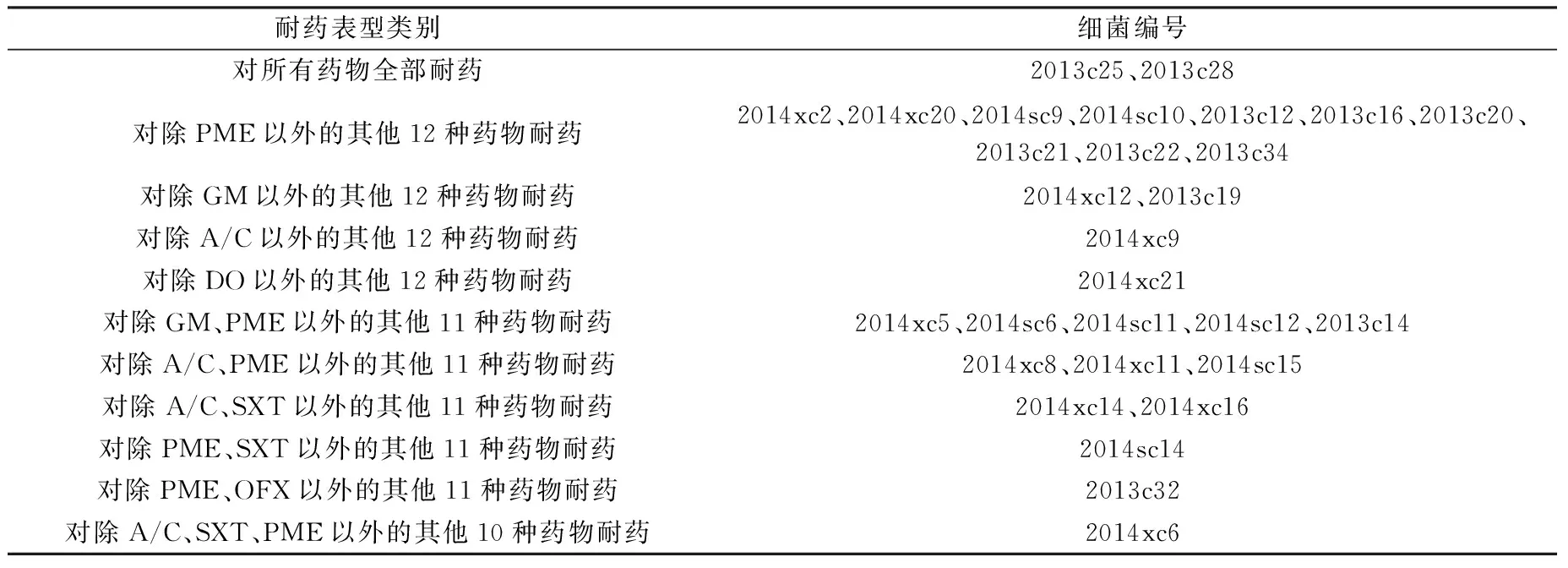
耐药表型类别细菌编号对所有药物全部耐药2013c25、2013c28对除PME以外的其他12种药物耐药2014xc2、2014xc20、2014sc9、2014sc10、2013c12、2013c16、2013c20、2013c21、2013c22、2013c34对除GM以外的其他12种药物耐药2014xc12、2013c19对除A/C以外的其他12种药物耐药2014xc9对除DO以外的其他12种药物耐药2014xc21对除GM、PME以外的其他11种药物耐药2014xc5、2014sc6、2014sc11、2014sc12、2013c14对除A/C、PME以外的其他11种药物耐药2014xc8、2014xc11、2014sc15对除A/C、SXT以外的其他11种药物耐药2014xc14、2014xc16对除PME、SXT以外的其他11种药物耐药2014sc14对除PME、OFX以外的其他11种药物耐药2013c32对除A/C、SXT、PME以外的其他10种药物耐药2014xc6
3 讨论与小结
3.1 分型方法比较 核糖体分型(RP)是针对核糖体DNA操纵子基因的保守序列设计探针,探针与膜上的DNA片段进行杂交,产生了特异性的DNA指纹图;而PFGE则是利用限制性内切酶,将菌株的基因组DNA切割成电泳方法可以区分的不同片段,反映了菌株全基因组遗传学特征。对于大肠埃希菌来说,RP分型利用EcoRⅠ酶切对菌株进行准确的鉴定与溯源。两者比较可见,PFGE可根据带型直观地反映菌株的基因突变位点等,对于分析菌株亲缘关系具有其优势。在本试验中,两种分型方法结果均表明,29株耐药大肠埃希菌的分子分型带型比较分散,未发现绝对优势带型,菌株在基因水平上具有多态性,与盖文燕等[13]报道一致。从分型能力上看,PFGE分为22个不同的带型,RP分为14个不同的带型,PFGE分型能力要强于RP,与国内外报道一致[14-16]。
3.2 分型结果与药敏试验结果联合分析 本研究将分离所得的741 株大肠埃希菌对9类13种抗菌药物进行了药敏试验,结果显示,鸡源大肠埃希菌对13种抗菌药物耐药率较高,多重耐药现象严重,80 %以上的为多重耐药菌株(即对三类或三类以上的抗菌药物耐药),表现出较为严重的耐药性,与王娟等报道结果一致[17]。将分型结果与药敏试验结果进行联合分析,菌株2013c14和2013c19的PFGE分型相似度为94.6 %,RP分型相似度为100%,两种分型方法的结果均为同一型,但耐药谱型不同,即分型相同的菌株其耐药谱型不一定相同。分析菌株2013c16和2014sc6,两种分型方法的结果均为不同型,但耐药谱型相同,即分型不同的菌株其耐药谱型可能相同,与余婷等[18-19]的报道的结果一致,由此可以看出同一克隆型的菌株在增殖播散的过程中存在耐药质粒的获取或丢失,导致耐药性的改变,使分型相同的菌株具有不同的耐药谱。将分型结果与药敏试验结果进行联合分析,通过建立的基因指纹图谱库,可以发现耐药株在基因指纹图谱上存在的差异,研究它们在致病因子和耐药性等方面的异同。
研究结果表明,鸡源大肠埃希菌对9类13种抗菌药物耐药率较高,多重耐药现象严重,表现出较为严重的耐药性,同一分型菌株的耐药谱型并非完全一致,将分型结果与药敏试验结果进行联合分析,通过建立的基因指纹图谱库,不但可以发现耐药株在基因指纹图谱上存在的差异,还可以利用图谱库内贮存的数据信息对基因型与耐药性的变化实行动态分析与研究,可为科学制定抗菌感染的防治方案及细菌耐药性的监测提供必要的理论依据。
[1] Guerra B, Junker E, Schroeter A,etal. Phenotypic and genotypic characterization of antimicrobial resistance in GermanEscherichiacoliisolates fromcattle, swine and poultry[J].J Antimicrob Chemother,2003,52(3) : 489-492.
[2] 曲志娜,胡学远,王娟,等.不同省区鸡源大肠杆菌耐药性调查与系统进化群分析[J].中国兽药杂志,2014,48(9): 4-8.
[3] 马苏,高艳春.动物源细菌耐药性对动物细菌传染性疾病防治的影响[J].中国兽药杂志,2012,46(2): 50-52,56.
[4] Carattoli A, García-Fernández A, Varesi P,etal. Molecular epidemiology ofEscherichiacoliproducing extended-spectrum beta-lactamases isolated in Rome, Italy. [J]. J Clin Microbiol, 2008, 46(1):103-108.
[5] 胡功政,匡秀华,苑丽,等.产ESBLs 鸡肠杆菌科细菌对21种抗菌药的敏感性检测[J].中国人兽共患病学报,2006,22(9): 884-887.
[6] 刘雅妮,商军,郭士博,等.猪源分离大肠埃希菌产ESBLs的基因型及耐药性分析 [J].中国兽药杂志,2011,45(9): 19-22.
[7] Nuorti J P, Whitney C G.Prevention of pneumococcal disease among infants and children-use of 13- valent pneumococcal conjugate vaccine and 23-valent pneumococcal polysaccharide vaccine- ecommendations of the Advisory Committee on Immunization Practices (ACIP) [J]. MMWR Recomm Rep, 2010, 10: 1-18.
[8] Gerner-Smidt P, Kincaid J, Kubota K,etal.Molecular surveillance of shiga toxigenicEscherichiacoliO157 by PulseNet USA[J].J Food Prot,2005,68(9): 1926-1931.
[9] Bhanumathi R, Sabeena F, Isac SR,etal.Characterization of a ToxigenicVibriocholeraeO139 Strain belonging to a new ribotype and isolated from a diarrheal patient[J].J Clin Microbiol, 2002,40(12):4779-4781.
[10]Clinical and Laboratory Standards Institute(CLSI).Performance standards for antimicrobial susceptibility testing:Twentieth informational supplement[S].
[11]Clinical and Laboratory Standards Institute(CLSI).Development ofinvitroSusceptibility Testing Criteria and Quality Control Parameters for Veterinary Antimicrobial Agents[S].
[12]Clinical and Laboratory Standards Institute(CLSI).Methods for Dilution Antimicrobial Susceptibility Tests for BacteriaThat Grow Aerobically[S].
[13]盖文燕,王娟,曲志娜,等.山东地区大肠杆菌的耐药性及分子分型研究[J].中国食品卫生杂志,2015,27(2):109-114.
[14]Tenover F C, Arbeit R D, Goering R V,etal.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophotesis: criteria for bacterial strain typing[J].JClinMicrobiol,1995,33(9):2233-2239.
[14]周海健,张力,韩辉,等.脉冲场凝胶电泳和自动化核糖体分型方法用于霍乱弧菌分子分型能力的比较[J].疾病监测,2011,26(4): 325-327,333.
[15]屠丽红,陈洪友,陈敏.利用脉冲场凝胶电泳及核糖体分型技术对14株上海崇明地区O139群霍乱弧菌分型分析[J].疾病监测,2011,26(2):159-160.
[16]Zhou H J,Diao B W,Cui Z G,et al. Comparison of automated ribotyping and pulsed-field gel electrophoresis for subtyping ofVibriocholera[J].Lett Appl Microbiol,2009,48(6) : 726-731.
[17]王娟,黄秀梅,翟海华,等.鸡大肠杆菌毒力因子流行病学调查及耐药性分析[J].中国兽医杂志,2013,49(10) : 38-41.
[18]余婷,安慧慧,吴聪明,等.奶牛乳房炎分离大肠杆菌的耐药性及脉冲场凝胶电泳分型研究[J].中国兽医杂志,2013,49 (10): 38-40.
[19]Daniela Benevides Melo, Ana Paula de Oliveira Menezes, Joice Neves Reis, et al.Antimicrobial resistance and genetic diversity ofEscherichiacoliisolated from humans and foods[J].Brazilian Journal of Microbiology,2015 ,46(4):1165-1170.
(编辑:陈希)
Study on Antimicrobial Resistance and Molecular Subtyping of Escherichia coli Isolated from Chickens
QIAN Xiao-lu1,SHANG Jun1*,DONG Dong2,ZHANG Hao-ran1,TIAN Kai1
(1.ShanghaiInstituteforVeterinaryDrug&Feedscontrol,Shanghai201103,China; 2.HuashanHospitalAffiliatedtoFudanUniversity,Shanghai200040,China)
This study was conducted to investigate the antimicrobial resistance and obtain the subtyping ofEscherichiacoliisolated from chickens in Shanghai. 741 strains ofEscherichiacoliwere collected from different areas in Shanghai in two years (2013-2014). Susceptibility test to 13 antimicrobial agents was performed by broth microdilution. Pulsed-field gel electrophresis(PFGE)and Ribo-printer(RP) were used to subtype the multidrug resistant strains. According to the antimicrobial susceptibility test ofEscherichiacoli, the resistance rates to ampicillin, amoxicillin/clavulanic acid, spectinomycin, tetracycline, doxycycline, florfenicol, sulfonamide isoxazole, trimenthoprim-sulfamethoxazole, ofloxacinand enrofloxacin were generally high. And more than 80% multidrug resistant strains were detected. Results of PFGE showed that these strains ofEscherichiacoliwere divided into 22 types after digested byXbaⅠ. While results of RP divided these strains into 14 types after digested byEcoRⅠ. Compared with RP, PFGE had higher definition on molecular subtyping. This study showed that the genetype ofE.coliwas polymorphic. And phenotypes of isolates with the same subtyping were not exactly identical.
Escherichiacoli; antimicrobial resistance ; PFGE ;Ribotyping ; molecular subtyping
钱晓璐,助理畜牧师,从事动物源细菌耐药性的研究。
商军。E-mail:sjshvdc@163.com
2016-01-28
A
1002-1280 (2016) 04-0015-06
S852.61
