鹅细小病毒灭活疫苗种子批建立
2016-02-07黄宇翔刘力威王志强张军邹越杨旭东李洪彬
黄宇翔,刘力威,王志强,张军,邹越,杨旭东,李洪彬
(黑龙江省兽医科学研究所, 黑龙江齐齐哈尔 161006 )
鹅细小病毒灭活疫苗种子批建立
黄宇翔,刘力威,王志强,张军,邹越,杨旭东,李洪彬
(黑龙江省兽医科学研究所, 黑龙江齐齐哈尔 161006 )
为保证制苗所用毒种质量和稳定性,在对制苗毒种病毒含量、病毒纯净性、特异性、免疫原性及扩繁代次等研究的基础上,建立了鹅细小病毒灭活疫苗毒种种子批。试验使用鹅胚对鹅细小病毒YA98株进行了20次传代。传代毒种的鉴定结果表明:抽检的各代次的毒种均无细菌、支原体、外源病毒污染,且病毒含量检测稳定,每0.3 mL 含104.78~4.85ELD50;各代次特异性检测均能被鹅细小病毒抗血清中和;将各代次病毒液制成灭活疫苗,免疫成鹅后均能产生完全保护。以此为依据,最终确定原始毒种和基础毒种的扩繁代次宜控制在5代以内,生产毒种的最高扩繁代次宜控制在15代以内。种子批的建立,为鹅细小病毒灭活疫苗的生产奠定了基础。
种子批建立;YA98株;培养特性;特异性
鹅细小病毒(Goose parvovirus, GPV)病又称小鹅瘟(Gosling plague),是由鹅细小病毒引起的急性或亚急性的败血性传染病[1],对雏鹅具有高度的致死性,给养鹅业造成巨大的经济损失。目前,疫苗接种仍是控制小鹅瘟的主要措施之一[2]。现有疫苗为活疫苗,在小鹅瘟的防疫中起到了良好的效果,由于,在小鹅瘟病发生流行的地区,种、雏鹅都存在水平不一的相应抗体,对现有活疫苗的接种免疫起到了中和、干扰,使活疫苗不能正常发挥免疫作用。因此,研制出不受残余抗体干扰的油乳剂灭活疫苗,对小鹅瘟病防治将起到更好的效果。
强毒株因有较好的免疫原性,被广泛用于灭活疫苗的制备[3]。近年,国内分离的鹅细小病毒有十余株,但用于鹅细小病毒灭活疫苗的研究不是很多,目前还没有研制出鹅细小病毒灭活疫苗正规产品。研究表明,小鹅瘟病毒只有一个血清型,不同毒株具有相同的抗原性,能起到免疫交叉保护作用,由于各毒株的培养特性存在一定的差异,将导致免疫原性存在着一定的差异,以至临床免疫动物后产生的抗体效价参差不齐。因此,具有较强的毒力和免疫原性的优质毒株,是制备疫苗的关键。本实验室分离鉴定的鹅细小病毒YA98株,经动物回归试验(前期试验)表明,毒力较强,经鹅胚传代,得到了鹅胚适应毒[4-5]。与国内近年分离的8株鹅细小病毒VP3基因核苷酸和推导氨基酸同源性比较[6],核苷酸同源性为93.0%~97.9%,推导的氨基酸同源性为96.8%~99.7%,毒株的亲缘性很近。应用该毒株病毒制备灭活疫苗,通过本动物免疫攻毒试验表明,对后代雏鹅完全包保护,可作为鹅细小病毒灭活疫苗的制苗用种毒。本试验在对GPV YA98株传代培养以及对各代次的生物学特性和免疫原性的研究基础上,建立了种子批,以期为小鹅瘟灭活疫苗生产奠定基础。
1 材料和方法
1.1 毒种 小鹅瘟病毒YA98株,鹅细小病毒强毒(HH98株),由黑龙江省兽医科学研究所鉴定保存。
1.2 鹅胚 12日龄易感鹅胚,在孵化前用琼脂扩散试验检测同批鹅蛋的卵黄抗体,小鹅瘟抗体呈阴性。
1.3 鹅只 120日龄健康鹅,试验前用琼脂扩散试验检测血清,小鹅瘟抗体呈阴性。
1.4 小鹅瘟阳性血清 东北农业大学王君伟教授惠赠。
1.5 种子批的建立 试验以前期经过系统鉴定确认具有良好免疫原性、繁殖特性、特异性和纯净性的YA98毒株为原始种子,将原始种子用灭菌生理盐水作10倍稀释,尿囊腔接种12日龄易感鹅胚连续传代,每胚0.3 mL,收取各代次48~120 h死亡鹅胚液,进行病毒培养特性、病毒含量、特异性、免疫原性、病毒纯净性及保存期试验。将检验合格的鹅胚液与冻干保护剂1∶1混合均匀,进行定量分装,各代次命名为YA98F1~20。抽取原始毒种、YA98F3、YA98F5、YA98F7、YA98F10、YA98F12、YA98F15、YA98F20冻干后产物用于后续检验,依据检验结果建立种子批。
1.6 培养特性 将毒种用灭菌生理盐水作10倍稀释,经尿囊腔内接种12日龄易感鹅胚10枚,每胚0.3 mL,置37~38 ℃继续孵育,观察并记录鹅胚接种后24~168 h死亡与剖检情况。
1.7 病毒含量 随机抽取10%冻干产品,用灭菌生理盐水作10倍系列稀释,取10-2、10-3、10-4、10-54个稀释度,每个稀释度,经尿囊腔接种12日龄鹅胚,5枚,每胚0.3 mL,置37 ℃孵育观察168 h,24 h前死亡鹅胚不计,记录24~168 h鹅胚死亡情况,计算ELD50。1.8 特异性 将毒种稀释至病毒含量为200 ELD50/0.3 mL,与等量抗小鹅瘟病毒特异性血清混合,置37 ℃水浴中和1 h后,尿囊腔接种12日龄易感鹅胚5枚,每胚0.3 mL;同时设病毒对照组5枚,每胚接种同条件处理的病毒液和生理盐水混合液0.3 mL,37 ℃孵育观察168 h,记录24~168 h鹅胚死亡情况,并取病毒液做鸡红细胞凝集试验(HA)。
1.9 免疫原性 将甲醛灭活后的含毒尿囊液与油相按1∶1制备油乳剂灭活疫苗。肌肉接种120日龄易感鹅10只(公、母比例为1∶4),每只1 mL,于接种疫苗后的28日,连同对照鹅5只,分别采血,分离血清,测定鹅细小病毒的琼扩抗体(AGP)效价。并收集种蛋孵育后代雏鹅,于3日龄进行攻毒保护试验,试验组与对照组各皮下接种鹅细小病毒强毒(HH98株)病毒液,每组10只,每只0.2 mL。观察10日,统计保护率。
1.10 纯净性检查 无菌检验、支原体检验、外源病毒检验按现行《中国兽药典》方法[7]进行。1.11 毒种保存期试验 抽检保存时间分别为2年、3年、4年的YA98F5、YA98F10、YA98F15三个代次的毒种,经鹅胚培养复壮,测定ELD50。
2 结果
2.1 培养特性 将原始毒种、YA98F3、YA98F5、YA98F7、YA98F10、YA98F12、YA98F15、YA98F20抽检样品,在接种鹅胚后72~168 h,各批次病毒均致8枚以上鹅胚死亡,剖检死亡胎儿,头部、颈部及绒毛尿囊膜呈明显水肿,胚头、颈部、胸部、爪、翅尖及喙旁均有出血,病变特征明显。对鹅胚培养特性稳定。
2.2 病毒含量 结果见表1。各代次病毒含量的测定结果都在104.7ELD50/0.3 mL以上,表明连续传代20次时各代次毒株对冻干处理的耐受能力未发生明显改变。

表1 鹅胚半数致死量(ELD50)的测定结果
2.3 特异性检验 结果见表2。各代次病毒均能被抗小鹅瘟血清中和,接种鹅胚全部存活,且各代次病毒液做鸡红细胞凝集试验,均无血凝性,符合小鹅瘟病毒特性。

表2 病毒特异性鉴定结果
分母为试验鹅胚数,分子为存活鹅胚数
2.4 免疫原性 结果见表3。可以看出,各代次免疫抗体效价无明显差异,免疫组血清抗体效价≥1∶1,连续传代未影响免疫效果,对后代雏鹅有良好保护作用,有效保护率可达90%。

表3 免疫原性试验结果
“-”表示检验结果为阴性
2.5 纯净性检验 结果显示:检测的各代次种毒,分别接种于三种培养基中,进行细菌和霉菌检验,结果均无细菌和霉生长;在液体和固体两种培养基上进行的支原体检验也均未见支原体生长;各代次种毒外源病毒检验,分别进行了鸡胚和细胞检验,结果均未检测到外源病毒(表4),各代次种毒纯净。
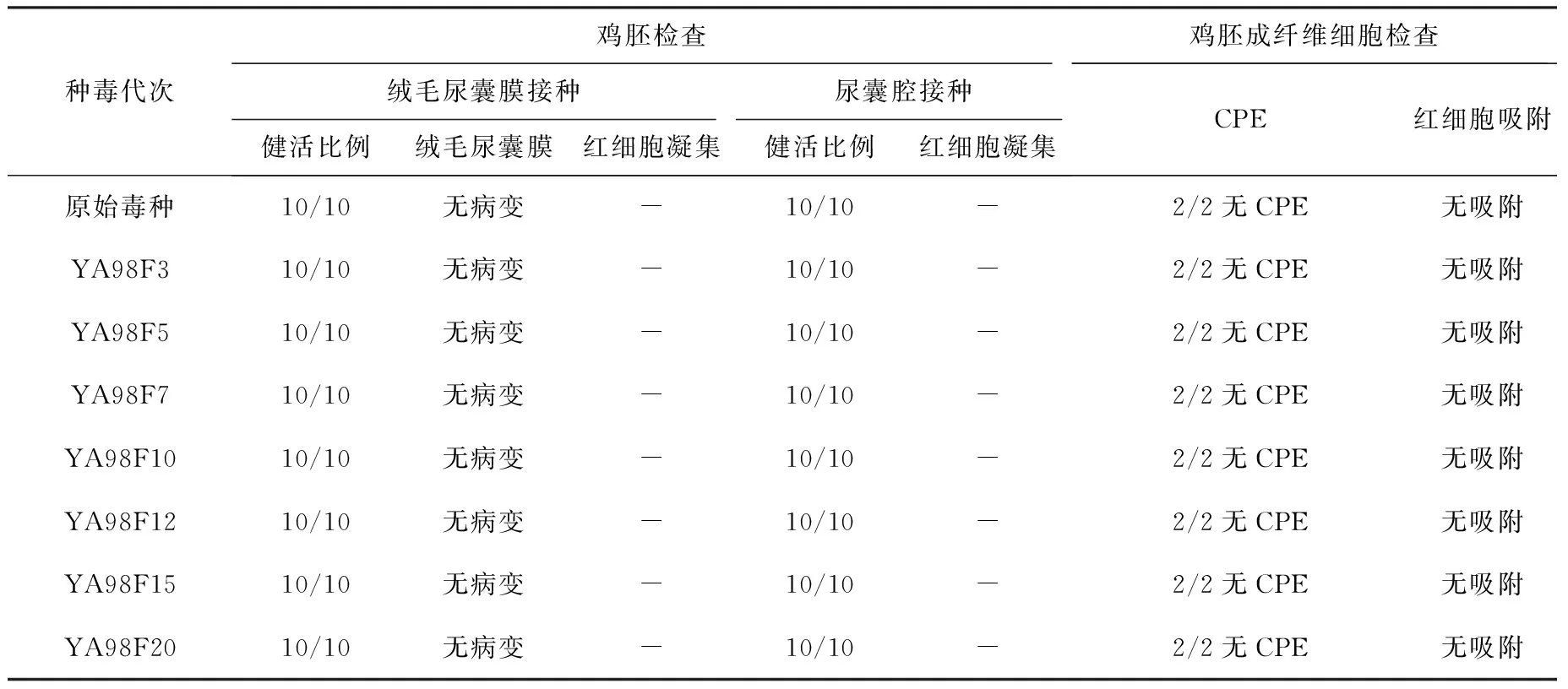
表4 外源病毒检验(鸡胚和细胞检查法)结果
“-”表示红细胞凝集阴性
2.6 基础种毒保存期测定 将-70 ℃保存2年、3年、4年的YA98F5 、YA98F10、YA98F15种毒(冻干毒)取出,接种12日龄鹅胚,测定ELD50,并与保存前的结果进行比较,结果见表5。可以看出,冻干毒种于-70 ℃经4年保存,种毒的病毒含量未见降低。
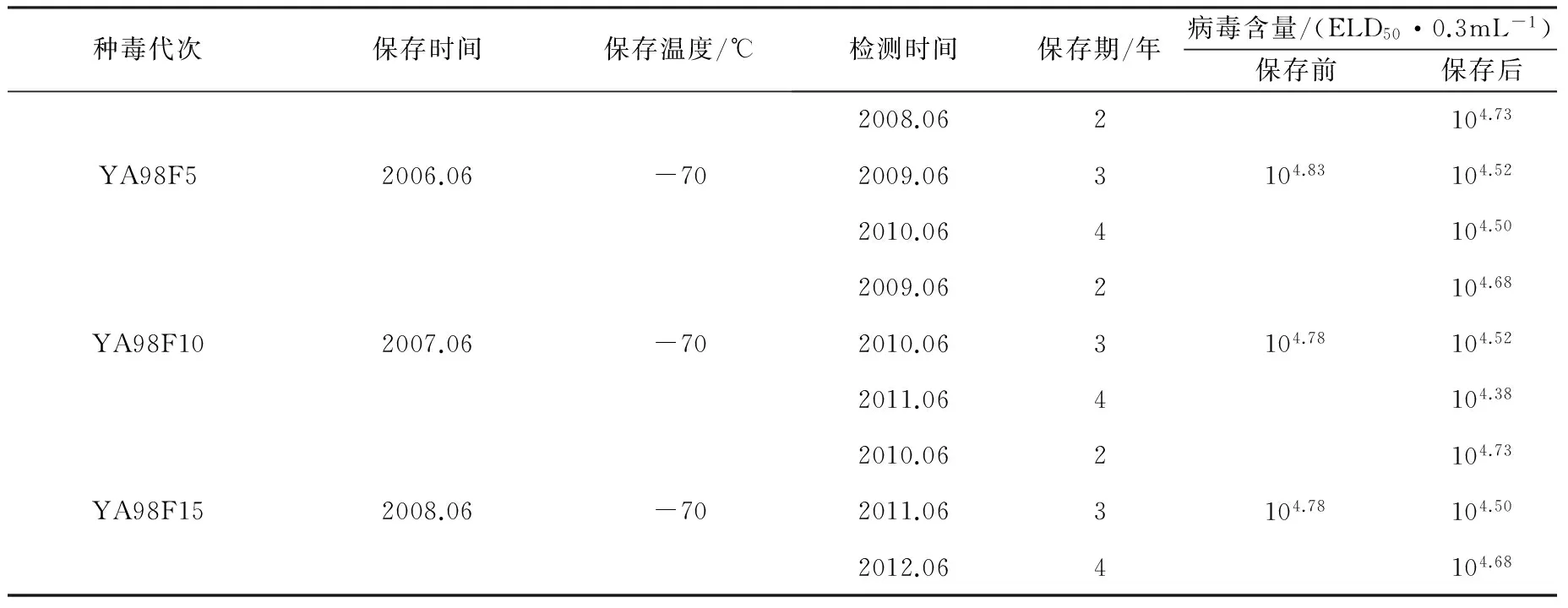
表5 基础种毒保存期测定结果
3 小结
通过对YA98株各代次冻干种毒的病毒含量测定、纯净性、特异性和免疫原性等鉴定证明,各代次病毒传代稳定;纯净性检验均无细菌、霉菌、支原体和外源病毒污染;特异性检验均能够被小鹅瘟抗血清特异性中和;各代次病毒制成灭活疫苗免疫动物后,均能够产生完全的攻毒保护,以此为依据,建立了毒种的种子批,确定原始毒种和基础毒种的扩繁代次宜控制在5代以内,适宜的保存方法和保存期为-70 ℃保存3年;生产毒种的最高扩繁代次宜控制在15代以内,适宜的保存方法和保存期为-70 ℃保存3年。
本试验种子批的建立可为小鹅瘟灭活疫苗的研制,以及将来的规模化生产提供稳定、可靠的生产用种毒。
[1] B W 卡尔尼克.禽病学[M]. 高 褔,主译. 第10版. 北京:中国农业出版社,1999.
[2] 费恩阁,李德昌,丁 壮.动物疫病学[M].北京:中国农业出版社,2004.[3] 宁宜宝.兽用疫苗学[M].第1版.北京:中国农业出版社,2008.
[4] 黄宇翔,刘力威,李洪彬,等.鹅细小病毒、鹅副黏病毒流行病学调查及病原分离鉴定[J].中国家禽,2013,(2):22-26.
[5] 黄宇翔,李洪彬,刘力威,等.鹅细小病毒的分离鉴定与生物学特性研究[J].黑龙江畜牧兽医,2008,(2):77-78.
[6] 王志强,刘力威,杨旭东,等.鹅细小病毒VP1-VP3非重叠区基因的克隆与序列分析[J].中国家禽,2011,(19):28-31.
[7] 中国兽药典委员会.中国人民共和国兽药典二0一0年版三部[S].
(编辑:李文平)
The Seed Lots Built of Goose Parvovirus Inactivated Vaccine Candidate
HUANG Yu-xiang, LIU Li-wei, WANG Zhi-qiang, ZHANG Jun, ZOU Yue, YANG Xu-dong,LI Hong-bin
(HeilongjiangInstituteofVeterinaryScience,Qiqihar,Heilongjiang161006,China)
In order to ensure vaccine-made virus seed quality and stability, we established a goose parvovirus inactivated vaccine virus seed lot, on the research basis of vaccine-made virus seed virus content, virus pure, specific, immunogenicity and expanding propagation generations. The goose parvovirus YA98 strain was propagated and passaged 20 generations on goose embryo. Passage of virus identification results showed that there were not found bacteria, mycoplasma, contamination with exogenous virus in sampling of each propagation generations virus; and virus content test was stable, containing 104.78~4.85ELD50per 0.3 mL; and it can be neutralized by goose parvovirus antiserum in specific detection; when it was made inactivated vaccine to inject geese, they could produce complete protection. On this basis, we ultimately determined that the propagation generations of the original virus and virus should be controlled within 5 ones and the highest propagation generation of production virus should be controlled within 15 ones. The establishment of the seed lot laid the foundation for the goose parvovirus inactivated vaccine production.
seed lots built; strain YA98; culture characteristics; specificity
黄宇翔,硕士,研究员,从事家畜传染病防治及相关生物制品的研究。E-mail:huangyuxiang-2007@163.com
2015-11-05
A
1002-1280 (2016) 04-0011-05
S858.33
