新型喹乙醇残留标志物人工半抗原的设计及其在动物组织残留检测中的应用
2016-02-07白玉惠王鹤佳刘智宏黄耀凌徐士新
白玉惠,王鹤佳,刘智宏,黄耀凌,徐士新
(中国兽医药品监察所,北京100081)
新型喹乙醇残留标志物人工半抗原的设计及其在动物组织残留检测中的应用
白玉惠,王鹤佳,刘智宏*,黄耀凌,徐士新
(中国兽医药品监察所,北京100081)
为提高酶联免疫方法测定喹乙醇残留标志物(MQCA)的检测性能,设计了一种新型MQCA人工半抗原,该半抗原既完整保留MQCA分子特征性基团和结构,又具有便于和蛋白质载体偶联的基团-NH2。通过三步化学反应合成该半抗原,将其与蛋白质载体偶联成为免疫抗原后,进一步制备特异性抗体,研制了MQCA酶联免疫试剂盒,灵敏度高,特异性好,IC50为1.94 μg/L。建立了测定动物性产品中MQCA残留量的直接竞争酶联免疫法,测定猪肝、猪肉、鸡肉、鸡蛋中MQCA的检测限分别为0.42、0.23、0.28、0.28 μg/kg。猪肉中不同添加浓度MQCA(1, 2, 4 μg/kg)的回收率为70%~97%;批内、批间变异系数均低于12%。本试剂盒可同时快速检测大批样品,有望在MQCA残留检测中发挥重要作用。研究有助于指导小分子药物半抗原的合理设计,为现有的半抗原设计方法提供新的理念和思路。
喹乙醇残留标志物;半抗原设计;酶联免疫分析;残留检测
喹乙醇(OLA),分子式C12H13N3O4,是喹噁啉类抗菌药物的典型代表,其主要代谢物为3-甲基喹噁啉-2-羧酸(MQCA)。由于OLA对大多数动物有明显的致畸作用,对人也有潜在的三致性,即致畸、致突变和致癌[1-2],很多国家规定禁止或限制使用OLA。作为指定的主要残留标志物,MQCA用于监控OLA在畜牧生产中的违禁使用情况。利用仪器方法检测MQCA的技术相对复杂、耗时长、成本高[3-5],而酶联免疫方法(ELISA)具有快速、灵敏、简便、有效等优点,能满足目前生产链所需要的大量样本的快速筛选和现场检测的要求。
目前已有检测MQCA方法主要是直接在MQCA分子的-COOH位置设计改造抗原[6]。这种偶联情况下,MQCA的部分特征性基团和结构(-COOH、氮杂环)很可能不能充分暴露作为B淋巴细胞的抗原表位,进而影响抗体灵敏度或特异性。因此,连接位点的选择对于抗体质量至关重要,这就要求对半抗原进行科学合理的设计与改造。
1 材料与方法
1.1 试剂与仪器 OLA,MQCA,喹噁啉-2-羧酸(QCA),乙酰甲喹,辣根过氧化物酶(HRP),人血清蛋白(HSA),吐温20,甘油,弗氏完全佐剂和弗氏不完全佐剂,1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC),N-羟基琥珀酰亚胺(NHS),西格玛化学试剂公司(北京)。卡巴氧,喹烯酮,百灵威科技有限公司。全脂奶粉,Becton-Dickingson 公司(美国)。四甲基联苯胺, 硫酸(H2SO4),北京化学试剂公司。去离子水由Milli-Q系统(Millipore, MA)纯化制备。其它试剂均为分析纯,使用前未经纯化。
ELISA测定通过sunrise酶标仪完成,核磁共振氢谱通过瑞士BRUKER DRX300MHz核磁共振仪完成,所用液质联用仪为岛津LC-MS 2020。1.2 (缓冲)溶液体系 使用的(缓冲)溶液包括:(1)包被缓冲液:0.05 mol/L的碳酸盐缓冲液(pH9.6);(2)PBS缓冲液(pH7.2):含有0.01mol/L磷酸二氢钠-磷酸氢二钠的水溶液;(3)洗涤液:含有0.05%(质量百分含量)吐温-20的PBS缓冲液;(4)显色液A:浓度为1 mg/mL的四甲基联苯胺溶液(溶剂为二甲基甲酰胺);(5)显色液B:含有0.2 mol/L磷酸氢二钠-柠檬酸的水溶液,pH5.0;(6)终止液:1 mol/L硫酸溶液。
1.3 半抗原的合成 喹乙醇残留标志物人工半抗原分子结构如图1所示,既完整保留MQCA分子特征性基团和结构,同时又具有氨基(-NH2)便于和蛋白质载体偶联,该半抗原简称为AMQCA。
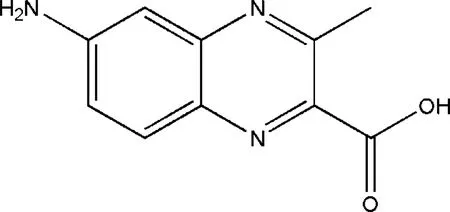
图1 半抗原分子AMQCA结构图
半抗原分子的合成路线如图2所示。
(1)将650 mg乙酰乙酸乙酯溶于20 mL蒸馏水,加入N-溴代丁二酰亚胺(NBS)1.06 g,再加入4-硝基邻苯二胺750 mg,反应过夜。用乙酸乙酯萃取,滤液减压蒸干得化合物2。(2)取500 mg化合物2溶于无水乙醇15 mL,加入氯化亚锡570 mg,室温反应4 h。加入20 mL 1mol/L NaOH 溶液,二氯甲烷萃取,滤液减压蒸干,得化合物3。(3)取230 mg化合物3溶于甲醇和水(5 mL∶2 mL)的混合溶液,加入氢氧化锂120 mg,室温反应过夜。减压蒸干得化合物4,即图1所示产物AMQCA。
分别采用LC-MS和核磁共振方法表征制备的半抗原。

图2 喹乙醇残留标志物半抗原的合成路线图
1.4 人工免疫抗原的合成 将25 mg AMQCA溶于2 mL水,加入2 mL 1 mol/L盐酸水溶液,然后依次加入20 mg亚硝酸钠和200 mg人血清白蛋白,混匀,于2~8 ℃及120 r/min条件下搅拌反应2 h,然后在PBS缓冲液中透析以除去未与蛋白结合的AMQCA。将制备的AMQCA-HSA保存于-20oC备用,结构示意图见图3。采用紫外可见吸收光谱(UV-vis)对制备的免疫抗原进行表征,以确定是否偶联成功,并计算半抗原/蛋白质的分子结合比。

图3 喹乙醇残留标志物人工抗原的结构示意图
1.5 酶结合物的制备 将5 mg AMQCA溶于1 mL水,然后逐滴加入0.5 mL EDC水溶液(含5 mg EDC)和0.5 mL NHS水溶液(含3 mg NHS)并混匀,于4℃搅拌5 min,加入1 mL 20 mg/mL HRP溶液(将辣根过氧化物酶溶于PBS缓冲液,得到HRP溶液)并于4 ℃、120 r/min搅拌反应16 h,在生理盐水中透析,得到酶标抗原AMQCA-HRP浓溶液,用等体积甘油稀释后,-20oC保存备用。
1.6 动物免疫 动物福利和实验程序严格遵循北京市实验动物福利伦理审查条例(2005),以及涉及动物的生物医学研究的国际指导准则(1985),并经中国兽医药品监察所动物福利伦理审查委员会同意。试验过程尽量做到减轻动物痛苦,减少动物数量。
采用3只新西兰大耳兔(北京维通利华实验动物技术有限公司)作为免疫动物,以制备的AMQCA-HSA人工抗原为免疫原。首次免疫用乳液按照如下方法配制:2 mL浓度为2 mg/mL(以蛋白浓度计)的免疫原水溶液与2 mL完全弗氏佐剂乳化。加强免疫用乳液按照以下方法配制:2 mL浓度为2 mg/mL(以蛋白浓度计)的免疫原水溶液与2 mL不完全弗氏佐剂乳化。首次免疫采用背部皮下多点注射以及后脚掌趾间注射(免疫原的剂量为1 mg /只);加强免疫采用大腿肌肉注射(免疫原的剂量为0.5 mg /只),每次免疫间隔2周,最后一次不加免疫佐剂直接肌肉注射,最后一次加强免疫7 d后采血,收集血清,即为多克隆抗体。
1.7 用棋盘滴定法确定抗体及酶结合物效价 分别取来自3只兔子的多克隆抗体,用包被缓冲液梯度稀释,得到系列抗体稀释液。在酶标板每孔分别加入150 μL上述抗体稀释液,37 ℃静置2 h,然后4 ℃静置12 h,弃去孔内液体,用洗涤液洗涤3次,拍干。每孔加入250 μL含5%(质量百分含量)脱脂牛奶的PBS缓冲液,37 ℃温育1 h,弃去孔内液体,干燥。取上述酶标板,分别加入0浓度标准溶液(即PBS缓冲液)和含10 ng/mL MQCA的PBS缓冲液(50 μL/孔),然后每组再分别加入100 μL系列稀释酶标抗原溶液,混匀并静置孵育30 min。用洗涤液洗涤酶标板3次并用吸水纸拍干,每孔加入100 μL显色液并避光显色15 min,最后每孔加入100 μL终止液,用酶标仪测定450 nm处吸光值(A450值)。
加入0浓度标准溶液的孔的吸光度值为B0。加入含10 ng/mL MQCA的PBS缓冲液的孔的吸光度值为B。B0大于1.5且抑制率为50%以上判断为阳性。百分吸光度值越低,抗体灵敏度越高。按此要求血清抗体效价达1∶5000。选取3只兔子中效果最好的血清抗体用于进一步试验。
抑制率(%) = [1-(B/B0)] × 100%
1.8 直接竞争免疫测定 取制备好的多克隆抗体,用包被缓冲液稀释,得到蛋白浓度为0.2 μg/mL的溶液。在酶标板每孔分别加入150 μL抗体稀释液,37℃静置2 h,然后4 ℃静置12 h,弃去孔内液体,用洗涤液洗涤3次,拍干。每孔加入250 μL含5%(质量百分含量)脱脂牛奶的PBS缓冲液,37 ℃温育1 h,弃去孔内液体,干燥。每孔加入50 μL MQCA标准品溶液(浓度分别为:0、0.3、1.0、3.0、10.0、30.0 μg/L),然后每孔加入100 μL酶标抗原溶液(0.1 mg/L),并于室温孵育30 min。用洗涤液洗涤酶标板3次并用吸水纸拍干,每孔加入100 μL显色液并避光显色15 min,最后每孔加入100 μL终止液,用酶标仪测定450 nm处吸光值(A450值)。1.9 特异性测定 选择与MQCA结构和功能类似的5种药物,将MQCA配制成如下浓度:0、0.3、1.0、3.0、10.0、30.0 μg/L,其它5种类似药物配制成如下浓度:0、10、30、100、300、1000 μg/L。用本试剂盒按照上述直接竞争免疫法测定标准曲线,得到各药物50%抑制浓度,与MQCA50%抑制浓度相比,得出一系列交叉反应率(CR),按以下公式计算:
CR (%) = (IC50,MQCA/IC50,类似物) × 100%
1.10 猪肝、猪肉、鸡肉、鸡蛋样品检测限测定 用制备的试剂盒测定各个空白样品(已确认不含MQCA的猪肝、猪肉、鸡肉、鸡蛋,各20份)的A450值,每个样品进行2次重复取平均值。将各样品的A450平均值分别代入标准曲线(0、0.3、1.0、3.0、10.0、30.0 μg/L)中,获得各样品中的测定值,按测定平均值加3倍标准差计算检测限。
猪肝、猪肉、鸡肉、鸡蛋样品前处理方法如下:称取2(±0.02)g均质样品至50 mL离心管中,加入8.0 mL乙酸乙酯,涡旋混匀;加入4 mL 1.5 mol/L盐酸水溶液,涡旋混匀,用振荡器振荡5 min,5000 r/min室温离心5 min;取5 mL上清液至另一50 mL离心管中,加入3 mL 33.3%(质量百分比)NaCl水溶液,涡旋混匀,5000 r/min室温离心5 min;取4.0 mL上清液至10 mL干净玻璃试管中,于50 ℃~60 ℃水浴氮气流下吹干;在玻璃试管中加入1 mL正己烷,涡旋溶解干燥残留物,然后加入1 mL水,涡旋混匀,静置分层;除去上层有机相,取下层水相,用水稀释至两倍体积,即为待测样本溶液。
1.11 添加回收试验 空白猪肉样品中分别添加MQCA使其浓度为1.0、2.0、4.0 μg/kg,每个浓度分别制备6个样品,采用上述前处理方法进行处理后,用ELISA方法进行测定。
添加回收率(%)计算公式如下:
回收率=实测值/添加值×100%
2 结果
2.1 半抗原的鉴定 LC-MS图谱结果如下,(ESI, m/z):204 [M+H]+。图谱中,得到m/z 比为204的主峰,对应半抗原的[M+H]+。
核磁共振图谱如图4所示,1H NMR (300 MHz, Chloroform-d) δ 7.71 (d,J= 9.0 Hz, 1 H), 7.29 (dd,J= 9.0, 1.8 Hz, 1H), 6.92 (d,J= 1.8 Hz, 1H), 6.13 (br, 2H), 2.68 (s, 3H)。氢化学位移值、质子的裂分峰数与半抗原相一致。
以上结果表明,半抗原的结构式为图1所示。
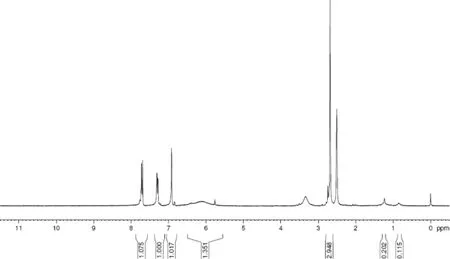
图4 喹乙醇残留标志物半抗原的核磁共振氢谱
2.2 人工抗原的鉴定 AMQCA与载体蛋白HSA通过重氮化反应偶联。为了证明偶联成功,分别对AMQCA溶液(a)、HSA溶液(b)以及AMQCA-HSA溶液(c)进行紫外(250~400 nm)光谱扫描,发现吸收峰有明显变化,见图5。
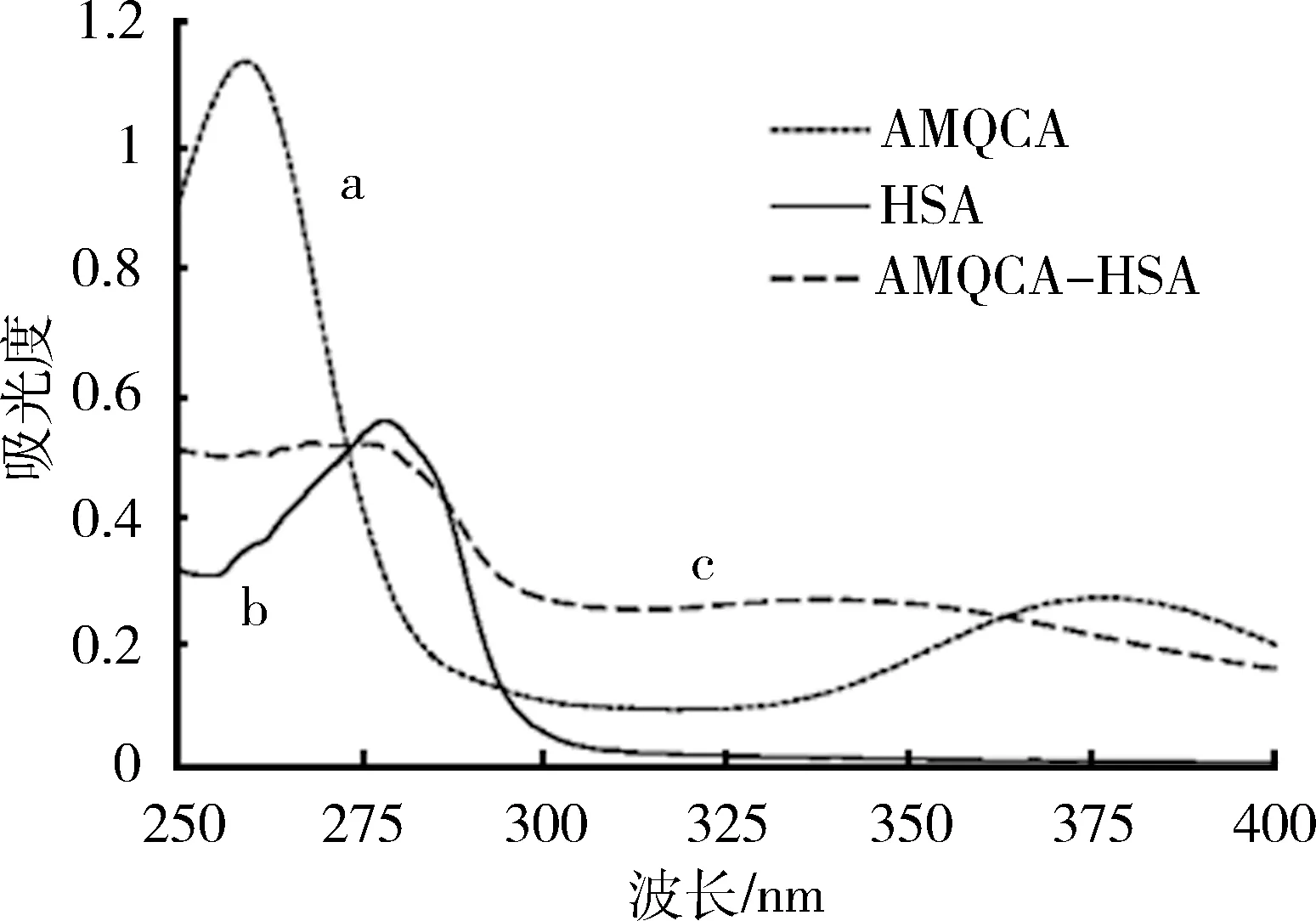
图5 紫外可见光谱 (a) AMQCA (b) HSA (c) AMQCA-HSA
2.3 试剂盒检测限、灵敏度、特异性、精密度和准确度
2.3.1 试剂盒检测限 在不含MQCA的猪肝、猪肉、鸡肉、鸡蛋各20份空白样品的测定基础上,计算得到该ELISA方法在猪肝、猪肉、鸡肉、鸡蛋中的检测限分别为0.42、0.23、0.28、0.28 μg/kg。
2.3.2 试剂盒灵敏度 50%抑制浓度(即IC50,指0 μg/L吸光度值的50%处所对应的MQCA浓度)常作为评价竞争ELISA试剂盒灵敏度的指标。用试剂盒分别测定5次标准曲线的IC50在1.8~2.1 μg/L范围之内,平均值为1.94 μg/L。本试剂盒抑制曲线和标准校正曲线见图6。

图6 试剂盒抑制曲线(A)和标准校正曲线(B)(每个点为重复5次测定的平均值)
2.3.3 试剂盒特异性 特异性测定结果如表1所示,表明该试剂盒能特异性测定MQCA而不受其它类似物干扰。

表1 试剂盒特异性试验结果
2.3.4 精确度和准确度 通过添加回收试验,对该方法的精确度和准确度进行评估。批内变异系数是通过测定6个平行样品计算得到,批间变异系数是3个不同批次试剂盒分别测定6个平行样品计算得到。测定结果见表2。
3 讨论与小结
3.1 半抗原AMQCA的优点 众所周知,小分子由于不能诱导动物产生免疫应答而不具备免疫原性。因此,AMQCA不能直接用作免疫抗原,而是需要与蛋白质载体连接。试验设计的半抗原AMQCA与MQCA结构相似,唯一区别在于苯环上远离-COOH的位置多一个-NH2。将AMQCA作为半抗原具有以下优点:(1)完整保留MQCA分子特征性基团和结构(氮杂环、-COOH等);(2)具有便于和蛋白质载体进行偶联的基团-NH2;(3)特征性基团和结构远离偶联位置,不容易受到蛋白质载体屏蔽,可充分暴露而成为抗原表位,利于高灵敏度和特异性抗体的制备。

表2 猪肉精确度和准确度的试验结果
3.2 半抗原与蛋白质载体的偶联 紫外可见光谱(图5)中,AMQCA在260 nm处具有很大的吸收峰,这可能是由于其分子中具有较多共轭结构(-C=C-,-C=O,-C=N-)。HSA在278 nm处的吸收峰来自于分子中色氨酸和酪氨酸残基[7]。对于AMQCA-HSA,偶联形成的-N=N-将半抗原和蛋白质连接起来,同时也将各个共轭体系连接,导致340 nm附近新的吸收宽峰的出现。此外,根据先前报道的方法[8-9],计算半抗原AMQCA和人血清白蛋白的偶联比为8∶1,即8个半抗原分子结合1个人血清白蛋白。
3.3 MQCA试剂盒的性能 将制备的抗体用于ELISA试剂盒的研制,其各方面性能均良好。IC50比已有报道的ELISA方法的IC50降低2~3倍[6,10-11]。与文献[6]报道直接在MQCA分子的-COOH位置设计改造抗原并在此基础上建立测定动物可食性组织中MQCA的ELISA方法相比,本方法在猪肉中测定MQCA的检测限降低了8倍,在鸡肉中测定MQCA的检测限降低了6倍。此外,本方法在猪肝中测定MQCA的检测限比Shen等[10]方法降低2.4倍,并且与HPLC-MS/MS方法测定鸡组织中MQCA的检测限具有可比性[12]。
本方法特异性高,抗体对MQCA高度敏感(CR为100%),而对QCA稍有反应(CR为3.6%),但是对乙酰甲喹、喹乙醇、卡巴氧、喹烯酮等几乎无反应(CR<0.1),因此测定MQCA时不受类似物(例如QCA)干扰。可能的原因有以下两个:第一,设计的半抗原AMQCA与蛋白质载体偶联后,由于偶联位置远离分子特征性基团和结构,氮杂环、-COOH以及-CH3不容易受到蛋白质载体屏蔽,仍能同时暴露而成为抗原表位;第二,从结构上看,MQCA比QCA的-COOH邻位多一个-CH3,导致抗体对MQCA以及QCA反应率相差迥异。Jiang等[6]在MQCA分子的-COOH上接入间隔臂后偶联载体蛋白作为抗原,制备的抗体对具有喹噁啉母环结构的多种药物均有反应,这也从另一个方面说明本文设计的半抗原结构能大大提高抗体特异性,并且本方法解决了上述文献中假阳性率高的问题。
此外,该试剂盒测定猪肉中1.0、2.0和4.0 μg/kg MQCA添加浓度的回收率范围为70%~97%,批内变异系数CV≤12%,批间变异系数CV≤12%。说明本方法的精确度和准确度能够满足要求,并且具有较好地重现性和可重复性。
本文设计了一种新型MQCA人工半抗原,该半抗原既完整保留分子特征性基团和结构并使其充分暴露而成为抗原表位,同时又具有连接基团便于和蛋白质载体偶联制备人工抗原,进而利于高灵敏度和特异性抗体的制备。人工半抗原合成原料试剂简单、低廉,易于购买,采用的化学反应安全,易于操作。制备的特异性抗体用于MQCA酶联免疫试剂盒,建立了测定动物性产品中MQCA残留量的直接竞争酶联免疫法。该方法具有高特异性、高灵敏度、高精确度、高准确度等特点,可同时快速检测大批样品,有望在MQCA残留检测中发挥重要作用。更重要地,本研究有助于指导小分子药物半抗原的合理设计,为现有的半抗原设计方法提供新的理念和思路。
[1] Zhang K, Ban M, Zhao Z,etal. Cytotoxicity and genotoxicity of 1,4-bisdesoxyquinocetone, 3-methylquinoxaline-2-carboxylic acid (MQCA) in human hepatocytes [J]. Res. Vet. Sci. 2012, 93: 1393-1401.
[2] Bi Y, Wang X, Xu S,etal. Metabolism of olaquindox in rat and identification of metabolites in urine and feces using ultra-performance liquid chromatography/quadrupole time-of-flight mass spectrometry [J]. Rapid Commun. Mass Spectrom. 2011, 25: 889-898.
[3] Wu Y, Yu H, Wang Y,etal. Development of a high-performance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues [J]. J. Chromatogr. A, 2007, 1146, 1-7.
[4] Boison J O, Lee S C, Gedir R G. A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues [J]. Anal. Chim. Acta, 2009, 637: 128-134.
[5] Merou A, Kaklamanos G, Theodoridis G. Determination of carbadox and metabolites of carbadox and olaquindox in muscle tissue using high performance liquid chromatography tandem mass spectrometry [J]. J. Chromatogr. B, 2012, 882: 90-95.
[6] Jiang W X, Beier R C, Wang Z H,etal. Simultaneous screening Analysis of 3 Methyl-quinoxaline-2-carboxylic acid and quinoxaline-2-carboxylic acid residues in edible animal tissues by a competitive indirect immunoassay [J]. J. Agric. Food Chem. 2013, 61: 10018-10025.
[7] Yang L G, Hu S Y, Wei P H,etal. Enzyme immunoassay technology [M]. Nanjing: Nanjing University Press, 1998.
[8] Bai Y H, Liu Z H, Bi Y F,etal. Preparation of polyclonal antibodies and development of a direct competitive enzyme-linked immunosorbent assay to detect residues of phenylethanolamine A in urine samples [J]. Journal of Agricultural and Food Chemistry, 2012, 60: 11618-11624.
[9] Jiang J, Wang Z, Zhang H,etal. Monoclonal antibody-based ELISA and colloidal gold immunoassay for detecting 19-nortestosterone residue in animal tissues [J]. Journal of Agricultural and Food Chemistry, 2011, 59: 9763-9769.
[10]Shen J, Wang Z, Jiang W,etal. A sensitive and specific ELISA for determining a residue marker of three quinoxaline antibiotics in swine liver [J]. Analytical and bioanalytical chemistry, 2013, 405(8): 2653-2659.
[11]Yue N, Ji B Q, Liu L Q,etal. Synthesis of olaquindox metabolite, methyl-3-quinoxaline-2-carboxylic acid for development of an immunoassay [J]. Food and Agricultural Immunology, 2009, 20(2): 183-193.
[12]Liu Y, He L, Xu L,etal. Simultaneous determination of quinocetone and its major metabolites in chicken tissues by high-performance liquid chromatography tandem mass spectrometry [J]. Journal of chromatography B, 2013, 919/920: 30-37.
(编辑:陈希)
A Novel Hapten Design for Marker Residue of Olaquindox and Its Application on the Veterinary Residue Detection in Animal Tissues
BAI Yu-hui, WANG He-jia, LIU Zhi-hong*, HUANG Yao-ling, XU Shi-xin
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
In order to improve the detection performance of enzyme-linked immunosorbent assay (ELISA) for maker residue of Olaquindox (MQCA), a novel hapten of MQCA was designed. This hapten keeps the characteristic structure and goups of MQCA, additionally, it can be easily coupled with protein carrier according to its -NH2. The hapten was synthesized involving in three steps. Based on its coupling with protein to become the immunogen, polyclonal antibodies were prepared. A rapid direct competitive ELISA was established to detect MQCA in animal tissues. The antibody showed high sensitivity and high specificity, with the IC50being 1.94 μg/L. The limits of detection of MQCA in liver, pork, chicken, and egg were 0.42, 0.23, 0.28 and 0.28 μg/kg, respectively. The average recoveries ranged from 70% to 97% at different spiked levels (1, 2 and 4 μg/kg) in pork for MQCA, and the intra/inter-day coefficients of variation were below 12%. The prototype kit could be advantageously used for the screening of large groups of samples, and has potential to play important role in the detection of MQCA. In addition, this study may help to guide the antigen design of small molecule medicine more reasonably, and supply new concept for the hapten design.
maker residue of Olaquindox; Hapten Design; ELISA; residue detection
白玉惠,博士,从事兽药残留检测方法研究及试剂盒研发工作。
刘智宏。E-mail: liuzhihong@ivdc.org.cn
2015-12-02
A
1002-1280 (2016) 02-0022-07
S859.84
