磺胺嘧啶钠与兔血浆蛋白结合率的检测研究
2016-02-07陈培荣吴海港彭升武
陈培荣,吴海港,彭升武
(1.信阳农林学院,河南信阳 46400;2.河北省承德县农牧局,河北承德 067400)
磺胺嘧啶钠与兔血浆蛋白结合率的检测研究
陈培荣1,吴海港1,彭升武2
(1.信阳农林学院,河南信阳 46400;2.河北省承德县农牧局,河北承德 067400)
为研究磺胺嘧啶钠与兔血浆中血浆蛋白结合情况,采用平衡透析法和超滤法模拟磺胺嘧啶钠与血浆蛋白结合过程,高效液相色谱法测定透析内液及外液中药物浓度,计算磺胺嘧啶钠血浆蛋白结合率。结果表明:血浆中其他成分对测定无干扰,各待测物在选择浓度范围内线性关系均良好,精密度及稳定性结果均符合方法学要求。透析外液线性范围为0.5~20 μg/mL,透析内液的线性范围为1~100 μg/mL,提取回收率在78.67%~98.36%之间,日内、日间变异均小于10%,磺胺嘧啶钠的体外血浆蛋白结合率平均为32.47%,体内血浆蛋自结合率平均为36.43%。本试验建立的方法简单,灵敏、专属性强,磺胺嘧啶钠在兔血浆中蛋白结合率较低,且具有浓度依赖性。
磺胺嘧啶钠;血浆蛋白结合率;平衡透析法,兔
磺胺嘧啶是兽医临床方面广泛应用的抗微生物药物之一,通常与磺胺甲氧苄啶合用,通过双重阻断细菌叶酸合成而抑制细菌繁殖,两者合用,抗菌作用可增效数倍至数十倍,并可减少抗药菌株的出现[1]。药物血浆蛋白结合率是药代动力学的重要参数之一,药物与血浆蛋白结合对药物具有贮存、运输和缓冲毒性的作用,影响药物在体内的分布、代谢、排泄,甚至吸收,进而影响药物在靶位的效应[2]。临床研究发现,磺胺嘧啶钠与血浆蛋白结合率具有种属差异性,存在饱和现象[3],因此研究磺胺嘧啶钠兔体内血浆蛋白结合率具有重要临床意义。本文用平衡透析法结合超滤法,并用高效液相色谱法测定了磺胺嘧啶钠家兔体内及体外血浆蛋白结合率,为临床上科学使用磺胺嘧啶钠提供理论依据。
1 材料和方法
1.1 材料
1.1.1 仪器与试剂 Agilent1100型高效液相色谱仪(美国Agilent公司);JY2002型电子天平(上海精密科学仪器有限公司生产);管状半透膜(上海兴亚净化材料厂生产);磺胺嘧啶钠标准品(中国兽医药品监察所提供,批号H080401,含量99.7%);磺胺嘧啶钠原料(浙江新昌国邦兽药厂生产,批号070814,含量98%);甲醇、乙腈、乙酸乙酯、三乙胺均为分析纯(上海国药集团)。
1.1.2 试验动物 健康大耳白兔6只,雌雄各半,体重(2±0.2) kg,信阳职业技术学院实验动物中心提供,实验前禁食24 h自由饮水。1.1.3 溶液配制 磺胺嘧啶钠贮存液:取标准品0.125 g溶于蒸馏水中,并稀释至1000 mL。磺胺嘧啶钠标准液:精确吸取贮存标准液3 mL,置100 mL容量瓶中,用3%三氯醋酸稀释至刻度。透析液:精密称取磷酸氢二钾14.11 g,磷酸二氢钾2.59 g,氯化钠1.99 g于1 L容量瓶中,加去离子水溶解并稀释至刻度,得pH 7.4磷酸缓冲液。
1.2 方法
1.2.1 色谱条件 色谱柱:Agilent TC-C18柱(150 mm×4.6 mm,5 μm),流动相:水:乙腈:磷酸(体积分数为12.5%):三乙胺(体积分数为15%)=85∶13∶1∶1;紫外检测波长270 nm;流速1.0 mL/min;柱温30 ℃;进样量20 μL[4]。
1.2.2 样品处理方法 透析内液样品的预处理:取血浆样品(透析内液)0.5 mL,置10 mL具塞离心管中,加入乙腈1 mL涡旋混合30 s,4000 r/min 离心20 min,取上清液过微孔滤膜(0.22 μm),取滤液20 μL注入高效液相色谱仪测定。
透析外液样品的预处理:取透析外液样品微孔滤膜(孔径0.22 μm)过滤后,精密吸取1 mL,离心(3000 r/min) 5 min,取上清液20 μL注入高效液相色谱仪测定。
1.2.3 标准曲线 取空白血浆0.5 mL,加入磺胺嘧啶钠标准液,配成相当于磺胺嘧啶钠血浆浓度为1、2、5、10、20、50、100 μg/mL的模拟透析内液样品;另取空白透析液1 mL,加入磺胺嘧啶钠标准液,配成相当于磺胺嘧啶钠血浆浓度为0.5、1、2、5、10、20 μg/mL的模拟透析外液样品,按1.2.2项下方法操作。以SD的峰而积(y)对其血药浓度(c)作图,求得回归方程。
1.2.4 准确度和精密度 取空白血浆0.5 mL,按标准曲线项下的方法操作,分别配制成低、中、高3个浓度透析内液(1、10、100 μg/mL)和透析外液(0.5、2、20 μg/mL)。考察方法的日内和日间精密度(RSD)和准确度。
1.2.5 回收率测定 精密吸取空白血浆0.5 mL,按标准曲线项下的方法操作,配制成低、中、高3种浓度,每个浓度5样品,计算加样提取后进样的药物峰面积和标准溶液进样的峰面积之比,考察样品的回收率。
1.2.6 稳定性测定 精密吸取空白血浆0.5 mL,按标准曲线项下的方法操作,配制成低、中、高3种浓度,每个浓度3样品,考察血浆样品预处理后室温放置4 ℃和-20 ℃下放置7 d的稳定性。1.2.7 体外血浆蛋白结合率测定方法 参考文献[5],将管状半透膜一端折叠用线结扎,将空白血浆2.0 mL于上述半透膜袋内,并扎紧口袋另一端(注意:袋口不得污染血浆)。将两端扎紧的半透膜置于盛有9.75 mL透析液的30 mL广口瓶中,透析外液的质量浓度分别为0.0125、0.025、0.05 mg/mL将该广口瓶于冰箱中放置至药物扩散平衡。透析结束后,吸出袋外透析液少许,加等量磺基水杨酸试剂,检查有无血浆蛋白漏出。如检查为阳性,则该样品作废。另取加2.0 mL透析液代替血浆于半透膜袋内,作平衡时间对照样品,以确定药物从袋内外自由扩散达到平衡所需时间。分别测定透析袋内外的药物浓度,计算血浆蛋白结合率,其公式为fb=(Dt-Df)/Dt×100%,其中fb:血浆蛋白结合率,Dt:血药总浓度(透析袋内的血浆药物浓度),Df:游离药物浓度(透析袋外缓冲液中药物浓度)。
1.2.8 体内血浆蛋白结合率实验方法 健康大耳白兔6只耳静脉注射SD 100 mg/kg,10 min心脏取血, 4 ℃,3000 r/min离心 10 min,取血浆0.5 mL 按“透析内液样品的预处理”项下操作。另取0.5 mL于超滤离心管中、4 ℃,10000 r/min离心20 min,取滤液20 μL注入高效液相色谱仪测定。
2 结果与分析
2.1 方法专属性 在本试验建立的色谱条件下,基线走动平稳,峰形良好,无杂质峰出现,色谱图见图1~图4。该测定方法简便,重现性好,分析样品的时间均不超过10 min,分析效率高。
图1 空白缓冲溶液色谱图

图2 空白血浆色谱图

图3 透析内液色谱图

图4 透析外液色谱图
2.2 标准曲线的制备 本研究所建立的标准工作曲线相见图5、图6。透析内液的标准回归曲线为y=0.0219x+0.1742,线性范围为1~100 μg/mL。透析外液的标准曲线为y=0.0588x+0.0616,线性范围为0.5~20 μg/mL。其相关系数均在0.9990以上。

图5 透析内液标准曲线图
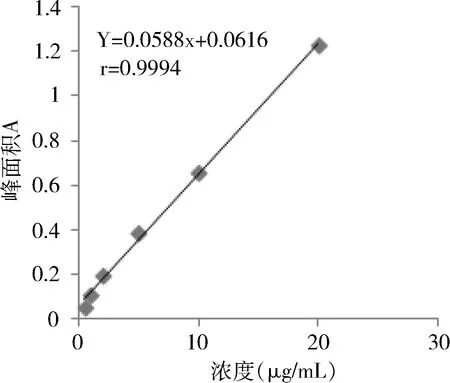
图6 透析外液标准曲线图
2.3 回收率、准确度和精密度 参透析内液和透析外液回收率、准确度及精密度数据见表1、表2,从表1、表2可以看出,3种浓度磺胺嘧啶钠的回收率的值在78.67%~98.36%之间,准确度高。日内变异系数均小于10%,日间变异系数均小于10%,方法具有较好的精密度。
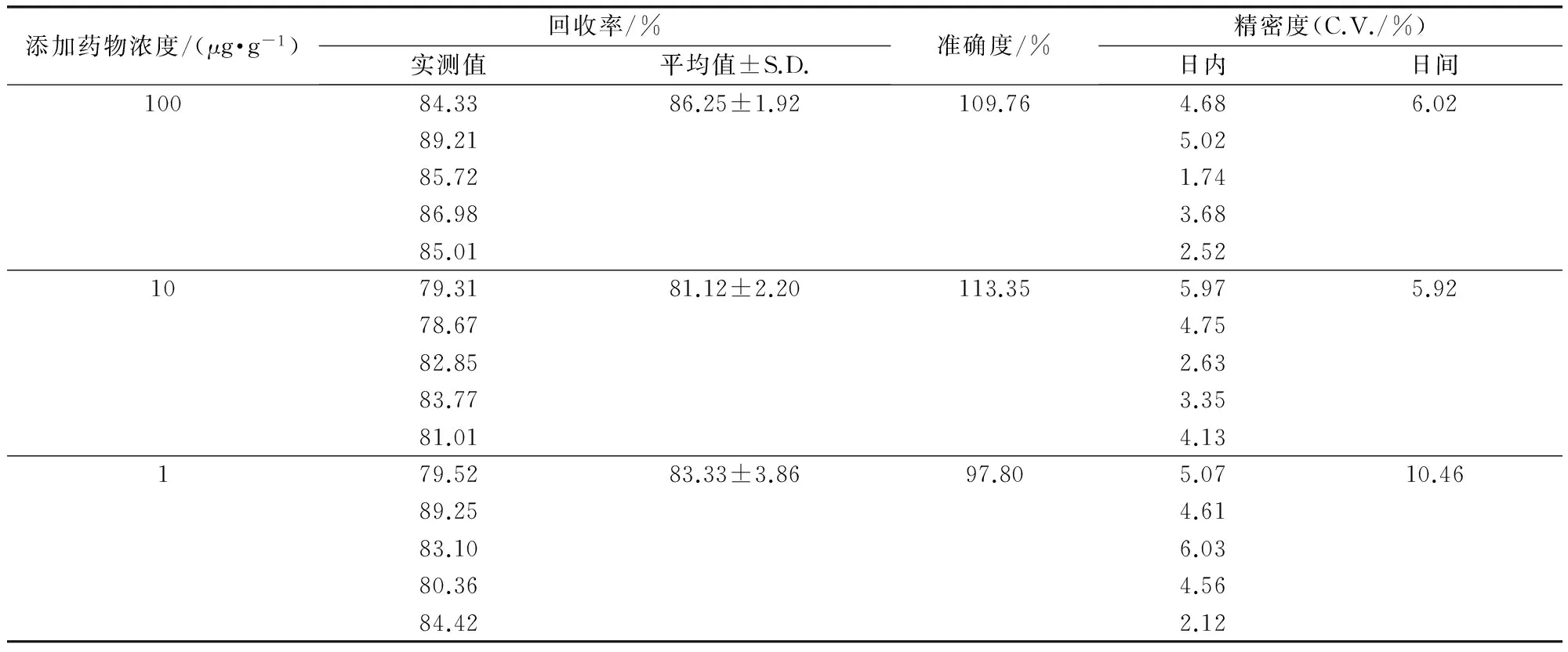
表1 透析内液回收率、准确度和精密度结果表

表2 透析外液回收率、准确度和精密度结果表
2.4 稳定性实验结果 考察结果表明:血浆样品在室温放置4 h和-20 ℃下放置7 d等条件下稳定性良好。
2.5 平衡时间 磺胺嘧啶钠平衡时间见表3,由表3可以看出,平衡时间为60 h时,透析袋内外磺胺嘧啶钠的浓度达到平衡。
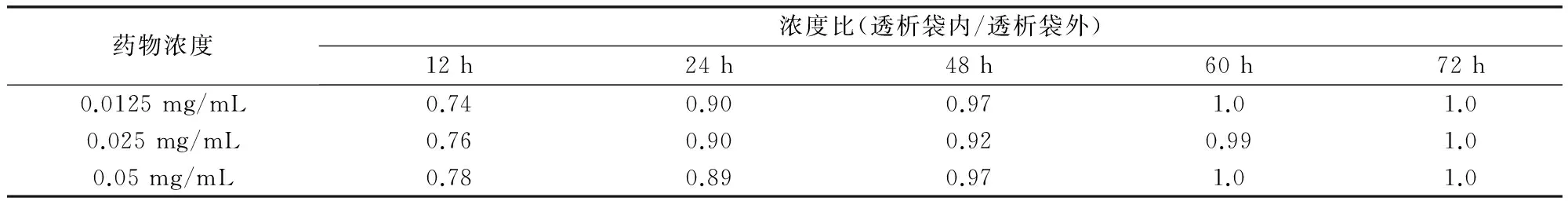
表3 磺胺嘧啶钠平衡时间表
2.6 血浆蛋白结合率 体外血浆蛋白结合率试验结果:低、中、高3个质量浓度的血浆蛋白结合率分别为(41.3±1.1)%、(32.2±1.3)%和(23.9±0.8)%。
体内血浆蛋白结合率试验结果:母兔和公兔的血浆蛋白结合率分别为(35.2±2.3)%和(37.7±4.5)%。
3 讨论与小结
3.1 药物与血浆蛋白结合率测定方法的选择 药物与血浆蛋白结合的方法包括平衡透析(equilibrium dialysis)、超过滤(ultrafiltration)、超离心(ultracentrifugation、快速或动力透析、分配平衡、光谱等各类方法[6]。在这些常用的方法中,平衡透析(ED)和超过滤(UF)是两种使用最多的方法。ED法基于药物结合的平衡原理,且受实验因素的干扰很小,常被认为是研究药物一蛋白结合的经典参比方法。UF的最大优点是实现血浆中游离药物的快速分离,加之与高灵敏度的液相联用检测技术相结合,UF已被广泛运用于大规模生物样品的游离药物浓度分析。微透析方法是以生理溶液不断灌注埋在组织中的微透析探针,组织中小分子物质经探针头部的半透膜弥散进入灌注液而在膜两侧达成动态平衡,同时被连续流动的灌注液不断带出从而达到活体取样的目的,但是微透析法不能进行血液药物总浓度检测[7]。
3.2 磺胺嘧啶钠血浆蛋白结合率的影响因素 药物与血浆蛋白之间的结合反应不仅关系到药物在体内的分布和消除,还与药物相互作用密切相关,影响药物和血浆蛋白结合的因素比较多,主要有药物性质、血浆pH值、血浆蛋白对药物的亲和率等[8]。文献报道,一般带负电荷的药物及酸性药物和血浆蛋白结合率较高[9]。磺胺类药物的消除速率与其血浆蛋白结合率关系密切,蛋白结合率高,半衰期相对长。对SD的血浆蛋白结合率的研究发现,SD血浆蛋白结合率存在着种属差异性,其中SD与绵羊血浆蛋白结合率最高,为40.76%,而在鸡体内SD血浆蛋白的结合率为33.69%。本试验中磺胺嘧啶钠与兔体外血浆蛋白结合率平均为32.47%,其血浆蛋白率结合较高原因可能是在动物血浆中,磺胺嘧啶钠是一种带负电的弱酸性药物容易和血浆蛋白结合,此外血浆pH值、血浆中血浆蛋白组成及含量也可能会影响磺胺嘧啶钠在兔体内的血浆蛋白结合率。此外,从试验结果中可以看出磺胺嘧啶钠和血浆蛋白结合率存在着质量浓度依赖性,表明磺胺嘧啶钠和血浆蛋白结合具有一定的饱和性,随着药物浓度增加血浆蛋白结合率降低,这和文献报道的相一致[10-11]。
本试验中采用平衡透析和超滤法模拟磺胺嘧啶钠与兔血将蛋白的结合过程,建立了磺胺嘧啶钠在透析外液及透析内液中含量测定方法。试验结果显示:本试验所建立的试验方法简便、专属性强、准确度高,血浆中其他成分对测定无干扰,各待测物在选择浓度范围内线性关系均良好,精密度及稳定性结果均符合方法学要求,能够满足临床上对生物样品检测和分析的要求。
[1] 陈仗榴.兽医药理学[M].北京:中国农业出版社,2009.
[2] Dust K,Jones D C,Davidson G. Detemunation of sulfanamides packed column supercritical fluid chromatography with atmosheric pressure chemical ionnizatian mass spectrometric detection[J].Analyst,2000, 125(7): 1243.
[3] 李在建,吴玉容,易维学,等.三种不同磺胺类药物对鲤鱼干细胞色素P450酶系生化指标的影响[J].中国兽医科学,2010, 40 (9):970-974.
[4] 林丽聪,樊海平,廖碧钗,等.磺胺嘧啶在欧洲鳗鲡体内的药代动力学研究[J].检验检疫学刊,2010,4(20):14-17.
[5] 孙言春,王瑛,杜宁宁,等.液相色谱串联质谱测定磺胺间甲氧嘧啶钠与鲤鱼血浆蛋白结合率[J].中国渔业质量与标准,2012,2(4):81-85.
[6] 肖超,陈风春,刘忠文,等.磺胺二甲嘧啶及其乙酰化代谢产物与血浆蛋白体外结合特点[J].解放军预防医学杂志,2012,30(4):243-245.
[7] 郭宾,李川.药物与血浆蛋白结合的药理学基础及其研究进展[J].中国临床药理学与治疗学,2005,10(3):241-253.
[8] 关瑾,丁爽,刘芷含,等.药物-血浆蛋白结合率测定方法的研究进展[J].中国新药杂志,2014,10(23):1149-1153.
[9] Zhong J, Tang M K, Zhang Y,etal. Effect of salvianolicacid B on neural cells damage and neurogenesis after brainischemia-reperfusion in rats [J].Acta Pharm Sin,2007, 42: 716-721.
[10]Lund T,Bylund G. Effect oI sulphadiazine and trimethoprimnn the immune response oI rainbow trout(On corhyachus mykiss) [J].Vet Immunol Immunop,2002,85 (1/2):99-108.
[11]Hou X,Shen J,Zhang S,etal.Bioconcentration and elimination on sullamethazine and its main metabolite insturgeon (Acipenser.schrenkii) [J].J Agric Food Chem,2003,51 (26):7725-7729.
(编辑:侯向辉)
Determination of the Binding Rate of Rabbit Plasma Protein with Sulfadiazine Sodium
CHEN Pei-rong1,WU Hai-gang1,PENG Sheng-wu2
(1.XinyangCollegeOfAgriculturalandForestry,Xinyang,Henan464000,China;2.AgricultureandAnimalBureauofChengdeCity,Chengde,Hebei067400,China)
To study the plasma protein binding rate of sulfadiazine sodium in rabbit plasma. The equilibrium dialysis method and the ultrafiltration method were used to imitate the binding process between sulfadiazine sodium and plasma protein, The HPLC was adopted to determined sulfadiazine sodium in plasma. The results showed that there was no interference from other ingredients for the determination of sulfadiazine sodium. The calibrationcurve of the analytes was in good linearity in certain range of contents. The precision and stability of the analytes met the methodology requirements. The calibration curve of the buffer solution was linear in the range of0.5~20 μg/mL,The calibration curve of the plasma was linear in the range of 1~100 μg/mL,The extract recovery was 78.67%~98.36%,RSDs of infra and inter-day precisions were all less than 10%.The binding rates of plasma protein with sulfadiazine sodium in vitro was 32.47% andinvivowas 36.43%. The HPLC method established in the paper is simple sensitive and stable. SD has a lower protein binding rate with rabbit plasma and The binding of SD to plasma protein was concentration dependent.
sulfadiazine sodium(SD); protein binding rate; equilibrium dialysis; rabbit
陈培荣,讲师,从事畜牧兽医专业教学工作及研究。E-mail:xycpr@126.com
2015-12-11
A
1002-1280 (2016) 02-0041-05
S859.796
