水溶性酵母葡聚糖对猪细小病毒灭活疫苗免疫效果的影响
2016-02-06靳晓慧王瑞宁徐卫松耿静微何潇湘郑兰兰魏战勇河南农业大学牧医工程学院河南郑州45000河南省动物性食品安全重点实验室河南郑州455000河南省信阳市平桥区动物卫生监督所河南信阳46400
靳晓慧,王瑞宁,徐卫松,耿静微,何潇湘,郑兰兰,张 建,魏战勇*(.河南农业大学 牧医工程学院,河南 郑州 45000; .河南省动物性食品安全重点实验室,河南 郑州 455000; .河南省信阳市平桥区动物卫生监督所,河南 信阳 46400)
水溶性酵母葡聚糖对猪细小病毒灭活疫苗免疫效果的影响
靳晓慧1,2,王瑞宁1,徐卫松1,耿静微1,何潇湘1,郑兰兰2,张 建3,魏战勇1,2*
(1.河南农业大学 牧医工程学院,河南 郑州 450002; 2.河南省动物性食品安全重点实验室,河南 郑州 455000; 3.河南省信阳市平桥区动物卫生监督所,河南 信阳 464100)
为研究水溶性酵母葡聚糖作为免疫佐剂对猪细小病毒(PPV)灭活疫苗免疫效果的影响,将水溶性酵母葡聚糖与PPV灭活疫苗联合免疫小鼠,采用ELISA方法检测免疫后不同时间小鼠血清中的抗体水平及IL-4、IL-6、IFN-γ的分泌水平,应用流式细胞仪检测免疫小鼠CD3+、CD3+CD4+、CD3+CD8+T淋巴细胞百分比值的动态变化。结果显示,与疫苗单独免疫组相比,酵母葡聚糖对抗体水平无明显影响,CD3+、CD3+CD4+、CD3+CD8+细胞数量增加,且均能不同程度诱导IL-4、IL-6、IFN-γ分泌。表明,水溶性酵母葡聚糖联合PPV灭活疫苗能够有效增强机体的免疫功能,水溶性酵母葡聚糖可以作为PPV的免疫佐剂。
猪细小病毒; 灭活疫苗; 水溶性酵母葡聚糖; T淋巴细胞亚群; 细胞免疫; 体液免疫
猪细小病毒病是由猪细小病毒(porcine parvovirus, PPV)感染引起的一种猪的繁殖障碍病,主要引起初产母猪不孕、流产、死产、产木乃伊胎及弱胎等[1-2]。近年来, PPV病的广泛流行给养猪业造成了巨大的经济损失[3]。对该病目前尚无有效的治疗方法,临床上主要使用PPV疫苗进行免疫预防。PPV弱毒苗免疫效果较好,但其本身存在散毒的危险。PPV灭活疫苗作为预防PPV的常用疫苗,安全性较高,但由于其主要引起体液免疫应答,引起的细胞免疫应答水平较低甚至没有,从而导致免疫保护率不高,且其易导致机体长期处于持续性感染状态。因此,如何提高疫苗刺激的保护性抗体水平和细胞免疫应答效应是防制PPV感染的关键。
佐剂的选择对灭活疫苗免疫效果起着至关重要的作用[4-7]。酵母葡聚糖是存在于酵母细胞壁中的一种多糖,对细菌有很明显的抑制作用,同时具有抗癌、抗病毒的功能,可以增强哺乳动物的免疫力,具有降低血脂、促进伤口愈合等功能,是一种良好的生物效应调节剂。酵母葡聚糖被广泛应用到动物饲料、食品添加剂等各个领域[8-10]。目前,酵母葡聚糖作为免疫增强剂在水产养殖中使用最广泛[11],然而,在畜禽养殖业中,有关葡聚糖的应用报道较少。李军等[12]在断奶仔猪日粮中添加适量的啤酒酵母葡聚糖发现,啤酒酵母葡聚糖可以提高断奶仔猪的生产性能以及细胞免疫功能。但有关酵母葡聚糖作为免疫佐剂在畜禽疾病防制方面的研究尚未见报道。为此,本研究采用水溶性酵母葡聚糖联合PPV油乳剂灭活疫苗免疫小鼠,分析水溶性酵母葡聚糖对PPV灭活疫苗免疫效果的影响,以期为猪PPV灭活疫苗新型佐剂的开发奠定基础。
1 材料和方法
1.1 疫苗
猪PPV油乳剂灭活疫苗购于中牧实业股份有限公司(批号1009006-2);自制猪PPV油乳剂灭活疫苗。
1.2 供试动物
60只体质量20 g左右的Balb/C小鼠,购自郑州大学医学院实验动物中心。
1.3 主要试剂
猪细小病毒抗体检测ELISA试剂盒购自BioXL公司;酵母细胞壁粗提物,购于安琪酵母股份有限公司;辣根过氧化物酶(HRP)标记的羊抗小鼠IgG,购于北京鼎国生物技术发展公司;小鼠IL-4 、IL-6及IFN-γ ELISA检测试剂盒,购自武汉华美生物工程有限公司;大鼠抗小鼠CD3+、CD4+和CD8+分子单克隆抗体以及FITC、PE标记的兔抗大鼠IgG,购自北京邦定泰克生物技术有限公司;其余试剂均为国产分析纯。
1.4 水溶性酵母葡聚糖的制备
取干燥的酵母细胞壁粗提物20 g,悬浮于120 mL 6% NaOH溶液中, 60 ℃条件下剧烈搅拌4 h,冷却至室温后3 000 r/min离心15 min,弃上清液后,用80 mL 3%NaOH溶液重新悬浮,加热至90 ℃并不断搅拌2 h,3 000 r/min离心15 min, 弃上清液,加入50 mL 4%HCl充分搅拌,室温下静置2 h。3 000 r/min离心15 min,弃上清液,用蒸馏水充分洗涤3次,再用50 mL 95%乙醇于75 ℃搅拌3 h,脱水2次,37 ℃干燥12 h,得到淡黄色的酵母碱不溶性葡聚糖粉末。将其放入水解管中,加入27 mL 2.7 mol/L的H2SO4后封管,置于100 ℃的水浴中水解3 h。水解液转入100 mL容量瓶中,定容备用。将经酸处理后的样品溶液稀释到质量浓度为0.04 mg/mL后,取1.0 mL加入蒽酮试剂,按照硫酸-蒽酮法测定含量[13]。
酵母碱不溶性葡聚糖按1∶10(m/v)添加90%甲酸,85 ℃降解1 h,加热,除去甲酸,调节pH值至11,过滤,将过滤浓缩液的pH值调节至中性,加热到70 ℃处理30 min, 真空冷冻干燥即获得水溶性酵母葡聚糖,最后将其用pH值8.0的磷酸缓冲液配制成8 mg/mL的水溶性酵母葡聚糖供试液,备用[14]。
1.5 试验设计
60只Balb/C小鼠随机分为6组,每组10只,雌雄各半,猪PPV抗体检测ELISA试剂盒检测PPV抗体均为阴性。皮下分点注射,隔周进行二免,每组免疫剂量与首次免疫剂量相同。免疫后不同时间每组分别随机抽取3只小鼠进行摘眼球采血并分离血清。具体分组及免疫方案见表1。
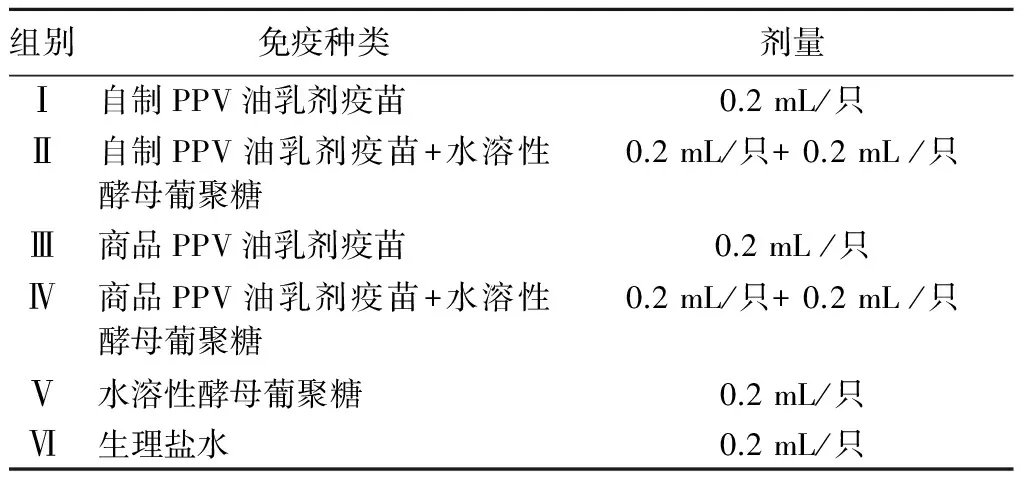
表1 试验分组及免疫情况
1.6 抗体水平的测定
免疫0、1、2、3、4、5、6周后,对分离到的血清在56 ℃水浴灭活30 min。按照PPV ELISA诊断试剂盒(试剂盒中酶标羊抗猪IgG更换为辣根过氧化物酶标记羊抗小鼠IgG)使用说明书操作,应用间接ELISA方法检测小鼠血清中PPV的抗体水平。
1.7 小鼠T淋巴细胞亚群的测定
免疫0、1、2、3、4周后,对采集的血液使用柠檬酸钠抗凝,取抗凝血0.2 mL, 加2 mL 红细胞裂解液, 充分混匀,室温作用10 min, 2 000 r/min离心5 min, 弃上清液, 加5 mL PBS洗涤, 2 000 r/min 离心10 min,重复2次。将每份血清样品分装2管,一管加入鼠抗CD3-FITC、CD4-PE单克隆抗体各10 μL,另一管加入鼠抗CD3-FITC、CD8-PE单克隆抗体各10 μL,每管取细胞悬液500 μL,4 ℃冰箱中避光反应1 h,再加PBS 缓冲液1 mL,混匀,2 000 r/min离心5 min,弃上清,将管底细胞用1 mL PBS 悬浮,用FACsort 流式细胞仪检测,每个样本计数3 000个细胞,结果用Mod Fit LT软件分析[15]。
1.8 细胞因子IL-4、IL-6 和IFN-γ含量的测定
按照ELISA检测试剂盒使用说明书,检测小鼠免疫7、14、21、28 d后血清中IL-4、IL-6和IFN-γ的含量。以标准品的质量浓度为横坐标、OD值为纵坐标,绘制标准曲线。根据样品的OD值计算小鼠血清中IL-4、IL-6和IFN-γ的含量。
1.9 数据处理
用SPSS 11.5及Excel 2000将所得数据进行统计处理,计算其平均值,试验数据以平均值± 标准差表示,并用SPSS 11.5软件进行Duncan’s多重分析。
2 结果与分析
2.1 水溶性酵母葡聚糖对PPV抗体水平的影响
用ELISA方法对每周收集的血清进行抗体水平的检测,得到抗体水平消长曲线(图1)。统计分析结果表明,从第2周开始,除了水溶性酵母葡聚糖组,自制疫苗组、自制疫苗+水溶性葡聚糖组、商品疫苗组、商品疫苗+水溶性葡聚糖组抗体水平均显著高于生理盐水组,自制疫苗免疫组与商品疫苗免疫组差异不显著,水溶性酵母葡聚糖联合PPV灭活疫苗组的抗体效价与相应的灭活疫苗单独免疫组差异均不显著。整体上,水溶性酵母葡聚糖联合PPV灭活疫苗组的抗体水平高于相应的灭活疫苗单独免疫组。
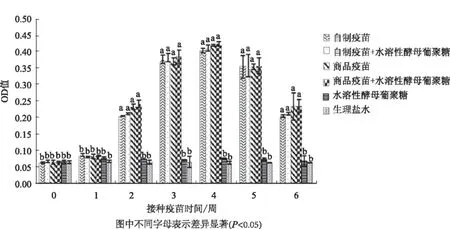
图1 小鼠血清抗体水平的检测结果
2.2 水溶性酵母葡聚糖对外周血中T淋巴细胞亚群的影响
2.2.1 CD3+T淋巴细胞 各组CD3+T淋巴细胞百分率均比生理盐水组高(图2)。自制疫苗免疫组与商品疫苗免疫组差异不显著,水溶性酵母葡聚糖联合PPV灭活疫苗免疫组均比相应的灭活疫苗组的CD3+百分率高,但差异不显著。
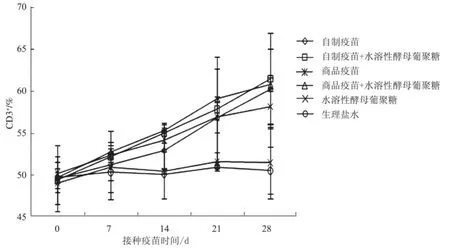
图2 免疫小鼠后外周血CD3+细胞百分率
2.2.2 CD3+CD4+T淋巴细胞 各组的CD3+CD4+T淋巴细胞百分率均高于生理盐水组,各疫苗免疫组CD3+CD4+T淋巴细胞百分率均高于水溶性酵母葡聚糖组(图3)。在免疫后14 d自制疫苗免疫组显著高于商品疫苗免疫组,在免疫后21 d水溶性酵母葡聚糖联合PPV灭活疫苗免疫组趋于下降,但仍高于相应的灭活疫苗免疫组。整体上,水溶性酵母葡聚糖联合PPV灭活疫苗免疫组均比相应的灭活疫苗组的CD3+CD4+T淋巴细胞百分率高,但差异不显著。
2.2.3 CD3+CD8+T淋巴细胞 在免疫后14~28 d,除水溶性酵母葡聚糖单独免疫组外,各试验组的CD3+CD8+T淋巴细胞百分率均显著高于生理盐水组(图4)。商品疫苗免疫组CD3+CD8+T淋巴细胞显著高于自制疫苗免疫组。在免疫后21 d,水溶性酵母葡聚糖联合PPV灭活疫苗免疫组显著高于相应的灭活疫苗组。

图3 免疫小鼠后外周血CD3+CD4+细胞百分率
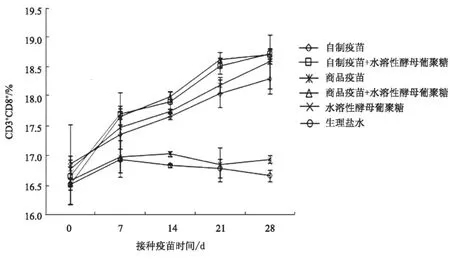
图4 免疫小鼠后外周血CD3+CD8+细胞百分率
2.3 水溶性酵母葡聚糖对细胞因子的影响
2.3.1 IL-4 从图5可以看出,免疫小鼠后,各组的IL-4水平呈上升趋势。免疫后7~28 d,水溶性酵母葡聚糖联合PPV灭活疫苗组的IL-4水平显著高于相应的疫苗组,各试验组的IL-4水平均极显著高于生理盐水组。
2.3.2 IL-6 由图6可知,免疫小鼠后,各个试验组的IL-6水平均显著高于生理盐水组。免疫后14~28 d时,水溶性酵母葡聚糖联合PPV灭活疫苗组的IL-6水平显著高于相应的PPV灭活疫苗组。
2.3.3 IFN-γ 由图7可知,水溶性酵母葡聚糖联合自制疫苗组与自制疫苗单独免疫组的IFN-γ水平均在免疫后14 d达到峰值,且水溶性酵母葡聚糖联合灭活疫苗组的IFN-γ水平均显著高于相应的灭活疫苗组。免疫后7~28 d,除水溶性酵母葡聚糖组外,其余试验组的IFN-γ水平均极显著高于生理盐水组(图7)。
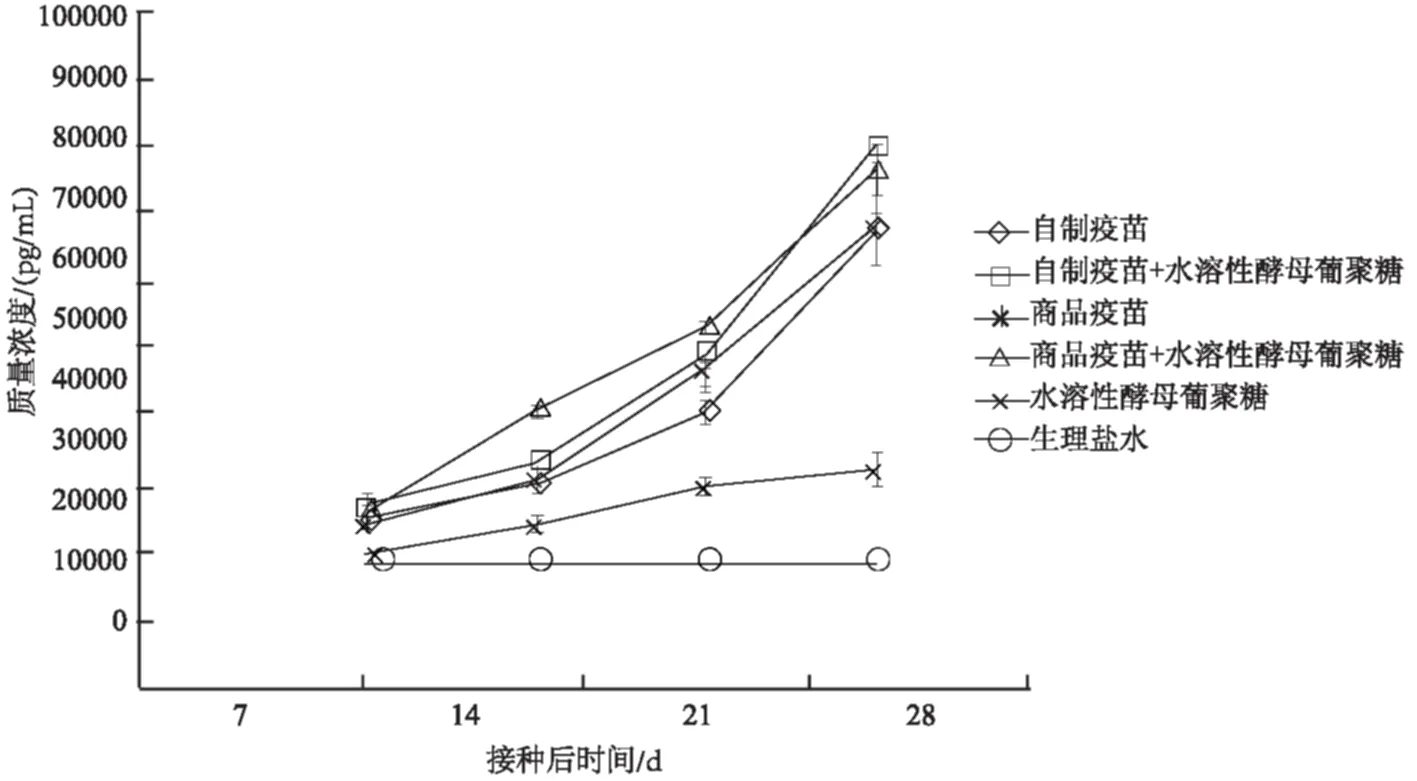
图5 免疫后小鼠血清中IL-4水平

图6 免疫后小鼠血清中IL-6水平
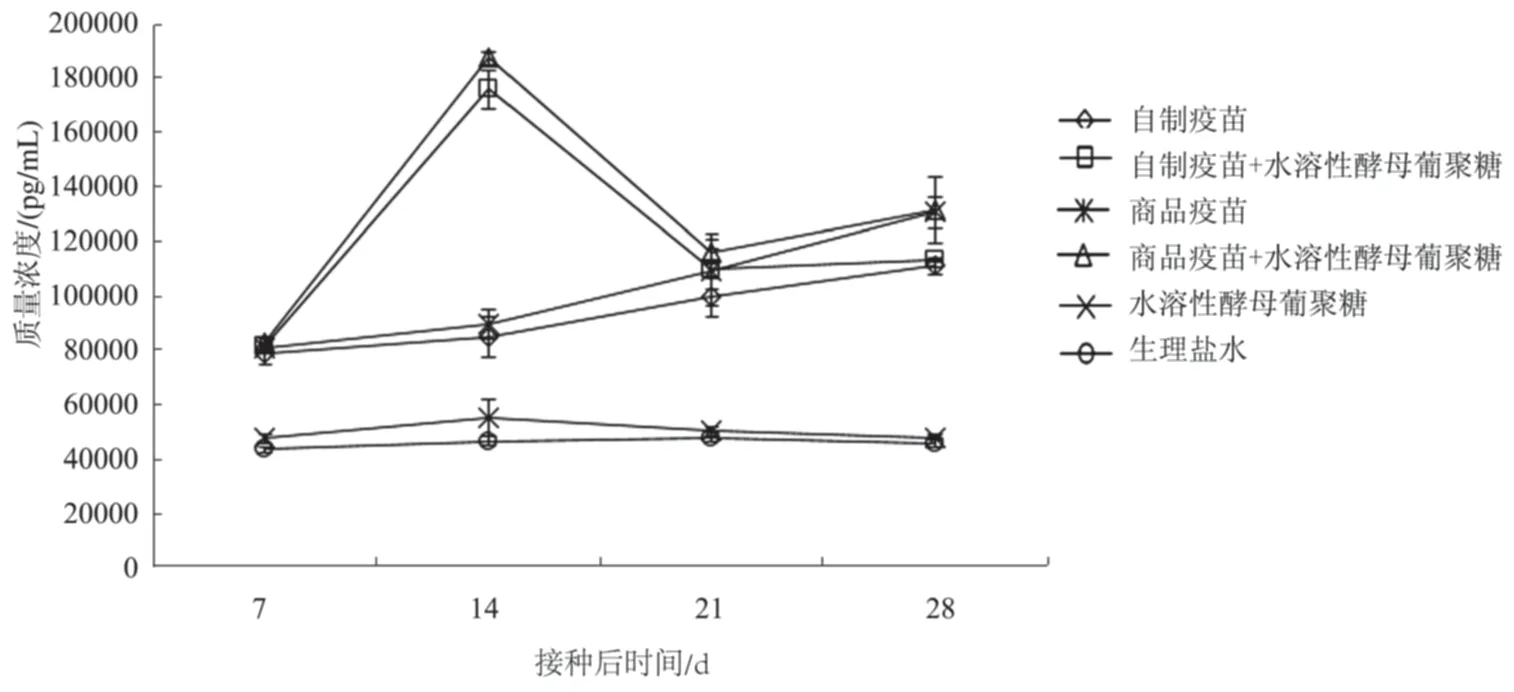
图7 免疫后小鼠血清中IFN-γ水平
3 讨论
本研究结果表明,整体上,水溶性酵母葡聚糖组的抗体水平高于相应的灭活疫苗单独免疫组,但差异不显著。水溶性酵母葡聚糖作为免疫佐剂有利于抗体产生。
CD3是T细胞膜上的重要分化抗原,CD3+是成熟T细胞的特征性标志,CD3+分子的主要功能是传递T细胞活化信号,代表了机体的细胞免疫水平[16]。CD4+和CD8+分子是T淋巴细胞的2个重要表面标志,其中CD4+T淋巴细胞的作用是辅助和诱导增强免疫应答,其主要功能是分泌细胞因子,如IFN-γ、IL-2、TNF和淋巴毒素(LT)等[17-18],CD8+T淋巴细胞主要是抑制、介导细胞毒性杀伤作用[19-21]。本试验利用流式细胞仪检测小鼠免疫后CD3+、CD3+CD4+、CD3+CD8+T淋巴细胞百分率的变化,评价水溶性酵母葡聚糖联合PPV灭活疫苗组的细胞免疫水平。结果显示,水溶性酵母葡聚糖组的CD3+CD4+、CD3+CD8+T淋巴细胞百分率均比相应的灭活疫苗单独免疫组高,表明水溶性酵母葡聚糖佐剂可增强小鼠的细胞免疫应答。
Th1和Th2效应细胞是由CD3+CD4+T淋巴细胞亚群激活后增殖分化得到的,通过分泌不同的细胞因子介导各自的免疫功能[22]。IL-4、IL-6是Th2型细胞产生的具有抗病毒作用的细胞因子,在免疫调节中具有非常重要的作用;IL-4还可以调节Th1型细胞分化,间接介导细胞免疫[23-24]。IFN-γ是由Th1细胞分泌的,不仅具有抗病毒作用,而且具有较强的免疫调节作用。本试验结果表明,水溶性酵母葡聚糖能刺激淋巴细胞分泌IL-4、IL-6,能促进小鼠外周血淋巴细胞诱生IFN-γ,这可能是水溶性酵母葡聚糖增强免疫的分子机制之一。IFN-γ、IL-4、IL-6作为重要的Thl、Th2型免疫相关因子,相互制约、彼此调节,维持着机体正常的细胞免疫和体液免疫功能。
目前,PPV感染尚无有效的治疗药物,有效预防PPV病的主要手段是使用PPV疫苗进行免疫预防,但各种PPV疫苗均不能100%预防该病。本研究结果表明,水溶性酵母葡聚糖能够增强PPV灭活疫苗的免疫应答,为水溶性酵母葡聚糖作为免疫增强剂的应用提供了理论依据。
[1] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1148-1150.
[2] 樊振华,王娟萍,孟帆,等.猪细小病毒和猪圆环病毒2型多重PCR检测方法的建立与应用[J].山西农业科学,2012,40(10):1102-1106.
[3] Zhou Y,Zhou T,ZhouR,etal.Chemiluminescence immunoassay for the rapid and sensitive detection of antibody against porcine parvovirus by using horseradish peroxidase/detection antibody-coated gold nanoparticles as nanoprobes[J].Luminescence,2014,29(4):338-343.
[4] Chen H Y,Zhao L,Wei Z Y,etal.Enhancement of the immunogenicity of an infectious laryngotracheitis virus DNA vaccine by a bicistronic plasmid encoding glycoprotein B and interleukin-18[J].Antiviral Research,2010,87(2):235-241.
[5] Reed S G,Bertholet S,Coler R N,etal.New horizons in adjuvants for vaccine development[J]. Trends in Immunology,2009,30(1):23-32.
[6] 张红英,王学兵,崔保安,等.山药多糖对PRRSV灭活苗免疫猪抗体和T细胞亚群的影响[J].华北农学报,2010,25(2):236-238.
[7] 杜立中,马霞,刘永录,等.黄芪多糖对猪瘟活疫苗免疫应答的佐剂作用[J].河南农业科学,2014,43(9):156-159.
[8] 刘丽,郑全辉,张庆波,等.酵母多糖对机体免疫功能的影响[J].河北医药,2013,35(15):2257-2259.
[9] 王元秀,张桂香,李峰,等.酵母多糖的提取及其对雏鸡免疫器官发育的影响[J].食品科学,2011,32(2):256-259.
[10] 李桂峰,康裕财,孙际佳,等.酵母多糖对赤眼鳟非特异性免疫机能的影响[J].中山大学学报(自然科学版),2003,42(4):55-58.
[11] 李家政,魏泽能.β-葡聚糖预防鲫鱼疾病的生产性应用研究[J].现代农业科技,2014(18):248-253.
[12] 李军,邢建军,李德发,等.啤酒酵母葡聚糖对断奶仔猪生产性能及淋巴细胞转化率的影响[J].中国畜牧杂志,2006,42(1):17-21.
[13] 祁业明,杜丽平,肖冬光,等.酵母不溶性葡聚糖测定方法的研究[J].酿酒科技,2007,159(9):92-94,97.
[14] 祁业明.酵母葡聚糖的研制[D].天津:天津科技大学,2007.
[15] 邱妍,胡元亮,崔保安,等.怀牛膝多糖对雏鸡疫苗免疫效果的影响[J].畜牧兽医学报,2007,38(7):723-727.
[16] 郭敏,郎广平,梁志选,等.PRRSV特异性肽对CSFV、PRRSV疫苗免疫猪后T淋巴细胞亚群的影响[J].中国兽医学报,2014,34(3):361-365.
[17] Yu D P,Han Y,Zhao Q Y,etal.CD3+CD4+and CD3+CD8+lymphocyte subgroups and their surface receptors NKG2D and NKG2A in patients with non-small cell lung cancer[J].Asian Pacific Journal of Cancer Prevention,2014,15(6):2685-2688.
[18] Yao S,Huang D,Chen C Y,etal.CD4+T cells contain early extrapulmonary tuberculosis (TB) dissemination and rapid TB progression and sustain multieffector functions of CD8+T and CD3+lymphocytes:Mechanisms of CD4+T cell immunity[J].Journal of Immunology, 2014,192(5):2120-2132.
[19] 孙庆申,蔡雪晖,童光志.CD4和CD8分子在细胞免疫中的作用及其与PRRSV感染的关系[J].中国预防兽医学报,2002,24(2):151-152.
[20] 严健,原永明,张舒,等.CD3+、CD4+、CD8+T淋巴细胞亚群在肿瘤患者外周血中检测的临床意义[J].检验医学,2013,28(10):901-903.
[21] 魏育蕾,程祥,杨藩,等.牛白介素32基因可变剪接体(IL-32γ)的分子克隆及功能验证[J].农业生物技术学报,2013,21(1):38-46.
[22] Kawamoto K,Nakamura S,Iwashita A,etal.Clinicopathological characteristics of primary gastric T-cell lymphoma[ J].Histopathology,2009,55(6):641-653.
[23] 冯志华,王全楚.新概念疫苗[M].北京:人民卫生出版社,2004:208-222.
[24] 王越,杨洁,高燕,等.IL-6、IL-8上调卵巢癌细胞雄激素受体表达的作用分别依赖MAPK途径和Src活化[J].免疫学杂志,2008,24(4):424-429.
Influence of Water-soluble Yeast Glucan on Immune Effects of Porcine Parvovirus Inactivated Vaccines
JIN Xiaohui1,2,WANG Ruining1,XU Weisong1,GENG Jingwei1,HE Xiaoxiang1,ZHENG Lanlan2,ZHANG Jian3,WEI Zhanyong1,2*
(1.College of Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China;2.Key Laboratory for Animal-derived Food Safety of Henan Province,Zhengzhou 455000,China;3.Animal Health Supervision Institute of Pingqiao Distrit,Xinyang 464100,China)
In order to research the effect of water-soluble yeast glucan as immune adjuvant on immune effects of PPV inactivated vaccines,the mice were injected with PPV inactivated vaccine with the water-soluble yeast glucan,blood samples were taken weekly after vaccination.The antibody titers and sera secreting IL-6,IL-4, IFN-γand CD3+,CD3+CD4+,CD3+CD8+T lymphocytes percentage were measured by ELISA and FCA.Compared with the vaccine immunization group alone,yeast glucan could enhance the number of CD3+,CD3+CD4+,CD3+CD8+T-lymphocytes subpopulations,as well as IL-6, IL-4 and IFN-γ secretion of serum.However,there was unexpectedly little difference on antibody titers.It demonstrated that water-soluble yeast glucan injected with PPV inactivated vaccines could effectively enhance the body’s immune function,and water-soluble yeast glucan could serve as PPV immune adjuvant.
porcine parvovirus; inactivated vaccine; water-soluble yeast glucan; T-lymphocyte subsets; cellular immunity; humoral immunity
2016-01-10
河南省科技开放合作项目(142106000042);河南省重大科技攻关项目(132102110034)
靳晓慧(1991-),女,河南开封人,在读硕士研究生,研究方向:动物分子病毒学、分子免疫学。 E-mail:1114780675@qq.com
*通讯作者:魏战勇(1975-),男,河南安阳人,教授,博士,主要从事动物分子病毒学、分子免疫学研究。 E-mail:weizhanyong@henau.edu.com
S852.4
A
1004-3268(2016)08-0125-06
