1株油茶病害拮抗真菌的鉴定、生物学特性及拮抗作用研究
2016-02-06李春琪傅本重李国元王立华湖北工程学院生命科学技术学院特色果蔬质量安全控制湖北省重点实验室湖北孝感432000
魏 蜜,路 露,李春琪,傅本重,李国元,王立华(湖北工程学院 生命科学技术学院/特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000)
1株油茶病害拮抗真菌的鉴定、生物学特性及拮抗作用研究
魏 蜜,路 露,李春琪,傅本重,李国元,王立华*
(湖北工程学院 生命科学技术学院/特色果蔬质量安全控制湖北省重点实验室,湖北 孝感 432000)
为了给油茶病害的生物防治提供科学依据,从油茶根部土壤分离获得1株能拮抗油茶主要病害的真菌F217-3。依据该菌株的形态特征,并结合全自动微生物鉴定系统及 rDNA-ITS序列分析,将其鉴定为草酸青霉(Peniciliumoxalicum)。对其生物学特性研究结果表明:该菌株在查氏培养基上生长最佳,碳源和氮源分别以蔗糖和尿素最适宜,生长适温为28 ℃,致死温度为65 ℃,在pH值为3~10条件下均生长良好,其中最适pH值是4~7,通气与否对菌丝生长无明显影响,但光照24 h条件下菌丝生长较差。平板对峙试验结果表明,F217-3对油茶炭疽病菌(C.nicotianae)、油茶软腐病菌(A.camellia)、黑斑病菌(A.alternate)和溃疡病菌(B.dothidea)的抑菌率均达到90%以上,可抑制油茶胶孢炭疽病菌、黑斑病菌分生孢子产生,抑制或致畸油茶炭疽病菌、溃疡病菌和叶斑病菌菌丝,是一株具有广谱拮抗作用的生防菌株。
草酸青霉; 鉴定; 生物学特性; 油茶病害; 拮抗作用
油茶(Camelliaoleifera)属山茶科(Theaceae)山茶属(Camellia),是我国南方特有的一种木本油料树种[1]。油茶全身都是宝,种子是优质、高级食用油的原料;茶油在医药、工业上应用广泛;茶枯也是优质的有机肥料,提取后的固体残渣可作为猪的精饲料。因此,油茶具有很好的应用开发前景,是我国重要的经济作物之一。
随着我国南方各地油茶种植面积逐年增加,各类油茶病害也日趋严重。油茶炭疽病、叶枯病、软腐病是由病原物引起的3种毁灭性病害,在我国各油茶产区普遍发生[2]。同样,油茶其他病害如根腐病、茶饼病、黑斑病、溃疡病等也时常发生,每年油茶产业因病害造成了巨大的经济损失。寻求安全、高效和经济的生物源农药是防治油茶病害的当务之急,其中拮抗微生物在植物病害生物防治中起到十分重要的作用。
在植物病害的生物防治中研究和应用较多的微生物主要有细菌类、真菌类和放线菌。真菌类主要有哈茨木霉、康宁木霉、青霉、丝核菌、酵母菌等。Melgarejo等[3]报道了从桃枝条分离的产紫青霉(Penicilliumpurpurogenum)对桃褐腐病原菌的防治效果;申光辉等[4]筛选到灰黄青霉(Penicilliumgriseofulvum)和土曲霉(Aspergillusterreus)2种拮抗真菌,其对草莓根腐病有较强的拮抗作用;王国平等[5]从南方红豆杉分离到一种新内生真菌紫杉木霉(Trichodermataxi),该内生真菌通过菌丝缠绕附着等重寄生方式,导致水稻纹枯病菌菌丝断裂或其内含物降解直至死亡;另外,也有采用生物农药草酸青霉水剂防治玉米小斑病的研究报道[6]。然而,关于利用青霉菌防治油茶主要病害的研究及应用报道很少,且尚未见对油茶黑斑病和油茶溃疡病2种病害进行防治的报道。
本研究从植物根际土壤分离筛选获得对油茶多种主要病害病原菌具有广谱拮抗作用的生防青霉菌,对该生防菌株进行生理生化鉴定、分子鉴定和生物学特性研究,并通过平板对峙试验研究该拮抗真菌对油茶炭疽病菌、油茶溃疡病菌、油茶黑斑病菌等多种病原菌的拮抗作用,以期为油茶病害的无公害防治提供理论基础和参考依据。
1 材料和方法
1.1 材料
1.1.1 菌株来源 油茶炭疽病菌(Colletotrichumnicotianae)、油茶胶胞炭疽病菌(C.gloeosporioides)、油茶叶斑病菌(Phyllostictacapitalensis)、油茶软腐病菌(Agaricodochiumcamellia)、油茶黑斑病菌(Altermariaalternate)、油茶溃疡病菌(Bothyosphaeriadothidea)分离自湖北孝感大悟油茶林地,所有菌株均保藏于湖北工程学院特色果蔬质量安全控制湖北省重点实验室。
1.1.2 主要试剂、仪器和分析软件 试剂:蛋白胨、酵母粉、氯化钠、琼脂、DNA 凝胶回收试剂盒、PCR反应用的各种试剂均购自上海生工生物工程有限公司。气相色谱系统:美国Agilent 6890N 型,包括全自动进样装置、石英毛细管柱及氢火焰离子化检测器;分析软件:美国MIDI 公司开发的基于微生物细胞脂肪酸成分鉴定的全自动微生物鉴定系统Sherlock MIS 4.5和LGS 4.5软件。
1.1.3 培养基 菌株分离和筛选培养基为PDA培养基:称取马铃薯 200 g,去皮,切成小块煮沸30 min,2层纱布过滤后加入葡萄糖20 g,融化后补足水至1 000 mL,加入琼脂 15~20 g,自然pH值,121 ℃高压灭菌20 min。生物学特性研究供试培养基5种[7]:Ⅰ.马铃薯蔗糖培养基(PSA):马铃薯200 g、蔗糖20 g、琼脂20 g、蒸馏水1 000 mL;Ⅱ.燕麦培养基(OA):燕麦片30 g、琼脂20 g、蒸馏水1 000 mL; Ⅲ.清水洋菜培养基(WA):琼脂20 g、蒸馏水1 000 mL; Ⅳ.玉米粉培养基(CMM):玉米粉40 g、蔗糖10 g、琼脂20 g、蒸馏水1 000 mL;Ⅴ.查氏培养基(CA):蔗糖30 g、硝酸钠3 g、氯化钾0.5 g、硫酸铁0.01 g、硫酸镁0.5 g、磷酸二氢钾1 g、琼脂20 g、蒸馏水1 000 mL。
1.2 拮抗菌的分离及筛选
于2014年10月从湖北省孝感市油茶苗木基地(油茶品种为长林2号)采集病株和健康株根际土壤。采用稀释分离法[8]从油茶根部土壤分离拮抗真菌,用三步划线法进行分离纯化,分离到20株菌株统一编号登记如下:F217-1、F217-2、F217-3、…、F217-20。菌种保藏:接种斜面后,可在4 ℃短暂保藏;用体积分数为50%的甘油作为保护剂,可在-80 ℃长久保藏。
初筛:采用平板对峙法[9]筛选其中能拮抗油茶病原菌的真菌,将直径为7 mm的油茶炭疽病菌菌饼和拮抗菌菌饼放置平板中心线上,分别距离平板中心1.5 cm,置于28 ℃恒温培养箱培养,3~5 d后观察抑菌带有无及大小,每个处理重复3次。复筛:将初筛有拮抗作用的菌株经液体培养基培养48 h后,10 000 r/min 室温离心20 min,用0.22 μm的微孔滤膜过滤除去菌体,取拮抗菌滤液与灭菌后约50 ℃的PDA固体培养基按照1∶19的比例混匀后倒入培养皿,冷却后在平板中央放入直径为7 mm的油茶病原菌菌饼,以无菌水处理为对照,每个处理3次重复,5 d后测量病原菌菌落直径。
1.3 拮抗菌的鉴定
1.3.1 拮抗菌的形态特征和生物学特性研究 将纯化后的菌种转接到PDA平板上,置于28 ℃条件下培养24 h后,对菌落形态、颜色、基质颜色等形态特征进行鉴定,并依据傅本重等[10]的方法对拮抗菌进行生物学特性研究。
1.3.1.1 培养基 沿 PSA 培养基上培养5 d 的拮抗菌菌落边缘打取菌龄一致的菌饼(直径7 mm),分别接种在供试5种培养基平板中央,置于28 ℃培养。培养6 d后用目测法测量菌落面积占整个平皿面积的百分数,每个处理 5皿,试验重复2次(下同)。
1.3.1.2 碳源 以查氏培养基为基础,以不加碳源为对照,用含有等量碳的多种碳源(葡萄糖、麦芽糖、淀粉)代替查氏培养基中的蔗糖,配制成不同碳源的固体培养基,对拮抗菌进行培养。
1.3.1.3 氮源 以查氏培养基为基础,以不加氮源为对照,用含有等量氮的多种氮源(硝酸铵、尿素)代替查氏培养基中的硝酸钠,配制成不同氮源的固体培养基,对拮抗菌进行培养。
1.3.1.4 温度 设置5、13、21、28、37 ℃共5 个温度,在PSA 培养基上分别培养。
1.3.1.5 致死温度 移取直径7 mm 的菌丝块至无菌EP管中,加入1.5 mL无菌水后分别置于40、45、50、55、60、65、70、75、80 ℃的水浴锅中水浴10 min,取出后立即在冰水中冷却至室温。将处理后的菌丝块接种到 PSA 平板中央,置于28 ℃培养箱培养。
1.3.1.6 pH值 将PSA培养基的pH值分别设为3、4、5、6、7、8、9、10共8个梯度。将菌龄相同的菌饼接种到 PSA 平板中央,置于28 ℃培养箱培养。
1.3.1.7 光照和通气 分别设置4种不同光照条件(光/暗,h): 0/24、8/16、16 /8、24/0 。不通气条件下用Parafilm封口,通气条件下培养皿不封口。将菌龄相同的菌饼接种到 PSA 平板中央,置于28 ℃培养箱培养。
1.3.2 拮抗菌的rDNA-ITS分析 拮抗菌的DNA提取参考何月秋[11]的方法。采用上海生工生物工程有限公司生产的PCR扩增试剂盒(No: B639297)进行PCR反应,引物使用真菌的通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAA-3′),由上海生工生物工程有限公司合成。PCR反应总体系为50 μL,反应液为:DNA 1 μL、ITS4和ITS5各2 μL、Mix 25 μL、双蒸水20 μL。 PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共设35个循环;最后72 ℃延伸10 min,4 ℃保存。扩增产物用1.0%的琼脂糖凝胶进行电泳,通过凝胶成像系统显示记录电泳结果。PCR产物委托天一辉远生物科技有限公司进行纯化和测序。
1.3.3 运用全自动微生物鉴定系统进行鉴定 脂肪酸的提取和气相色谱检测参考Fernandes等[12]和蓝江林等[13]的方法。抽提后的脂肪酸样品通过Agilent 气相色谱仪进行检测。在下述色谱条件下平行分析脂肪酸甲酯混合物标样和待检样本:二阶程序升高柱温,170 ℃起始,5 ℃/min 升至260 ℃,而后40 ℃/min 升温至310 ℃,维持90 s;汽化室温度250 ℃,检测器温度300 ℃;载气为氢气(2 mL/min),尾吹气为氮气(30 mL/min);柱前压10.00 psi(1 psi=6.895 kPa);进样量1 μL,进样分流比100∶1。
1.4 拮抗菌的拮抗效果测定
采用平板对峙法分析拮抗菌对油茶主要真菌病害的拮抗作用[9],同1.2中步骤,以PDA培养基块代替拮抗菌菌饼为对照。抑菌率=(对照菌落直径-处理菌落直径) /(对照菌落直径-7)×100%。
2 结果与分析
2.1 拮抗菌筛选结果
以实验室保藏的油茶炭疽病菌为指示菌,分离得到的菌株为待检菌,采用平板对峙法筛选其中能拮抗油茶病原菌的真菌,初筛共获得3株有拮抗效果的菌株:F217-1、F217-3、F217-15。同时采用液体培养法复筛,最后获得1株拮抗效果明显且稳定的拮抗菌F217-3。
2.2 拮抗菌鉴定结果
F217-3在PDA培养基上菌落圆形,边缘白色,孢子形成后菌落呈黄绿至深绿色;其显微形态显示,分生孢子梗直立、无色、有分隔,分生孢子球形至椭圆形、无色至着色、光滑,大小为(4~6) μm×(2~4 ) μm;常为链状生长(图1)。
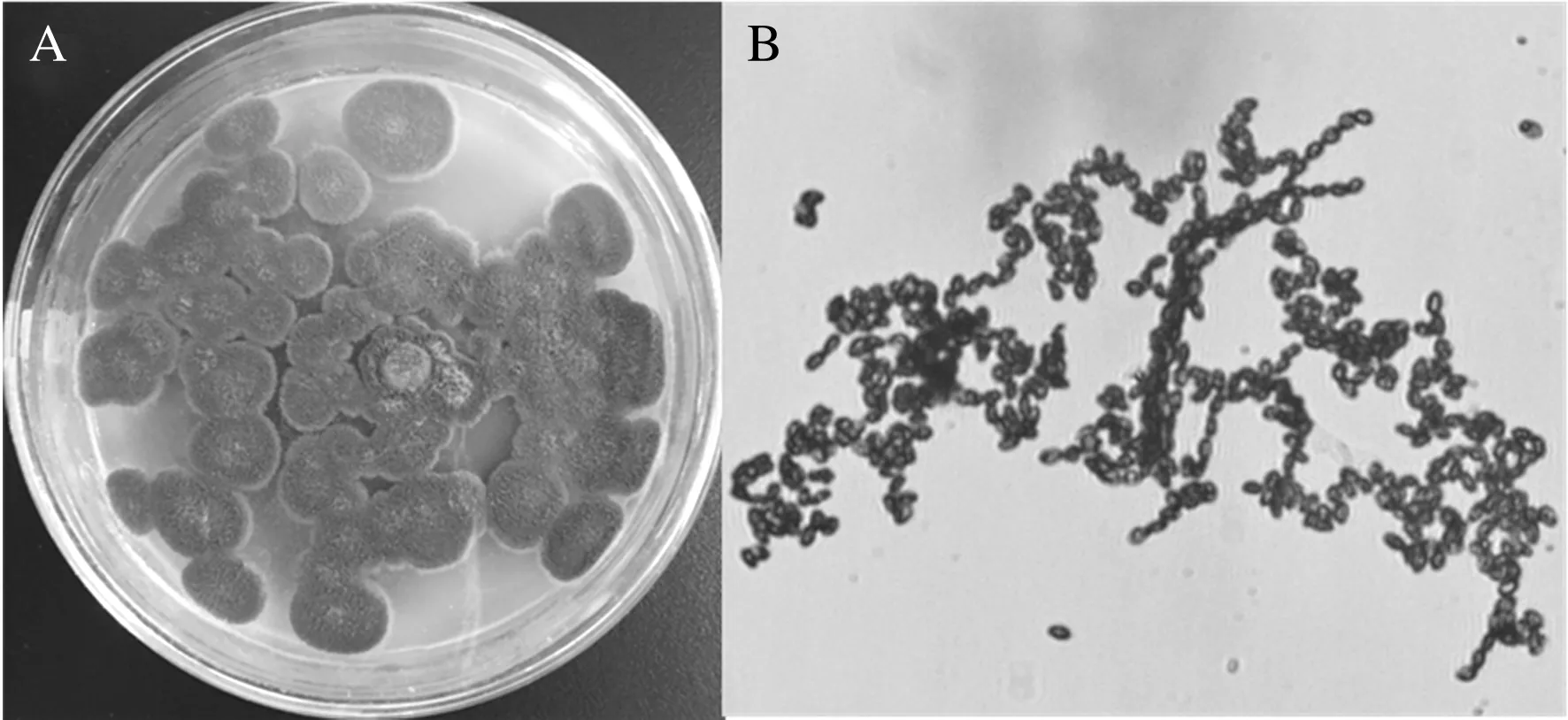
图1 菌株F217-3菌落形态(A)和显微形态(B)
对菌株F217-3进行脂肪酸成分分析,并与全自动微生物鉴定系统LGS 4.5软件的FUNGI 3.80库中数据比对,与之相似性指数最高的是Penicillium-species-GC subgroup A 和Penicillium-came-mbertii,相似性指数分别为0.710和0.697,该结果表明菌株F217-3可能为青霉属。
对菌株F217-3进行分子鉴定,将测得的rDNA-ITS序列(长度为680 bp)与GenBank中已知序列进行比对,选取9株菌株用ClustalX 2.1 进行多序列比对分析,利用MEGA 6.0 软件采用邻接法进行系统发育树构建和聚类分析。如图2所示,菌株F217-3与GenBank中登录号为KP780809.1和EF103451.1菌株的同源性达到100%,聚在同一分支。结合上述形态和部分生理生化特征,可初步判定拮抗菌F217-3属于草酸青霉,并将其命名为PeniciliumoxalicumF217-3。

图2 菌株F217-3 rDNA-ITS序列聚类分析
2.3 拮抗菌的生物学特性
2.3.1 最佳培养基 草酸青霉菌在不同培养基上的菌落生长情况如表1所示,结果表明,该青霉菌在CA培养基上生长最好,菌落最大,其次是PSA培养基,其在WA培养基上不生长。
2.3.2 最佳碳源 草酸青霉菌在不同碳源培养基上的菌落生长情况如表2所示,结果表明,该菌株在无碳源的培养基上菌落稍小,菌丝稀疏,菌落颜色不深,在以蔗糖、麦芽糖、葡萄糖和淀粉为碳源的培养基上生长状况都很好,其菌落生长速率及菌丝密集程度无明显差异。
2.3.3 最佳氮源 草酸青霉菌在不同氮源培养基上的菌落生长情况如表3所示, 其在以尿素为氮源的培养基上菌落最大,生长速率最高;在无机氮源硝酸钠和硝酸铵培养条件下生长较差,而在无氮源的情况下生长最差。

表1 不同培养基对青霉菌生长的影响 %
注:菌落面积百分比=该菌落在平板上的总面积/平板面积×100%,生长速率=菌落面积百分比/培养时间;同行不同字母表示差异显著。下同。

表2 不同碳源对青霉菌生长的影响 %

表3 不同氮源对青霉菌生长的影响 %
2.3.4 最佳温度 如表4所示,草酸青霉菌在28 ℃培养条件下菌落生长速率最高,生长状况最佳,在37 ℃和21 ℃条件下生长次之,其也可在13 ℃的低温状态下缓慢生长,但是在5 ℃条件下已经不能生长。

表4 温度对青霉菌生长的影响 %
2.3.5 最佳pH值 如表5所示,草酸青霉菌耐受pH值范围广,在pH值3~10条件下均生长良好,其最适pH值范围是4~7,在pH值为3和8时生长次之,在pH值为9和10条件下生长相对较差,且菌落稀疏,颜色较淡。

表5 pH值对青霉菌生长的影响 %
2.3.6 致死温度 结果表明,草酸青霉菌在40~60 ℃的温度范围内水浴后均生长良好,但在65 ℃水浴处理后不生长,表明该青霉菌致死温度为65 ℃,相对一般真菌致死温度为40~55 ℃,其有耐高温的优势[14-15]。
2.3.7 光照和通气 结果表明,通气与否对草酸青霉菌菌丝生长无明显影响。在光照为0、8、16 h条件下青霉菌菌丝生长较好,但光照24 h条件下菌丝生长较差,说明24 h昼夜全部光照条件不利于菌丝生长。
2.4 拮抗菌与多种油茶病原菌的体外互作
2.4.1 F217-3对油茶病原菌菌落生长的影响 图3显示,在对峙过程中PeniciliumoxalicumF217-3生长旺盛,几乎完全抑制了油茶炭疽病菌的生长。通过测量对照及对峙过程中病原菌菌落的直径(表6)发现,PeniciliumoxalicumF217-3对油茶炭疽病菌、软腐病菌、黑斑病菌和溃疡病菌的抑菌率均达到90%以上,尤其是对油茶炭疽病菌、溃疡病菌和黑斑病菌拮抗效果显著。

A为对峙状态下F217-3与炭疽病菌的生长状况; B为对照图3 菌株F217-3对油茶炭疽病菌的拮抗作用
2.4.2 F217-3对油茶病原菌形态的影响 在平板对峙试验中,分别挑取PDA平板上未接F217-3菌饼的病原菌和已接F217-3菌饼的病原菌相同位置的菌丝置于显微镜下观察,结果如图4和图5所示。拮抗菌F217-3能抑制炭疽病菌、溃疡病菌和叶斑病菌菌丝的生长,正常生长的病原菌菌丝丰富、光滑(图4A、4C、4E),F217-3的孢子可分别包围和散落在炭疽病菌、溃疡病菌和叶斑病菌菌丝周围,拮抗后的菌丝变细、畸形、断裂,菌丝数量明显减少(图4B、4D、4F)。拮抗菌F217-3可充分抑制胶孢炭疽病菌和黑斑病菌孢子的产生,病原菌正常生长状态下有大量孢子散落在菌丝周围(图5A和5C),经过F217拮抗作用后,胶孢炭疽病菌和黑斑病菌的孢子产生量极少甚至被完全抑制(图5B和5D)。虽然拮抗菌F217-3可以抑制油茶软腐病菌菌落生长,但在显微镜下并没有观察到该菌对软腐病菌菌丝和孢子产生明显的致畸和抑制作用。
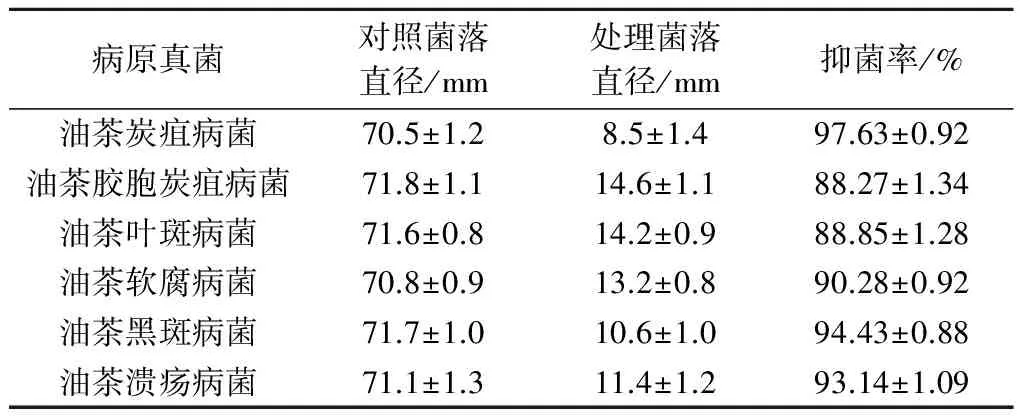
表6 菌株F217-3对油茶主要病原菌的抑制效果
3 结论与讨论
目前对油茶主要病害普遍通过种植抗性品种和化学防治来控制,但有害生物抗性问题日益严重,化学农药残留也造成多种危害,污染环境,对人类健康和生态环境存在较大威胁,不利于油茶产业的健康可持续发展[2]。本试验从油茶植株根际土壤筛选对油茶主要病害病原菌有拮抗作用的生防菌株,最终获得1株能同时高效拮抗油茶多种病原菌的草酸青霉F217-3,草酸青霉作为拮抗菌株防治油茶病害在国内外的生物药剂中鲜有报道,这对油茶病害的生物防治具有重要意义。

A、C和E为正常生长状态下炭疽病菌、叶斑病菌和溃疡病菌的菌丝形态,B、D和F为受到F217-3拮抗过程中炭疽病菌、叶斑病菌和溃疡病菌的菌丝形态图4 菌株F217-3对油茶炭疽病菌、叶斑病菌和溃疡病菌形态的影响
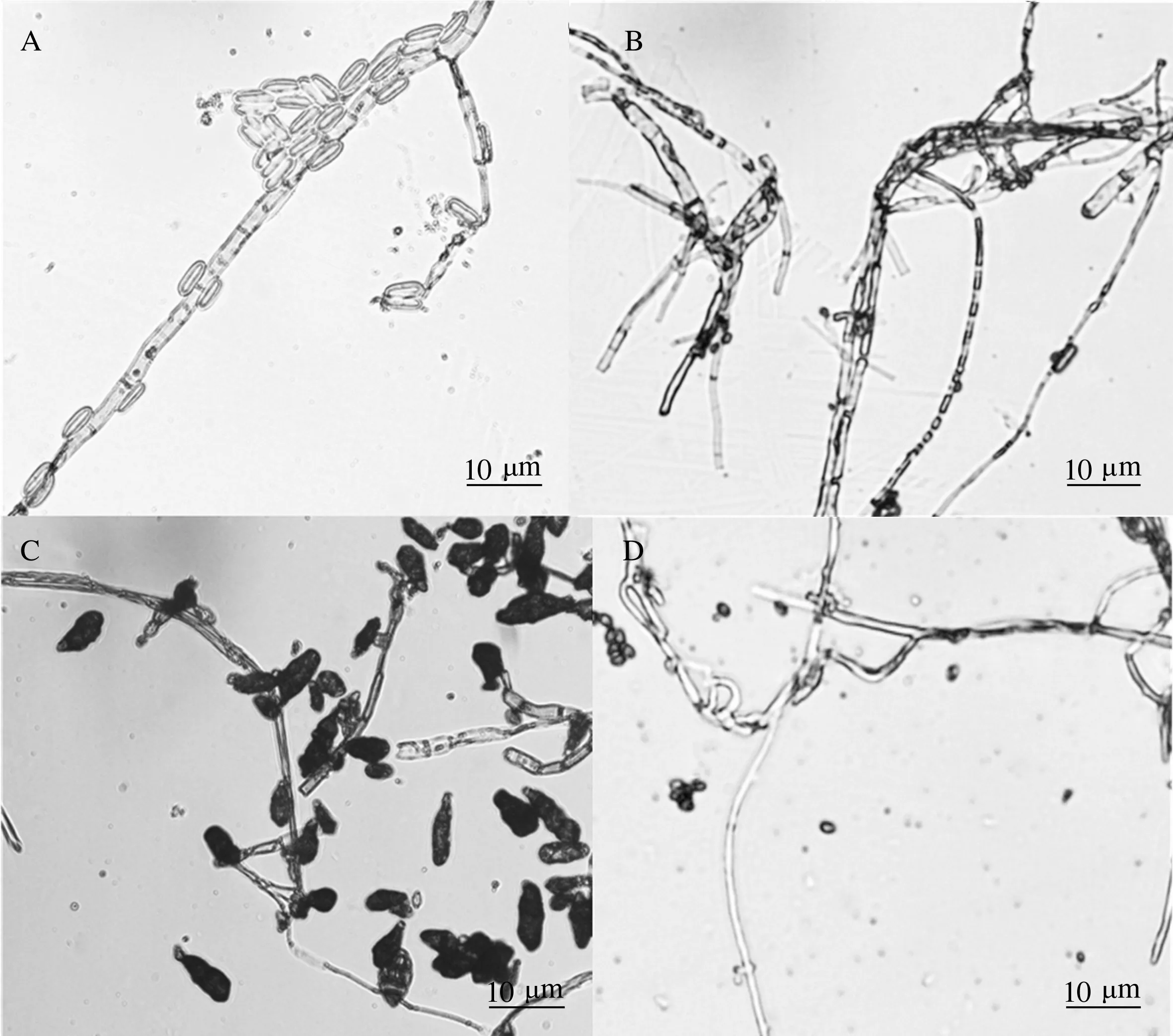
A和C为正常生长状态下胶孢炭疽病菌和黑斑病菌的菌丝和孢子形态,B和D为受到F217-3拮抗过程中胶孢炭疽病菌和黑斑病菌的菌丝和孢子形态图5 F217-3对胶孢炭疽病菌和黑斑病菌形态的影响
脂肪酸是生物体内不可缺少的能量和营养物质,是生物体的基本结构成分之一,已被成功用于细菌属、种和亚种的鉴定[16],如葡萄球菌属(Staphylococcus)含有19:0ISO、19:0ANTEISO 和C20:0 而区别于微球菌属(Micrococcus)[17]。本试验通过采用MIDI全自动微生物鉴定系统与数据库中的菌体脂肪酸图谱相比较发现,与F217-3相似性指数最高的均为青霉属,但鉴定结果未能确定到种。因此,又通过rDNA-ITS序列分析对F217-3进一步鉴定,结果表明,F217-3与P.oxalicumstrain BGPUP4和P.oxalicumstrain PO2 两种菌株同源性极高,因此确定该拮抗菌株为草酸青霉。
草酸青霉属半知菌亚门真菌,其中草酸青霉溶磷菌株有较强溶解多种无机磷的能力和促进作物生长的作用[18]。植物病害生物防治中,在平板培养基上对病原菌抑制作用最强的菌株在田间防治病害的能力并不一定最强,拮抗菌实际发挥的作用还与环境条件、土壤理化性状、土壤营养状况、土著微生物菌群及其多样性等因素密切相关[19]。有研究表明,利用草酸青霉水剂作为生物农药防治玉米小斑病取得了较好效果[6],田间处理剂量为稀释50 倍时,对玉米小斑病的防效在88%~90.6%,且对供试作物安全,这为草酸青霉应用于油茶病害防治提供了借鉴。在试验中还发现,草酸青霉无菌发酵液具有纤维素酶和果胶酶活性,说明该草酸青霉能分泌纤维素酶和果胶酶等降解酶系,这与彭霞薇等[20]研究结果一致,这些酶系可降解病原微生物的细胞壁,显著抑制病原物的生长繁殖,可能是该草酸青霉对油茶多种病害具有拮抗作用的原因之一。在后续工作中,该草酸青霉对油茶病害的拮抗作用机制、拮抗物质基础及如何有效地将该菌作为生防菌剂应用到油茶产业中还需进一步深入研究。
[1] 庄瑞林.中国油茶[M].2版.北京:中国林业出版社,2008:1-2.
[2] 束庆龙,张良富.中国油茶栽培与病虫害防治[M].北京:中国林业出版社,2009:147-148.
[3] Melgarejo P,De Cal A,M.-Sagasta E.Influence ofPenicilliumfrequentansand two of its antibiotics on production of stromata byMonilinialaxain culture[J].Canadian Journal of Botany,1989,67(1): 83-87.
[4] 申光辉,薛泉宏,张晶,等.草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J].中国农业科学,2012,45(22):4612-4626.
[5] 王国平,鲁书玲,郑必强,等.内生真菌紫杉木霉ZJUF0986菌株及其活性代谢产物防治水稻纹枯病的效果[J].中国生物防治,2009,25(1):30-34.
[6] 王勇,张文革,何璐,等.生物农药草酸青霉水剂对玉米小斑病的防治效果[J].安徽农业科学,2007,35(7):1965-1966.
[7] 范秀容,沈萍,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999:67-72.
[8] 郑琪,徐秉良,薛应钰,等.杏采后病害病原拮抗菌的分离筛选及鉴定[J].植物保护,2013,39(4):34-39.
[9] 高园园,胡秀芳.半夏软腐病内生拮抗真菌的筛选及鉴定[J].山东农业科学,2013,45(11):103-106.
[10] 傅本重,杨敏,李国元,等.滇楸叶斑病病原菌的生物学特性及其抑菌药剂筛选[J].华中农业大学学报,2013,32(6):65-69.
[11] 何月秋.真菌菌丝体培养和提取DNA方法的改进[J].菌物系统,2000,19(3):434.
[12] Fernandes M F,Saxena J,Dick R P.Comparison of whole-cell fatty acid (MIDI) or phospholipid fatty acid (PLFA) extractants as biomarkers to profile soil microbial communities[J].Microbial Ecology,2013,66(1): 145-157.
[13] 蓝江林,刘波,朱育菁,等. 水葫芦内生细菌脂肪酸生物标记特性研究[J].生态毒理学报,2010,5(2):242-254.
[14] 傅本重,张智慧,王立华,等.地涌金莲一种新病害病原菌特性研究[J].云南农业大学学报(自然科学版),2014,29(3):347-352.
[15] Michailides T J,Ogawa J M.Effects of high temperatures on the survival and pathogenicity of propagules ofMucorpiriformis[J].Phytopathology,1989,79(5): 547-554.
[16] 刘志辉,蔡杏姗,竺澎波,等.应用气相色谱技术分析全细胞脂肪酸快速鉴定分枝杆菌[J].中华结核和呼吸杂志,2005,28(6):403-406.
[17] Coloe P J,Slattery J F,Cavanaugh P,etal.The cellular fatty acid composition ofCanpylobacterspecies isolated from cases of enteritis in man and animals[J].Journal of Hygiene,1986,96(2):225-229.
[18] 范丙全,金继运,葛诚.溶磷草酸青霉菌筛选及其溶磷效果的初步研究[J].中国农业科学,2002,35(5):525-530.
[19] 刘邮洲,陈志谊,梁雪杰,等.番茄枯萎病和青枯病拮抗细菌的筛选、评价与鉴定[J].中国生物防治学报,2012,28(1):101-108.
[20] 彭霞薇,谢响明,白志辉,等.草酸青霉BZH-2002 产果胶酶特性研究[J].生物技术,2005,15(6):27-30.
Identification of Antagonistic Fungus toCamelliaDiseases and Study of Biological Characteristics and Antagonism Effect
WEI Mi,LU Lu,LI Chunqi,FU Benzhong,LI Guoyuan,WANG Lihua*
(College of Life Science and Technology,Hubei Engineering University/Hubei Key Laboratory of Quality Control of Characteristic Fruits and Vegetables,Xiaogan 432000,China)
In order to provide scientific basis for the biocontrol ofCamelliadiseases,a strain of fungus was isolated from soil ofCamelliaroot which could antagonize majorCamelliadiseases.Following morphological characteristics and quantificational analysis by gas chromatography using the Sherlock microbial identification system(MIDI),combining with the result of the rDNA-ITS sequence analysis,it was identified asP.oxalicumand namedP.oxalicumF217-3.The results indicated that F217-3 grew best in CA medium,sucrose and urea were the suitable carbon and nitrogen resource respectively.The strain grew best under 28 ℃,and the lethal temperature was 65 ℃.Although the mycelium could grow at pH 3 to 10,pH of 4 to 7 was optimal.Ventilation had no significant effect on the growth of penicillium mycelium,but 24 h light was not beneficial to the mycelial growth.Moreover,the inhibition rates of F217-3 against the mycelia growth of majorCamelliapathogens were higher than 90%.It was observed that F217-3 could inhibit the spore germination ofC.gloeosporioidesandA.alternate,and also inhibit and defect the hyphae ofC.nicotianae,B.dothideaandP.capitalensis.The results showed that F217-3 was a biocontrol strain with broad-spectrum antagonism.
Peniciliumoxalicum; identification; biological characteristics;Camelliadiseases; antagonism effect
2015-12-24
湖北省教育厅中青年人才资助项目(Q20152707);湖北省教育厅重点项目(D20102704);国家自然科学基金项目(31200488);特色果蔬质量安全控制湖北省重点实验室开放基金重点资助项目(2016K07);湖北省自然科学基金项目(2013CFC004)
魏 蜜(1987-),女,湖北孝感人,讲师,博士,主要从事微生物学和植物病害防治研究。 E-mail:weimi555@163.com
*通讯作者:王立华(1963-),男,湖北天门人,教授,博士,主要从事微生物学教学与研究。E-mail:lwang@hbeu.edu.cn
S435.659
A
1004-3268(2016)08-0074-07
