以蝴蝶兰种子萌发的原球茎为受体的遗传转化体系构建
2016-02-06张和臣董晓宇王利民孟月娥符真珠李艳敏河南省农业科学院园艺研究所河南郑州450002
张和臣,董晓宇,王利民,张 晶,孟月娥,符真珠,李艳敏(河南省农业科学院 园艺研究所,河南 郑州 450002)
以蝴蝶兰种子萌发的原球茎为受体的遗传转化体系构建
张和臣,董晓宇,王利民*,张 晶,孟月娥,符真珠,李艳敏
(河南省农业科学院 园艺研究所,河南 郑州 450002)
以蝴蝶兰种子萌发的原球茎为试材,研究了蝴蝶兰遗传转化过程中不同植物生长调节剂、抗生素对蝴蝶兰原球茎增殖和转化效率的影响,并对转基因后代进行了检测。结果表明,适用于蝴蝶兰原球茎的增殖培养基,即蝴蝶兰原球茎遗传转化的共培养培养基配方为:3.0 g/L花宝1号+2.0 g/L活性炭+2.0 g/L水解酪蛋白+15 g/L蔗糖+3.0 mg/L 6-BA+0.6 mg/L 2,4-D+6.5 g/L琼脂,pH=5.5~5.6;适用于蝴蝶兰遗传转化过程中的筛选培养基配方为:增殖培养基+8.0 mg/L 潮霉素+50 mg/L 头孢霉素,pH值为5.5~5.6。蝴蝶兰转基因后代的PCR分子检测及GUS活性组织化学检测结果表明,外源基因成功整合到了蝴蝶兰基因组中。
蝴蝶兰; 原球茎; 遗传转化
蝴蝶兰(Phalaenopsisspp.)花型奇特,花色亮丽,因花型似蝴蝶而得名,是重要的盆栽花卉种类。在自然界中,目前尚未见具有蓝色、香味等观赏性状的蝴蝶兰资源。因此,育种者不能通过传统的杂交手段获得具有蓝色、花香的品种。当前,转基因育种在作物抗病、抗虫、抗除草剂等性状改良上已经获得了成功[1];在月季、非洲菊、康乃馨等花卉的花色改良上也取得了重大突破[2]。因此,转基因育种也是将来获得具有香味、蓝色等性状蝴蝶兰品种的优先方法。
转基因育种方法虽然具有育种目的明确、育种时间短等优点,但是在一些植物转基因具体实施中,经常被受体材料所制约。适宜的受体材料有助于加快植物的遗传转化及转基因植物的成功培育。针对蝴蝶兰的转基因育种,体细胞胚、类原球茎及原球茎理论上都可以作为遗传转化的受体材料。但是,体细胞胚、类原球茎的获得方式主要通过茎尖、茎段、叶片、根尖、根段、腋芽等外植体的诱导[3-6],而在诱导过程中,常存在褐变、诱导率低等问题。因此,蝴蝶兰转基因育种实践中,以体细胞胚或类原球茎作为受体材料具有一定的局限性。另外,在以体细胞胚或类原球茎为受体材料进行转基因操作时,还存在转染率低的缺陷[7-8]。因此,找到一种适宜于蝴蝶兰遗传转化的受体,即建立适用于蝴蝶兰的遗传转化体系对于利用基因工程手段进行蝴蝶兰的遗传改良具有重要意义。鉴于此,以蝴蝶兰种子萌发的原球茎为受体材料,通过原球茎的增殖培养、抗生素筛选,并利用农杆菌侵染法对受体材料进行遗传转化,建立蝴蝶兰的遗传转化体系,可为今后通过基因工程手段进行蝴蝶兰的遗传改良提供借鉴。
1 材料和方法
1.1 供试材料
供试蝴蝶兰品种为红龙,种子由蝴蝶兰自交获得。所用重组农杆菌菌株为GV3101,内含有质粒表达载体pCAMBIA1303-VwF3′5′H。三色堇蓝色花瓣关键基因VwF3′5′H(收录号:AB332097)的的克隆参照NCBI数据库全长序列,通过RT-PCR方法整合到pCAMBIA1303载体,并由CaMV35S启动子启动。
1.2 方法
1.2.1 蝴蝶兰种子萌发及原球茎增殖培养 蝴蝶兰种子萌发培养基为:3.0 g/L花宝1号+2.0 g/L活性炭+2.0 g/L水解酪蛋白+15 g/L蔗糖+2.0 mg/L 6-BA+0.2 mg/L NAA+6.5 g/琼脂,pH=5.5~5.6。种子萌发60~90 d后形成的原球茎(0.3~0.5 cm)用于后续增殖培养试验。
原球茎增殖培养的基本培养基为:3.0 g/L花宝1号+2.0 g/L活性炭+2.0 g/L水解酪蛋白+15 g/L蔗糖。植物生长调节剂选用2,4-D、6-BA和TDZ,设置12种配方组合进行试验,具体处理组合如表1所示。每瓶培养基中接种10粒蝴蝶兰原球茎,每个处理重复5瓶。统计指标及计算公式为:增殖系数=增殖的切块数/接种总数×100%,其中,增殖的切块数为产生新原球茎或愈伤组织的切块数。
进一步对2,4-D和6-BA的质量浓度进行优化。2,4-D质量浓度分别设为0.4、0.6、0.8 mg/L,6-BA质量浓度分别设为1.0、3.0、5.0 mg/L,共9个处理。统计指标及计算公式如下:原球茎增殖率=增殖形成新原球茎的切块数/接种总数×100%。
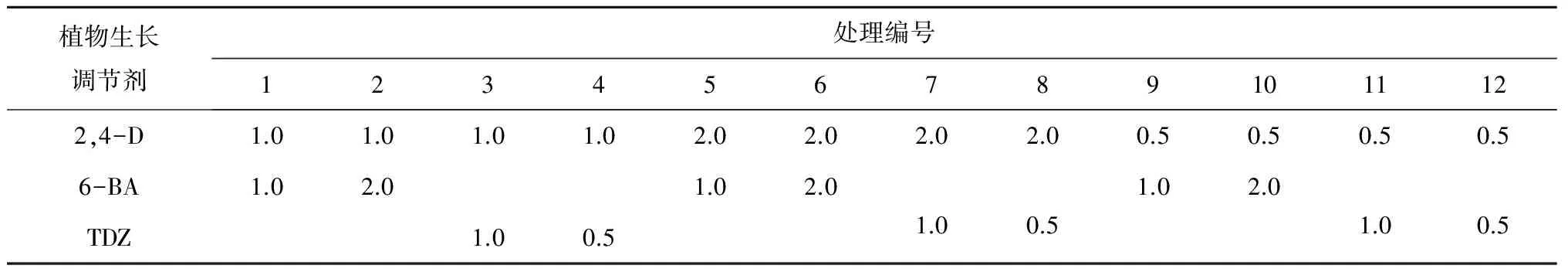
表1 不同植物生长调节剂种类及质量浓度处理组合 mg/L
以上原球茎萌发及增殖培养的条件为:日温25 ℃、夜温17 ℃、光强3 000 lx、日光照16 h,培养时间60~90 d。
1.2.2 蝴蝶兰原球茎增殖抗生素筛选培养 为了获得蝴蝶兰原球茎在遗传转化试验中最佳的抗生素种类及质量浓度,进行硫酸卡那霉素(Kan)、潮霉素(Hyg)、头孢霉素(Cef)的抗性筛选试验。Kan抗性筛选:将原球茎切块后分别接入含Kan为0、10、50、100 mg/L的增殖培养基中进行筛选。Hyg抗性筛选:将原球茎切块后分别接入含Hyg为1.0、3.0、5.0、8.0、10.0 mg/L的增殖培养基中进行筛选。Cef抗性筛选:将原球茎切块后分别接入含Cef为50、100、200、300 mg/L的增殖培养基中进行筛选,以获得适宜的抑制农杆菌生长的Cef质量浓度。
每瓶培养基中接种14粒蝴蝶兰原球茎,每个处理重复5瓶。在日温25 ℃、夜温17 ℃、光强3 000 lx、日光照16 h的培养室中培养。培养30 d后,观察统计各个处理的存活率。计算公式为:原球茎切块存活率=存活的切块数/接种总数×100%。
1.2.3 蝴蝶兰原球茎的遗传转化 将直径0.3~0.5 cm、长势优良的原球茎切成块,转接入预培养培养基中(同原球茎增殖培养基),预培养3 d后进行农杆菌侵染。本研究中重组农杆菌菌株为GV3101,侵染步骤如下:(1)从-80 ℃冰箱中取出重组农杆菌菌株,用接种针在含Kan(100 mg/L)、利福平(Rif,40 mg/L)的LB固体培养基上划线,置于培养箱中,在28 ℃条件下培养2~3 d至单菌落出现。(2)用接种针从平板上挑取单菌落,接种于5 mL含Kan(100 mg/L)、Rif(40 mg/L)的LB液体培养基中,28 ℃、180 r/min振荡过夜培养。(3)取上述菌液1 mL,添加到50 mL无抗生素的LB液体培养基中培养3~5 h,至菌液OD600=0.4~0.6;4 ℃条件下,2 500 r/min离心10 min,收集菌体;之后,用液体增殖培养基将菌体重新悬浮至OD600=0.4~0.6。(4)将蝴蝶兰原球茎切块,用悬浮的菌液侵染10~15 min;侵染完成后,将受体材料转移到无菌滤纸上晾干;然后转接入共培养培养基上(同增殖培养基),置于25 ℃条件下暗培养3 d。(5)共培养完成后,在筛选培养基上(增殖培养基+抗生素)进行筛选培养,期间每20 d左右更换一次培养基,直至增殖出现新的原球茎。
1.2.4 转基因植株的分子检测及GUS活性的组织化学检测 抗性材料PCR检测的上、下游引物分别为:5′-ACCTCAACTTCTCCAACCGC-3′、5′-GCTCCTTCACCATCTTCGTC-3′。PCR反应体系及步骤参照天根生化科技有限公司TaqPCR Mastermix的试剂盒进行。GUS活性的组织化学检测参照Jefferson等[9]的方法进行。以未经侵染的蝴蝶兰叶片为阴性对照(N)。
2 结果与分析
在接种60~90 d后,蝴蝶兰种子多数长成直径为0.3~0.5 cm左右的原球茎,少数分化成芽(图1)。选取长势一致、未分化成芽的优良原球茎用于增殖试验。

图1 蝴蝶兰种子萌发的原球茎
2.1 不同质量浓度2,4-D、6-BA和TDZ组合对蝴蝶兰原球茎增殖的影响
从表2和图2可以看出,在12种组合中,处理1、2、9、10、11和12的原球茎切块均在培养30 d时出现增殖现象。其中,处理9和10的原球茎增殖系数在30 d时已达到90%;而处理5、6、7、8不仅无愈伤组织及新的原球茎增殖发生,到60 d时甚至出现材料死亡现象。上述结果表明:原球茎增殖过程中2,4-D质量浓度过大(大于1.0 mg/L)不仅不利于原球茎的增殖,甚至会造成原球茎切块的死亡。2,4-D质量浓度为1.0 mg/L时,虽然在30 d的培养过程中也出现原球茎增殖现象,但增殖效率不及2,4-D质量浓度为0.5 mg/L时。因此,初步判断2,4-D质量浓度小于1.0 mg/L时对蝴蝶兰原球茎的增殖培养最有利。处理9、10中的组合为2,4-D+6-BA,在培养60 d后增殖系数达到95%;而处理11、12则是2,4-D和TDZ的组合,该组合虽然也具有较高的增殖系数(达到80%),但对比前2个组合而言效果稍差。因此,6-BA的分化增殖效果比TDZ好。以上试验表明,适用于蝴蝶兰原球茎增殖培养的植物生长调节剂组合为2,4-D和6-BA。
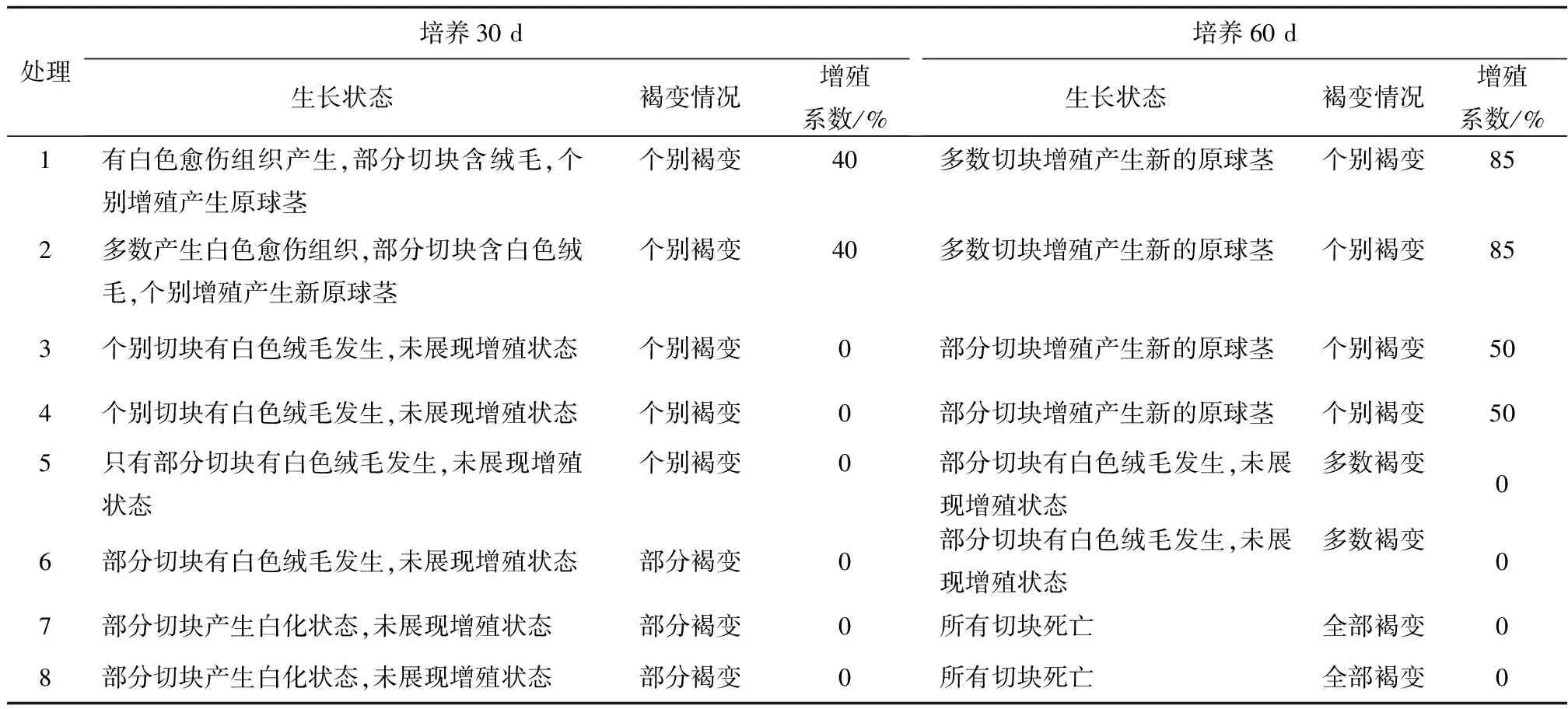
表2 不同质量浓度2,4-D、6-BA和TDZ组合对蝴蝶兰原球茎增殖的影响

续表2 不同质量浓度2,4-D、6-BA和TDZ组合对蝴蝶兰原球茎增殖的影响

图2 不同质量浓度2,4-D、6-BA和TDZ组合下蝴蝶兰原球茎的增殖情况
2.2 不同质量浓度2,4-D和6-BA组合对蝴蝶兰原球茎增殖的影响
根据2.1试验结果,进一步对6-BA和2,4-D的质量浓度进行优化。结果如表3所示,2,4-D质量浓度为0.4 mg/L时,个别原球茎呈现出芽分化状态,并且随着6-BA质量浓度的提高,增殖产生新原球茎的切块数也随之提高。当2,4-D质量浓度在0.6 mg/L时,增殖产生的原球茎以团块状为主,组合6-BA的质量浓度为3.0 mg/L时,原球茎切块的增殖率达到最大。当2,4-D质量浓度达到0.8 mg/L时,团块原球茎的增殖受到抑制,并且随着6-BA质量浓度的提高增殖率随之降低。因此,蝴蝶兰原球茎增殖培养的最佳植物生长调节剂组合为0.6 mg/L 2,4-D+3.0 mg/L 6-BA。根据以上试验结果,确定蝴蝶兰原球茎增殖的培养基配方为:3.0 g/L花宝1号+2.0 g/L活性炭+2.0 g/L水解酪蛋白+15 g/L蔗糖+3.0 mg/L 6-BA+0.6 mg/L 2,4-D+6.5 g/L琼脂,pH=5.5~5.6,该培养基配方适用于后续蝴蝶兰原球茎遗传转化过程中的共培养。

表3 不同质量浓度6-BA和2,4-D组合对蝴蝶兰原球茎增殖的影响
2.3 不同抗生素对蝴蝶兰原球茎存活率的影响
从表4可以看出,随着Kan质量浓度的升高,原球茎切块的存活率逐渐降低,当Kan达到100 mg/L时,原球茎的增殖受到严重抑制,存活率只有7.1%。在培养基中添加Hyg时,蝴蝶兰原球茎的切块存活也受到明显影响。当Hyg为3.0 mg/L时,存活率已低至30%以下;当Hyg为5.0~8.0 mg/L时,切块呈现出严重的生长受抑制现象;当Hyg为10.0 mg/L时,无切块存活。抗生素筛选结果表明,Kan和Hyg对原球茎的增殖均有抑制作用,但就抑制效果而言,Hyg优于Kan。Hyg在较低的质量浓度(5.0 mg/L)时即有很好的抑制效果,而Kan则需要较高的质量浓度(100 mg/L)才能达到抑制增殖的效果。因此,在蝴蝶兰的遗传转化上更适合以Hyg作为筛选剂。为了降低假阳性出现的概率,在筛选培养过程中选用Hyg 8.0 mg/L较为适宜。

表4 不同抗生素类型及质量浓度对蝴蝶兰原球茎存活率的影响
另外,由表4可知,在培养基中添加Cef时,蝴蝶兰原球茎的存活率随着Cef质量浓度的升高逐渐降低。当Cef达到200 mg/L时,对切块的增殖产生少许的抑制效果;当Cef为300 mg/L时,切块存活率降低程度已较为明显。由于抗生素的作用具有累加性,为了尽可能地减少Cef对切块增殖的影响,可选用50 mg/L的Cef用于筛选过程中的培养。综上,适合蝴蝶兰原球茎筛选的培养基为:增殖培养基+8.0 mg/L Hyg+50 mg/L Cef,pH=5.5~5.6。
2.4 蝴蝶兰转基因后代的分子及GUS活性组织化学检测
本研究利用蝴蝶兰种子萌发的原球茎进行遗传转化,共培养选用增殖培养基,筛选培养选用增殖培养基+8.0 mg/L Hyg+50 mg/L Cef,经过持续筛选,最后获得具有Hyg抗性的蝴蝶兰分化植株11株,提取其基因组DNA,进行PCR检测。结果表明,用于PCR检测的转基因后代中(1~11)都能获得与目的基因片段大小相同的条带,而阴性对照不能获得扩增(图3)。进一步对转基因后代进行GUS活性组织化学检测,以确定外源基因是否能够正常表达。结果表明,转基因后代都能检测到GUS的活性。以上试验证明,外源基因VwF3′5′H已经成功整合到了蝴蝶兰基因组中。
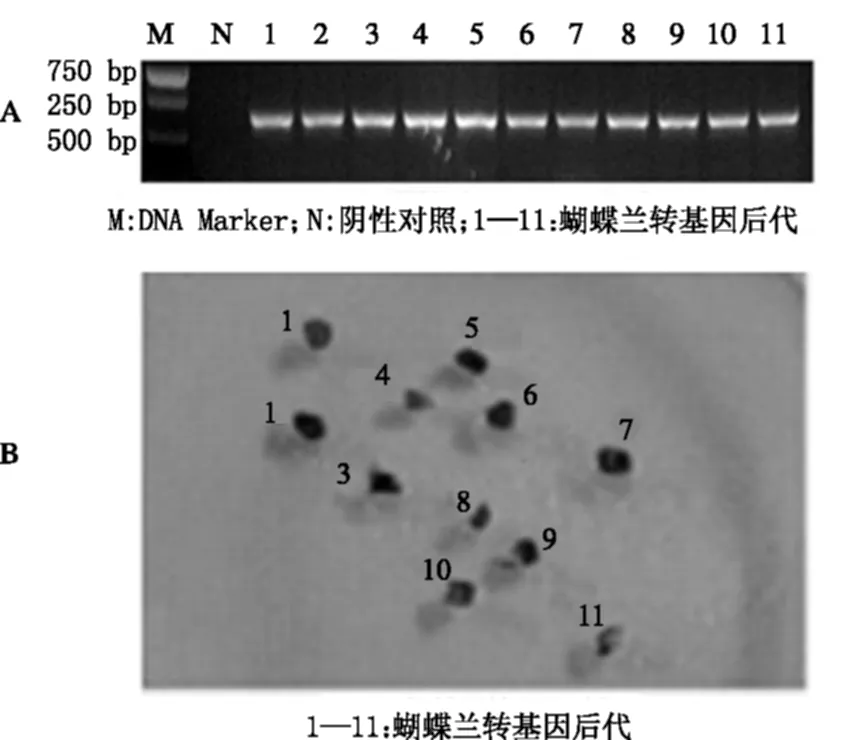
图3 蝴蝶兰转基因后代的分子鉴定(A)及GUS活性组织化学检测(B)
3 结论与讨论
本研究将蝴蝶兰种子萌发的直径大小为0.3~0.5 cm的原球茎进行切块,通过农杆菌进行介导转染,然后通过共培养、筛选培养,建立了以蝴蝶兰种子萌发原球茎为受体材料的遗传转化体系及相应的检测体系。适宜原球茎增殖的培养基,即遗传转化共培养培养基配方为:3.0 g/L花宝1号+2.0 g/L活性炭+2.0 g/L水解酪蛋白+15 g/L蔗糖+3.0 mg/L 6-BA+0.6 mg/L 2,4-D+6.5 g/L琼脂,pH=5.5~5.6。适用于蝴蝶兰遗传转化过程中的筛选培养基配方为:增殖培养基+8.0 mg/L Hyg+50 mg/L Cef,pH=5.5~5.6。
该体系相比现有的蝴蝶兰转化体系,有较为明显的技术优势。首先,该体系在获得受体材料方式上更加快捷。其次,本研究建立的原球茎增殖体系,与通过茎尖、茎段、叶片等方式诱导原球茎相比,具有材料性能稳定、来源广泛的特点。另外,该遗传转化体系对抗生素敏感性较好,有利于抗性转基因材料的筛选。
但是,通过转基因手段将外源基因整合到受体植物基因组中只是最终转基因成功与否的第一步,外源基因能否正常表达并行使功能,与受体本身遗传系统也有关系。另外,植物的表型性状一般是由多个基因控制的,例如,影响植物蓝色花瓣表型的因子中有细胞内各种色素的累计比、pH环境、花色素的金属离子螯合特性等,控制这些因子形成的基因都会影响花瓣的最终呈色。因此,就蝴蝶兰通过转基因手段创建蓝色花种质而言,本研究只是将蓝色花关键基因VwF3′5′H整合到了蝴蝶兰基因组中,能否获得具有蓝色花瓣的蝴蝶兰表型还需要后续功能鉴定。
[1] 彭永刚,张磊,朱祯.国内外转基因农作物研发进展[J].植物生理学报,2013,49(7):611-614.
[2] Yoshida K,Mori M,Kondo T.Blue flower color development by anthocyanins:From chemical structure to cell physiology[J].Nat Prod Rep,2007,26:884-915.
[3] Chai M L,Xu C J,Senthil Y,etal.Stable transformation of protocorm-like bodies inPhalaenopsisorchid mediated byAgrobacteriumtumefaciens[J].Scientia Horticulturae,2002,96:213-224.
[4] 柴明良,金斗焕.农杆菌介导的蝴蝶兰基因转化系统的建立[J].园艺学报,2004,31(4):537-539.
[5] Mishiba K,Chin D P,Mii M.Agrobacterium-mediated transformation ofPhalaenopsisby targeting protocorms at early stage after germination[J].Plant Cell Rep,2005,24:297-303.
[6] Chai D,Yu H.Recent advances in transgenic orchid production[J].Orchid Sci Biotech,2007,1:34-39.
[7] Anzai H Y,Ishii M S,Katsumata K,etal.Transformation ofPhalaenopsisbyparticlebombardment[J].Plant Tissue Cult Lett,1996,13:265-272.
[8] Belarmino M M,Mii M.Agrobacterium-mediated genetic transformation of a Phalaenopsis orchid[J].Plant Cell Rep,2000(19):435-442.
[9] Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:Beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBO J,1987,6(13):3901-3907.
Establishment of Genetic Transformation System for HybridPhalaenopsisBased on Protocorm from Geminated Seed
ZHANG Hechen,DONG Xiaoyu,WANG Limin*,ZHANG Jing,MENG Yue’e,FU Zhenzhu,LI Yanmin
(Horticulture Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China)
We studied the effects of different hormones,antimicrobial agent on protocorms propagation and transformation efficiency in genetic transformation by targeting protocorms bodies germinated from seeds ofPhalaenopsis,and we also identified the transformed offspring.The results showed that the appropriate medium for protocorms propagation was: 3.0 g/L Hyponex No.1+2.0 g/L activated carbon+2.0 g/L casein hydrolysate+15 g/L sucrose+3.0 mg/L 6-BA+0.6 mg/L 2,4-D+6.5 g/L agar, pH=5.5—5.6,and the selective culture-medium for transformation was: the propagation medium+8.0 mg/L Hyg+50 mg/L Cef, pH=5.5—5.6. GUS histochemical identification and PCR detection results showed that the exogenous gene had been successfully integrated into thePhalaenopsisgenome.
Phalaenopsis; protocorm; genetic transformation
2016-01-20
河南省农业科学院科研发展专项资金项目(20148407);河南省留学回国人员专项经费项目(2015-10)
张和臣(1979-),男,河南范县人,副研究员,博士,主要从事植物花瓣呈色的分子基础及花色性状相关的分子育种研究。E-mail:zhc5128@126.com
*通讯作者:王利民(1971-),男,河南温县人,副研究员,博士,主要从事园林花卉育种及栽培生理相关研究。 E-mail:wanglimin923@126.com
S682.31
A
1004-3268(2016)08-0107-06
