聚胸腺嘧啶寡核苷酸介导的铜纳米粒子荧光探针高灵敏检测L-半胱氨酸
2016-02-01李保新
吴 佳, 刘 伟, 李保新
(陕西省生命分析化学重点实验室, 陕西师范大学 化学化工学院, 陕西 西安 710119)
聚胸腺嘧啶寡核苷酸介导的铜纳米粒子荧光探针高灵敏检测L-半胱氨酸
吴佳, 刘伟, 李保新*
(陕西省生命分析化学重点实验室, 陕西师范大学 化学化工学院, 陕西 西安 710119)
摘要:以聚胸腺嘧啶寡核苷酸为模板分子,利用一步法温和快速合成了稳定性好、荧光性能优异的铜纳米粒子。基于L-半胱氨酸能通过巯基高选择性地与铜纳米粒子发生相互作用形成Cu—S键,从而淬灭铜纳米粒子荧光的现象,建立了测定L-半胱氨酸的荧光检测新方法。此方法测定L-半胱氨酸的线性范围为3~50 μmol/L,检出限为0.56 μmol/L,可望用于尿液中L-半胱氨酸含量的测定。
关键词:聚胸腺嘧啶; 铜纳米粒子; 荧光; L-半胱氨酸
半胱氨酸作为一种重要的生物巯基化合物,在生物体内蛋白质合成、折叠、代谢、解毒及氧化还原反应等很多过程中起到积极作用[1-4],其变化直接反映了生物体的生理状况。半胱氨酸水平较低时可能引起许多健康问题,如造血减少、毛发色素脱失、皮肤损伤、肝功能损伤和癌症[5]。半胱氨酸还被广泛应用于各种化妆品和药物制剂中[6]。因此,排除其他氨基酸和类似物的干扰,实现半胱氨酸在环境、药物和具有高灵敏度和选择性的生物样品或制剂中的检测具有非常重要的意义。目前检测L-半胱氨酸的方法主要包括高效液相色谱法[7]、质谱法[8]、电化学法[9-10]、比色法[11-12]、荧光法[13]、化学发光法[14]。然而,这些方法存在检测成本高、消耗时间较长、实验过程繁琐以及需要专业技术人员操作大型仪器等不足。
近十年来,贵金属荧光纳米材料由于其独特的电学性质、光学性质,被广泛地用于生物偶联技术、催化、纳米器件、细胞成像以及生物传感等各个领域[15-19]。其中,以蛋白质、氨基酸、DNA为模板合成的荧光纳米粒子,具有不易光漂白、生物相容性好、合成条件温和等优点。比如,双链DNA稳定的荧光铜纳米粒子已被成功应用于各类生物传感器的构建,主要包括DNA的检测[20-21]、小分子的测定[22-23]、酶活性的检测[24-25]。最近,王柯敏课题组报道了聚胸腺嘧啶寡核苷酸作为一种特殊的单链DNA也可用作模板合成荧光性能优异的铜纳米粒子[26],并利用此荧光探针实现了S1核酸酶[27]及铜离子[28]的检测。聚胸腺嘧啶寡核苷酸介导的荧光铜纳米粒子与其他荧光纳米材料相比,合成方法更为简单快速,室温下即可生成,且合成时间只需2 min;双链DNA稳定的荧光铜纳米粒子因需要进行链杂交反应,合成时间大于1 h[29];银纳米簇的合成需要控制温度,还需避光,反应时间相对较长;金纳米簇的合成对实验温度要求很严格,反应时间至少为12 h[15]。因而,聚胸腺嘧啶寡核苷酸介导的荧光铜纳米粒子为生物及化学分析检测提供了新颖的传感平台。
本文以聚胸腺嘧啶寡核苷酸介导的铜纳米粒子作为荧光探针,基于L-半胱氨酸能通过巯基高选择性地与铜纳米粒子发生相互作用形成Cu—S键,从而淬灭铜纳米粒子荧光的现象,建立了测定L-半胱氨酸的荧光新方法,实现了对L-半胱氨酸的简单、快速、高灵敏、高选择性检测。该方法测定L-半胱氨酸的线性范围为3~50 μmol/L,检出限为0.56 μmol/L,考察了可能的干扰组分对该体系的影响,并将该方法已应用于尿液中加入L-半胱氨酸含量的测定。
1实验
1.1仪器和试剂
F-4600型荧光分光光度计(日本Hitachi公司),JEM-2100型透射电子显微镜(日本Jeol公司),PB-10酸度计(赛多利斯科学仪器有限公司),QL-861漩涡混合器(海门市其林贝尔仪器制造有限公司)。
3-(N-吗啉基)丙磺酸(MOPS)、抗坏血酸钠购于sigma公司,L-半胱氨酸(L-Cys)购于国药集团化学试剂有限公司,硫酸铜(CuSO4)、氯化钠(NaCl)、氯化钙(CaCl2)、氯化钾(KCl)、氯化镁(MgCl2)、葡萄糖购于上海化学试剂有限公司,甘氨酸(Gly)、 L-苯丙氨酸(L-Phe)、L-脯氨酸(L-Pro)、L-丙氨酸(L-Ala)、L-谷氨酸(L-Glu)、L-精氨酸(L-Arg)、L-蛋氨酸(L-Met)、L-亮氨酸(L-Leu)、L-酪氨酸(L-Tyr)、L-色氨酸(L-Trp)、尿素购于阿拉丁试剂(上海)有限公司。聚胸腺嘧啶寡核苷酸(T30,5’-TTTTTTTTTTTTTTTTTTTTTTTTTTTTTT-3’)由生工生物工程有限公司合成,纯化方式为PAGE。T30溶解在MOPS缓冲液(10 mmol/L MOPS,150 mmol/L NaCl,pH 7.6)中,并储存在4 ℃。所用试剂均未进一步纯化,实验用水均为超纯水(Millipore-Q 18.2 MΩ·cm)。
1.2荧光铜纳米粒子的制备及L-半胱氨酸的检测
向10 μL 10-4mol/L T30溶液中加入963 μL MOPS缓冲液(10 mmol/L MOPS,150 mmol/L NaCl,pH 7.6)和20 μL 0.1 mol/L抗坏血酸钠溶液,最后加入7 μL 10 mmol/L CuSO4溶液[26]。充分振荡混匀后,室温下孵育2 min,以形成荧光铜纳米粒子(CuNPs),分别进行荧光光谱测定。
在1.5 mL离心管中,分别加入100 μL以T30为模板合成的荧光铜纳米粒子溶液和100 μL不同浓度的L-半胱氨酸,充分混匀后,室温下反应5 min后分别进行荧光光谱测量。发射和激发狭缝宽度均为10 nm,扫速为1 200 nm/min,平均采样时间为0.05 s,PMT检测电压为700 V。
2结果与讨论
2.1荧光探针设计
L-半胱氨酸的检测原理如图1所示,聚胸腺嘧啶寡核苷酸是铜纳米粒子形成的有效模板,且形成的铜纳米粒子具有强的荧光发射。但是,当加入一定量的L-半胱氨酸到该传感体系中时,铜纳米粒子的荧光响应强度明显降低。L-半胱氨酸淬灭铜纳米粒子荧光的机理仍在探究之中。根据卿志和等[26]的报道,聚胸腺嘧啶寡核苷酸介导的铜纳米粒子形成过程可能是,胸腺嘧啶与Cu2+首先特异性结合形成络合物,然后由抗坏血酸钠沿着模板聚胸腺嘧啶寡核苷酸的轮廓将Cu2+还原为铜原子。推测L-半胱氨酸淬灭铜纳米粒子荧光的机理可能是:一方面,L-半胱氨酸与Cu2+具有很强的结合作用,可形成络合物[30];另一方面,相比其他氨基酸,L-半胱氨酸含有巯基,可形成Cu—S键[31],破坏了铜纳米粒子的结构,从而引起荧光信号的减弱。
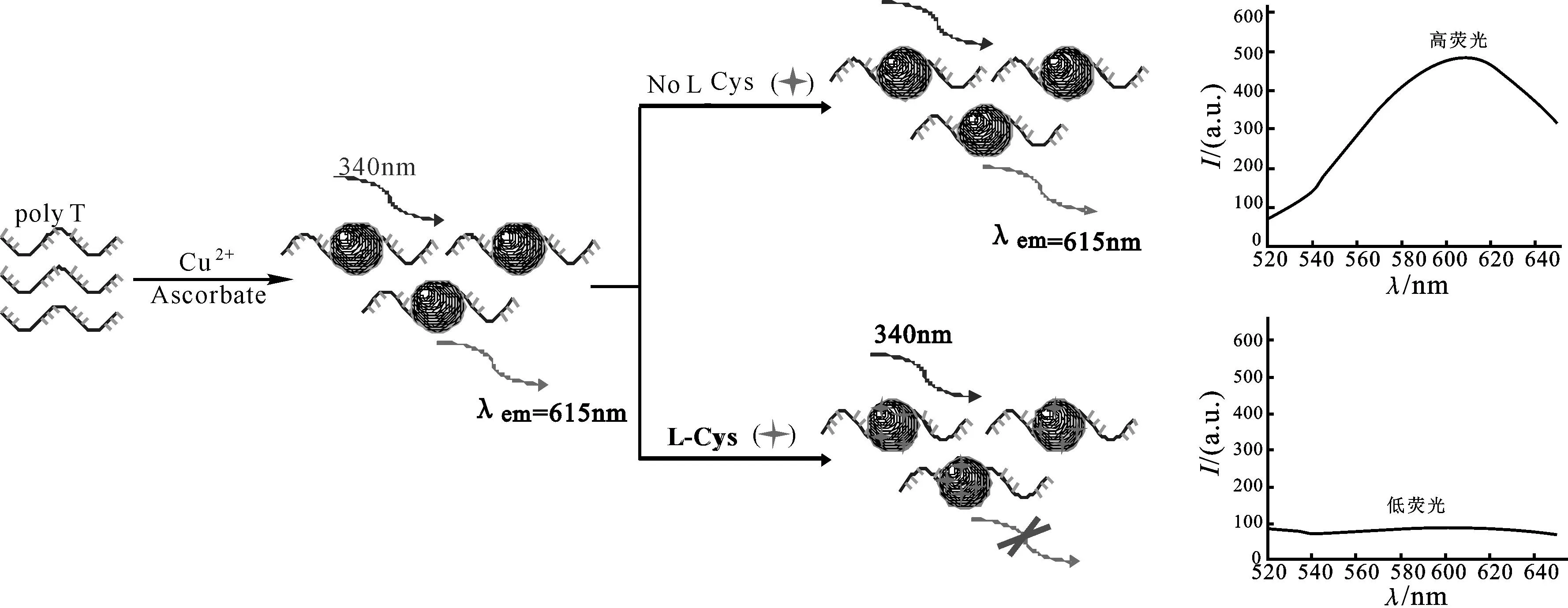
图1 聚胸腺嘧啶寡核苷酸介导的铜纳米粒子检测L-半胱氨酸原理示意图
本文在设计序列时选择了T30作为模板合成铜纳米粒子,TEM检测及粒径分布图(图2)确证了铜纳米粒子的形成,其平均粒径为2.0 nm。图3表明铜纳米粒子的荧光性能良好,最大激发波长为340 nm,最大发射波长为615 nm。图4为聚胸腺嘧啶寡核苷酸介导的铜纳米粒子与100 μmol/L L-半胱氨酸作用前后的荧光响应光谱图。当没有L-半胱氨酸存在时,铜纳米粒子保持其荧光特性;加入L-半胱氨酸后,铜纳米粒子的荧光被淬灭,在615 nm处的荧光强度明显降低。基于以上现象,本文以聚胸腺嘧啶寡核苷酸介导的铜纳米粒子为荧光探针构建了检测L-半胱氨酸的新方法。

图2 聚胸腺嘧啶寡核苷酸介导的铜纳米粒子的透射电镜图(a)和粒径分布柱状图(b)
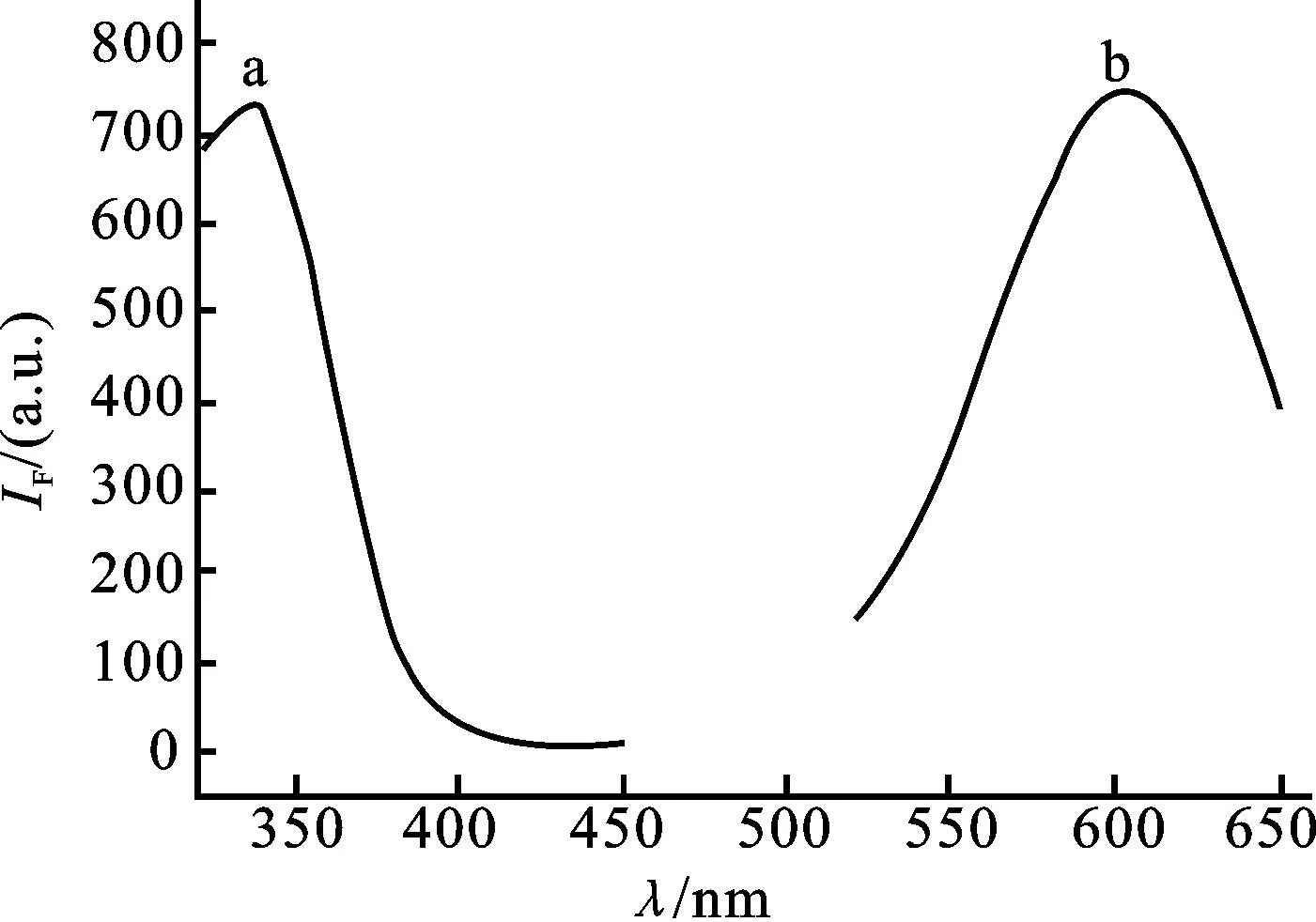
图3 聚胸腺嘧啶寡核苷酸介导的铜纳米
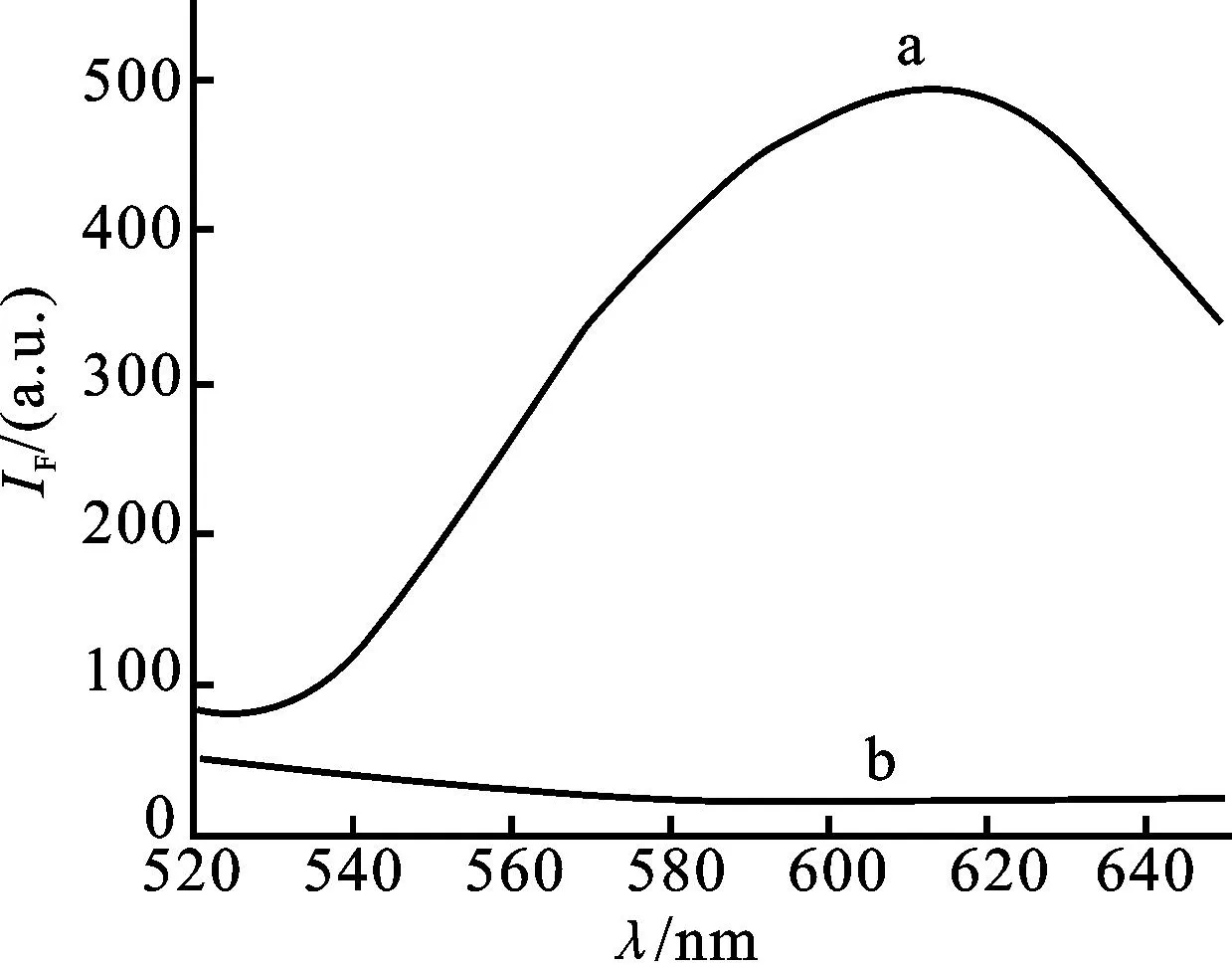
图4 聚胸腺嘧啶寡核苷酸介导的铜纳米粒子在100 μmol/L
2.2实验条件优化
根据实验原理,检测L-半胱氨酸传感体系的灵敏度极大程度上取决于聚胸腺嘧啶寡核苷酸介导的铜纳米粒子荧光探针的性质。本文考察了铜纳米粒子的合成条件,包括T30的浓度、Cu2+的浓度、抗坏血酸钠的浓度,以及铜纳米粒子与L-半胱氨酸的反应时间对整个传感体系的影响。T30作为形成铜纳米粒子的模板,其浓度对铜纳米粒子的荧光强度有很大的影响。随着T30浓度的增加,铜纳米粒子的荧光强度也逐渐增加。T30的浓度为1 000 nmol/L时所形成的铜纳米粒子荧光相对较强,达到了检测要求,更有利于提高L-半胱氨酸检测的灵敏度。铜纳米粒子的形成包含Cu2+被还原为铜原子的过程,随着Cu2+浓度的增加,荧光强度也逐渐升高,而当Cu2+浓度高于70 μmol/L时,形成的铜纳米粒子的荧光强度略有降低,因此Cu2+浓度选择70 μmol/L较为合适。抗坏血酸钠作为形成荧光铜纳米粒子的还原剂,其浓度达到2 mmol/L时,荧光强度最大。不同浓度的L-半胱氨酸刚加入铜纳米粒子,立刻引起了铜纳米粒子荧光的淬灭,当反应时间较短时,体系荧光强度未能达到稳定值,为保证反应的充分进行以及实验结果的准确性,选择5 min作为铜纳米粒子与L-半胱氨酸的反应时间。
2.3方法灵敏度和选择性
在最佳的实验条件下对该方法的灵敏度进行了考察,实验结果如图5a所示,当L-半胱氨酸浓度在3~50 μmol/L范围内时均能不同程度地淬灭铜纳米粒子的荧光,其最大淬灭效率可达96%,随着L-半胱氨酸加入浓度的逐渐增大,荧光强度减小的程度也越来越大,铜纳米粒子在615 nm处的荧光强度逐渐降低。根据铜纳米粒子荧光强度变化与L-半胱氨酸浓度之间的关系,我们建立一种基于荧光法定量检测L-半胱氨酸的分析方法。F0-F与L-半胱氨酸浓度的关系如图5b所示,其中F0和F分别表示不存在和存在目标物时的荧光信号。L-半胱氨酸浓度在3~50 μmol/L范围内时,F0-F与L-半胱氨酸浓度具有良好的线性关系,相关系数R为0.997 0,该荧光方法对L-半胱氨酸的检出限为0.56 μmol/L。
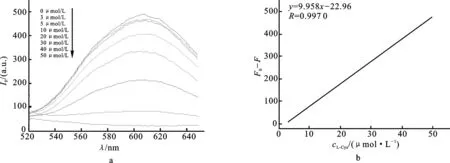
图5 不同浓度L-半胱氨酸对铜纳米粒子荧光淬灭光谱图(a)、荧光强度差值(F0-F) 与L-半胱氨酸浓度关系图(b)
为了进一步探究所设计的荧光法检测L-半胱氨酸的选择性,本文考察了体系对其他氨基酸的响应情况,如甘氨酸、 L-苯丙氨酸、L-脯氨酸、L-丙氨酸、L-谷氨酸、L-精氨酸、L-蛋氨酸、L-亮氨酸、L-酪氨酸、L-色氨酸。50 μmol/L L-半胱氨酸的加入使得铜纳米粒子的荧光明显减小,淬灭程度极大;而50 μmol/L其他氨基酸独自存在于铜纳米粒子溶液中,对铜纳米粒子的荧光信号强度基本没有影响,其对铜纳米粒子荧光强度变化率为±5%。同时,本文还考察了尿液中可能含有的干扰物质对L-半胱氨酸检测的影响,10-7mol/L葡萄糖、10-4mol/L尿素以及10-5mol/L Na+、K+、Ca2+、Mg2+均无干扰。
2.4样品分析
为了进一步考察该方法的实用性及准确性,本文将不同浓度的L-半胱氨酸加入到稀释100倍的尿液样品中,将铜纳米粒子作为荧光探针,以上述标准曲线进行L-半胱氨酸含量的检测,结果列于表1。本方法对尿液中L-半胱氨酸加入量检测的回收率在95.6% ~ 100.9%之间,相对标准偏差范围为2.5%~5.1%,这些结果表明该传感体系对尿液中L-半胱氨酸含量的测定具有适用性和可靠性。

表1 尿液中测定加入L-半胱氨酸含量的分析结果
3结论
本文报道了以聚胸腺嘧啶寡核苷酸介导的铜纳米粒子为荧光探针检测L-半胱氨酸。当L-半胱氨酸存在时,铜纳米粒子的荧光被淬灭,依据加入L-半胱氨酸前后的荧光信号强度的变化,实现了对L-半胱氨酸的定量分析。与常规测定法相比,该方法无需对DNA进行标记从而极大地降低了检测成本;过程中无须任何洗涤、分离等操作步骤,操作简单方便;同时,整个实验过程在10 min内即可完成,高效快速;此外,该方法还具有较好的选择性,不受其他组分的干扰,方法灵敏度也较高,检出限达到了0.56 μmol/L,已成功应用于尿液中L-半胱氨酸含量的测定,在实际应用方面具有较好的前景。
参考文献:
[1] SAEED S. Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J]. Analytical Chemistry, 2001, 73: 5972-5978.
[2] CHEN X Q, ZHOU Y, PENG X J, et al. Fluorescent and colorimetric probes for detection of thiols[J]. Chemical Society Reviews, 2010, 39: 2120-2135.
[3] ERANTHIE W,WANG C,GABRIEL M S,et al. Quantitative reactivity profiling predicts functional cysteines in proteomes[J]. Nature, 2010, 468: 790-795.
[4] KHALILAH G R, KATE S C. Expanding the functional diversity of proteins through cysteine oxidation[J]. Current Opinion in Chemical Biology, 2008, 12: 746-754.
[5] LIU B, WANG J F, ZHANG G, et al. Flavone-based ESIPT ratiometric chemodosimeter for detection of cysteine in living cells[J]. ACS Applied Materials & Interfaces, 2014, 6: 4402-4407.
[6] KHALIL F, MEHRDAD F, ATEFEH P, et al. Highly sensitive and selective colorimetric probe for determination of L-cysteine in aqueous media based on Ag/Pd bimetallic nanoparticles[J]. Sensors and Actuators B: Chemical, 2014, 202: 993-1001.
[7] MITSUHIRO W, MANA K, YUU M, et al. Quantitation of sulfur-containing amino acids, homocysteine, methionine and cysteine in dried blood spot from newborn baby by HPLC-uorescence detection[J]. Biomedical Chromatography, 2014, 28: 810-814.
[8] NEIL B,MELANIE D E,DAVID E M,et al. Definitive identification of cysteine and glutathione complexes of bismuth by mass spectrometry: Assessing the biochemical fate of bismuth pharmaceutical agents[J]. Chemical Communications, 2003, 1:146-147.
[9] FRANCISCO de A dos S S, MONIQUE G A da S, PHABYANNO R L, et al. A very low potential electrochemical detection of L-cysteine based on a glassy carbon electrode modied with multi-walled carbon nanotubes/gold nanorods[J]. Biosensors and Bioelectronics, 2013, 50: 202-209.
[10] FEI S D, CHEN J H, YAO S Z, et al. Electrochemical behavior of L-cysteine and its detection at carbon nanotube electrode modified with platinum[J]. Analytical Biochemistry, 2005, 339: 29-35.
[11] CHEN S, GAO H L, SHEN W W, et al. Colorimetric detection of cysteine using noncrosslinking aggregation of fluorosurfactant-capped silver nanoparticles[J]. Sensors and Actuators B: Chemical, 2014, 190: 673-678.
[12] HABIBOLLAH K, AZARMIDOKHT S. A selective naked-eye detection and determination of cysteine using an indicator-displacement assay in urine sample[J]. Sensors and Actuators B: Chemical, 2014, 199: 457-462.
[13] MAINAK G, JAYA P, CHANCHAL M, et al. Intriguing manipulation of metal-enhanced fluorescence for the detection of Cu2+and cysteine[J]. Chemistry-A European Journal, 2014, 20: 12470-12476.
[14] AMIR W, MOHAMMAD Y, ABDUL N. Flow-injection determination of cysteine in pharmaceuticals based on luminol-persulphate chemiluminescence detection[J]. Luminescence, 2008, 23: 144-149.
[15] XIE J P, ZHENG Y G, JACKIE Y Y. Protein-directed synthesis of highly fluorescent gold nanoclusters[J]. Journal of the American Chemical Society, 2009, 131: 888-889.
[16] ZHANG Y D, CAI Y N, QI Z L, et al. DNA-templated silver nanoclusters for fluorescence turn-on assay of acetylcholinesterase activity[J]. Analytical Chemistry, 2013, 85: 8455-8461.
[17] NIRMAL G,ANUPAM G,BOOTHARAJU M S,et al. Copper quantum clusters in protein matrix: potential sensor of Pb2+ion[J]. Analytical Chemistry, 2011, 83: 9676-9680.
[18] LIU X Q, WANG F, RUTH A, et al. Graphene oxide/nucleic-acid-stabilized silver nanoclusters: functional hybrid materials for optical aptamer sensing and multiplexed analysis of pathogenic DNAs[J]. Journal of the American Chemical Society, 2013, 135: 11832-11839.
[19] WU X, HE X X, WANG K, et al. Ultrasmall near-infrared gold nanoclusters for tumor fluorescence imaging in vivo[J]. Nanoscale, 2010, 2: 2244-2249.
[20] JIA X F, LI J, HAN L, et al. DNA-hosted copper nanoclusters for fluorescent identification of single nucleotide polymorphisms[J].ACS Nano, 2012, 6: 3311-3317.
[21] XU F Z, SHI H, HE X X, et al. Concatemeric dsDNA-templated copper nanoparticles strategy with improved sensitivity and stability based on rolling circle replication and its application in microRNA detection[J].Analytical Chemistry, 2014, 86: 6976-6982.
[22] LIU J, CHEN J H, FANG Z Y, et al. A simple and sensitive sensor for rapid detection of sulfide anions using DNA-templated copper nanoparticles as fluorescent probes[J]. Analyst, 2012, 137: 5502-5505.
[23] CHEN J H, LIU J, FANG Z Y, et al. Random dsDNA-templated formation of copper nanoparticles as novel uorescence probes for label-free lead ions detection[J]. Chemical Communications, 2012, 48: 1057-1059.
[24] ZHANG L L, ZHAO J J, DUAN M, et al. Inhibition of dsDNA-templated copper nanoparticles by pyrophosphate as a label-free fluorescent strategy for alkaline phosphatase assay[J]. Analytical Chemistry, 2013, 85: 3797-3801.
[25] ZHANG L L, ZHAO J J, ZHANG H, et al. Double strand DNA-templated copper nanoparticle as a novel fluorescence indicator for label-free detection of polynucleotide kinase activity[J]. Biosensors and Bioelectronics, 2013, 44: 6-9.
[26] QING Z H, HE X X, HE D G, et al. Poly(thymine)-templated selective formation of fluorescent copper nanoparticles[J]. Angewandte Chemie International Edition, 2013, 52: 9719-9722.
[27] QING Z H, HE X X, QING T P, et al. Poly(thymine)-templated fluorescent copper nanoparticles for ultrasensitive label-free nuclease assay and its inhibitors screening[J]. Analytical Chemistry, 2013, 85: 12138-12143.
[28] QING Z H, MAO Z G, QING T P, et al. Visual and portable strategy for copper(Ⅱ) detection based on a striplike poly(thymine)-caged and microwell-printed hydrogel[J]. Analytical Chemistry, 2014, 86: 11263-11268.
[29] ALEXANDRU R,SUBRATA D,ELMAR J,et al. Selective dsDNA-templated formation of copper nanoparticles in solution[J]. Angewandte Chemie International Edition, 2010, 49: 5665-5667.
[30] ZHANG W W, LU C S, ZOU Y, et al. Self-assembly of L-cysteine-copper(Ⅱ)/copper(Ⅰ) multilayer thin films on gold[J]. Journal of Colloid and Interface Science, 2002, 249: 301-306.
[31] ZONG J, YANG X L, ADRIAN T, et al. Carbon dots as uorescent probes for ‘off-on’ detection of Cu2+and L-cysteine in aqueous solution[J]. Biosensors and Bioelectronics, 2014, 51: 330-335.
〔责任编辑王勇〕
第一作者: 王艳,女,硕士研究生,研究方向为电化学分析。E-mail:1006579188@qq.com
Poly(thymine)-templated copper nanoparticles as fluorescent probes
for highly sensitive detection of L-cysteine
WU Jia, LIU Wei, LI Baoxin*
(Key Laboratory of Analytical Chemistry for Life Science of Shaanxi Province,
School of Chemistry and Chemical Engineering, Shaanxi Normal University,
Xi′an 710119, Shaanxi, China)
Abstract:A simple and sensitive method for the detection of L-cysteine was established using fluorescent copper nanoparticles (CuNPs) synthesized by polythymine (poly T) as a templet. In the presence of L-cysteine, the fluorescence of CuNPs was tremendously quenched through a robust Cu-S bond between -SH in cysteine molecule and Cu of CuNPs. Under the optimized experimental conditions, the probe exhibited excellent performance in the range from 3 to 50 μmol/L with a detection limit of 0.56 μmol/L. Moreover, the developed bioassay was successfully applied to selective detection and determination of L-cysteine in human urine samples.
Keywords:polythymine; copper nanoparticles; fluorescence; L-cysteine
通信作者:* 郭志慧,女,副教授,博士。E-mail:zhguo@snnu.edu.cn
基金项目:国家自然科学基金(21375085)
收稿日期:2015-02-10
doi:10.15983/j.cnki.jsnu.2016.01.312
文章编号:1672-4291(2016)01-0060-06
中图分类号:O657.3
文献标志码:A
