沉默FATE/BJ-HCC-2基因的表达对肝癌细胞迁移及侵袭的影响*
2016-01-29葛丽丽朴军颜杨小昂尹艳慧
葛丽丽,朴军颜,杨小昂#, 尹艳慧,张 毓
1)郑州大学医药科学研究院 郑州 450052 2)郑州市儿童医院检验科 郑州 450053 3)北京大学免疫学系T细胞实验室 北京 100083
沉默FATE/BJ-HCC-2基因的表达对肝癌细胞迁移及侵袭的影响*
葛丽丽1,2),朴军颜1),杨小昂1)#, 尹艳慧3),张毓3)
1)郑州大学医药科学研究院 郑州 4500522)郑州市儿童医院检验科 郑州 4500533)北京大学免疫学系T细胞实验室 北京 100083
关键词FATE/BJ-HCC-2;RNA干扰;肝癌;转移
摘要目的:研究FATE/BJ-HCC-2基因表达与肝癌细胞迁移及侵袭的关系。方法:体外合成FATE/BJ-HCC-2基因序列特异性小干扰RNA(siRNA),转染肝癌细胞系克隆株5B4,并设非特异性siRNA转染和空白对照组。采用RT-PCR及Western blot方法检测各组细胞中 FATE/BJ-HCC-2 mRNA和蛋白的表达;通过Transwell小室模型检测各组细胞体外迁移及侵袭的能力;激光共聚焦显微镜下观察5B4及空质粒转染的对照细胞(Mock)的骨架结构。结果:各组细胞中FATE/BJ-HCC-2 mRNA和蛋白表达差异有统计学意义(F=15.321,P=0.020),特异性siRNA转染组细胞低于其他2组(P<0.05)。抑制FATE/BJ-HCC-2基因表达后,细胞体外迁移及侵袭的能力降低(F=6.171和10.109,P<0.05)。5B4细胞形态拉长,蝌蚪状,呈现迁移、游走的状态;微丝丰富,形态规则,平行贯穿于细胞全长,细胞膜周围有较多丝状伪足伸出;微管减少,分布不规则。结论:FATE/BJ-HCC-2基因表达促进肝癌细胞的迁移及侵袭。
AbstractAim: To study the effects of FATE/BJ-HCC-2 gene expression on the migration and invasion of hepatocellular carcinoma(HCC) cells.Methods: The HCC cell clone line 5B4 cells was transfected with FATE/BJ-HCC-2 gene sequence-specific small interference RNA(siRNA) synthesised in vitro.The expressions of FATE/BJ-HCC-2 mRNA and protein were detected by RT-PCR and Western blot,respectively.The migration and invasion ability of cells were examined by Transwell assay. The cytoskeleton of 5B4 cells transfected FATE/BJ-HCC-2 and empty vector control(Mock) cells was observed by laser scanning confocal microscope.The 5B4 cells not treated were used as blank control.Results: Both of mRNA and protein expressions declined in the group of cells transfected with FATE/BJ-HCC-2 sequence-specific siRNA(F=15.321,P=0.020). The migration and invasion ability of 5B4 cells obviously reduced after FATE/BJ-HCC-2 gene was silenced (F=6.171 and 10.109,P<0.05). Compared with that of the mock cells, the morphological and cytoskeleton structure of 5B4 cells transfected with FATE/BJ-HCC-2 changed obviously. Conclusion: FATE/BJ-HCC-2 gene expression promotes migration and invasion of hepatocellular carcinoma cells.
肿瘤-睾丸抗原是一类具有特异性表达模式的肿瘤相关抗原。正常情况下,肿瘤-睾丸抗原仅在睾丸的生殖细胞如精子、卵子和胎盘的滋养层细胞中表达。研究发现肿瘤-睾丸抗原在黑色素瘤等多种肿瘤组织中高表达,与肿瘤形成、肿瘤细胞凋亡、肿瘤细胞增殖与转移等有密切关系,且能引起细胞和体液免疫应答,是目前临床肿瘤免疫治疗中最具有应用前景的一类肿瘤相关抗原。FATE/BJ-HCC-2是最近发现的新的肿瘤-睾丸抗原基因。该基因位于染色体Xq28,全长7 000 bp,共编码含183个氨基酸的蛋白质[1]。在国际肿瘤-睾丸抗原分类中,FATE/BJ-HCC-2基因被命名为FATE/CT43[2]。作者前期的研究结果显示,FATE/BJ-HCC-2 mRNA在肝癌组织中高表达,并与肝癌细胞的增殖以及肝癌组织的分化程度密切相关。该研究通过体外化学合成FATE/BJ-HCC-2序列特异性小干扰RNA(small interference,siRNA),抑制肝癌细胞中FATE/BJ-HCC-2基因的表达,采用Transwell小室模型检测细胞迁移及侵袭能力的改变,并在激光共聚焦显微镜下观察细胞骨架的变化,进一步探讨FATE/BJ-HCC-2 基因表达水平的变化对肝癌细胞迁移和侵袭的影响。
1材料与方法
1.1细胞和主要试剂稳定表达FATE/BJ-HCC-2的人肝癌细胞系7402的单克隆细胞株5B4和空载体转染的Mock细胞由北京大学医学部免疫学系T细胞实验室建立并保存。DMEM培养基和胎牛血清购自美国Gibco公司;LipofectamineTM2000 为Invitrogen 公司产品;抗-FATE/BJ-HCC-2多抗由北京大学医学部免疫学系T细胞实验室制备保存;羊抗兔HRP IgG抗体购自Zymed公司(北京中杉生物技术公司分装);DAB显色剂购自北京中杉生物技术公司;总RNA提取试剂Trizol购自Gibco-BRL公司。dsRNA由上海吉玛制药技术有限公司设计合成。
1.2细胞培养5B4细胞和Mock细胞均生长于DMEM培养基中,在37 ℃、体积分数5%CO2的条件下培养。取对数生长期细胞于转染前1 d接种于6孔板,待细胞生长至50%~60%融合时,准备转染。
1.3siRNA合成与细胞转染根据GenBank 中FATE/BJ-HCC-2的序列,参考siRNA设计原则,设计FATE/BJ-HCC-2基因的siRNA。FATE/BJ-HCC-2特异性siRNA的正义链序列:5’-CCAAACGAGUU UGGAAUAUTT-3’,反义链序列:5’-AUAUUCCA AACUCGUUUGGTT-3’。为检测siRNA的转染效率,合成带荧光标记的非特异性siRNA,正义链序列:5’-UUCUCCGAACGUGUCACGUCT-3’,反义链序列:5’-ACGUGACACGUUCGGAGAATT-3’。250 μL无血清DMEM中加入20 μmol/L dsRNA 8 μL,室温孵育5 min;另在250 μL无血清DMEM中加入LipofectamineTM2000 5 μL,室温孵育5 min。将上述两种溶液混匀,室温孵育20 min,加入6孔板中,转染48 h后收集细胞。
1.4RT-PCR检测细胞中FATE/BJ-HCC-2 mRNA表达取转染48 h后的5B4细胞,提取细胞总RNA,用紫外分光光度计检测RNA的浓度和纯度。取2 μg总RNA加入反转录酶处理,以反转录的cDNA为模板进行PCR扩增。内参GAPDH上游引物:5’-ACCACAGTCCATGCCATCAC-3’,下游引物:5’-TCCACCACCCTGTTGCTGTA-3’。FATE/BJ-HCC-2上游引物:5’-ACCACAGTCCATGCCATCAC-3’,下游引物:5’-TCCACCACCCTGTTGCTGTA-3’。PCR反应条件:94 ℃预变性 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 25 s,共30个循环;72 ℃ 延伸5 min。用2-ΔCT表示目的基因的表达量。
1.5Western blot检测FATE/BJ-HCC-2蛋白表达取转染48 h的细胞,用1×SDS裂解,提取细胞总蛋白。每个样品上样50 μg, 经SDS-PAGE电泳分离后,将蛋白转移到PVDF膜上。10 g/L BSA 4 ℃封闭过夜,加入FATE/BJ-HCC-2抗体(稀释5 000倍),室温孵育2 h,TBST漂洗3次,加入HRP标记的二抗(稀释1 000倍),4 ℃孵育1 h,TBST漂洗3次后显影。
1.6细胞迁移及侵袭实验 将含有趋化因子的无血清DMEM培养基按每孔600 μL加入Transwell实验小室的底层,小心盖上孔径8 μm的聚碳酯膜。将消化好的空白对照(未作转染)细胞和实验组(特异性转染组为转染了FATE/BJ-HCC-2 siRNA的5B4细胞;非特异性转染组为转染了非特异性siRNA的5B4细胞)细胞按每孔2×105个加入上层小室,置于37 ℃、体积分数5% CO2培养箱中培养8 h后,吸弃上层小室培养基,用PBS湿润的棉球小心擦去聚碳酯膜上面的细胞,取出聚碳酯膜,膜下面附着的即是迁移的细胞。将迁移的细胞用甲醇固定30 min,结晶紫染色20 min。每张聚碳酯膜随机选择5个视野,10倍镜下计数迁移细胞。将50 μg ECM铺在直径8 μm的聚碳酯膜上,将细胞按每孔2×105个加入上层小室,培养10 h后,按照上述方法处理后计数侵袭到小室背面的细胞数。
1.7免疫荧光激光共聚焦实验 取对数生长期的5B4和Mock细胞,接种于6孔板中,每组设3个复孔,培养板中预先植入高压灭菌的盖玻片,常规培养24 h。取出盖玻片,PBS冲洗3次。40 g/L多聚甲醛室温固定30 min, PBS冲洗3次,Triton X-100 通透15 min, PBS冲洗3次,用10 g/L的BSA室温封闭1 h。将罗丹明标记的鬼笔环肽和FITC标记的β-tublin分别加入细胞中,室温孵育1 h。PBS冲洗3次,加入hoechst33342避光染色30 min。PBS冲洗、沥干,置于洁净无荧光载玻片上,于激光共聚焦显微镜下观察并拍照。
1.8统计学处理应用SPSS 17.0 进行分析,各组细胞FATE/BJ-HCC-2 mRNA的表达和体外迁移及侵袭能力的比较采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2结果
2.15B4和Mock细胞中FATE/BJ-HCC-2基因的表达见图1。
5B4细胞FATE/BJ-HCC-2 mRNA表达(1.000±0.102)高于Mock细胞(0.026±0.028)(t=17.600,P=0.003)。5B4细胞FATE/BJ-HCC-2蛋白表达高于Mock细胞。
2.2转染后,各组细胞中FATE/BJ-HCC-2基因的表达FATE/BJ -HCC-2 mRNA的表达见表1,蛋白的表达见图2。

表1 各组细胞FATE/BJ-HCC-2 mRNA的表达
F=15.321,P=0.020;*:与空白对照组和非特异性siRNA转染组比较,P<0.05。
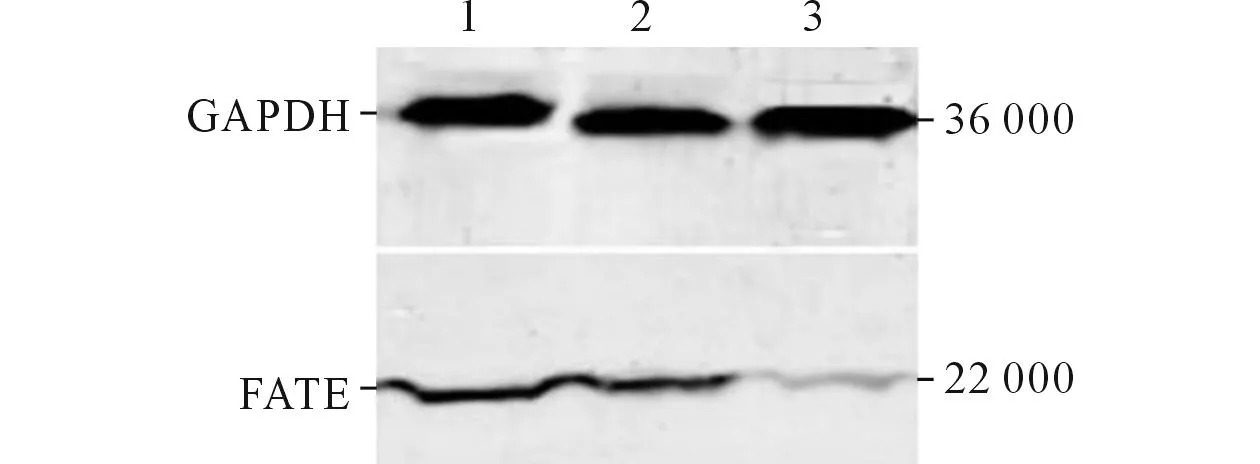
图2 各组细胞FATE/BJ-HCC-2蛋白的表达
1:空白对照组;2:非特异性siRNA转染组;3:特异性siRNA转染组。
2.3各组细胞体外迁移及侵袭能力比较结果见表3。

表3 各组细胞的体外迁移和侵袭能力比较 个
*:与空白对照组和非特异性siRNA转染组比较,P<0.05。
2.4细胞形态改变的观察免疫荧光共聚焦显微镜下(图3)可见,Mock细胞多呈不规则状,形态较圆润,易相连成片生长;微丝稀疏、紊乱;胞质内显示丰富的微管组成的网状结构,由细胞中心呈放射状伸展到细胞边缘,核周呈现较强的绿色荧光。5B4细胞形态拉长,蝌蚪状,呈现迁移、游走的状态;微丝丰富,形态规则,平行贯穿于细胞全长,细胞膜周围有较多丝状伪足伸出;微管减少,分布不规则,荧光弱。
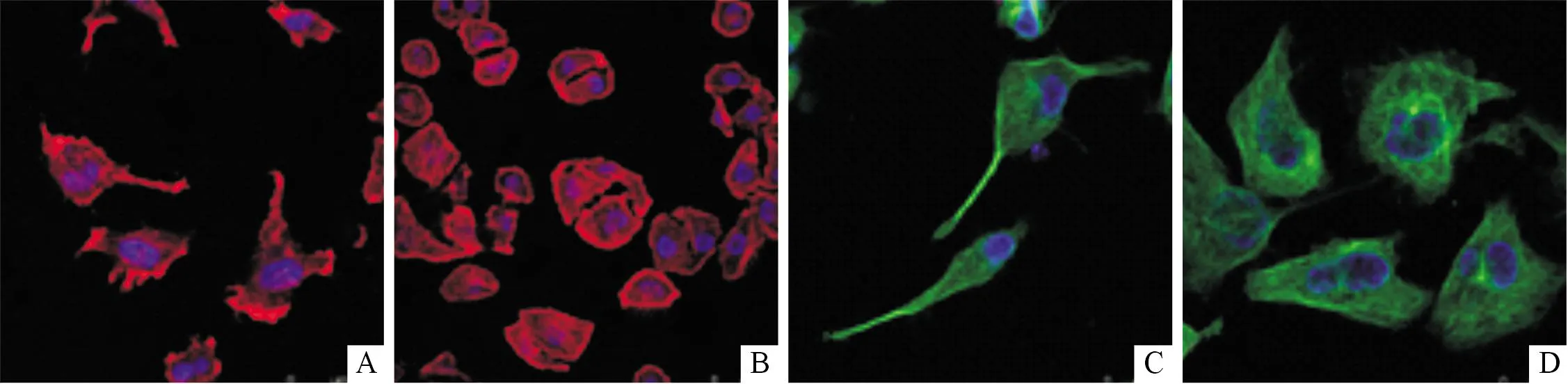
图3 细胞形态及细胞骨架观察(标准尺=50 μm)
3讨论
作者前期研究[3-5]显示,FATE/BJ-HCC-2基因的表达与肝癌细胞的增殖呈正相关,而在肝癌组织中FATE/BJ-HCC-2蛋白的表达频率为20%;部分患者外周血FATE/BJ-HCC-2 mRNA呈阳性表达。因此推测,FATE/BJ-HCC-2 可能在肝癌的发生、发展中发挥着重要作用。为进一步探索FATE/BJ-HCC-2的生物学功能,作者采用能够稳定表达FATE/BJ-HCC-2基因的肝癌细胞株5B4细胞,观察FATE/BJ-HCC-2基因表达变化后细胞形态的改变及该基因被沉默后肝癌细胞体外迁移和侵袭能力的变化。
肿瘤细胞的迁移及侵袭能力是其在体内转移能力的体现。肿瘤细胞中存在多种促癌基因和抑癌基因,它们功能失调或者缺失从而导致肿瘤的形成、发展以及转移[6-7]。恶性肿瘤转移的形成过程包括侵袭、内渗、外渗和转移4个部分。当肿瘤细胞失去细胞之间的黏附后,就会离开原发灶,渗入内皮血管进入体循环,最后定居于远端位点从而完成肿瘤的转移。肿瘤细胞的转移是影响患者生活质量和死亡的主要原因,因此,探索肿瘤转移的机制是拯救肿瘤患者的关键所在。近来研究[8]发现,上皮间质转化(epithelia-l mesenchymal transitions,EMT)这一现象与肿瘤的发生、发展以及转移密切相关。上皮间质转化是肿瘤转移的重要组织屏障。该研究结果显示,干扰FATE/BJ-HCC-2基因表达后,肝癌细胞的迁移及侵袭能力明显降低,提示FATE/BJ-HCC-2基因的表达与肝癌细胞的迁移及侵袭有密切联系。
肿瘤细胞的侵袭和转移与其运动能力密不可分,而细胞的有效运动一方面来自于细胞内、外的细胞因子对细胞骨架动力装置所给予的原动力,另一方面则是骨架成分介导的黏附作用所提供的锚定力,两者之间相互协调才能完成细胞的移动[9]。细胞骨架是由细胞中细纤维网状物质组成的网架结构,直接影响细胞的结构和功能[10]。在细胞迁移过程中,细胞骨架前端伸出片状或丝状伪足,通过与细胞外基质建立新的黏附来维持伸展状态;然后,细胞借助肌动蛋白、肌球蛋白来调节细胞体收缩,从而使细胞不断向前运动;最后,细胞的尾部与基质部分分离,细胞回缩。由此可见,细胞的有效运动是肿瘤细胞迁移和侵袭能力的关键步骤[11-13]。因此,细胞骨架在肿瘤细胞的转移和侵袭中起着非常重要的作用。该研究结果显示,转染了FATE/BJ-HCC-2基因的肝癌细胞的骨架结构发生明显变化,细胞形态变得细长,蝌蚪状,周围有伪足,呈现迁移、游走的状态。可见,FATE/BJ-HCC-2基因表达能够改变肝癌细胞骨架结构,从而对促进肝癌细胞的迁移、侵袭及转移能力具有一定的作用。
参考文献
[1] 李官成,童永清. 自身抗体—肿瘤新的早期诊断标志物[J].西安交通大学学报:医学版,2009,30(4):392
[2]Scanlan MJ,Simpson AJ,Old LJ.The cancer/testis genes: review, standardization, and commentary[J].Cancer Immun,2004,4:1
[3]Yang XA,Dong XY,Qiao H,et al.Immunohistochemical analysis of the expression of FATE/BJ-HCC-2 antigen in normal and malignant tissues[J].Lab Invest,2005,85(2):205
[4]闫萌,王巍,杨小昂,等.FATE/BJ-HCC-2基因表达促进细胞增殖及肿瘤形成[J].中国生物化学与分子生物学报,2008,24(8):748
[5]Dong XY,Su YR,Qian XP,et al.Identification of two novel CT antigens and their capacity to elicit antibody response in hepatocellular carcinoma patients[J].Br J Cancer,2003,89(2):291
[6]Voulgari A,Pintzas A.Epithelial-mesenchymal transition in cancer metastasis: mechanisms, markers and strategies to overcome drug resistance in the clinic[J].Biochim Biophys Acta,2009,1796(2):75
[7]Moustakas A,Heldin CH.Signaling networks guiding epi-thelial-mesenchymal transitions during embryogenesis and cancer progression[J].Cancer Sci,2007,98(10):1512

[8]田音,朱蓉,汪荣泉. Ascl2表达抑制对结肠癌细胞上皮-间质转化的影响[J].解放军医学杂志,2013,38(4):292
[9]张钢,龙勉,吴泽志.肝癌细胞粘弹性的实验研究[J].解放军医学杂志,2001,26(3):204
[10]蔡贞,熊石龙,周园,等. 利用亚细胞组分蛋白分离技术有效提取细胞骨架及其相关蛋白[J].南方医科大学学报,2013, 33(5):698
[11]Vignjevic D,Montagnac G.Reorganisation of the dendritic actin network during cancer cell migration and invasion[J].Semin Cancer Biol,2008,18(1):12
[12]Weaver AM.Invadopodia: specialized cell structures for cancer invasion[J].Clin Exp Metastasis,2006,23(2):97
[13]Yamaguchi H,Condeelis J.Regulation of the actin cytoskeleton in cancer cell migration and invasion[J].Biochim Biophys Acta,2007,1773(5):642
*国家自然科学基金项目321400531010
Effects of silencing FATE/BJ-HCC-2 gene on migration and invasion of hepatocellular carcinoma cells
GELili1,2),PIAOJunyan1),YANGXiaoang1),YINYanhui3),ZHANGYu3)
1)AcademyofMedicalandPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou4500522)ClinicalLaboratory,ZhengzhouChildren′sHospital,Zhengzhou4500533)DepartmentofImmunology,HealthSciencesCenter,PekingUniversity,Beijing100083
Key wordsFATE/BJ-HCC-2;RNA interference;liver cancer;metastasis
doi:10.13705/j.issn.1671-6825.2015.06.020
中图分类号R735.7
通信作者#,男,1963年5月生,博士,研究员,研究方向:肿瘤免疫学,E-mail:xiaoangyang@163.com
