甲型副伤寒沙门菌噬菌体LSPA1启动子筛选方法的建立*
2016-01-29曾韦锟毛普加冯梦蝶许泽仰宋武战杨洪文赵继华王纪爱井申荣
曾韦锟,毛普加,洪 愉,冯梦蝶,许泽仰,宋武战,杨洪文,赵继华,王纪爱,黄 芬,井申荣
1)昆明学院医学院临床检验教研室 昆明 650214 2)昆明理工大学医学院病原微生物学实验室 昆明 650500 3)成都军区昆明总医院核医学科 昆明 650532
△男,1974年10月生,博士,讲师,研究方向:病原微生物学,E-mail:zengweikun@126.com
甲型副伤寒沙门菌噬菌体LSPA1启动子筛选方法的建立*
曾韦锟1)△,毛普加2),洪愉3),冯梦蝶2),许泽仰2),宋武战3),杨洪文3),赵继华3),王纪爱1),黄芬2),井申荣2)
1)昆明学院医学院临床检验教研室 昆明 6502142)昆明理工大学医学院病原微生物学实验室 昆明 6505003)成都军区昆明总医院核医学科 昆明 650532
△男,1974年10月生,博士,讲师,研究方向:病原微生物学,E-mail:zengweikun@126.com
关键词甲型副伤寒沙门菌;噬菌体;启动子
摘要目的:通过构建pCAT3启动子陷阱载体筛选甲型副伤寒沙门菌噬菌体LSPA1启动子。方法:PCR无义突变去除pCAT2载体骨架上CalⅠ酶切位点,并在CAT片段的5’端引入CalⅠ的酶切位点,构建启动子陷阱载体pCAT3。TaqⅠ酶切噬菌体LSPA1基因组,插入pCAT3载体中,转化至大肠杆菌DH5α,通过氯霉素抗性平板筛选获得噬菌体LSPA1基因文库菌;随机挑取1株提取质粒,测序及比对分析插入序列;根据分析结果设计引物,扩增可能的启动子序列,并插入验证载体p-3lysm-egfp,转化DH5α,荧光显微镜观察。结果:成功构建pCAT3启动子陷阱载体,获得约100启动子文库菌,其中1株文库菌质粒中随机插入片段可能对应噬菌体LSPA1的 ORF4启动子;插入待验证DNA片段的p-3lysm-egfp载体重组菌在荧光显微镜下能见到明显绿色荧光。结论:该启动子文库可有效筛选噬菌体LSPA1启动子,为进一步深入研究噬菌体LSPA1提供帮助。
AbstractAim: To screen promoter of Salmonella paratyphi A phage LSPA1 through promoter trap vector pCAT3. Methods: CalⅠ restriction site on plasmid pCAT2 backbone was deleted by PCR nonsense mutation, and then the CAT gene with new CalⅠ on the 5′end was inserted into pCAT2 to get promoter trap vector pCAT3. The digested fragment of LSPA1 phage genome was inserted to pCAT3 and then transformed into E.coli DH5α. The bacteria phage LSPA1 promotor library was screened using plates containing chloramphenicol. After plasmid was extracted from a randomly picked bacterial, the information of inserted sequences was gained by sequencing.According to the results, primers were designed to amplify the possible promoter sequence and inserted to plasmid p-3lysm-egfp. After this plasmid was transformed into DH5α, the recombinant bacteria were observed under fluorescence microscopy. Results: Promoter trap vector pCAT3 was successfully constructed. About 100 bacteria containing promoter were gained, one of which was presumed to be ORF4 promoter of phage LSPA1. Recombinant bacteria DH5α/p-3lysm-egfp carried the insert DNA fragments was obviously observed green fluorescence under fluorescence microscope. Conclusion: This library can effectively screen phage LSPA1 promoter, which would be helpful for further research of phage LSPA1.
由伤寒和甲型副伤寒沙门菌引起的伤寒肠热病在东南亚仍然是一个主要的卫生健康问题[1]。流行病学调查[2]表明,每年全球伤寒肠热病病例约为2 700万,其中死亡病例高达20万。在我国特别是在广西、浙江、江苏、贵州、云南等省份,近十几年均有甲型副伤寒的暴发或流行[3]。临床分离的甲型副伤寒沙门菌常表现出耐药性,给治疗带来了困难。噬菌体作为细菌的杀手,可用来控制生物防控细菌的感染[4]。作者所在的实验室在前期筛选出一株甲型副伤寒沙门菌CMCC50973烈性噬菌体LSPA1,采用鸟枪法测序获得全基因组序列,并预测出58个开放阅读框(ORF)。启动子是DNA链上指导RNA聚合酶结合并起始mRNA合成的DNA序列,是控制基因表达的重要组成部位[5]。对于噬菌体而言,侵染宿主的每一步都受到精确的调控,启动子在此扮演的角色至关重要,这些ORF编码蛋白的表达依赖于噬菌体自身的启动子。分析未知启动子,除了利用生物信息学方法预测外,还可利用启动子陷阱载体,通过构建基因组文库的方法进行筛选[6-7]。为了深入研究LSPA1的活动,该研究构建CAT为报告基因的启动子陷阱载体pCAT3,尝试构建噬菌体LSPA1基因组文库的方法来筛选噬菌体LSPA1启动子。
1材料与方法
1.1菌株与试剂甲型副伤寒沙门菌CMCC50973(实验室保存,噬菌体LSPA1宿主菌),噬菌体LSPA1(实验室保存,由医院污水中分离获得,GenBank登录号为KM272358[8-9]),大肠杆菌DH5α(实验室保存,用于制备感受态),pCAT2[10](实验室保存,以pET-28a为基础,利用PCR、酶切等方法构建的缺乏T7启动子且含有CAT报告基因的筛选载体),重组质粒pET-28a-3lysm-egfp[实验室构建保存。将3lysm-egfp(约1 500 bp)用XhoⅠ/NdeⅠ双酶切构建到pET-28a载体上,并测序验证]。3lysm是一种锚定序列,能将融合蛋白锚定到乳酸菌细胞壁上[11]。DNA Marker DL5000购自大连宝生物工程公司,卡那霉素(K+,50 mg/L)、氯霉素(Chl+,20 mg/L)、PCR试剂均购自上海生工生物工程技术服务有限公司,TransStart FastPfu Fly DNA Polymerase(FPfu)购自北京全式金生物技术有限公司。实验中所用引物均由上海捷瑞生物工程有限公司合成(表1)。
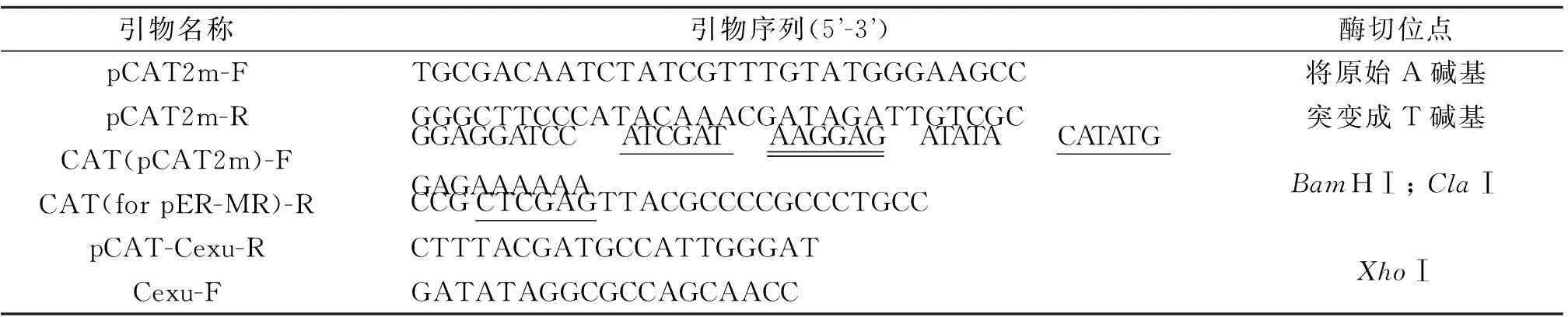
表1 实验中所用引物
F:上游引物;R:下游引物;单下划线:酶切位点;双下划线:RBS。
1.2启动子陷阱载体pCAT3的构建及自激活验证根据pCAT2 K+基因中CalⅠ的酶切位点设计pCAT2m-F和pCAT2m-R突变引物,扩增pCAT2全长,转化至DH5α,提取转化子质粒,用CalⅠ酶切鉴定,突变成功后的载体命名为pCAT2m;设计引物CAT(pCAT2m)-F和CAT(for pER-MR)-R,扩增CAT基因,在其5’端引入BamHⅠ和CalⅠ,下游引入XhoⅠ,PCR产物经BamHⅠ、XhoⅠ双酶切pCAT2m载体,鉴定正确后命名为pCAT3,并用NdeⅠ/XhoⅠ双酶切鉴定。将构建的pCTA3/DH5α在Chl+(20 mg/L)平板中划线,37 ℃培养过夜,观察pCTA3是否能够生长。
1.3噬菌体LSPA1基因文库的建立噬菌体LSPA1基因组的提取:取100 mL噬菌体LSPA1,加入1 mg/L DNaseⅠ和RNase,37 ℃静置30 min;再加入58.4 g/L NaCl,冰水浴1 h后离心,收集上清;加入100 g/L PEG8000,充分溶解后冰水浴1 h,离心,弃上清,加入2 mL TE重悬;加入等体积的氯仿混匀,离心,收集上清,重复一次;加入终质量浓度5 mg/L DNaseⅠ和1 mg/L RNase,37 ℃温育1 h;加入终质量浓度1 mg/L EDTA(pH 8.0)、50 mg/L 蛋白酶K、5.0 g/L SDS混匀,56 ℃温育1 h,加入等体积的酚(pH 8.0)混匀,离心,收集上清水相,再加入等体积氯仿混匀,离心,收集上清水相;将上清水相进行乙醇沉淀回收即为噬菌体LSPA1基因组。
取1 μg噬菌体基因组、0.5 μLTaqⅠ、1 μL Buffer,ddH2O补至10 μL,37 ℃酶切30 min;加90 μL ddH2O补至100 μL,乙醇沉淀全基因回收。将构建的pCAT3用CalⅠ单酶切,切胶回收,并去磷酸化,再和噬菌体酶切片段连接、转化DH5α感受态。用pCAT-Cexu-R和Cexu-F验证插入片段大小。
1.4测序及比对挑选上面获得的文库菌,抽提质粒测序,并与噬菌体LSPA1基因比较分析。
1.5启动子表达重组质粒的构建根据比对和LSPA1注释结果,设计引物gp4-P-R和gp4-P-F,扩增疑似ORF4启动子;将其与pCAT3分别用BamHⅠ/HindⅢ双酶切,切胶回收,连接构建重组质粒p-4-CAT3,并转化至DH5α感受态中,挑取单菌,提取质粒用BamHⅠ/HindⅢ双酶切鉴定。将重组p-4-CAT质粒和pET-28a-3lysm-egfp用XhoⅠ/NdeⅠ双酶切,分别回收3lysm-egfp和p-4载体,在T4连接酶作用下连接构建p-4-3lysm-egfp,XhoⅠ/NdeⅠ双酶切鉴定。
1.6重组菌的表达及荧光观察取1 mL新鲜培养鉴定正确的重组菌p-4-3lysm-egfp/DH5α菌液(D595 nm约为0.6),10 000g离心1 min,弃上清,沉淀用ddH2O重悬洗涤3次,稀释100倍后,取1滴于载玻片上,晾干,于荧光显微镜下观察荧光,以重组菌pCAT3-3lysm-egfp/DH5α为阴性对照。
2结果
2.1启动子陷阱载体pCAT3的构建及自激活验证结果见图1。扩增pCAT2质粒全长(图1A);利用点突变方法无义突变pCAT2质粒K+抗性基因中CalⅠ酶切位点(图1B),点突变后质粒不能被CalⅠ酶切,点突变成功。设计合成引物扩增CAT基因,并在前端添加CalⅠ酶切位点,替换点突变pCAT中CAT基因,重组pCAT3能够被CalⅠ酶切,并且NdeⅠ/XhoⅠ双酶切出理论大小的CAT基因,证明筛选载体pCAT3改造成功(图1C和D);将构建成功的pCAT3于Chl+平板中划线,pCAT3不能在Chl+平板中生长,表明pCAT3无自激活现象。A:PCR扩增pCAT2全长;1:Marker;2:pCAT2全长。B:pCAT2无义突变鉴定图;1:Marker;2:pCAT2无义突变CalⅠ酶切;3:pCAT2原始质粒。C:pCAT3CalⅠ酶切鉴定图;1:Marker;2:pCAT3CalⅠ酶切;3:pCAT3原始质粒。D:pCAT3NdeⅠ/XhoⅠ双酶切鉴定图;1:Marker;2:pCAT3NdeⅠ/XhoⅠ双酶切;3:pCAT3原质粒。

图1 启动子陷阱载体pCAT3的构建结果
2.2噬菌体LSPA1基因文库的构建结果将提取的噬菌体LSPA1基因用TaqⅠ酶切(图2左),乙醇沉淀全基因组回收,并构建到pCAT3载体上,在Chl+平板中成功筛选出启动子;挑取10株单菌,PCR验证(图2右),并测序;将测序结果提交NCBI与LSPA1基因比对,证明插入片段为噬菌体LSPA1基因片段。

图2 噬菌体LSPA1基因文库的构建结果
左:噬菌体LSPA1基因组酶切图;1:Marker;2:噬菌体LSPA1基因组酶切。右:启动子随机菌株PCR鉴定;1:Marker;2~11:随机10株启动子单菌PCR。
2.3启动子表达重组质粒的构建结果设计引物,扩增ORF4上游启动子片段并酶切构建到pCAT3载体上,BamHⅠ/HindⅢ双酶切鉴定重组质粒p-4-CAT3(图3左),酶切出149 bp大小的启动子片段,与理论相符;将重组表达载体p-4-3lysm-egfp用XhoⅠ/NdeⅠ双酶切鉴定(图3右),酶切产物为1 700 bp大小片段,证明重组表达载体构建成功。

图3 启动子表达重组质粒的构建结果
左:重组质粒p-4-CAT3双酶切鉴定;1:Marker;2:p-4-CAT3双酶切。右:重组质粒p-4-3lysm-egfp双酶切鉴定;1:Marker;2:p-4-3lysm-egfp双酶切。
2.4重组菌的表达及荧光观察结果取1滴新鲜的构建成功的重组表达菌p-4-3lysm-egfp/DH5α于载玻片上,荧光显微镜观察,重组表达菌有荧光产生,阴性对照p-3lysm-egfp/DH5α重组菌无荧光。
3讨论
噬菌体LSPA1是甲型副伤寒沙门菌烈性噬菌体。噬菌体的感染周期一般分为早期、中期、晚期3个时期,其中早期主要转录RNA聚合酶,中期编码调节因子,而晚期主要是完成噬菌体DNA复制、装配、以及宿主菌的裂解[12],每个时期都由相对应的启动子发挥作用,为了更深入研究噬菌体的生命活动,筛选其启动子并鉴定具有重要的意义。
筛选和检测启动子的方法可利用缺乏启动子的报告基因构建陷阱载体,该研究选择常用的CAT基因作为报告基因。在研究之前作者发现pET-28a中T7启动子能够本底启动CAT基因的表达,所以为了实验的进行,首先将pET-28a进行改造获得无T7启动子的pCAT重组载体。在对噬菌体LSPA1基因进行酶切分析时发现,虽然Sau3AⅠ与TaqⅠ一样也是识别4碱基,但是Sau3AⅠ在LSPA1基因组分布不如TaqⅠ广泛,因此该研究采用TaqⅠ酶切基因组,而不是最常用的Sau3AⅠ酶切。与TaqⅠ配套使用的同位酶是CalⅠ,由于pCAT2载体在K+基因上有一个CalⅠ酶切位点,为此作者先利用PCR方法将K+基因CalⅠ酶切位点的A碱基突变成T碱基,无义突变掉CalⅠ位点;同时为了在CAT前插入TaqⅠ酶切的片段,又重新扩增CAT基因并在5’端添加CalⅠ酶切位点,从而获得新的启动子陷阱载体pCAT3。
将LSPA1酶切插入pCAT3后转化DH5α,通过氯霉素抗性即可简单获得LSPA1启动子文库菌,从文库菌质粒PCR鉴定的结果看,插入片段具有一定的多样性,从插入片段测序分析结合LSPA1测序结果,作者选定ORF4上游插入片段进一步验证。考虑到启动子片段的大小,选择性扩增了大小约149 bp的片段。同时为了方便观察启动子活性并进一步验证,作者选择实验室前期构建的pET-28a-3lysm-egfp,将扩增片段插入3lysm-egfp上游,携带该质粒的重组菌在荧光显微镜下能够发出绿色荧光,表明该片段的确具有启动子功能。
总之,该研究成功地通过启动子陷阱载体获得了LSPA1启动子文库菌,为深入研究LSPA1生命活动以及与宿主的相互作用奠定了基础,但是以大肠杆菌DH5α作为筛选宿主,可能会影响噬菌体LSPA1启动子识别,因此下一步研究仍需要以甲型副伤寒沙门菌作为宿主。
参考文献
[1]Dutta S,Das S,Mitra U,et al.Antimicrobial resistance, virulence profiles and molecular subtypes of salmonella enterica Serovars Typhi and Paratyphi A blood isolates from Kolkata, India during 2009-2013[J].PLoS One,2014,9(8):1
[2]Zhou ZM,Mccann A,Weill FX,et al.Transient darwinian selection in Salmonella enterica serovar Paratyphi A during 450 years of global spread of enteric fever[J].Proc Natl Acad Sci U S A,2014,111(33):12199
[3]周建芳,杨珊敏.副伤寒甲连续5年流行特点及细菌耐药性监测[J].中华传染病杂志,2003,21(6):421
[4]Hagens S,Loessner MJ.Application of bacteriophages for detection and control of foodborne pathogens[J].Appl Microbiol Biotechnol,2007,76(3):513
[5]Dale JW,Park SF.Molecular genetics of bacteria[M]. 3rd.London:John Wiley&Sons,1998:169
[6]Jeong DW,Choi YC,Lee JM,et al.Isolation and characterization of promoters from Lactococcus lactis ssp cremoris LM0230[J].Food Microbiol,2006,23(1):82
[7]Singh A,Hodgson N,Yan M,et al.Screening Helicobacter pylori genes induced during infection of mouse stomachs [J].World J Gastroenterol,2012,18(32):4323

[8]Zeng W,Mao P,Hong Y,et al.Complete genome sequence of the Salmonella enterica serovar Paratyphi A bacteriophage LSPA1 isolated in China[J].Genome Announce,2015,3(1):e01011
[9]毛普加,冯梦蝶,洪愉,等.抗噬菌体甲型副伤寒沙门菌突变菌的构建及其生物学特性[J].吉林大学学报:医学版,2015,41(2):275
[10]冯梦蝶,洪愉,许泽仰,等.CAT为报告基因的铜绿假单胞菌启动子文库的建立及初步鉴定[J].生命科学研究,2014,18(6):521
[11]冯金,洪愉,毛普加,等.带锚定基序3LysM的EGFP融合蛋白与乳酸乳球菌的体外混合展示[J].中国微生态学杂志,2014,26(5):497
[12]蔡炯,钟彦伟,荆霞,等.噬菌体展示技术筛选甲型H1N1流感病毒抗原模拟表位的研究[J].解放军医学杂志,2010,35(1):61
(2015-01-20收稿责任编辑赵秋民)
*国家自然科学基金项目U1204807;河南省科技厅科技攻关项目340600531525;河南省医学科技攻关项目201304013
Establishment of a method to screen promoter ofSalmonellaparatyphiA phage LSPA1
ZENGWeikun1),MAOPujia2),HONGYu3),FENGMengdie2),XUZeyang2),SONGWuzhan3),YANGHongwen3),ZHAOJihua3),WANGJi′ai1),HUANGFen2),JINGShenrong2)
1)DepartmentofClinicalLaboratory,MedicalFaculty,KunmingUniversity,Kunming6502142)LaboratoryofPathogenyBiology,MedicalFaculty,KunmingUniversityofScienceandTechnology,Kunming6505003)DepartmentofNuclearMedicine,KunmingGeneralHospitalofChengduMilitaryCommand,Kunming650532
Key wordsSalmonella paratyphi A; phage; promoter
doi:10.13705/j.issn.1671-6825.2015.06.005
中图分类号Q939.48;R378.2
