细叶百合低温解除休眠过程中鳞茎细胞淀粉粒及花芽分化的变化
2016-01-28刘芳田忠平蔡英杰张雨周蕴薇
刘芳,田忠平,蔡英杰,张雨,周蕴薇*
(1.东北林业大学园林学院,黑龙江 哈尔滨150040;2.黑龙江八一农垦大学农学院,黑龙江 大庆163319)
细叶百合低温解除休眠过程中鳞茎细胞淀粉粒及花芽分化的变化
刘芳1,2,田忠平1,蔡英杰1,张雨1,周蕴薇1*
(1.东北林业大学园林学院,黑龙江 哈尔滨150040;2.黑龙江八一农垦大学农学院,黑龙江 大庆163319)
摘要:以细叶百合为试材,通过低温(5℃)解除鳞茎休眠,研究了休眠解除过程中鳞茎细胞的淀粉粒的变化及细叶百合花芽分化的变化过程。通过石蜡切片和实体显微结构观察,结果表明,低温冷藏期间,顶芽生长锥的高度和宽度逐渐增加,细叶百合花芽分化主要分为4个时期,0~48 d为小花原基分化期,60 d为外轮花被原基分化期,72 d为内轮花被原基分化期,84 d为雄蕊和雌蕊原基分化期;鳞片及顶芽细胞内淀粉粒数量随着冷藏时间的延长逐渐减少。冷藏0~24 d内,鳞茎细胞没有进行有丝分裂,冷藏36 d以后细胞分裂数量逐渐增加,冷藏84 d分裂期细胞数量增加到2.6个。
关键词:细叶百合;鳞茎;休眠;淀粉粒;花芽分化
Change in starch grains and flower bud differentiation ofLiliumpumilumbulbs during breaking of dormancy under refrigerated conditions
LIU Fang1,2, TIAN Zhong-Ping1, CAI Ying-Jie1, ZHANG Yu1, ZHOU Yun-Wei1*
1.CollegeofLandscapeArchitecture,NortheastForestryUniversity,Harbin150040,China; 2.CollegeofAgriculture,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China
Abstract:Changes in starch grains and flower bud differentiation of lily (Lilium pumilum) were studied during the breaking of dormancy at 5℃. Observations of paraffin sections under a microscope revealed that the height of the growth cone and the width of apical buds increased gradually during cold storage. The flower bud differentiation process in lily could be divided into four stages: the floral primordium differentiation stage from 0 to 48 days, the outer perianth primordium differentiation stage at 60 days, the inner perianth primordium differentiation stage at 72 days, and the stamen and pistil primordium differentiation stage at 84 days. The number of starch grains in apical bud cells gradually decreased as the duration of the cold temperature treatment extended. There were almost no mitotic cells in the plant tissues from 0 to 24 days of cold storage. The number of mitotic cells increased gradually after 36 days in cold storage, reaching 2.6 at 84 days of cold storage.
Key words:Lilium pumilum; bulbs; dormancy; starch grains; flower bud differentiation
百合是国内外花卉市场上重要的切花之一,由于其鳞茎具有生理休眠的特性,收获后不能立即用于切花再生产,必须在冷库中贮藏3~4个月才能打破休眠。未完全解除休眠的鳞茎种植后会影响切花质量或导致盲花出现,从而影响了百合切花的周年生产和供应,为此百合鳞茎休眠机理的研究获得了广泛的关注。
百合花芽分化过程的研究是百合花期调控研究的前提,目前,关于百合花芽形态发育过程的研究报道主要涉及麝香百合(Liliumlongifolorum)、新铁炮百合(Liliumformolongi)、毛百合(Liliumdahuricum)、东方百合(Liliumorientalhybrids)及亚洲百合(Liliumasiatichybrids)栽培品种[1-5]。但是,百合鳞茎休眠期的持续时间和花芽发育的变化过程也因种系不同而有较大差异[6-8],即便在同一种系内也不完全相同。鳞茎的休眠程度与芽分生组织的有丝分裂活性有关[9]。已有研究表明,5℃贮藏30 d的龙牙百合试管鳞茎茎尖细胞的分裂已开始启动,细胞中可见明显的染色体[10]。淀粉含量的变化及休眠解除过程中细胞的分裂情况都是百合鳞茎休眠解除过程中的重要生理指标。
细叶百合(Liliumpumilum),花朵艳丽,是抗性极强的耐寒野生种百合,不仅是百合育种的良好亲本,在园林绿化应用方面也是宝贵的资源。本试验前期工作已经系统研究了百合休眠解除过程中鳞茎细胞的超微结构的变化,休眠打破时顶芽分生组织细胞中细胞器内部结构及数量增加,在液泡膜与质膜边缘形成内质网桥,细胞通过质膜内吞及胞间连丝进行物质交流[11],低温处理解除了特异转录和转译序列的阻抑作用,导致了茎顶细胞发生结构上的变化[12]。可见,植物细胞显微及超微结构的变化都与休眠进程的发展密切相关[13-15]。前人的研究很少将鳞茎的花芽分化进程与休眠解除进程联系在一起。细叶百合未见这方面的研究。因此,本试验中从5℃低温诱导细叶百合鳞茎休眠解除过程中淀粉粒和花芽分化变化的研究入手,对低温冷藏过程中百合鳞片及顶芽细胞淀粉粒数量和结构的变化及花芽分化动态进行细致的观察,以期为全面揭示细叶百合鳞茎休眠机理提供依据。本研究对补充细叶百合的生物学特性及调控细叶百合的花期和促成栽培都具有重要的实践指导意义。
1材料与方法
1.1 试验材料
供试材料为东北林业大学花圃中引种的野生种细叶百合,鳞茎周径4~6 cm。
1.2 试验方法与设计
试验于2011年10月中旬采收无病虫害的独头细叶百合鳞茎,用50%多菌灵可湿性粉剂800倍水溶液杀菌30 min后,充分洗净并晾干,以蒸汽消毒的潮湿珍珠岩为贮藏介质,置于5℃冰箱中冷藏处理。低温处理阶段,以12 d为周期,每次随机取10个鳞茎用于茎尖形态观察及石蜡切片、超薄切片的制作。利用实体解剖镜观察百合鳞茎整个花芽及中央纵切并拍照。
石蜡切片的制作: 每次取样时将内外层鳞片切成0.5 cm3左右,并切取顶芽分别用FAA固定液固定,采用常规石蜡切片法制片[16],番红固绿染色。切片厚度8 μm。Leica光学显微镜下观察茎尖结构及鳞片淀粉粒分布情况并拍照。
超薄切片的制作:每次取样时同时切取鳞茎顶芽生长锥基部组织0.5~1.0 mm3,用2.5%戊二醛固定,抽真空使材料下沉,4℃低温固定24 h以上,用0.1 mol/L磷酸缓冲液冲洗2 h,分别用浓度为30%,50%,70%,80%,90%,100%的乙醇逐级脱水,Epon812渗透及包埋。ULTRACUTE型超薄切片机切片,醋酸双氧铀、柠檬酸铅染色,H-7650透射电子显微镜下观察顶芽生长锥基部组织细胞淀粉粒分布情况并拍照。
淀粉粒观察每次取3个视野,每个视野5个细胞。分裂期细胞每次取5个视野。每个视野100个细胞进行观察统计。每个指标测定各重复3次。
1.3 数据处理方法
试验数据采用Excel软件进行计算和处理,利用DPS软件进行差异显著性分析。
2结果与分析
2.1 细叶百合鳞茎冷藏过程中鳞片及顶芽细胞淀粉粒的变化
由表1,图1,图2,图3,可清楚看到百合鳞茎外部鳞片、 内部鳞片及顶芽生长锥基部细胞内淀粉粒数量的变化过程。刚采收的百合鳞茎,鳞片薄壁组织细胞内含有大量的淀粉粒,充满了整个细胞腔(图1,0 d,图2,0 d)。 淀粉粒均为单粒,体积大小不等,以椭圆形和长卵形为主,可见染色较深呈黑褐色的淀粉粒的脐点,包裹在淀粉粒外围的半透明膜也被染成淡红色,休眠期外部鳞片细胞内淀粉粒数量平均为13.2个,内部鳞片细胞内淀粉粒数量平均为12.8个,外层鳞片淀粉粒数量比内层鳞片数量多一些。顶芽生长锥细胞内淀粉粒含量较高,平均每个细胞内可达28.5个,淀粉粒多为圆球形,有的散布在细胞腔中,有的存在于质体中(图3,0 d)。

图1 冷藏过程中细叶百合鳞茎外层鳞片淀粉粒的变化Fig.1 The changes of starch grain in outer scales of L. pumilum during cold storage
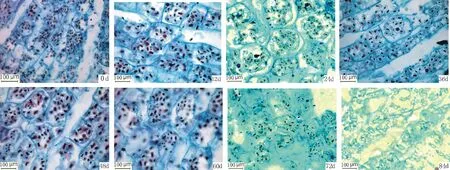
图2 冷藏过程中细叶百合鳞茎内层鳞片淀粉粒的变化Fig.2 The changes of starch grain in inner scales of L. pumilum during cold storage
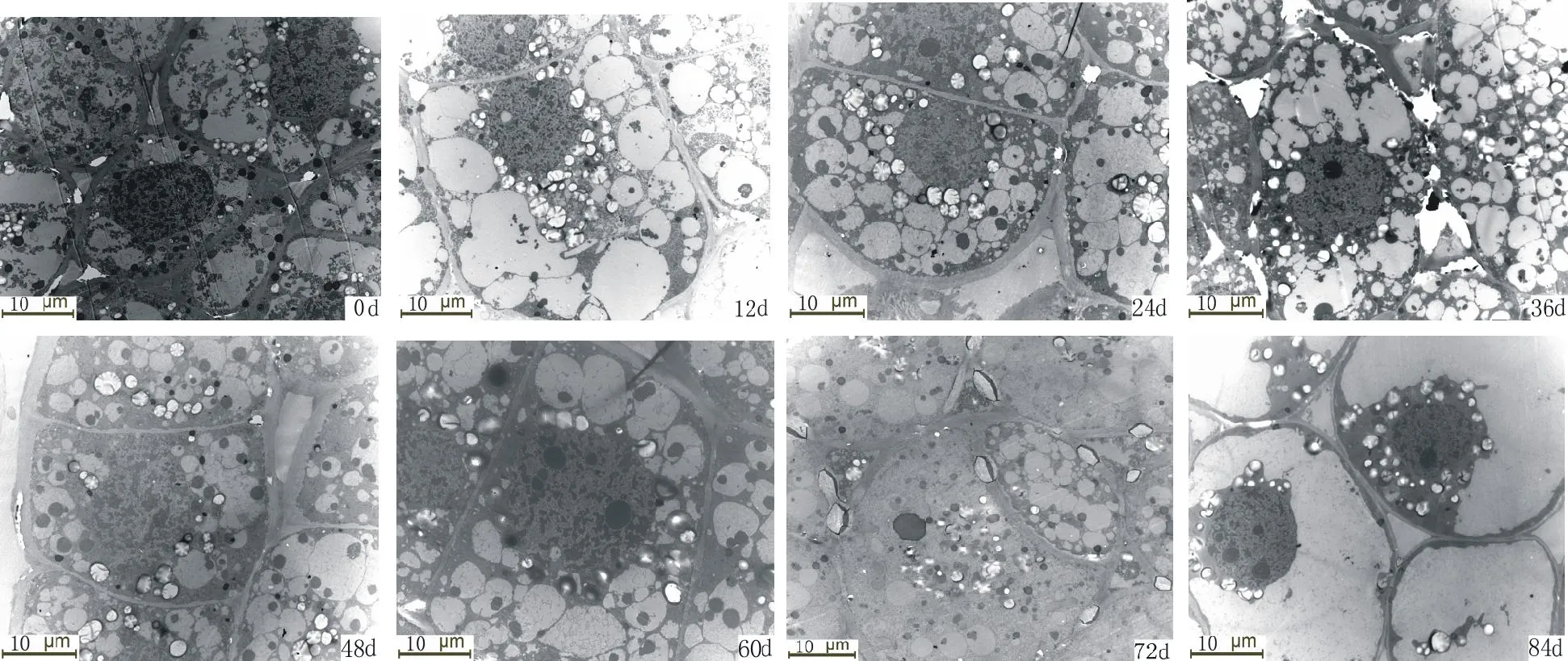
图3 冷藏过程中细叶百合鳞茎顶芽淀粉粒的变化Fig.3 The changes of starch grain in apical buds of L. pumilum during cold storage
从表1可以看出,在低温解除休眠过程中,百合鳞茎外部及内部鳞片细胞的淀粉粒数量随着冷藏时间的延长逐渐减少,说明鳞茎需要不断消耗贮藏在细胞中的淀粉。内外层鳞片内淀粉粒变化趋势相似,但外层鳞片比内层鳞片细胞内淀粉粒的数量变化幅度要大。冷藏84 d时内部鳞片淀粉粒的数量只有8.7个,而外部鳞片淀粉粒的数量减少到8.2个。冷藏过程中有些淀粉粒的轮廓变得模糊,可能是因为在贮藏过程中有些淀粉降解导致的。顶芽生长锥基部细胞内淀粉粒数量在冷藏过程中整体上呈下降的变化趋势,在鳞茎冷藏60~84 d内数量下降幅度较大,冷藏84 d时淀粉粒数量较采收时明显减少。冷藏过程中,淀粉粒主要分布在细胞核周围。采收时内外层鳞片淀粉粒数量与冷藏60~84 d内的数量存在显著差异。顶芽采收时淀粉粒数量只与冷藏84 d的数量差异显著。
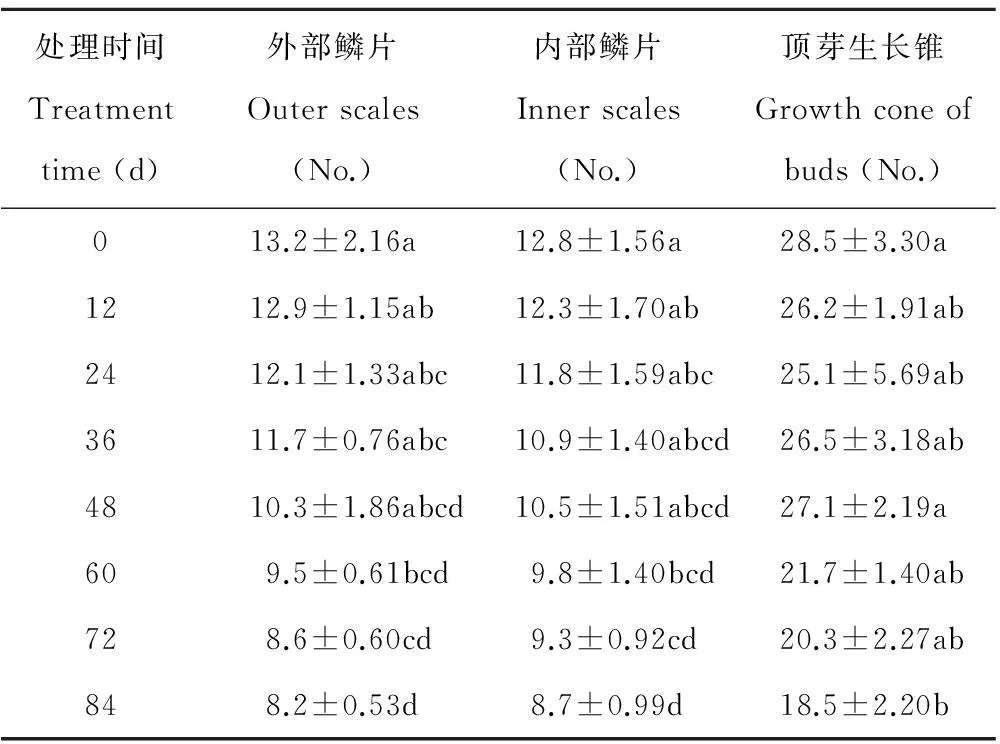
表1 冷藏过程中细叶百合鳞茎淀粉粒数量的变化
注:不同小写字母表示在P<0.05差异显著。下同。
Note: Different small letters mean significant difference atP<0.05.The same below.
2.2 细叶百合鳞茎冷藏过程中花芽分化特征及细胞分裂动态变化
细叶百合在夏季开花,花期较其他品种要早,在本试验中发现,细叶百合鳞茎在9月末至10月初开始进行花芽分化,10月中旬鳞茎采收进行冷藏时,花芽不透明(图4a),生长锥两侧有许多幼叶,休眠鳞茎的花芽生长锥体积增大,已经进入小花原基分化期(图4def),生长锥已经具有一定的高度和宽度。此时,顶芽基部组织两侧可见着色较深的丰富的维管束,在花序轴上可见2~3个圆球状突起,即为小花原基。本试验中细叶百合为3~5年生植株,多为2~3朵花。此时期顶芽分生区细胞观察不到有丝分裂现象(表2)。
百合鳞茎冷藏12~48 d内,顶芽生长锥的高度和宽度略有增加,差异不明显。此时期花芽没有明显分化,花芽主要处于小花原基分化期,鳞茎冷藏36 d时可观察到分裂期细胞,但数量很少,随冷藏时间的延长,细胞分裂数量增加,冷藏48 d时,花芽较冷藏初期明显变得水润(图4b),生长锥两侧幼叶增多,此时分裂期细胞已经增加到1.2个。分裂期细胞数量较36 d时没有显著变化(表2)。
细叶百合为两轮花被,外轮花被3片,内轮花被3片。鳞茎冷藏至60 d时,随着叶片的伸长,顶芽生长锥进入小花原基分化期后进一步生长发育,生长锥更为突起膨大,继续增高,生长锥的高度和宽度较冷藏0~48 d内没有显著地变化,冷藏0~60 d内,各取样时期之间生长锥的高度与宽度的变化也没有显著差异,生长锥中央及下部边缘隆起,两侧出现3个月牙形小凸起,形成的凸起即为外轮花被原基(图4g),此时已能清晰看到处于分裂后期的细胞(图5,60 d)。大部分细胞仍处于分裂间期。分裂期细胞数量较冷藏36 d时变化显著(表2)。
鳞茎冷藏至72 d时(图4h,i),顶芽生长锥的高度和宽度都有较大幅度地增加,花被原基进一步生长,在生长锥周围基部,外轮花被内侧的两个花被相邻处,出现3个三角形小突起,即为内轮花被原基,内轮花被与外轮花被形状相似,外轮花被较内轮花被稍宽。此时,细胞有丝分裂数量增加 (图5,72 d)。分裂期细胞数量较冷藏36 d时变化显著,与其他各时期间没有显著地变化(表2)。
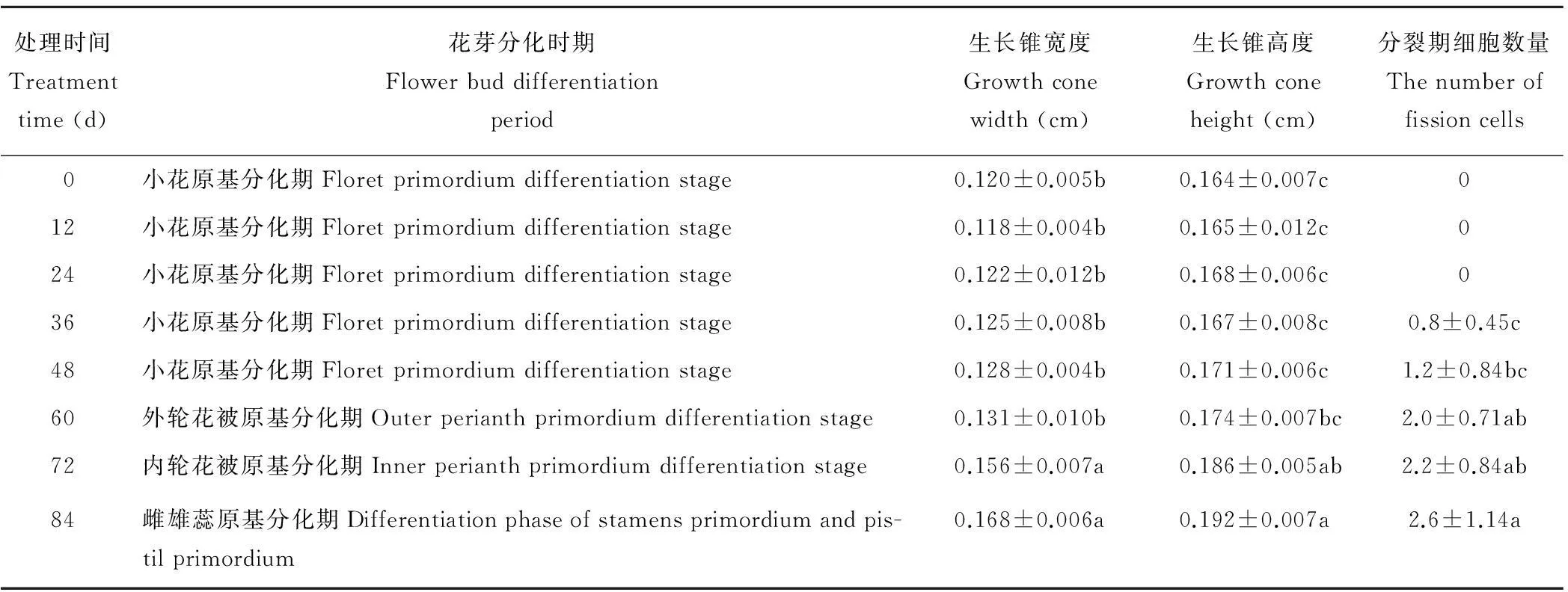
表2 细叶百合鳞茎冷藏过程中花芽分化过程及分裂期细胞数量的变化
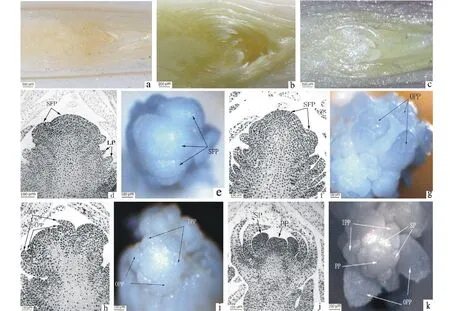
图4 细叶百合鳞茎冷藏过程中花芽分化过程Fig.4 The process of flower bud differentiation of L. pumilum during cold storage a:冷藏0 d;b:冷藏48 d;c:冷藏84 d; d~f:小花原基分化期;g:外轮花被原基分化期;h~i:内轮花被原基分化期;j~k:雌雄蕊原基分化期;LP:叶原基; SFP:小花原基;OPP:外轮花被原基;IPP:内轮花被原基;SP:雄蕊原基;PP:雌蕊原基。a: Refrigerated 0 days;b: Refrigerated 48 days;c: Refrigerated 84 days;d-f: Floret primordium differentiation stage;g: Outer perianth primordium differentiation stage; h-i:Inner perianth primordium differentiation stage; j-k:Differentiation phase of stamens primordium and pistil primordium; LP:Leaf primordium;SFP:Small floral primordium;OPP:Outer perianth primordium;IPP:Inner perianth primordium;SP:Stamen primordium;PP:Pistil primordium.
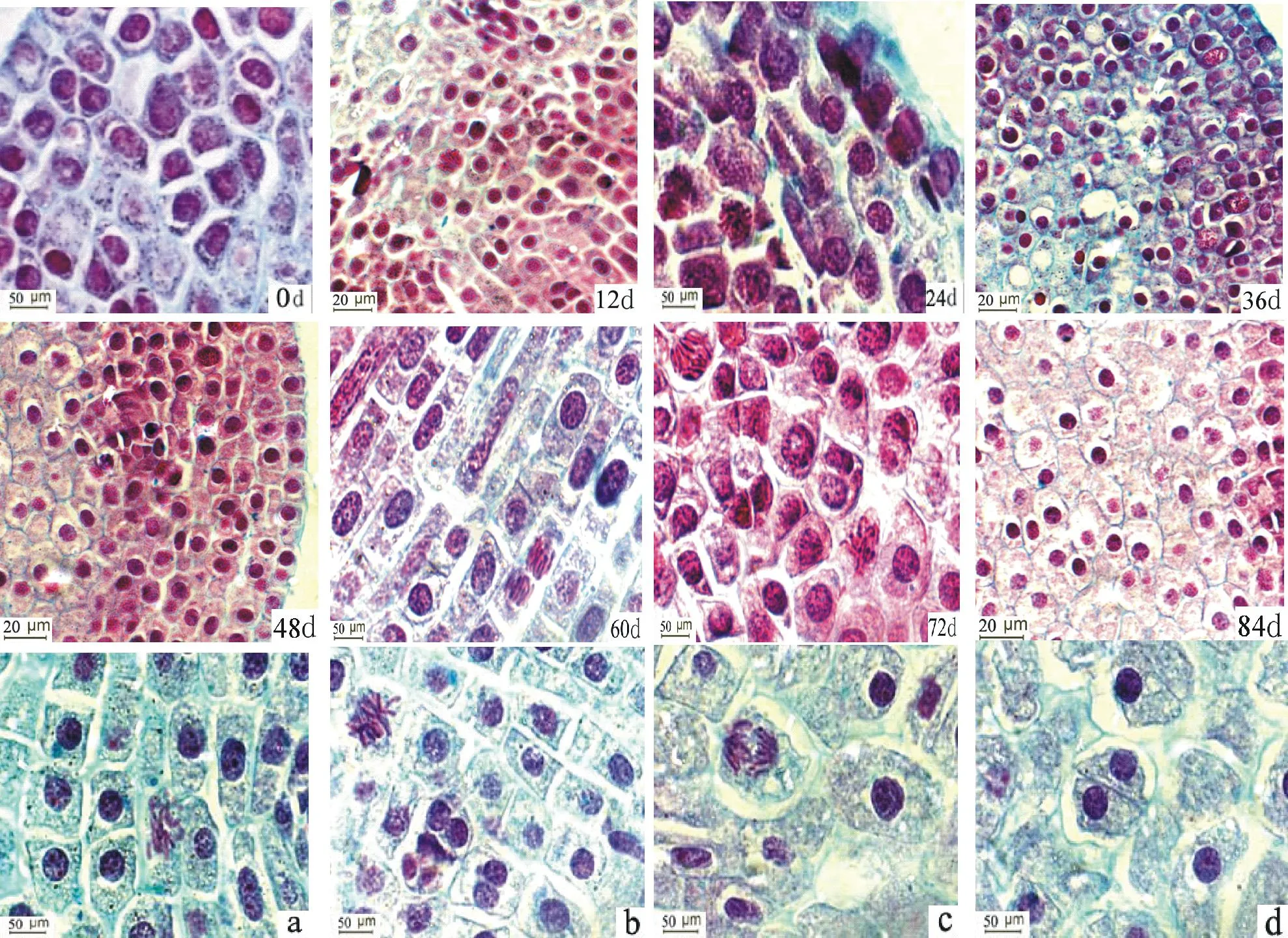
图5 细叶百合鳞茎冷藏过程中顶芽细胞有丝分裂的变化Fig.5 The changes of mitosis in apical buds of L. pumilum during cold storage a. 分裂前期;b. 分裂中期;c.分裂后期; d.分裂末期。a. prophase;b. metaphase;c.anaphase; d.telophase.
百合的雄蕊有6枚,鳞茎冷藏至84 d时,由于鳞茎细胞内新陈代谢活动比较活跃,花芽变得更加水润(图4c),生长锥两侧幼叶继续增多、伸长。顶芽生长锥的高度和宽度迅速增加,0~60 d各时期与冷藏72和84 d的生长锥的高度与宽度均在0.05水平上存在显著差异。花被原基形成后,花被内侧出现6个小突起,形成雄蕊原基,石蜡切片纵切图(图4j) 和在实体显微镜下观察(图4k)中,花被原基中央还没有逐渐凹陷。在部分分化芽中,可见雄蕊原基内侧的中央生长点形成一个比较大的突起,即为雌蕊原基(图4j,k)。此时, 顶芽内细胞有丝分裂数量大大增加,分裂期细胞数量较冷藏36和48 d时变化显著(表2)。在切片中可以明显看见处于分裂前期(图5a)、中期(图5b)、后期(图5c)、末期(图5d)的细胞。
3讨论
3.1 鳞茎休眠解除过程中细胞内淀粉粒的变化
百合鳞茎为贮藏器官,淀粉在鳞茎休眠过程中为重要的贮藏物质,为鳞茎休眠解除过程中的代谢活动提供能源。孙红梅等[17]研究表明,兰州百合低温解除休眠过程中,鳞茎的淀粉含量逐渐减少,贮藏后34 d顶芽迅速发育,此时是物质变化最为活跃的时期,淀粉明显降解,34~67 d淀粉含量变化幅度不大,本试验中鳞片淀粉粒的数量随贮藏时间的延长而下降,这一结果与管毕财等[18]研究龙牙百合(Liliumbrowniivar.viridulum)低温贮藏过程中鳞茎的淀粉含量变化结果是相符的。本试验中观察到的淀粉粒的数量变化与宁云芬等[19]的研究也是一致的。张月等[20]及柳文慧[21]指出兰州百合鳞片大小维管束中心细胞淀粉粒数量变化与大维管束周围细胞内淀粉粒数量的变化趋势基本相同。说明鳞片不同部位细胞内淀粉的变化是类似的。夏宜平等[22]在东方百合“索邦”栽种期取鳞茎的外层和内层鳞片,利用扫描电子显微镜观察鳞片中细胞的亚显微结构,可清楚地看到淀粉粒呈稍不规则的薄晶体状的近圆形或圆柱体形态,其内部没有任何结构。栽种期的内外层鳞片中存在明显的淀粉颗粒,多集中在细胞壁附近,内层鳞片的淀粉颗粒稍多于外层鳞片,这些结果与本试验的研究结果也是一致的。
目前,有关百合鳞片淀粉粒亚显微结构的变化已有研究,但百合顶芽细胞内淀粉粒变化的研究尚少。刘成运和彭隆金[23]对丽江百合(Liliumlijiangense)鳞茎发育过程中贮藏物质的细胞形态学观察中指出,鳞片细胞内含有2种贮藏颗粒,一种体积较大,椭圆形,另一种体积略小呈圆球形。较大的颗粒内含有淀粉物质,较小的颗粒内含有蛋白质、脂肪、多糖和少量核糖核酸。在本试验中发现,在冷藏过程中生长锥顶部不断增高,体积不断增大,芽不断伸长。试验中观察到顶部细胞内淀粉粒数量很少,基部细胞内淀粉粒数量很多,芽伸长生长过程中需要增大细胞体积和数量,在这个生长过程中需要贮藏物质代谢提供能量,基部细胞丰富的淀粉粒可能为顶部细胞提供了能源,但在冷藏36~48 d内顶芽基部淀粉粒数量又有所增加,在60 d后又逐渐减少,顶芽生长锥基部细胞内的淀粉粒主要是圆球形,这种圆球形的贮藏颗粒内可能还含有除了淀粉以外的其他物质,在鳞茎冷藏的不同时期不同的贮藏物质可能参与了代谢。鳞茎整个贮藏过程中,顶芽分生区细胞生长发育所需的能源物质在冷藏初期可能更直接来源于芽的下部组织,在冷藏后期还需要贮藏大量糖类营养物质的鳞片的供应。
3.2 鳞茎冷藏期花芽分化与休眠解除的关系
已有研究表明百合由于种类、品种的不同及种植地的气候条件有所差异,其花芽分化的时间及进程也不同。根据前人的研究可按百合花芽分化时间分为4种类型:第1种,花芽分化在夏季末开始,秋季完成。如毛百合[3];第2种,花芽分化在晚秋开始,至次年春天出土前完成,如日本百合;第3种,春季刚发芽时花芽开始分化,如条叶百合、轮叶百合[24];第4种,在春季发芽后约一个月开始出现花芽分化,如麝香百合[1]。这4种花芽分化类型在亚洲百合中均有存在,细叶百合属于亚洲百合野生种类。本试验中发现其花芽分化开始于秋季,在次年春天完成。在哈尔滨栽种的能露地越冬的百合中,毛百合的花芽分化较早,在5月中旬便能开花,细叶百合花芽分化较毛百合晚,其花期也稍晚,花期主要集中在5月末至6月初,其次,是亚洲百合栽培品种,花期主要集中在6月中下旬,可见,百合的花芽分化进程与其花期是一致的。
在试验中还发现,百合鳞茎的规格及鳞茎的贮藏温度不同,花芽分化也有所差异,5℃冷藏的鳞茎周径4~5 cm的百合花朵数多为2~3朵,而在0~4℃冷藏的8~10 cm的鳞茎花朵数量可达4~6朵,8~10 cm的鳞茎休眠期采收时基本进入了花被原基分化期。在鳞茎冷藏过程中不同花朵的分化时间上差距较大。周径4~5 cm的百合鳞茎在5℃冷藏84 d时鳞茎已经出芽,而此时花芽则处于雌雄蕊原基分化初期,雄蕊雌蕊分化程度较8~10 cm的鳞茎发芽时稍低,0~4℃冷藏的8~10 cm的鳞茎98 d时才能发芽[25]。2种鳞茎由于其贮藏温度不同,其休眠解除的时间不同,而且本试验发现,同一规格的鳞茎,在5℃冷藏条件下相比4℃贮藏鳞茎休眠解除时间稍短,花芽发育程度没有明显变化。不同规格鳞茎花芽分化进程上的差异是和其自身的发育程度相关的。鳞茎在5℃贮藏时较0~4℃冷藏的8~10 cm基质的含水量稍高,休眠解除进程相对较短,因此,含水量也是鳞茎休眠解除的一个关键的因素。百合有48条染色体,且有丝分裂过程中分裂间期时间较长,所以,进行有丝分裂的细胞大多处于分裂间期,整个冷藏期,间期细胞染色体变化不明显。鳞茎冷藏过程中,0~48 d内,花芽分化没有明显变化,冷藏初期细胞没有分裂现象,冷藏过程中,分裂期细胞数量极少。48 d后,花芽分化加快,48~84 d内已经进行了外轮花被原基、内轮花被原基及雌雄蕊原基的分化,而且细胞分裂数量明显增加。说明鳞茎休眠的完全解除是在48 d后开始的。因此,花芽分化的进程与鳞茎休眠解除的过程是密切相关的。
References:
[1]Huang J M, Yang J Y, Lin G D.The process of floral differentiation inLiliumlongifolorum. Acta Horticulturae Sinica, 1985, 12(3): 203-206.
[2]Ning Y F, Long M H, Tao J,etal. Morphological observation on flower bud differentiation ofLiliumformolongibulb. Acta Horticulturae Sinica, 2008, 35(9): 1368-1372.
[3]Feng F J. The Research on Flower Bud Differentiation and Late Development ofLiliumdahuricum[D]. Harbin: Northeast Forestry University, 1999.
[4]Ohkawa K, Kano A, Nukaya A. Time of flower bud differentiation in Asiatic hybrid lilies. Acta Horticulturae, 1990, 266: 211-220.
[5]Guo R, Zhao X Y, Wang W H,etal. Observation of morphological changes of lily bulb in bud differentiation periods. Journal of Shenyang Agricultural University, 2006, 37(1): 31-34.
[6]De Hertogh A A, Wilkins H F. The forcing of northwest grown Ace and Nellie White Easter lilies. Florists’ Review, 1971, 149: 29-31.
[7]Fukai S, Goi M. Floral initiation and development inLiliumlongiflorumThunb. Technical Bulletin of Faculty of Agriculture Kagawa University, 2001, 53: 31-34.
[8]Tu S P, Mu D, Liu C. The physiological and biochemical changes during flower bud differentiation of different lily cultivars. Chinese Agricultural Science Bulletin, 2005, 21(7): 207-209.
[9]Pak C, Vanderplas L H W, Deboer A D. Importance of dormancy and sink strength in sprouting of onions (Alliumcepa) during storage. Physiologia Plantarum, 1995, 94: 277-283.
[10]He X F. Microstructural and Ultrastructural Changes of Shoot Tip inLiliumbrowniivar.viridulumDuring Releasing Dormancy with Low Temperature[D]. Nanchang: Nanchang University, 2006.
[11]Chien C T, Ling L, Huan G,etal. Changes in ultrastructure and abscisic acid level, and response to applied gibberellins intaxus mairei seeds treated with warm and cold stratification.Annals of Botany, 1998, 81: 41-47.
[12]Zhao D G, Meng F J.Relationship between ultrastructural changes and zearalenone in triticum aestivum during vernalization. Acta Botanica Sinica, 1997, 39(6): 570-573.
[13]Fan W N, Sun X G, Ni J X,etal. Effect of photoperiod on phytochromes and endogenous hormones of alfalfa with different fall dormancies. Acta Prataculturae Sinica, 2014, 23(1): 177-184.
[14]Chen X Y, Liu M, Zhang X X,etal.Vegetative organ structures of ranunculaceae in northeastern china and notes on systematic implications. Acta Prataculturae Sinica, 2014, 23(3): 62-74.
[15]Feng L J, Yuan Z H, Yin Y L,etal.Effects of paclobutrazol on the photosynthetic characteristics and ultasatructure ofDahliapinnataleaves. Acta Prataculturae Sinica, 2014, 23(4): 114-121.
[16]Zeng X L. Practical Production Technology in Biology[M]. Beijing: Higher Education Press, 1987: 75-85.
[17]Sun H M, Li T L, Li Y F.Starch metabolism and sprouting of bulb inLiliumdavidiivar. Unicolor stored at different cold temperatures.Acta Horticulturae Sinica, 2004, 31(3): 337-342.
[18]Guan B C, Yang B Y, Luo L P,etal. Transformation of glucide during dormancy breaking at low temperature. Journal of Nanchang University, 2005, 29(1): 92-95.
[19]Ning Y F, Long M H, Tao J,etal.Microscopic observation of starch grains in the middle scales ofLiliumformolongiduring low temperature storage and flower bud differentiation. Acta Horticulturae Sinica, 2011, 38(9): 1770-1774.
[20]Zhang Y, Sun H M, Shen X Q,etal. Changes in ultrastructure of starch granule in the middle scales ofLiliumdavidiivar. unicolor during the bulb development and storage at low temperature. Acta Horticulturae Sinica, 2007, 34(3): 699-704.
[21]Liu W H. Study on Structure of Vascular Bundle and Starch Metabolism of Lily Bulb during Bulb Development[D]. Shenyang: Shenyang Agricultural University, 2012.
[22]Xia Y P, Zheng H J, Huang C H,etal. Accumulation and distribution of14C-photosynthate during bulb development ofLiliumoriental hybrid. Journal of Nuclear Agricultural Sciences, 2006, 20(5): 417-422.
[23]Liu C Y, Peng L J. Cytomorphological observation on the store substance in the bulb cell ofLiliumlijiangense. Acta Botanica Yunnanica, 1987, 9(3): 315-318.
[24]Mu D. Ornamental Lily: Physical, Cultivation, Bulb Production and Breeding[M]. Beijing: China Agriculture Press, 2005: 237-238.
[25]Wang J Y, Liu F, Su X,etal. Morphological observation on flower bud differentiation ofLiliumpumilumbulb. Pratacultural Science, 2014, 31(5): 878-883.
参考文献:
[1]黄济明, 杨建瑛, 林国栋. 麝香百合花芽分化过程的观察. 园艺学报, 1985, 12(3): 203-206.
[2]宁云芬, 龙明华, 陶劲, 等. 新铁炮百合花芽分化过程的形态学观察. 园艺学报, 2008, 35(9): 1368-1372.
[3]冯富娟. 毛百合花芽分化及其后期发育的研究[D]. 哈尔滨: 东北林业大学, 1999.
[5]郭蕊, 赵祥云, 王文和, 等. 百合花芽分化的形态学观察. 沈阳农业大学学报, 2006, 37(1): 31-34.
[8]涂淑萍, 穆鼎, 刘春. 不同百合品种花芽分化期的生理生化变化. 中国农学通报, 2005, 21(7): 207-209.
[10]贺晓芳. 龙牙百合低温解除休眠中茎尖的显微和超微结构变化[D]. 南昌: 南昌大学, 2006.
[12]赵德刚, 孟繁静. 冬小麦低温春化过程中茎尖细胞超微结构的变化与玉米赤霉烯酮的关系. 植物学报, 1997, 39(6): 570-573.
[13]樊文娜, 孙晓格, 倪俊霞, 等. 光周期对不同秋眠型苜蓿光敏色素和内源激素的影响. 草业学报, 2014, 23(1): 177-184.
[14]程薪宇, 刘玫, 张欣欣, 等. 东北毛茛科植物营养器官结构及其系统学意义. 草业学报, 2014, 23(3): 62-74.
[15]冯立娟, 苑兆和, 尹燕雷, 等. 多效唑对大丽花叶片光合特性和超微结构的影响. 草业学报, 2014, 23(4): 114-121.
[16]曾小鲁. 实用生物学制片技术[M]. 北京: 高等教育出版社, 1987: 75-85.
[17]孙红梅, 李天来, 李云飞. 不同贮藏温度下兰州百合种球淀粉代谢与萌发关系初探. 园艺学报, 2004, 31(3): 337-342.
[18]管毕财, 杨柏云, 罗丽萍, 等. 低温解除龙牙百合休眠过程中糖类物质的转化. 南昌大学学报, 2005, 29(1): 92-95.
[19]宁云芬, 龙明华, 陶劲, 等. 百合低温贮藏和花芽分化过程中鳞片细胞淀粉粒的显微观察. 园艺学报, 2011, 38(9): 1770-1774.
[20]张月, 孙红梅, 沈向群, 等. 百合鳞茎发育和低温贮藏过程中淀粉粒亚显微结构的变化. 园艺学报, 2007, 34(3): 699-704.
[21]柳文慧. 百合鳞茎发育过程中维管束结构及淀粉代谢研究[D]. 沈阳: 沈阳农业大学, 2012.
[22]夏宜平, 郑慧俊, 黄春辉, 等. 东方百合鳞茎更新发育的碳同化物积累与分配. 核农学报, 2006, 20(5): 417-422.
[23]刘成运, 彭隆金. 丽江百合鳞茎细胞内贮藏物质的细胞形态学观察. 云南植物研究, 1987, 9(3): 315-318.
[24]穆鼎. 观赏百合: 生理、栽培、种球生产与育种[M]. 北京: 中国农业出版社, 2005: 237-238.
[25]王家艳, 刘芳, 苏欣, 等. 细叶百合鳞茎花芽分化过程观察. 草业科学, 2014, 31(5): 878-883.
刘芳,田忠平,蔡英杰,张雨,周蕴薇. 细叶百合低温解除休眠过程中鳞茎细胞淀粉粒及花芽分化的变化. 草业学报, 2015, 24(9): 154-162.
LIU Fang, TIAN Zhong-Ping, CAI Ying-Jie, ZHANG Yu, ZHOU Yun-Wei. Change in starch grains and flower bud differentiation ofLiliumpumilumbulbs during breaking of dormancy under refrigerated conditions. Acta Prataculturae Sinica, 2015, 24(9): 154-162.
通讯作者*Corresponding author. E-mail:dlzhyw@126.com
作者简介:刘芳(1980-),女,黑龙江双城人,实验师,硕士。E-mail:byndliufang@163.com
基金项目:国家自然科学基金(31470698)资助。
收稿日期:2014-10-20;改回日期:2014-11-24
DOI:10.11686/cyxb2014428http://cyxb.lzu.edu.cn
