外源Si对盐胁迫下甘草幼苗形态及生理指标的影响
2016-01-28崔佳佳张新慧李月彤周达张恩和
崔佳佳,张新慧,李月彤,周达,张恩和*
(1.甘肃农业大学农学院,甘肃 兰州 730070;2.宁夏医科大学药学院,宁夏 银川 750004;3.宁夏回药现代化工程技术研究中心,宁夏 银川
750004;4.宁夏回医药协同创新中心,宁夏 银川 750004;5.宁夏医科大学回医药现代化省部共建教育部重点实验室,宁夏 银川 750004)
外源Si对盐胁迫下甘草幼苗形态及生理指标的影响
崔佳佳1,张新慧2,3,4,5,李月彤2,周达2,张恩和1*
(1.甘肃农业大学农学院,甘肃 兰州 730070;2.宁夏医科大学药学院,宁夏 银川 750004;3.宁夏回药现代化工程技术研究中心,宁夏 银川
750004;4.宁夏回医药协同创新中心,宁夏 银川 750004;5.宁夏医科大学回医药现代化省部共建教育部重点实验室,宁夏 银川 750004)
摘要:为深入了解Si对盐胁迫下甘草幼苗的影响,本实验采用培养皿滤纸床进行发芽试验,以乌拉尔甘草幼苗为试验材料,在两种浓度NaCl溶液胁迫下设置不同浓度的硅溶液对甘草幼苗进行处理,通过测定幼苗形态(胚根、胚芽)及生理(质膜相对透性、丙二醛和过氧化物酶)指标,以探讨在盐胁迫下外源硅对甘草幼苗形态及生理指标的影响。结果表明,在NaCl胁迫下,加入硅(Si)溶液后可以有效增加幼苗胚芽和胚根的长度及重量。在低盐(100 mmol/L)胁迫下,Si浓度为0.4 mmol/L时对胚根生长的促进最强;在高盐(200 mmol/L)胁迫下,Si浓度为0.8 mmol/L时对胚根生长的促进作用最强。外源Si也不同程度提高了过氧化物酶活性、渗透调节物质脯氨酸含量,以及丙二醛含量和质膜相对透性。由此可见,在盐胁迫条件下,加入适宜浓度的外源硅,可以通过保持一定的抗渗透胁迫能力和清除活性氧的能力,进而保持膜的稳定,来缓解盐胁迫对甘草幼苗生长的抑制作用。
关键词:甘草;硅;盐胁迫;幼苗;生理特性
Effect of silicon addition on seedling morphological and physiological indicators ofGlycyrrhizauralensisunder salt stress
CUI Jia-Jia1, ZHANG Xin-Hui2,3,4,5, LI Yue-Tong2, ZHOU Da2, ZHANG En-He1*
1.CollegeofAgronomy,GansuAgriculturalUniversity,Lanzhou730070,China; 2.CollegeofPharmacy,NingxiaMedicalUniversity,Yinchuan750004,China; 3.NingxiaEngineeringandTechnologyResearchCenterofHuiMedicineModernization,Yinchuan750004,China; 4.NingxiaCollaborativeInnovationCenterofHuiMedicine,Yinchuan750004,China; 5.KeyLaboratoryofHuiMedicineModernization,MinistryofEducation,Yinchuan750004,China
Abstract:In this study, a water culture experiment was conducted to investigate the effect of silicon addition on the morphological indicators (radicle, seed germ) and physiological indicators [membrane permeability, malondialdehyde (MDA) level and peroxidase activities] of Glycyrrhiza uralensis seedlings under salt stress. Two NaCl concentrations (100 and 200 mmol/L) and six Si levels (0, 0.4, 0.8, 1.2, 1.6 and 2.0 mmol/L) were set as treatments in the experiment. Potassium silicate (K2SO4) was used as the source of Si. The Si addition can effectively increase the length and dry weight of germ and radicle of G. uralensis seedlings under salt stress. Under 100 mmol/L NaCl, the 0.4 mmol/L Si treatment promoted radicle growth the most among all the Si treatments, while under 200 mmol/L NaCl, the 0.8 mmol/L Si treatment promoted radicle growth the most. Exogenous Si addition was also able to increase the peroxidase activity and proline content, and reduce the levels of MDA under salt stress. In conclusion, G. uralensis showed enhanced osmotic stress resistance and reactive oxygen scavenging capacity under salt stress when exogenous Si was added to the culture medium and Si addition alleviated growth suppression of G. uralensis seedlings caused by salt stress.
Key words:Glycyrrhiza uralensis; silicon; salt stress; growth parameters; physiological parameters
甘草(Glycyrrhizauralensis)为多年生豆科草本植物,主要以干燥的根及根状茎入药,药材名为甘草。甘草性平、味甘,具有润肺、清热解毒、调和诸药等功效。其地下根和根茎发达,具有较强的抗旱、抗寒、耐盐碱和防风固沙的能力[1]。甘草野生资源主要适合在含盐量0.1%~0.2%的土壤中生长,能忍耐含盐量0.3%~0.6%的盐化条件,在含盐量1%~2%的盐土上生长不良[1-3]。然而,近年来研究表明盐分胁迫对栽培甘草生长发育有一定的抑制作用,当NaCl浓度达到50 mmol/L或0.3%时就显著抑制甘草幼苗或一年生移栽苗的生长,且这种抑制效应具有浓度效应[4-6]。目前土壤盐渍化已成为困扰人工栽培甘草的重大问题之一,因此,如何提高栽培甘草的耐盐性就成为目前研究的热点。
Si是植物生长发育的有益元素,更是一种环境友好型元素[7]。近年来大量研究表明, Si不仅能促进植物生长发育[8-11], 也可以降低盐分胁迫对植物体的伤害[11],提高作物对盐环境胁迫的抗性。目前有关盐胁迫下外源Si对植物的影响主要集中在水稻(Oryzasativa)、玉米(Zeamays)、大麦(Hordeumvulgare)等籽粒类作物上[12-15],而在像甘草等根及根茎类作物上尚未见报道。
本课题组前期研究发现硅直接参与了甘草种子萌发出苗和幼苗生长的生理生化过程,且较低浓度的外源硅对甘草的盐害有一定的缓解作用[16]。因此,本试验在前期研究基础上,进一步以发芽的乌拉尔甘草幼苗为研究对象,通过研究外源Si 对盐胁迫下甘草幼苗的形态结构及生理指标的影响,以期从抗氧化角度阐明硅缓解甘草盐胁迫的生理生化机制,对提高人工栽培甘草的耐盐性提供科学依据。
1材料与方法
1.1 供试材料
试验材料为乌拉尔甘草种子,种子收获于2012年,收获并净种后,将种子装入牛皮纸袋放置冰箱冷藏室贮藏,于2013年8月开始试验。
1.2 种子预处理
在自然环境下,由于甘草种子种皮较厚而抑制发芽,导致甘草种子自然萌发率为10%~20%[17]。为了提高种子萌发率,在人工种植播种前通常要进行甘草种子预处理(种皮打磨或酸处理)。本试验选取籽粒饱满、大小一致的甘草种子,用85%的浓H2SO4处理45 min(打破因种皮抑制而导致的种子休眠)后,用无菌水冲洗3遍,再用0.1%的H2O2消毒10 min,最后用无菌水冲洗。洗净后置于玻璃杯中用无菌水浸泡8 h后待用。
1.3 试验方法
通过前期实验结果确定适宜的盐溶液与Si元素的浓度梯度范围:盐分设置为NaCl单盐溶液,浓度设置为100 mmol/L(Na1)、200 mmol/L(Na2)两个盐分处理,外源Si采用K2SiO3溶液,浓度设置为0 mmol/L(Si0)、 0.4 mmol/L(Si1)、0.8 mmol/L(Si2)、1.2 mmol/L(Si3)、1.6 mmol/L(Si4)、2.0 mmol/L(Si5)6个梯度, 试验中因加入K2SiO3引入K+,用KCl来平衡其误差。采用培养皿纸上发芽法,将种子用无菌滤纸吸去种子表皮多余的水分,均匀摆放在铺有被混合溶液浸湿的2层无菌滤纸的培养皿中,每皿81粒,每个处理设置3个重复,称量培养皿重量后置于恒温25℃的人工气候培养箱中黑暗培养。为避免水分蒸发,盐分在滤纸上积累,每天早晚(早上10点,下午16点)定量加入无菌水至恒重,以保证各处理中盐及硅浓度一致。
1.4 测定方法
待种子发芽后(以胚根露出2 mm为发芽标准)第10天结束发芽实验,然后统计其胚根胚芽长度、重量以及次生根个数,并取样测定各项生理指标。质膜透性测定采用电导率法[18], 过氧化物酶( POD) 活性的检测参照Rao等[19]的愈创木酚氧化法,以每分钟A值的变化值表示酶活性大小,即以ΔA470U/(g·min)表示。丙二醛(MDA)采用硫代巴比妥酸法,单位用μmol/L来表示。
1.5 统计方法
试验数据采用Excel 2010和SPSS 11.5软件进行方差分析和显著性检验,方差分析多重比较用Duncan法(P<0.05),各图表中的数据均为3次重复平均值。
2结果与分析
2.1 Si对盐胁迫下甘草幼苗形态特征的影响
2.1.1Si对甘草胚芽和胚根长度的影响由图1可看出,在Na1胁迫下,外源Si对甘草幼苗胚芽长度和胚根长度均没有显著影响。在Na2胁迫下,Si2处理显著增加了胚根长度,较Si0增加了25.45%。
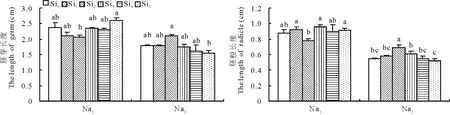
图1 Si对盐胁迫下甘草胚芽和胚根长度的影响Fig.1 Effect of silicon addition on length of germ and radicle G. uralensis seedling under salt stress 不同小写字母表示差异显著(P<0.05),下同。The different small letters mean the significant differences at P<0.05, the same below.
2.1.2Si对甘草次生根数量的影响由图2可看出,Si处理显著影响了盐胁迫下甘草幼苗的次生根数量。在Na1胁迫下,与Si0相比,Si5处理的甘草幼苗次生根数量提高了67.43%,差异达到显著水平。在Na2胁迫下,甘草幼苗次生根个数随Si浓度的增加呈现先增加后减少的趋势,但均与Si0没有显著差异。
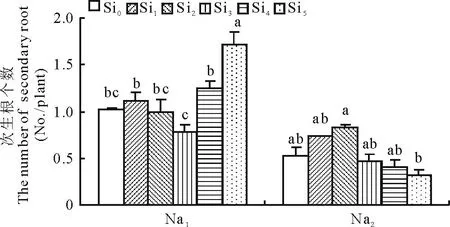
图2 Si对盐胁迫下甘草幼苗次生根数量的影响Fig.2 Effect of silicon addition on the number of secondary root of G. uralensis seedling under salt stress
2.1.3Si对甘草胚芽和胚根干重的影响由图3可看出,在Na1胁迫下,胚芽干重随着Si浓度的增加呈现逐渐下降的趋势,而胚根干重随着Si浓度的增加呈现逐渐上升的趋势。与Si0相比,Si1、Si3、Si4和Si5处理胚芽干重分别降低了6.71%,7.29%,9.23%和9.07%,差异均达到显著水平;Si1、Si2、Si3、Si4和Si5处理胚根干重分别提高了17.31%,23.72%,33.77%,30.87%和38.84%。在Na2胁迫下,除Si1处理显著降低胚芽干重外,其他浓度Si处理对胚芽干重均没有显著影响;所有浓度Si处理的胚根干重显著增加,Si1、Si2、Si3、Si4和Si5处理分别较Si0增加了26.73%,29.66%,20.70%,25.88%和16.27%。

图3 Si对盐胁迫下甘草幼苗胚芽和胚根干重的影响Fig.3 Effect of silicon addition on the dry weight of germ and radicle of G. uralensis seedling under salt stress
2.2 Si对盐胁迫下甘草幼苗生理指标的影响
2.2.1Si对盐胁迫下甘草幼苗保护酶POD的影响由图4可以看出,外源Si处理显著影响盐胁迫下甘草幼苗POD活性,且影响趋势因盐胁迫程度和Si浓度而异。在Na1胁迫下,在Si4处理下甘草幼苗POD活性显著提高,较Si0提高了35.92%;在Na2胁迫下,Si1、Si2、Si4和Si5处理均显著降低POD活性,分别较Si0降低了40.91%,48.57%,42.45%和31.85%。
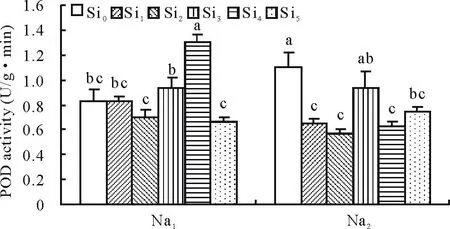
图4 Si对盐胁迫下甘草幼苗POD活性的影响Fig.4 Effect of silicon addition on the POD activity of G. uralensis seedling under salt stress
2.2.2Si对盐胁迫下甘草幼苗游离脯氨酸含量的影响由图5可以看出,在盐胁迫下,甘草幼苗游离脯氨酸含量均随Si浓度的增加呈现出先增加后减少的趋势。在Na1胁迫下,与Si0处理相比,在Si2处理下甘草幼苗游离脯氨酸含量显著增加,较Si0增加了30.79%。在Na2胁迫下,甘草幼苗游离脯氨酸含量在Si3处理下显著高于Si0处理,较Si0增加了71.91%。
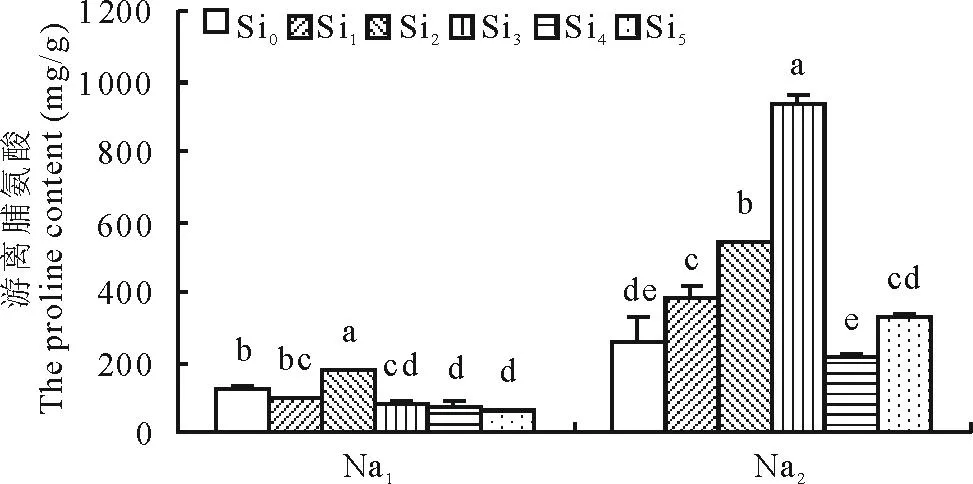
图5 Si对盐胁迫下甘草幼苗中游离脯氨酸含量的影响Fig.5 Effect of silicon addition on the proline content of G. uralensis seedling under salt stress
2.2.3Si对盐胁迫下甘草幼苗MDA含量的影响由图6可以看出,在Na1胁迫下,所有浓度Si处理除Si4外显著降低甘草幼苗MDA含量,且随Si浓度的增加呈现先降低后升高的趋势。与Si0相比,Si1、Si2、Si3、Si4和Si5处理MDA含量分别降低了5.14%,29.45%,21.79%,-3.85%和6.41%,差异均显著。在Na2胁迫下,Si1、Si2、Si3、Si4和Si5处理均显著降低MDA活性,分别较Si0降低了13.63%,14.77%,5.68%,1.14%和15.91%。
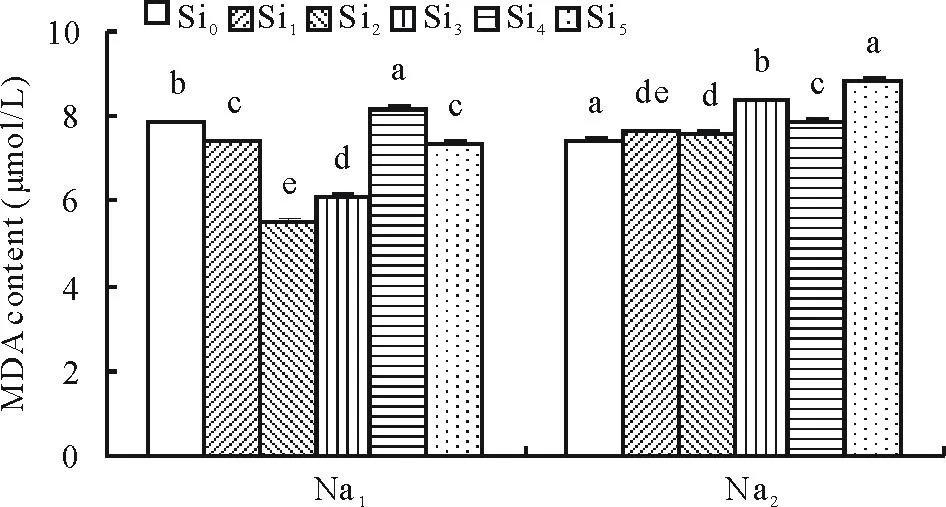
图6 Si对盐胁迫下甘草幼苗MDA含量的影响Fig.6 Effect of silicon addition on the MDA content of G. uralensis seedling under salt stress
2.2.4Si对盐胁迫下甘草幼苗质膜相对透性的影响由图7可以看出,在盐胁迫下,Si处理显著影响了甘草幼苗的质膜相对透性。在Na1胁迫下,甘草幼苗的质膜相对透性随Si浓度的增加呈现先后升高降低的趋势。与Si0处理相比,在Si2处理下甘草幼苗质膜相对透性显著增加,较Si0增加了8.75%。在Na2胁迫下,甘草幼苗质膜相对透性在Si5处理下显著高于Si0处理,较Si0增加了8.43%。
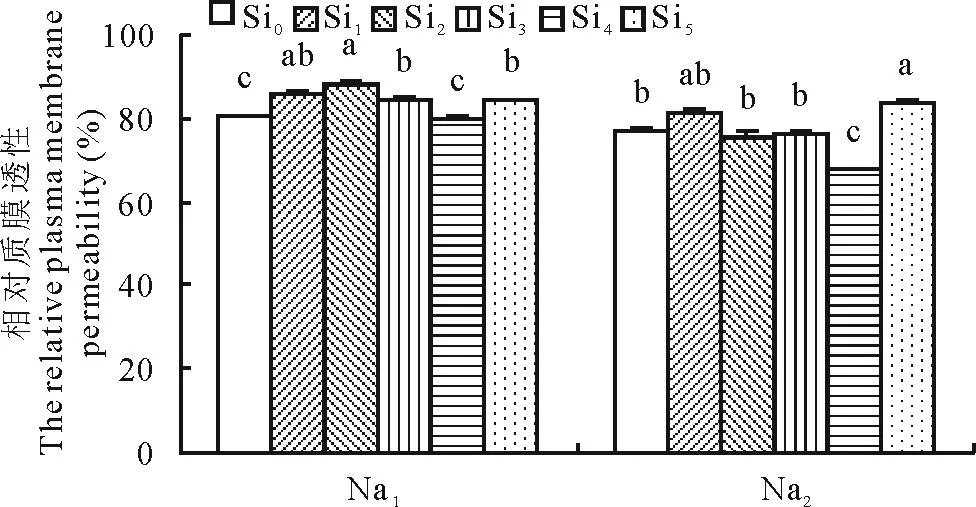
图7 Si对盐胁迫下甘草幼苗质膜相对透性的影响Fig.7 Effect of silicon addition on the relative plasma membrane permeability of G. uralensis seedling under salt stress
3结论与讨论
3.1 Si对盐胁迫下甘草幼苗形态特征的影响
盐胁迫对植物个体形态发育具有显著的影响,不同浓度盐胁迫对植物最普遍和最显著的效应就是抑制生长[20]。Matoh等[21]和Ahmad等[12]的试验结果表明, 硅提高水稻和小麦(Triticumaestivum)的抗盐性和干物质量。本试验结果表明,Si对盐胁迫下甘草幼苗生长有明显的促进作用。在Na1(100 mmol/L NaCl)胁迫下,2.0 mmol/L Si使不定根的个数增加了67.43%,胚根干重提高 了38.84%,但是观察其形态发现在2.0 mmol/L时甘草根部较粗短,尖端发黑有坏死现象,生长潜力不够好;而在0.4 mmol/L 时显著提高根干重,且对根长和次生根数量已有一定的促进作用。在Na2(200 mmol/L NaCl)盐胁迫下,0.8 mmol/L Si明显提高甘草幼苗胚根的长度及干重,分别增加了25.45%和29.66%。由以上结果可以看出Si对盐胁迫下甘草幼苗根系的生长具有一定的促进作用,但这种促进作用因盐胁迫程度和硅浓度而异。
3.2 Si对盐胁迫下甘草幼苗保护酶活性和渗透调节物质的影响
在盐胁迫下,细胞活性氧的产生与清除这一动态平衡将会被打破[22]。因此,植物在逆境胁迫下会在一定程度上提高其自身的抗氧化能力,从而提高植物对逆境的适应性。樊哲仁等[23]实验证明Si可显著提高盐胁迫下麻疯树(Jatrophacurcas)幼苗叶片POD活性。本试验结果表明,在Na1(100 mmol/L NaCl)胁迫下,1.6 mmol/L Si显著提高POD活性,较Si0提高了35.92%;而在Na2(200 mmol/L NaCl)胁迫下,加入外源Si后使得POD活性显著下降,与Si0相比,0.8 mmol/L Si处理POD活性下降了48.57%。
植物在正常条件下游离脯氨酸含量很低,但是在逆境条件下便会大量积累,大量的脯氨酸会使植物渗透胁迫耐性增加。从本试验的数据可以发现Si可显著提高植物体内游离脯氨酸含量。在Na1(100 mmol/L NaCl)胁迫下,0.8 mmol/L Si处理较Si0处理中游离脯氨酸含量提高30.79%;在Na2(200 mmol/L NaCl)胁迫下,1.2 mmol/L Si处理中游离脯氨酸含量增加71.91%。由此可见添加外源硅可通过增加幼苗游离脯氨酸含量而提高甘草的耐盐性,进而缓解盐胁迫对甘草幼苗的伤害。
3.3 Si对盐胁迫下甘草幼苗膜脂过氧化作用的影响
植物在逆境下遭受伤害与活性氧积累诱发的膜脂过氧化作用密切相关,过多的活性氧会导致膜脂过氧化、膜的选择通透性丧失。MDA是植物膜脂过氧化的最终产物,是检测植物膜伤害的一个重要指标,其量可以用来表示植物质膜过氧化的程度[24]。在本试验中,Na1(100 mmol/L NaCl)胁迫下加入Si后显著降低MDA含量, 0.8 mmol/L Si较Si0处理降低29.45%。武俊英等[25]在燕麦(Avena)上的研究发现植物在逆境下会提高细胞液的渗透压和细胞质的粘滞性,使得质膜的调节作用增加,透性降低。本试验中,Si处理可显著增加甘草幼苗质膜相对透性,使其Na1(100 mmol/L NaCl)、Na2(200 mmol/L NaCl)胁迫下分别在Si2、Si5处理升高8.75%和8.43%。说明Si可以通过缓解盐胁迫下甘草幼苗细胞膜系统所受到的伤害,增加甘草幼苗细胞膜的稳定性,使其能适应一定的盐渍环境。
综上所述,外源硅可促进盐胁迫下甘草幼苗的生长,但这种促进作用因盐胁迫程度和硅浓度而异。在Na1(100 mmol/L NaCl)胁迫下,Si浓度为0.4 mmol/L时对甘草幼苗生长的促进作用最强;在Na2(200 mmol/L NaCl)胁迫下,Si浓度为0.8 mmol/L时对甘草幼苗生长的促进作用最强。且硅对盐胁迫下甘草生长的促进可能是通过提高甘草幼苗保护酶POD活性,增加渗透调节物质脯氨酸含量,调控其膜脂过氧化作用而实现的。
References:
[1]Yang J S, Zhang E H, Huang G B,etal. The influence of H2O2, NaCl and SA sand grind on germination characteristics of liquorice seeds. Journal of Gansu Agricultural University, 2009, 44(5): 88-91.
[2]Li X Y. The research of classification system and new taxa aboutGlycyrrhiza. Bulletin of Botanical Research, 1993, 13(1): 14-43.
[3]Gu H Y. Study on Resources Ecology of Chinese Licorice[D]. Harbin: Northeast Forestry University, 2001.
[4]Wei Z Z, Li J Z. Effect of harvest time and depth on quality and production efficiency ofGlycyrrhizauralensis. Pratacultural Science, 2006, 23(8): 21-23.
[5]Yang F L, Li K C, Hu C L. The beginning report on the study of artificial breeding and cultivation techniques of seeds atGlycyrrhizauralensis. Pratacultural Science, 2004, 21(12): 90-94.
[6]Shao X L, Du B, Zhang Y,etal. Artificial cultivation technique ofGlycyrrhizauralensis. Gansu Rural Science and Technology, 2003, (4): 34-35.
[7]Wang J L, Huang X J, Zhong T Y,etal. The overview about sustainable utilization of saline alkali soil. Acta Geographica Sinica, 2011, 66(5): 673-684.
[8]Ando H, Kakuda K, Fuji H,etal. Growth and canopy structure of rice plants grown under field conditions as affected by Si application. Soil Science and Plant Nutrition, 2002, 48(3): 429-432.
[9]Gao X, Zou C, Wang L,etal. Silicon improves water use efficiency in maize plants. Journal of Plant Nutrition, 2005, 27(8): 1457-1470.
[10]Hossain M T, Mori R, Soga K,etal. Growth promotion and an increase in cell wall extensibility by silicon in rice and some other Poaceae seedlings. Journal of Plant Research, 2002, 115(1): 0023-0027.
[11]Inanaga S, Higuchi Y, Chishaki N. Effect of silicon application on reproductive growth of rice plant. Soil Science and Plant Nutrition, 2002, 48(3): 341-345.
[12]Ahmad R, Zaheer S, Ismail S. Role of silicon in salt tolerance of wheat (TritiumaestivumL.). Plant Science,1992, 85: 43-50.
[13]Liang Y C. Effects of Si on leaf ultrastructure, chlorophyll content and photosynthetic activity in barley under salt stress. Pedosphere, 1998, 8: 289-296.
[14]Yu B J, Zhang W H, Liu Y L. Effects of NaCl on protein and content of free amino acids in roots of barley. Acta Botanica Boreali-Occidentalia Sinica, 1997, 17(4): 439-445.
[15]Ma C C, Li Q F, Shu L Z,etal.Preliminary explanation of the mechanism about effects of silicon on maize seed germination and seedling growth. Acta Agronomica Sinica, 2002, 9(5): 665-669.
[16]Zhang X H, Lang D Y, Bai C C,etal. Effects of silicon addition on seed germination and seedling growth ofGlvarrhizauralensisunder salt stress. Chinese Traditional and Herbal Drugs, 2014, 7(45): 2075-2079.
[17]Wang Y X, Chen H Y, Xie L Q,etal. The experiments of improving the germination and seekling ratio ofGlycyrrhiza. Seed, 2004, 10(23): 27-29.
[18]Hao J J, Liu Y J. The Experiment Technology of Plant Physiology[M]. Shenyang: Liaoning Science and Technology Press, 2001.
[19]Rao M V, Paliyath G, Ormrod D P. Ultraviolet-B-and ozone-induced biochemical changes in antioxidant enzymes ofArabidopsisthaliana. Plant Physiology, 1996, 110(1): 125-136.
[20]Qin W, Han J, Karim·ali. Growth and Its physiological characteristics ofCydoniaoblongatissue-cultured plant with salt stress. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(12): 2467-2471.
[21]Matoh T, Kairusmee P, Takahashi E. Salt-induced damage to rice plants and alleviation effect of silicate. Soil Science Plant Nutrition, 1986, 32: 295-304.
[22]Yu B J, Liu Y L. Effects of salt on the metabolism of active oxygen in seedlings of annual halophyteGlycinesoja. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(1): 18-22
[23]Fan Z R, Wang X D, Tang L. Effects of silicon onJatrophacurcasL. germination and seedling growth under salt stress. Chinese Journal of Oil Crop Sciences, 2010, 32(2): 217-221.
[24]Liu A R, Zhang Y B, Chen D K. Effects of salt stress on the growth and the antioxidant enzyme activity ofThellungiellahalophile. Bulletin of Botanical Research, 2006, 26(2): 216-220.
[25]Wu J Y, Liu J H, Li Q,etal. Effect of salt stress on oat seed germination and seeding membrane permeability. Journal of Triticeae Crops, 2009, 29(2): 341-345.
参考文献:
[1]杨江山, 张恩和, 黄高宝, 等. H2O2, NaCl, SA处理对磨砂后甘草种子发芽特性的影响. 甘肃农业大学学报, 2009, 44(5): 88-91.
[2]李学禹. 甘草属分类系统与新分类群的研究. 植物研究, 1993, 13(1): 14-43.
[3]谷会岩. 中国甘草资源生态学研究[D]. 哈尔滨: 东北林业大学, 2001.
[4]魏昭智, 李剑中. 采挖期和采挖深度对人工甘草品质和产量效益的影响. 草业科学, 2006, 23(8): 21-23.
[5]杨发林, 李克昌, 胡崇礼. 甘草种子人工繁育暨配套栽培技术研究初报. 草业科学, 2004, 21(12): 90-94.
[6]邵晓林, 杜彪, 张瑛, 等. 甘草人工栽培技术. 甘肃农村科技, 2003, (4): 34-35.
[7]王佳丽, 黄贤金, 钟太洋, 等. 盐碱地可持续利用研究综述. 地理学报, 2011, 66(5): 673-684.
[14]於丙军, 章文华, 刘友良. NaCl对大麦幼苗根系蛋白质和游历氨基酸的影响. 西北植物学报, 1997, 17(4): 439-445.
[15]马成仓, 李清芳, 束良佐, 等. 硅对玉米种子萌发和幼苗生长作用机制初探. 作物学报, 2002, 9(5): 665-669.
[16]张新慧, 郎多勇, 白长财, 等. 外源硅对不同程度盐胁迫下甘草种子萌发和幼苗生长发育的影响. 中草药, 2014, 7(45): 2075-2079.
[17]王咏星, 陈海洋, 谢丽琼, 等. 提高甘草种子的发芽率和出苗率试验. 种子, 2004, 10(23): 27-29.
[18]郝建军, 刘延吉. 植物生理学实验技术[M]. 沈阳: 辽宁科学技术出版社, 2001.
[20]秦伟, 韩晶, 克热木·伊力. 盐胁迫对榅桲组培苗生长及其生理特征的影响. 西北植物学报, 2008, 28(12): 2467-2471.
[22]於丙军, 刘友良. 盐处理对一年生盐生野大豆幼苗活性氧代谢的影响. 西北植物学报, 2003, 23(1): 18-22.
[23]樊哲仁, 王晓东, 唐琳. 硅对盐胁迫下麻疯树种子萌发及幼苗生长的影响.中国油料作物学报, 2010, 32(2): 217-221.
[24]刘爱荣, 张远兵, 陈登科. 盐处理对盐芥(Thellungiellahalophila) 生长和抗氧化酶活性的影响. 植物研究, 2006, 26(2): 216-220.
[25]武俊英, 刘景辉, 李倩, 等. 盐胁迫对燕麦种子萌发、幼苗生长及叶片质膜透性的影响. 麦类作物学报, 2009, 29(2): 341-345.
2016年全国畜牧兽医期刊征订目录 中国畜牧兽医学会期刊编辑学分会会员单位
续表Continued
期刊名称邮发代号刊期年定价(元)电话地址邮编中国兽医学报12-105月 刊180.000431-87836534吉林省长春市西安大路5333号130062水禽世界24-51双月刊36.000531-85609923山东省济南市交校路1号250023家禽科学24-146月 刊72.000531-85609923山东省济南市交校路1号250023四川畜牧兽医62-43月 刊84.00028-85571780四川省成都市武侯祠大街4号附1号610041甘肃畜牧兽医54-49月 刊120.000931-4560928甘肃兰州市城关区武都路498号730030青海畜牧兽医杂志56-10双月刊30.000971-5318387青海省西宁市生物园区纬二路1号青海省牧科院810016养猪8-100双月刊108.00024-88412371辽宁省沈阳市东陵路120号110161养禽与禽病防治46-9月 刊42.00020-85280712广东省广州市五山华南农业大学9号楼510642草原与草坪54-13双月刊60.000931-7631885甘肃省兰州市安宁区迎门村1号甘肃农业大学730070贵州畜牧兽医66-58双月刊48.000851-5400593贵州省贵阳市南明区龙洞堡550005浙江畜牧兽医自办发行双月刊42.000571-86971701浙江省杭州市凯旋路268号310029黑龙江动物繁殖14-264双月刊48.000451-86644242黑龙江省哈尔滨市哈平路243号150069福建畜牧兽医34-81双月刊30.000591-87807454福建省福州市鼓屏路183号350003粮食与饲料工业38-151月 刊60.00027-87406138湖北省武汉市卓刀泉南路3号430079湖北畜牧兽医38-352月 刊120.00027-87389001湖北省武汉市武昌南湖瑶苑1号湖北省农科院内430064《农业知识》(科学养殖)24-19月 刊33.000531-88935267山东省济南市闵子骞路21号250100山东畜牧兽医24-231月 刊60.000538-8242644山东省泰安市山东农业大学转271018中国奶牛80-401半月刊200.00010-62948051北京德胜门外清河南镇北京奶牛中心院内100192中国动物传染病学报4-748双月刊42.00021-34293142上海市闵行区紫月路518号中国农业科学院200241中国动物保健82-991月 刊180.00010-62819395北京市海淀区北三环西路甲18号中鼎大厦A519100098中国畜牧兽医文摘80-282月 刊180.00010-82109390北京市中关村南大街12号中国农科院农业信息研究所100081中兽医学杂志44-46双月刊42.000791-86360234江西省南昌市高新区京东大道698号省动物疫控大楼330029农村大众·畜牧宝典23-5016月 报120.000531-81301008山东省济南市泺源大街6号250014当代畜牧82-338月 刊120.00010-62014549北京市西城区德外冰窖口胡同75号100088饲料科技自办发行月 刊70.000311-85880833/0823河北省石家庄市槐中路兴苑街4号415房间050031现代畜牧科技14-304月 刊216.000452-6116741黑龙江省齐齐哈尔市龙沙区合意大街2号161005草业科学54-51月 刊144.000931-8912486甘肃省兰州市嘉峪关西路768号730020畜牧兽医科技信息14-48月 刊120.0018946066051黑龙江省哈尔滨市南岗区马端街427号150001中国预防兽医学报14-70月 刊120.0018946066050黑龙江省哈尔滨市南岗区马端街427号150001中兽医医药杂志54-55双月刊48.000931-2656034甘肃省兰州市小西湖硷沟沿335号730050中国草食动物科学54-57双月刊48.000931-2656124甘肃省兰州市小西湖硷沟沿335号730050畜禽业62-184月 刊120.00028-85256716四川省成都市人民南路4段53号嘉云台乙8A610041畜禽业·南方养猪62-285双月刊60.00028-85256716四川省成都市人民南路4段53号嘉云台乙8A610041草食家畜58-71双月刊48.000991-4843824新疆乌鲁木齐市克拉玛依东街151号新疆畜牧科学院830000河北农机自办发行双月刊72.000311-87652515河北省石家庄市和平西路630号050051湖南畜牧兽医42-276双月刊30.000731-84615356湖南省长沙市远大二路泉塘畜牧兽医研究所内410131云南畜牧兽医自办发行双月刊30.000871-65017073云南省昆明市盘龙区金殿青龙山云南省畜牧兽医科学院650224今日养猪业80-261月 刊144.00010-51503820北京市海淀区曙光花园中路9号北京市农林科学院100097农业技术与装备(养殖业版)22-241双月刊36.000351-3035611山西省太原市府东街95号省政府东院农业产业化大楼030002饲料工业8-163半月刊144.00024-86391237辽宁省沈阳市金沙江街16号6门110036养殖与饲料38-381月 刊96.00027-87287369湖北省武汉市洪山区华中农业大学校内430070南方饲料快讯自办发行月 刊120.00020-86057592广东广州市白云大道北1364号四楼510440上海畜牧兽医通讯4-393双月刊45.00021-62206294上海市北翟路2901号农科院畜牧所201106兽药市场指南18-354月 刊84.000311-86108962河北石家庄市东三教街22号胜利小区明珠园1-1-702050020安徽畜牧兽医自办发行季 刊免费0551-62658642安徽省合肥市徽州大道197号农业大厦1503室230001
http://cyxb.lzu.edu.cn
崔佳佳,张新慧,李月彤,周达,张恩和. 外源Si对盐胁迫下甘草幼苗形态及生理指标的影响. 草业学报, 2015, 24(10): 214-220.
CUI Jia-Jia, ZHANG Xin-Hui, LI Yue-Tong, ZHOU Da, ZHANG En-He. Effect of silicon addition on seedling morphological and physiological indicators ofGlycyrrhizauralensisunder salt stress. Acta Prataculturae Sinica, 2015, 24(10): 214-220.
通讯作者*Corresponding author. E-mail:zhangeh@gsau.edu.cn
作者简介:崔佳佳(1991-),女,甘肃兰州人,在读硕士。E-mail:573377977@qq.com
基金项目:宁夏教育厅项目(NGY2012062)和国家自然科学基金项目(31260304和 31460330)资助。
收稿日期:2014-10-30;改回日期:2015-01-07
DOI:10.11686/cyxb2014445
