NR2B-Wnt3α-ADAM10信号通路与糖尿病脑病关系的研究进展
2016-01-28孙传峰,曹红
NR2B-Wnt3α-ADAM10信号通路与糖尿病脑病关系的研究进展
孙传峰曹红
(温州医科大学附属第二医院麻醉科温州医科大学疼痛医学研究所,浙江温州325027)
关键词〔〕糖尿病;糖尿病脑病;NR2B;Wnt3α;ADAM10
第一作者:孙传峰(1989-),男,硕士,主要从事围术期重要脏器损伤及保护机制研究。
糖尿病脑病(DE)是糖尿病引起的中枢神经系统损害,可引起认知功能障碍。糖尿病时大脑N-甲基-D-天冬氨酸受体(NMDARs)表达异常,人们由此推断NMDARs在DE的发展过程中可能发挥重要作用〔1〕。NMDARs的激活通过Wnt信号通路引起去整合素金属蛋白酶10(ADAM10)的变化,与认知功能密切相关〔2,3〕。本文就近年来关于NR2B-Wnt3α-ADAM10信号转导通路与DE的研究进展作一简要概述。
1DE
1.1概述糖尿病是一种以血糖升高为特征的代谢紊乱综合征,可引起视网膜、肾脏、周围神经、大血管等慢性并发症。以前对糖尿病神经病变的研究多集中在周围神经系统,现在越来越多的证据表明,糖尿病也可引起中枢神经系统的病变,如脑组织功能和完整性的损害,造成认知功能障碍,表现为学习、记忆、解决问题能力下降〔4〕,即DE。
1.2DE与阿尔兹海默病(AD)的关系2型糖尿病(T2DM)为AD发病的重要风险因子。研究表明,AD患者中枢神经系统出现胰岛素、胰岛素样生长因子(IGF)-1、IGF-2及其受体表达明显减少,表明AD与胰岛素有关,此研究首次提出“AD可能是3型糖尿病”的假说〔5〕。AD患者早期海马组织中出现tau蛋白过度磷酸化形成的神经纤维缠结、神经炎性斑块以及淀粉样β蛋白(Aβ)聚集形成的纤维性斑块,所以这种典型纤维缠结和斑块样的病理生理改变也被叫做AD样改变〔6〕。在STZ诱导的糖尿病大鼠模型中可见大鼠海马的萎缩,海马和皮质Aβ的积聚、突触的缺失,学习与记忆能力下降〔7〕。同样在T2DM人群大脑内,AD样改变也远早于其他人群出现。Aβ可引起神经突触功能障碍、神经元丢失,进而导致认知功能受损。所以DE引起的Aβ聚集等AD样改变可能是DE发生发展的机制。
2NMDAR与DE
2.1NMDAR概述NMDARs是由谷氨酸调控的离子型受体,它广泛分布在神经元细胞,对中枢神经系统功能具有重要的调节作用。其受体包括NR1亚基,NR2(A,B,C,D)亚基和NR3(A,B)亚基三种不同的亚基〔8〕,每个亚基包含了四个不同的结构域:细胞外氨基末端结构域、细胞外配体结合结构域、跨膜结构域和细胞内羧基末端结构域。它们一般分布于细胞表面,常见的亚型结构为NR1NR2结合的二聚体结构,且不同的亚型具有不同的生理学特性。NR1是NMDA受体的基本功能单位,构成离子通道;NR2亚基是调节亚基,对离子通道动力学具有调节作用;NR3亚基不能独自存在,需与NR1、NR2亚基结合共同发挥作用。其中NR2B亚基主要影响NMDA受体的结构和功能,是最重要的调节亚单位结构,与学习记忆关系最为密切〔9〕。
2.2NMDAR与DEDE的发病机制尚不完全清楚,海马突触可塑性的变化与糖尿病认知功能障碍有明显相关性〔10〕。糖尿病导致的神经系统海马组织突触数量锐减、突触间隙模糊不清、突触连接断裂、突触变性,严重影响了突触的神经传递功能,这可能是DE发病的重要机制之一,从而提示海马突触减少、变性等变化参与了糖尿病脑病的发生、发展过程〔11〕。已知突触传递的可塑性、突触发育的可塑性和突触形态的可塑性是突触可塑性的三个重要方面,其中根据突触传递可塑性变化的主要表现形式不同,把突触可塑性分为长时程增强效应(LTP)和长时程抑制效应(LTD),其中LTP与长期记忆的形成和储存有关,LTD与记忆的整合、遗忘和恢复突触产生LTP的能力有关,两者共同组成一个学习记忆的神经网络〔12,13〕。大量研究证实,NMDA受体在LTP形成过程中起着主要调控作用〔14〕。NMDARs的激活是学习记忆形成的基础,完全阻断NMDARs会引起明显的学习记忆障碍。而NMDARs的众多亚基中又以NR2B亚基和学习记忆的联系最密切。Gardoni等〔1〕研究显示NR2B在DE的发生发展中可能发挥着重要作用。有研究证实,NMDARs的激活可引起Wnt3a的分泌,分泌的Wnt3a通过Wnt-β-catenin信号通路,引起ADAM10的表达,见图1〔2〕。所以在糖尿病大鼠NMDARs激活的减少导致ADAM10的表达下降很可能参与DE的发展和形成过程。
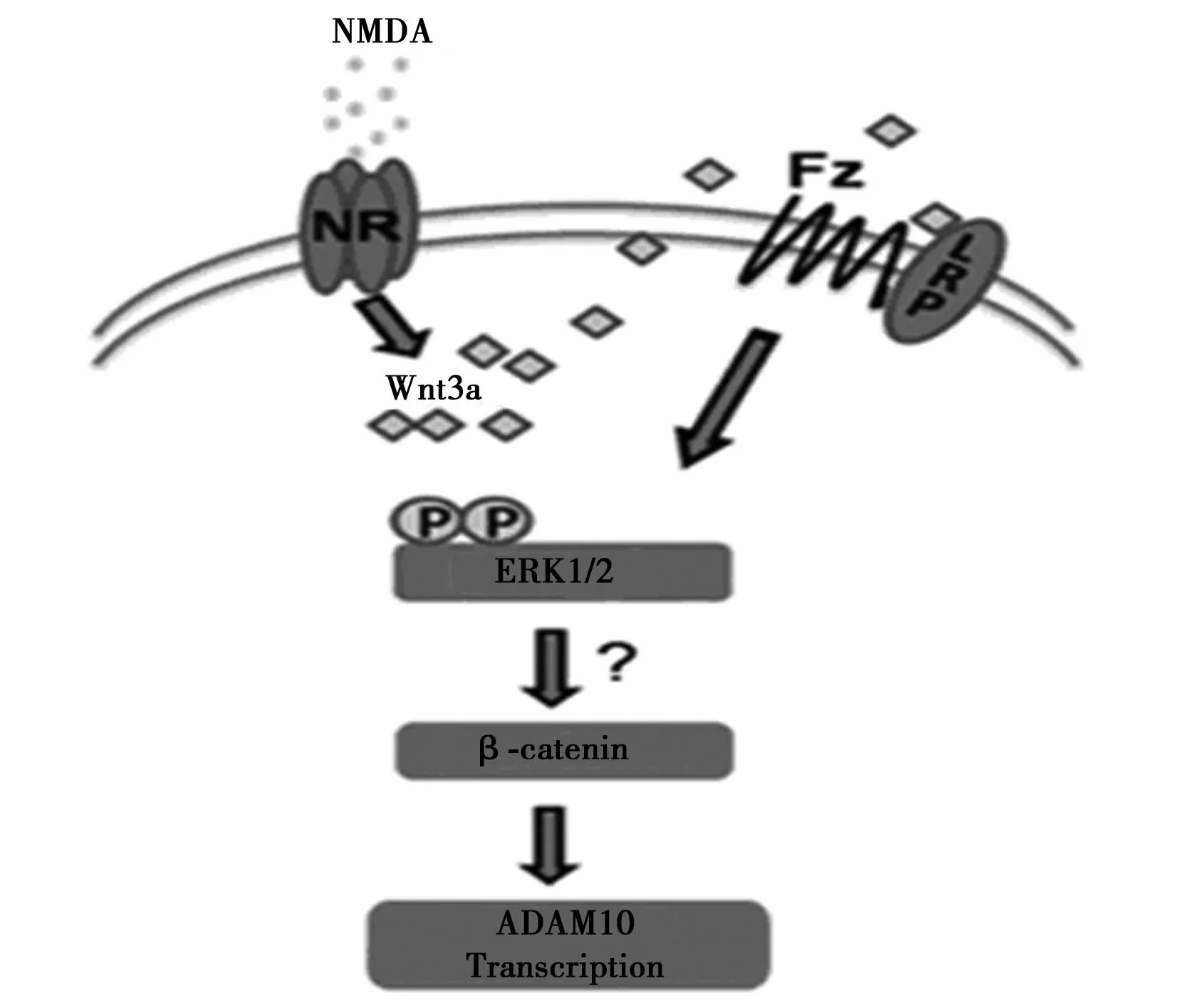
图1 正常情况下,NMDA受体激活介导ADAM10表达变化的信号通路〔2〕
3Wnt3a与DE
Wnts是一类分泌型的蛋白,可与细胞表面相应的受体结合后启动并激活细胞内相应信号的传导。在中枢神经系统,Wnt信号通路能够促进神经元的轴突、树突生长,介导神经元突触的形成和大脑的发育〔3,15〕。Wnt信号通路包括经典Wnt信号通路——Wnt-β-catenin信号通路,分泌的Wnt糖蛋白与细胞表面受体Frizzled蛋白或低密度脂蛋白受体相关蛋白结合形成复合物,结合形成的受体复合物可激活DVL蛋白,活化的DVL抑制GSK-3β的活性,使其失去结合β-catenin的能力,阻断了β-catenin的降解,引起β-catenin在神经细胞内的积累。该通路通过β-catenin在细胞内和核中的累积,启动Wnt相关靶基因的转录,调控中枢神经系统细胞的增殖和分化〔16〕。另外Wnt信号通路还包括非经典Wnt信号通路,此信号通路不依赖β-catenin在细胞内的积累,Wnt在G蛋白的介导下,通过Fzd蛋白家族促进细胞内钙离子的释放,钙离子可进一步激活蛋白激酶C,从而引起细胞内的各种反应〔17〕。而JNK是Wnt信号通路下游的中介子,当JNK被激活,活化的JNK转移至细胞核,从而进一步调控基因的表达。其中,经典Wnt信号通路在神经退行性变疾病中发挥着越来越重要的作用。
Wnt3a作为Wnt最常见的配体,结合Fz受体,通过抑制GSK-3β活性,使β-catenin在细胞内累积,胞浆内的β-catenin水平升高并转移至细胞核,在核内与特异靶因子结合,特异地启动、激活下游基因的转录,激活Wnt经典信号通路〔3〕。有研究证实,在T2DM中Wnt-β-catenin信号转导通路活化程度下降,GSK-3β活性升高,导致Wnt途径中β-catenin降解增加,可能与T2DM时胰岛素抵抗胰岛素信号转导途径下调有关〔18〕。
另外增加的Aβ通过影响Wnt-β-catenin信号通路使神经元形成障碍,进一步促进其凋亡。其机制可能是Aβ与Wnt-β-catenin信号通路的配体GSK-3β结合,阻断了β-catenin的形成,抑制了β-catenin在细胞内的积累,从而影响细胞的增殖分化〔19〕。另外Aβ可诱导Dkk-1的表达,阻断Wnt信号向胞内传递,使Wnt/β-catenin信号转导减弱,β-catenin磷酸化降解,使神经细胞发生变性凋亡〔20〕。增加的Aβ还可通过影响Wnt-β-catenin信号通路,使血脑屏障的形成,诱导和成熟发生障碍,并影响血脑屏障功能〔21〕。
最近有文献报道,NMDARs可以通过Wnt-β-catenin信号通路来调节海马神经元的LTP〔22〕。NMDARs激活可以促进海马神经元释放Wnt3a,Wnt3a与细胞表面相关受体结合,抑制GSK-3β的活性,使细胞内β-catenin累积,增多的β-catenin发生转移进入细胞核内,进入细胞核内的β-catenin进一步激活其特异基因的表达〔2〕,NMDARs可通过调节Wnt3a的释放来调节神经元树突的分支和突触可塑性的变化,相反阻断NMDARs可以抑制强直刺激介导的Wnt3a释放,影响LTP的产生。在糖尿病大鼠模型中,NMDARs表达的下调,Wnt-β-catenin信号转导通路活化程度下降,可最终导致LTP的抑制。可见,NMDARs活性的下降介导的Wnt3a释放的减少在DE的发生发展中可能发挥着重要作用。
4ADAM10与DE
ADAM10是去整合素金属蛋白酶家族成员之一,它是一个多结构域的膜蛋白,具有金属蛋白酶结构域,整合素结合域、胞内段信号域以及粘附活性,它通过金属蛋白酶结构域对其它组织结构膜蛋白的膜外结构域进行水解,具有重要的α蛋白酶活性〔23〕。可对多种与机体生长发育密切相关的分子进行水解,如Notch、N-Cadherin、Nectin-1分子,另外与阿尔海默病等退行性神经病变密切相关的淀粉样蛋白沉淀分子(APP)也是ADAM10水解的底物,所以ADAM10与神经系统的发生发育、抗衰老密切相关。
利用小鼠原代皮质神经元培养,发现NMDARs的激活可引起β-catenin和ADAM10的上调。当抑制Wnt-β-catenin信号通路时,ADAM10上调消失。相反,通过重组Wnt3a激活Wnt-β-catenin信号通路可刺激ADAM10的表达。进一步研究表明NMDARs和Wnt3a介导的ADAM10的上调可被ERK抑制剂阻滞。由此可见,NMDARs介导的ADAM10的上调是通过Wnt/MAPK信号通路〔2〕。
APP经过β-分泌酶和γ-分泌酶水解,释放出Aβ肽。Aβ肽是淀粉斑的核心成分,它的过多生成或聚集被认为是AD致病的主要原因,同样DE的大鼠模型中也存在Aβ的聚集。APP蛋白还可经非淀粉样蛋白加工途径,在这条途径中,它被α-分泌酶和γ-分泌酶连续水解。由于α-分泌酶的水解APP位点在Aβ肽内部,因此,可以减少Aβ肽的生成〔24〕。目前,已经证实ADAM10是神经元的组成型APPα-分泌酶,NMDAR介导的ADAM10的表达参与APP的剪切。
Postina等〔25〕将AD小鼠与ADAM10转基因的小鼠杂交,对杂交小鼠脑内淀粉样斑块进行检测,最后发现杂交后小鼠脑内淀粉样斑块显著减少,然而ADAM10剪切APP所产生的可溶性片段sAPPα则明显增多,并且杂交后小鼠通过水迷宫的行为学实验,发现它的学习和记忆的能力都有明显增强;相反的,ADAM10基因突变的小鼠则淀粉样斑块增多,突变的ADAM10使得其剪切APP所产生的可溶性片段sAPPα表达减少,测得的学习能力有所下降〔26〕。由此可见,ADAM10是一种功能性的分泌酶,具有重要的α蛋白酶活性,对APP水解可抑制淀粉样斑块的形成。
ADAM10同样也介导突触的发生,与突触的形态密切相关,通过对突触的调节参与认知功能的调节。ADAM10在突触后部位控制不同的脱落细胞黏附分子(CAMS)从而促进突触的发生和发展。ADAM10切割APP所产生的可溶性片段sAPPα也可参与突触的形成。在ADAM10敲除的神经元,N-Cadherin和neuroligin-1受损并且Aβ大量产生可损伤突触的发生,并产生短而粗的棘突,使突触的功能下降,造成认知功能的减退〔27〕。因此如何增强机体ADAM10的水解活性,让ADAM10裂解更多的APP而产生更多的sAPPα,同时抑制淀粉样斑块的生成,成为研究DE的一个新方向。
5小结与展望
综上所述,DE存在的AD样改变,如Aβ的积聚,很可能参与DE的形成与发展。因此,寻找参与脑内Aβ形成及其相关信号通路传导成为DE研究的热点。对NR2B-Wnt3α-ADAM10信号转导在DE中作用的探讨,对完善DE发病的分子机制及对DE的治疗将有重要意义。
参考文献6
1Gardoni F,Kamal A,Bellone C,etal.Effects of streptozotocin-diabetes on the hippocampal NMDA receptor complex in rats〔J〕.J Neurochem,2002;80(3):438-47.
2Wan XZ,Li B,Li YC,etal.Activation of NMDA receptors upregulates a disintegrin and metalloproteinase 10 via a Wnt/MAPK signaling pathway〔J〕.J Neurosci,2012;32(11):3910-6.
3彭彦茜,万仙子,李屹晨,等.NMDA受体的活化调节原代皮层神经元的Wnt/β-catenin信号通路〔J〕.中国细胞生物学学报,2011;34(3):250-6.
4Sima AA.Encephalopathies:the emerging diabetic complications〔J〕.Acta Diabetol,2010;47(4):279-93.
5Steen E,Terry BM,Rivera EJ,etal.Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease-is this type 3 diabetes〔J〕? J Alzheimers Dis,2005;7(1):63-80.
6杨雁,张晓洁,王玉萍,等.噻唑烷二酮通过Wnt通路改善2型糖尿病大鼠海马阿尔茨海默病样病变〔J〕.中国病理生理杂志,2010;26(12):2421-7.
7Wang JQ,Yin J,Song YF,etal.Brain aging and AD-like pathology in streptozotocin-induced diabetic rats〔J〕.J Diabetes Res,2014;2014:796840.
8Schüler T,Mesic I,Madry C,etal.Formation of NR1/NR2 and NR1/NR3 heterodimers constitutes the initial step in N-methyl-D-aspartate receptor assembly〔J〕.J Biol Chem,2008;283(1):37-46.
9Cui Z,Feng R,Jacobs S,etal.Increased NR2A:NR2B ratio compresses long-term depression range and constrains long-term memory〔J〕.Sci Rep,2013;3:1036.
10Zhou Y,Luo Y,Dai J.Axonal and dendritic changes are associated with diabetic encephalopathy in rats an important risk factor for Alzheimers disease〔J〕.J Alzheimer Dis,2013;34(4):937-47.
11张燕,樊东升.糖尿病与认知功能障碍〔J〕.中国卒中杂志,2007;2(7):597-600.
12高原.海马突触可塑性与糖尿病脑病〔J〕.国外医学老年病学分册,2006;27(1):19-22.
13Howland JG,Wang YT.Synaptic plasticity in learning and memory:stress effects in the hippocampus〔J〕.Frog Brain Res,2008;169(17):145-58.
14Baez MV,Oberholzer MV,Cercato MC,etal.NMDA receptor subunits in the adult rat hippocampus undergo similar changes after 5 minutes in an open field and after LTP induction〔J〕.PLoS One,2013;8(2):e55244.
15Davis EK,Zou Y,Ghosh A.Wnts acting through canonical and noncanonical signaling pathways exert opposite effects on hippocampal synapse formation〔J〕.Neural Dev,2008;3(1):32.
16Gordon MD,Nusse R.Wnt signaling:multiple pathways,multiple receptors,and multiple transcription factors〔J〕.J Biol Chem,2006;281(32):22429-33.
17Kuhl M,Sheldahl LC,Park M,etal.The Wnt/Ca2+pathway:a new vertebrate Wnt signaling pathway takes shape〔J〕.Trends Genet,2000;16(7):279-83.
18Jin T.The Wnt signaling pathway and diabetes mellitus〔J〕.Diabetologia,2008;51(10):1771-80.
19Inestrosa NC,Toledo EM.The role of Wnt signaling in neuronal dysfunction in Alzheimer's Disease〔J〕.Mol Neurodegener,2008;3(1):9.
20Caricasole A,Copani A,Caraci F,etal.Induction of Dickkopf-1 a negative modulator of the Wnt pathway is associated with neuronal degeneration in Alzheimer's brain〔J〕.J Neurosci,2004;24(26):6021-7.
21Liu L,Wan W,Xia S,etal.Dysfunctional Wnt/β-catenin signaling contributes to blood-brain barrier breakdown in Alzheimer's disease〔J〕.Neurochem Int,2014;75:19-25.
22Chen J,Park CS,Tang SJ.Activity-dependent synaptic Wnt release regulates hippocampal long term potentiation〔J〕.J Biol Chem,2006;281(17):11910-6.
23Deuss M,Reiss K,Hartmann D.Part-time alpha-secretases:the functional biology of ADAM9,10 and 17〔J〕.Curr Alzheimer Res,2008;5(2):187-201.
24Chasseigneaux S,Allinquant B.Functions of Aβ,sAPPα and sAPPβ:similarities and differences〔J〕.J Neurochem,2012;120(1):99-108.
25Postina R,Schroeder A,Dewachter I,etal.A disintegrin-metalloproteinase prevents amyloid plaque formation and hippocampal defects in an Alzheimer disease mouse model〔J〕.J Clin Invest,2004;113(10):1456-64.
26Schroeder A,Fahrenholz F,Schmitt U.Effect of a dominant-negative form of ADAM10 in a mouse model of Alzheimer's disease〔J〕.J Alzheimers Dis,2009;16(2):309-14.
27Prox J,Bernreuther C,Altmeppen H,etal.Postnatal disruption of the disintegrin/metalloproteinase ADAM10 in brain causes epileptic seizures,learning deficits,altered spine morphology,and defective synaptic functions〔J〕.J Neurosci,2013;33(32):12915-28.
〔2015-01-15修回〕
(编辑李相军)
·综述·
通讯作者:曹红(1966-),女,硕士,教授,硕士生导师,主要从事疼痛机制及调控研究、围术期重要脏器损伤及保护机制研究。
基金项目:国家自然科学基金资助项目(81073125)
中图分类号〔〕R587.1〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6257-04;doi:10.3969/j.issn.1005-9202.2015.21.125
