miR-215对胃癌细胞侵袭转移能力的影响及机制
2016-01-28林振吕郑建涛
林振吕 张 琳 郑建涛
(福建医科大学附属第一医院急诊外科,福建 福州 350005)
miR-215对胃癌细胞侵袭转移能力的影响及机制
林振吕张琳郑建涛1
(福建医科大学附属第一医院急诊外科,福建福州350005)
摘要〔〕目的探讨miR-215对胃癌细胞侵袭转移能力的影响及作用机制。方法通过RT-PCR检测miR-215在高转移胃癌细胞株NCI-N87,BGC-823,RF-48及低转移细胞株HGC-27及MKN-28中的表达;Transwell迁移及侵袭实验检测miR-215抑制剂对胃癌细胞迁移及侵袭能力的影响;Western印迹检测miR-215抑制剂对胃癌细胞活化白细胞黏附分子(ALCAM),基质金属蛋白酶(MMP)-2,MMP-9,上皮细胞-间充质转化(EMT)相关蛋白E-钙黏附素(E-cadherin),波形蛋白(Vimentin)表达量的影响。结果RT-PCR结果证实miR-215在高转移胃癌细胞株中的表达高于低转移胃癌细胞中的表达,且miR-215在BGC-823细胞中的表达最高,因此选用BGC-823作为后续实验细胞株。miR-215抑制剂转染BGC-823细胞48 h后,发现下调miR-215表达能显著抑制BGC-823细胞迁移及侵袭能力,并能下调ALCAM,MMP-2,MMP-9及Vimentin表达,上调E-cadherin表达。结论miR-215低表达能显著抑制胃癌细胞BGC-823侵袭及转移能力,与下调MMPs及抑制EMT生成有关。
关键词〔〕miR-215;胃癌细胞;侵袭;转移
1福建医科大学附属第一医院胃肠外科
第一作者:林振吕(1968-),男,副主任医师,主要从事普外科研究。
随着外科手术水平,生物治疗及化疗放疗手段的提高,胃癌患者的治愈率大大提高,但是5年生存率不足30%,主要原因是肿瘤组织的侵袭转移导致预后不良〔1,2〕。同时胃癌早期症状不易发现或无任何症状,因此,常导致诊断被延误。所以探索高敏感性,高特异性的肿瘤标志物,对于胃癌的诊断及肿瘤的侵袭转移机制的研究具有重要意义。大量的实验研究证实,miRNA与肿瘤的增殖,凋亡,分化,侵袭及转移密切相关,在人类肿瘤包括胃癌的发生发展中起着重要作用〔3,4〕。国内外研究发现miR-215在胃癌组织中表达异常,如Jin等〔5〕通过miRNA芯片技术及实时荧光定量-PCR证实miR-215在胃癌组织中的表达高于正常组织,且过表达miR-215可显著促进胃癌细胞HFE145迁移。李良平等〔6〕发现胃癌患者血清中miR-215的含量高于健康对照者,提示miR-215的表达与胃癌的发生或发展有关。因此本文在此基础上,进一步探讨miR-215在不同转移程度胃癌细胞株中的表达情况,从中选出miR-215表达量最高的胃癌细胞株,并探讨miR-215对胃癌细胞侵袭转移能力的影响及机制。
1材料和方法
1.1细胞株人胃癌细胞株NCI-N87,BGC-823,HGC-27购于中科院上海细胞库,目录号分别为:TCHu130,TCHu11,TCHu22;RF-48,MKN-28购自上海拜力生物科技有限公司;分别培养于含10%胎牛血清的DMEM培养基中。
1.2试剂及仪器四唑盐试剂(MTT,Sigma公司);兔抗基质金属蛋白(MMP)-2,MMP-9,E-钙黏附素(E-cadherin),波形蛋白(Vimentin), 活化白细胞黏附分子(ALCAM),GADPH抗体(Epitmics公司);Transwell 小室(Corning 公司);结晶紫(Sigma公司);miR-215抑制剂,miR-215 NC(上海吉玛制药公司)。倒置显微镜(Nikon公司);流式细胞仪(BD 公司);迷你双垂直电泳仪,迷你转印电泳仪,ChemiDocTM XRS凝胶成像系统(Bio-Rad公司)。
1.3RT-PCR检测miR-215在胃癌细胞株中的表达总RNA的提取参考Trizol试剂盒 (Invitrogen) 使用说明书,整个提取处于无RNAase的环境下。引物设计如下,miR-215上游引物:5'-CTCGAGATGTCATCCTCAG-3',下游引物:5'GAATTCGTGAGTTCTTCTG-3'。 GAPDH作为内参标记物,上游引物:5'- AATCCCATCACCATCTTCCA-3',下游引物5'- CCTGCTTCAACCACCTTCTTG-3'。通过一步法RT-PCR试剂盒将RNA逆转录成cDNA并进行PCR扩增,获取 5 μl扩增产物用于下一步2%的琼脂糖胶进行检测。
1.4迁移实验将BGC-823接种于96孔板,当细胞汇合度达到50%时,转染miR-215抑制剂和对照NC,转染达到48 h后,将细胞消化加入Transwell上室,下室用含 5%胎牛血清的DMEM培养基,继续培养24 h,取出Transwell小室,洗涤,多聚甲醛固定,结晶紫染色,被染色的细胞浆呈紫色,倒置光学显微镜下计数5个视野迁移细胞个数,计算平均每个视野的细胞数,即表示细胞的迁移能力。
1.5侵袭实验将 Matrigel 胶均匀平铺于Transwell 小室的微膜(8 μm)上,制成凝胶备用。后按1.4方法进行操作,最后倒置光学显微镜下计数5个视野穿膜细胞个数,计算平均每个视野的细胞数,即表示细胞的侵袭能力。
1.6Western印迹当细胞汇合度达到50%时,转miR-215和对应的对照NC,转染达到48 h后,转染达到48 h后,刮下细胞,离心,后加入适量的RIPA裂解液,每隔10 min置于涡旋仪中震荡30 s,40 min后,4℃,10 000 r/min离心10 min,小心吸取上清,即可获得总蛋白。根据BCA试剂盒对蛋白浓度进行测定。蛋白上样,跑SDS凝胶电泳,后湿法转膜。将膜浸入一抗溶液孵育,4℃过夜;漂洗后,浸入二抗溶液中室温孵育1~2 h。将膜取出漂洗,在膜上滴加ECL曝光液,在凝胶成像系统中曝光。用“Quantity one”软件对各抗体条带灰度值进行统计。
1.7数据分析采用SPSS17.0软件行t检验。
2结果
2.1miR-215在5株胃癌癌细胞株中的表达通过RT-PCR和检测发现miR-215在RF-48、NCI-N87、BGC-823高转移胃癌细胞株中的表达量〔(2.30±0.22),(2.54±0.14),(3.22±0.25)〕高于MKN-28、HGC-27低转移胃癌细胞株中的表达量〔(1.01±0.21)、(1.31±0.20)〕,且在BGC-823中miR-215表达量最高,因此作为后续实验的细胞株。
2.2miR-215抑制剂对BGC-823细胞迁移和侵袭能力的影响如图1,图2所示,抑制剂及NC转染48 h后,与NC组比较,miR-215抑制剂能显著抑制BGC-823细胞迁移能力〔(99.05%±7.43%)vs(48.32%±5.38%)〕及侵袭能力〔(99.98%±8.12%)vs(55.45%±6.07%)〕(P<0.01)。
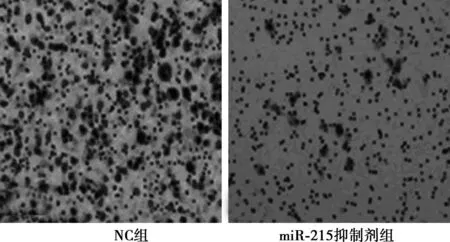
图1 miR-215抑制剂对BGC-823细胞迁移能力的影响

图2 miR-215抑制剂对BGC-823细胞侵袭能力的影响
2.3miR-215抑制剂对BGC-823细胞中ALCAM表达量的影响如图3所示,与NC组(1.25±0.14)比较,miR-215抑制剂(0.34±0.05)能显著抑制BGC-823细胞中ALCAM的表达(P<0.01)。

图3 miR-215抑制剂对BGC-823细胞中ALCAM表达量的影响
2.4miR-215抑制剂对BGC-823细胞中MMPs表达量的影响如图4,表1所示,与NC组比较,miR-215抑制剂能显著抑制BGC-823细胞中MMP-2及MMP-9的表达(P<0.01)。
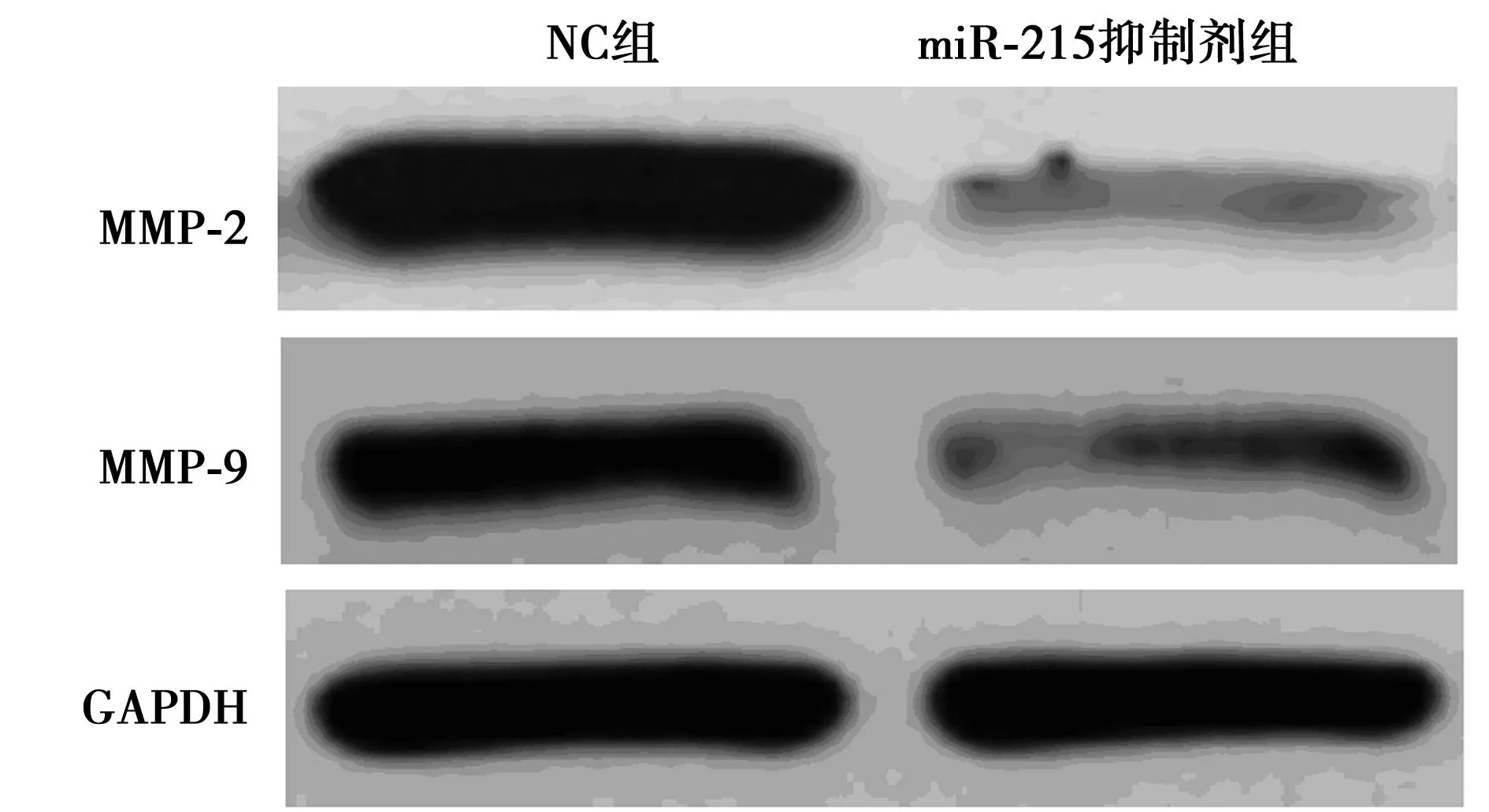
图4 miR-215抑制剂对BGC-823细胞中MMPs表达量的影响
2.5miR-215抑制剂对BGC-823细胞中E-cadherin及Vimentin表达量的影响如图5及表1示,与NC组比较,miR-215抑制剂能显著抑制BGC-823细胞中Vimentin的表达,促进E-cadherin的表达(P<0.01)。
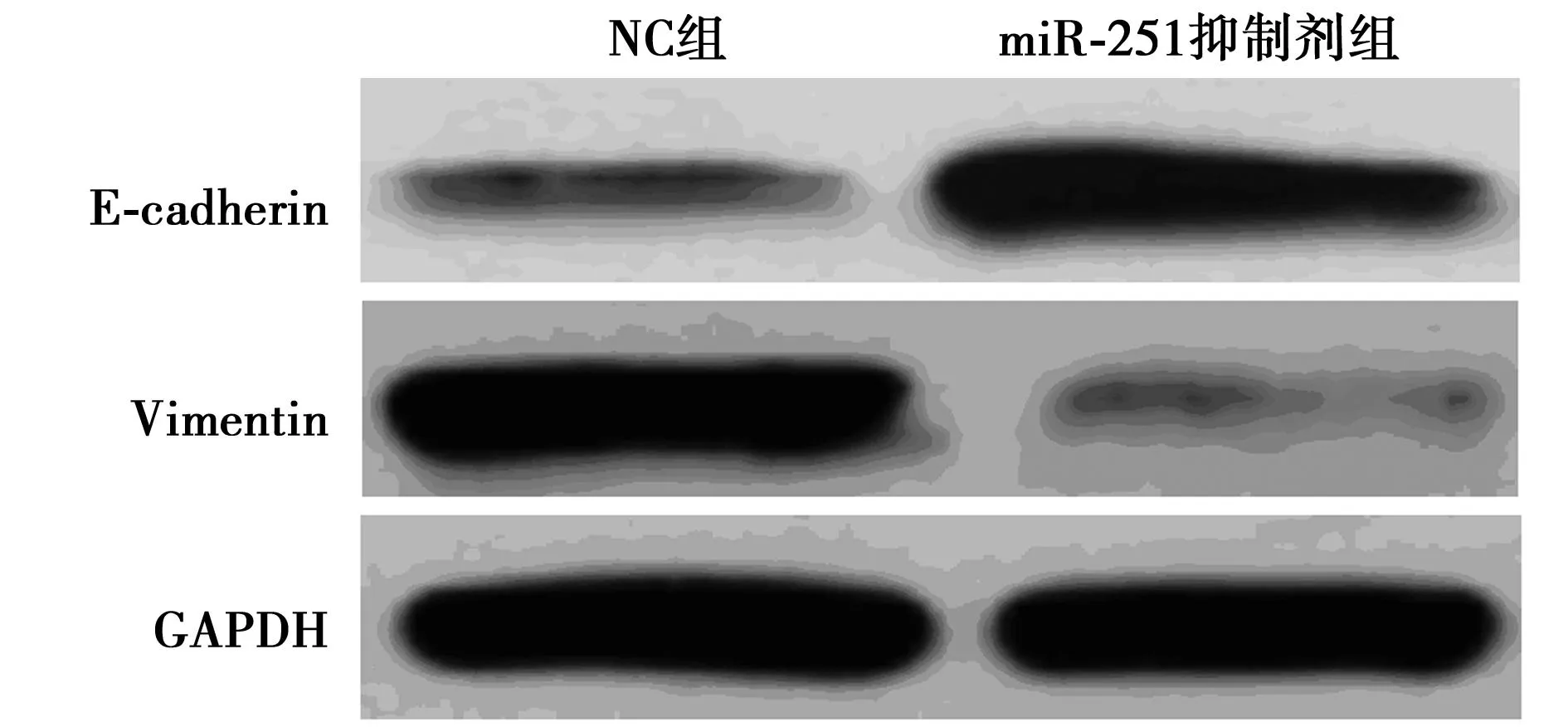
图5 miR-215抑制剂对BGC-823细胞中E-cadherin及Vimentin表达量的影响

组别MMP2/GADPHMMP9/GADPHE-cadherinGADPHVimentin/GADPHNC组1.29±0.140.88±0.080.37±0.041.05±0.10miR-215抑制剂组0.33±0.011)0.42±0.041)0.99±0.081)0.32±0.031)
与NC组比较:1)P<0.01
3讨论
miRNAs是一类进化上高度保守的内源性非编码小分子RNA,由21~23个氨基酸组成,它能够结合于靶基因mRNA的3'-UTR区域,阻遏靶基因的翻译,从而调控靶基因表达,参与多种疾病的病理生理过程。miR-215定位于人染色体1q41,在胃癌组织或血清中高表达,并通过调节靶基因的表达水平影响胃癌细胞的增殖迁移能力〔5〕。因此本研究在此基础上,通过RT-PCR进一步检测miR-215在不同转移程度胃癌细胞株中的表达,结果发现高转移胃癌细胞株中miR-215的表达高于低转移程度胃癌细胞株,且下调miR-215能显著的抑制BGC-823细胞的迁移侵袭能力,但具体机制未知。而先前Jin等〔5〕,周志威等〔7〕的研究报道证实ALCAM是miR-215的靶分子之一,且ALCAM在胃癌组织中表达异常。ALCAM是一种广泛存在于人体各组织器官中的糖蛋白,能通过介导同嗜性黏附或异嗜性作用介导细胞间的黏附,从而影响细胞运动状态。细胞的运动性增加可显著促进肿瘤的侵袭转移。因此,通过下调ALCAM的表达量能一定程度上的抑制肿瘤细胞的迁移。
同时细胞外基质的降解是肿瘤侵袭和转移的必要步骤,MMPs是降解细胞外基质的最重要的蛋白水解酶,在细胞肿瘤侵袭和转移中发挥重要作用。MMP-2不仅可以降解细胞外基质中的明胶Ⅳ型胶原等,有利于肿瘤细胞沿着受损的基底膜向周围浸润,还可以通过新生毛细血管促进肿瘤的侵袭及转移,是恶性肿瘤浸润和侵袭的标志〔8〕。MMP-9是由多种细胞分泌的一种蛋白水解酶,是MMPs中分子量最大的酶,能够降解细胞外基质和基底膜,从而增加细胞的运动能力,促进肿瘤的扩散和转移。MMPs在肿瘤细胞的侵袭过程中起到至关重要的影响。陈进等〔9〕发现MMP-2在胃癌组织中的表达率为75%,MMP-9在胃癌组织中的表达率为68.3%,均显著高于周围正常组织。孙述臣等〔10〕通过Northern印迹原位分子杂交ISH法证实胃癌组织中MMP2及MMP-9 mRNA的表达水平高于正常组织。临床研究Meta分析也指出,MMP-9的高表达能够增加胃癌组织的侵袭性,影响胃癌患者的预后〔11〕。因此通过下调胃癌细胞中MMPs的表达,能显著抑制癌细胞的侵袭能力。
上皮细胞-间充质转化(EMT)最早在胚胎发育过程中得到证实,越来越多的证据表明EMT对肿瘤发生,包括局部浸润和通过循环系统转移和扩散起着重要作用,是侵袭能力最强的肿瘤细胞的特性,并且在恶性肿瘤细胞发生EMT时,可视为浸润转移的开始〔12,13〕。EMT的分子标志性特征为细胞间黏附分子E-cadherin的表达下调,一系列间充质标记物的表达上调,包括N-cadherin,Vimentin和纤连蛋白。李德艳等〔14〕发现胃癌组织中E-cadherin表达阳性率为33.33%,明显低于正常胃癌组织。熊德明等〔15〕证实Vimentin在胃癌组织中的阳性表达明显高于正常组织,且与淋巴结转移密切相关,可能参与了EMT,在胃癌转移过程起重要作用。因此通过抑制EMT的生成,也能显著的抑制胃癌细胞的侵袭转移能力。
本研究说明miR-215抑制剂可通过下调ALCAM及MMPs表达来抑制BGC-823细胞的迁移侵袭能力,显著抑制EMT的生成,与上调E-cadherin表达,下调Vimentin表达有关。
参考文献4
1Mahar AL,Mcleod RS,Kiss A,etal.A systematic review of the effect of institution and surgeon factors on surgical outcomes for gastric cancer〔J〕.J Am Coll Surg,2012;214(5):860-8.
2Mcguill MJ,Byrne P,Ravi N,etal.The prognostic impact of occult lymph node metastasis in cancer of the esophagus or esophago-gastric junction:systematic review and meta-analysis〔J〕.Dis Esophagus,2008;21(3):236-40.
3Kim CH,Kim HK,Rettig RL,etal.miRNA signature associated with outcome of gastric cancer patients following chemotherapy〔J〕.BMC Med Genomics,2011;4(1):79.
4Jankovic R,Radulovic S,Brankovic-Magic M.siRNA and miRNA for the treatment of cancer〔J〕.J BUON,2009;14(Suppl 1):S43-9.
5Jin Z,Selaru FM,Cheng Y,etal.MicroRNA-192 and-215 are upregulated in human gastric cancer in vivo and suppress ALCAM expression in vitro〔J〕.Oncogene,2011;30(13):1577-85.
6李良平,龙思泽,高采平.胃癌患者血清microRNA-192和microRNA-215的表达及临床意义〔J〕.中华临床医师杂志(电子版),2013;7(12):5223-7.
7周志威,聂玉强,杜艳蕾,等.活化白细胞黏附分子在胃癌组织中的表达及其调控机制〔J〕.广东医学,2013;34(18):2784-8.
8Chang A,Parikh P,Thongprasert S,etal.Gefitinib (IRESSA) in patients of Asian origin with refractory advanced non-small cell lung cancer:subset analysis from the ISEL study〔J〕.J Thorac Oncol,2006;1(8):847-55.
9陈进,郭子健,王卫理.MMP-2、MMP-9在胃癌组织中的表达及相关性分析〔J〕.中国老年学杂志,2010;30(5):584-6.
10孙述臣,孙亚东,杨洋.胃癌组织中基质金属蛋白酶及其组织抑制物的基因表达意义〔J〕.中国老年学杂志,2006;26(1):40-1.
11Zhang QW,Liu L,Chen R,etal.Matrix metalloproteinase-9 as a prognostic factor in gastric cancer:a meta-analysis〔J〕.Asian Pac J Cancer Prev,2012;13(6):2903-8.
12Yang JD,Nakamura I,Roberts LR.The tumor microenvironment in hepatocellular carcinoma:current status and therapeutic targets〔J〕.Semin Cancer Biol,2011;21(1):35-43.
13Ogunwobi OO,Liu C.Therapeutic and prognostic importance of epithelial-mesenchymal transition in liver cancers:insights from experimental models〔J〕.Crit Rev Oncol Hematol,2012;83(3):319-28.
14李德艳,刘爱东,高峰.MMP-7和E-cad在胃癌组织中表达的临床价值〔J〕.中国老年学杂志,2011;31(2):185-6.
15熊德明,张瑶,王国平,等.FOXC2和Vimentin蛋白在胃癌中的表达及意义〔J〕.重庆医学,2013;42(30):3612-4.
〔2014-05-17修回〕
(编辑赵慧玲/曹梦园)
通讯作者:郑建涛(1967-),男,副主任医师,主要从事胃肠癌诊治及基础研究。
中图分类号〔〕R73〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6064-04;doi:10.3969/j.issn.1005-9202.2015.21.026
