水溶性壳聚糖对缺血再灌注损伤大鼠心肌的作用
2016-01-28张二伟马佳男任彦锋
张二伟 马佳男 费 瑜 桑 翠 任彦锋
(吉林大学第二医院心内科,吉林 长春 130041)
水溶性壳聚糖对缺血再灌注损伤大鼠心肌的作用
张二伟马佳男1费瑜桑翠任彦锋2
(吉林大学第二医院心内科,吉林长春130041)
摘要〔〕目的探讨水溶性壳聚糖(WSC)对心肌缺血再灌注损伤(IRI)大鼠心肌的作用机制。方法将60只SD大鼠随机分为假手术组、IRI模型组、低剂量WSC组、中剂量WSC组、高剂量WSC组,每组 12只。其中,IRI模型组和各剂量WSC组大鼠用结扎左冠脉前室间支法建立大鼠IRI模型,假手术组大鼠仅分离而不结扎左冠脉前室间支。假手术组和IRI模型组给予生理盐水10 ml/kg、低、中、高剂量WSC组分别给予120、180 mg/kg和240 mg/kg,灌胃1次/d,15 d后处死大鼠,心脏取血,分离血清,用酶联免疫吸附(ELSIA)法检测血清中起氧化物歧化酶(SOD)、丙二醛(MDA)、白细胞介素(IL)-6和肿瘤坏死因子(TNF)-α水平,用酶动力法检测肌酸激酶(CK)和低密度脂蛋白(LDH)水平。在靠近心尖部1/3处平行于房室沟横行切取心肌组织块,固定后石蜡包埋。用苏木素-伊红(HE)染色法观察心肌组织形态变化。结果光镜下观察,假手术组心肌纤维排列整齐,结构清楚,细胞核染色清晰,心肌间质未见炎性细胞浸润;IRI模型组大鼠心肌纤维紊乱,界限不清,胞质淡染,核有浓缩或溶解,大量炎性细胞浸润,充血淤血,心肌纤维横纹消失,心肌组织灶性坏死;WSC干预组肌纤维偶有断裂、融解现象,少量心肌细胞颗粒变性、水肿,偶见炎性细胞浸润。与假手术组相比,IRI模型组SOD水平明显下降,而CK、LDH、 MDA、IL-6和TNF-α水平明显升高(P<0.01);与IRI模型组比较,低剂量WSC组、中剂量WSC组和高剂量WSC组可显著提高SOD水平,降低CK、LDH、 MDA、IL-6和TNF-α水平(P<0.05,P<0.01)。结论WSC逆转心肌IRI,对IRI大鼠心肌具有保护作用。这种作用可能与对抗IRI时氧化应激和炎症反应有关。
关键词〔〕超氧化物歧化酶;丙二醛;白细胞介素-6;肿瘤坏死因子-α
1吉林大学临床医学院2新乡市中心医院心内科
第一作者:张二伟(1991-),男,在读硕士,主要从事心血管疾病基础与临床研究。
心肌缺血再灌注损伤(IRI)的发病机制与氧化应激和炎症反应有极其密切的关系,药物可通过对抗氧化应激和炎症反应来防止心肌IRI〔1~3〕。水溶性壳聚糖(WSC)是甲壳素脱乙酰基的产物,具有抗氧化和抗炎等方面作用〔4~7〕。但目前有关WSC能否防治心肌IRI的文献报道甚少。本文制作大鼠心肌IRI模型,并用WSC进行干预,旨在探讨WSC对IRI大鼠心肌的作用及其机制,为药物防治心肌IRI提供实验依据。
1材料与方法
1.1实验材料健康雄性清洁级SD大鼠,吉林大学白求恩医学院动物中心提供〔动物合作证号SCXX(吉)2010-0005〕,体重(250±10)g。饲养条件:室温18℃~25℃,相对湿度 40%~60%,每日正常光照,空气流通,自由摄食、饮水,所有大鼠实验前在室内给予标准饲料常规饲养2 d,实验前称重,禁食12 h。
UltraCutE 超薄切片机(奥地利卫永仪器公司),显微镜(日本JEOL公司),酶标测定仪(日本 MODEL550),小动物人工呼吸机(成都泰盟科技有限公司),全自动生化分析仪(日立)WSC(青岛海普生物技术有限公司,溶解度为125,脱乙酰度54.73%),大鼠超氧化物歧化酶(SOD)、丙二醛(MDA)、白细胞介素-6(IL-6)和肿瘤坏死因子(TNF)-α试剂盒(北京邦定泰克生物技术有限公司)。
1.2实验方法按文献报道方法建模:麻醉,仰卧固定手术台上,连接小动物人工呼吸机和心电图机。剪开心包膜,暴露心脏,左手拇食指轻压胸廓把心脏挤出,于左心耳下方2 mm处,用10/0号无损伤缝合针穿线,进针深度为1.5~2 mm,宽为2~3 mm,适应5 min,在缝合线与左冠脉前室间支血管间垫于一细小塑料管(直径约1.0 mm),结扎时用活结结扎。同步观察心电图变化,当出现ST段抬高与高耸T波融合呈弓背向上单向曲线为左室游离壁缺血成功的标志。结扎30 min后剪去胶管使缺血再灌通,再灌通时间为120 min。再通后心电图形表现为缺血图形减轻或出现病理性Q波,当抬高的ST段下降1/2以上者,以此图形作为心肌IRI标准,符合标准者即为心肌IRI造模成功并入选实验。假手术组仅分离左冠脉前室间支,并穿线不结扎。
将60只大鼠随机分为假手术组、IRI模型组、低剂量WSC组、中剂量WSC组和高剂量WSC组,每组12只。假手术组和IRI模型组分别给予生理盐水10 ml/kg、低、中、高剂量WSC组分别给予120、180 mg/kg和240 mg/kg,灌胃1次/d,连续15 d。各组分别于实验结束后处死大鼠,心脏取血,分离血清,用酶联免疫吸附(ELSIA)法检测血清中SOD、MDA 、TNF-α和IL-6水平。用酶动力法检测肌酸激酶(CK)和乳酸脱氢酶(LDH)水平。在靠近心尖部1/3处平行于房室沟横行切取心肌组织块,放入4% 多聚甲醛溶液,固定24 h,石蜡包埋。用苏木素-伊红(HE)染色法观察心肌组织形态变化。
2结果
2.1大鼠心肌组织形态学观察光镜下观察,假手术组心肌纤维排列整齐,结构清楚,细胞核染色清晰,心肌间质未见炎性细胞浸润;IRI模型组大鼠心肌纤维紊乱,界限不清,胞质淡染,核有浓缩或溶解,大量炎性细胞浸润,充血淤血,心肌纤维横纹消失,心肌组织灶性坏死;WSC干预组肌纤维偶有断裂、融解现象,少量心肌细胞颗粒变性、水肿,偶见炎性细胞浸润。见图1。
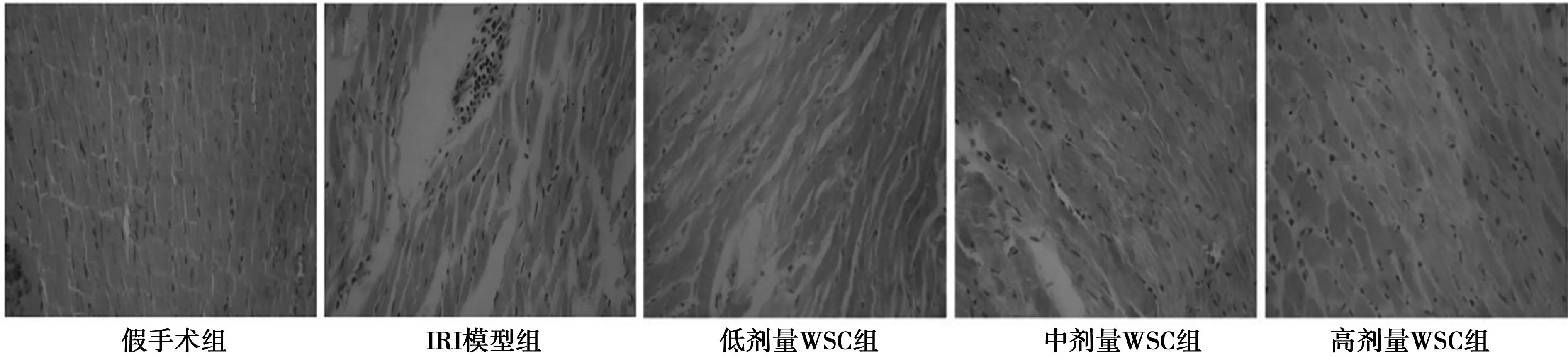
图1 大鼠心肌组织形态学变化(HE,10×40)
2.2WSC对IRI大鼠血清CK和LDH水平的影响与假手术组〔(887.24±156.32)U/L〕相比,IRI模型组CK的水平〔(2 023.57±861.71)U/L〕明显升高(P<0.01);与IRI模型组比较,低剂量WSC组〔(1 514.23±716.38)U/L〕、中剂量WSC组〔(1 492.91±544.25)U/L〕和高剂量WSC组〔(1 134.52±479.28)U/L〕的CK水平显著降低(P<0.05,P<0.01)。与假手术组〔(799.84±98.54)U/L〕相比,IRI模型组LDH的水平〔(1 763.55±162.15)U/L〕明显升高(P<0.01);与IRI模型组比较,低剂量WSC组〔(1 287.29±136.32)U/L〕、中剂量WSC组〔(1 195.96±125.17)U/L〕和高剂量WSC组〔(1 012.17±101.25)U/L〕的LDH水平显著降低(P<0.05,P<0.01)。
2.3WSC对IRI大鼠血清SOD、MDA、IL-6和TNF-α水平的影响,与假手术组相比,IRI模型组SOD水平下降,而MDA、IL-6和TNF-α水平明显升高(P<0.01);与IRI模型组比较,低剂量WSC组、中剂量WSC组和高剂量WSC组可显著提高SOD水平,降低MDA、IL-6和TNF-α水平(P<0.05,P<0.01)。见表1。

表1 WSC对IRI大鼠血清SOD、MDA、IL-6和
与假手术组比较:1)P<0.01;与IRI模型组比较:2)P<0.05;3)P<0.01
3讨论
在生理状态下机体内的活性氧簇对机体有一定的保护作用,当较多的活性氧簇产生后,机体多数组织器官可通过抗氧化系统清除活性氧簇,使机体结构和功能维持在稳定的平衡状态。SOD是机体内清除活性氧簇的一种金属酶,能使生物体内过氧化物转化成过氧化氢和氧,其活性的高低可间接反映体内自由基的浓度。MDA是膜脂质不饱和脂肪酸发生脂质过氧化反应产物,是反映氧化损伤的指标。已有报道,IRI时大鼠心肌纤维紊乱,界限不清,胞质淡染,核有浓缩或溶解,大量炎性细胞浸润,充血淤血,心肌纤维横纹消失,心肌组织灶性坏死,血清 SOD水平明显下降、CK、LDH、MDA水平明显升高〔1,2〕,提示SOD和MDA与心肌IRI有关。本实验结果与文献报道一致,进一步证实氧化应激参与心肌IRI病理过程的结论。IRI时由于黄嘌呤氧化酶形成增多、中性粒细胞呼吸爆发等原因使得活性氧簇增多,这些过多活性氧簇本应由机体清除,但由于此时SOD的能力下降,结果导致活性氧簇大量堆积,造成机体进一步损伤。因此SOD活性降低是导致心肌IRI的主要原因。
IRI时体内产生大量活性氧簇可从以下几方面对机体损伤:(1)破坏生物膜的结构,使不饱和脂肪酸与蛋白质比例失调,细胞膜和细胞器膜的液态性及流动性降低,进而导致通透性增加,钙离子内流增加。另外,还能间接地抑制膜蛋白功能,进而影响离子通道的正常功能。上述变化引起膜电位不稳定,触发严重的心律失常;(2)使细胞结构蛋白质和酶氧化,使其功能下降;(3)使细胞内DNA断裂,染色体变异;(4)激活血小板环氧化酶,生成TXA2,促进血栓形成;(5)线粒体膜损伤,使其功能障碍,ATP合成减少。
再灌注时的炎症反应贯穿于IRI的全过程,促进了心肌继发性损害,是心肌IRI的主要原因之一。IL-6、TNF-α是重要的炎症递质,它们主要是由单核巨噬细胞、中性粒细胞、淋巴细胞和内皮细胞产生,具有吸引和激活上述细胞,可诱导机体炎症反应。钟伟等〔3〕对IRI大鼠的炎症因子进行观察,发现IRI时炎症因子升高;孙莉等〔2〕发现IRI时炎症因子变化与心室功能和心肌损伤程度相平行。本实验与文献报道一致,证实心肌缺血再灌注给机体造成损伤,这一过程与炎症反应有关。
IRI时体内TNF-α和IL-6可从以下几方面对机体损伤:(1)炎症反应因子促进中性粒细胞及黏附分子激活与表达,介导与心肌细胞结合,损伤心肌;(2)炎症反应中可生成大量的氧自由基,造成心肌进一步损伤〔8〕;(3)炎症递质诱导中性粒细胞黏附穿过内皮迁移至心肌缺血部位,可阻塞毛细血管,使心肌微循环的损伤程度加重,诱导心肌细胞凋亡,增大梗死面积。
壳聚糖是一种白色或灰白色无味、无毒、略带珍珠光泽、半透明的片状或粉状固体,它分子呈线状,极性强,易结晶。它不溶于水和碱性溶液,但可溶于酸性溶液,当它与稀酸作用时呈黏糊状,带正电荷且慢慢水解,故壳聚糖一般是随用随配。WSC是壳聚糖脱乙酰反应的产物,在无需其他化学修饰的情况下就能够溶于水中因而它独特的生理活性和物化性质更容易得到体现,且保留原壳聚糖的生物学功能〔9〕。Hou等〔7〕研究发现WSC能促进成骨细胞功能,如碱性磷酸酶活动,细胞生存能力和矿化,这一过程是通过抗氧化活性进而减少或防止成骨细胞变性来实现的。Chung等〔10〕发现WSC有抑制过敏性哮喘炎症反应的作用。本实验说明WSC能逆转心肌IRI,对IRI大鼠心肌具有保护作用。这种作用可能与对抗IRI时氧化应激和炎症反应有关。目前有关WSC抗IRI时氧化应激和炎症反应的机制还不清楚,有待于进一步研究。
参考文献4
1春玉虎,党宏伟,闫业军.番茄红素对大鼠心脏缺血再灌注的保护作用及其机制研究〔J〕.现代药物与临床,2014;29(9):974-9.
2孙莉,荀平.西洋参茎叶皂苷抗大鼠心肌缺血再灌注损伤的作用及机制〔J〕.中国实验方剂学杂志,2014;20(24):176-9.
3钟伟,王永刚,于远望,等.双参通冠方对心肌缺血再灌注模型大鼠炎症因子及血管内皮功能的影响〔J〕.陕西中医学院学报,2013;36(1):67-9.
4Xia Z,Wu S,Chen J.Preparation of water soluble chitosan by hydrolysisusing hydrogen peroxide〔J〕.Int J Biol Macromol,2013;59(3):242-5.
5Ji Q,Deng J,Yu X,etal.Modulation of pro-inflammatory mediators in LPS-stimulated human periodontal ligament cells by chitosan and quaternized chitosan〔J〕.Carbohydr Polym,2013;92(7):824-9.
6Liu J,Wen XY,Lu JF,etal.Free radical mediated grafting of chitosan with caffeic and ferulic acids:structures and antioxidant activity〔J〕.Int J Biol Macromol,2014;65(2):97-106.
7Hou JW,Qian L,Kou JM,etal.Effect of water-soluble chitosan on the osteoblast function in MC3T3-E1 cells〔J〕.Int J Biol Macromol,2015;72(11):1041-3.
8夏世金,孙涛,吴俊珍.自由基、炎症与衰老〔J〕.实用老年医学,2014;28(2):100-3.
9Ma JX,Qian L,Zhou Y.Stimulation effect of chitosan on the immunity of radiotherapy patients suffered from lung cancer〔J〕.Int J Biol Macromol,2015;72(2):195-8.
10Chung MJ,Park JK,Park YI.Anti-inflammatory effects of low-molecular weight chitosan oligosaccharides in IgE-antigen complex-stimulated RBL-2p cells and asthma model mice〔J〕.Int Immunopharmacol,2012;12(2):453-9.
〔2015-06-19修回〕
(编辑袁左鸣/滕欣航)
通讯作者:任彦锋(1987-),男,硕士,主要从事心血管疾病基础研究。
基金项目:吉林省自然科学基金资助(201215058)
中图分类号〔〕R541.4〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6056-03;doi:10.3969/j.issn.1005-9202.2015.21.022
