高盐饮食对大鼠大脑皮质氧化应激及钠钙泵活性的影响
2016-01-28商黔惠
刘 婵 陈 涛 商黔惠
(遵义医学院临床医学研究所 心血管病研究所 高血压研究室,贵州 遵义 563003)
高盐饮食对大鼠大脑皮质氧化应激及钠钙泵活性的影响
刘婵陈涛商黔惠
(遵义医学院临床医学研究所心血管病研究所高血压研究室,贵州遵义563003)
摘要〔〕目的探讨长期高盐饮食对大鼠大脑皮质氧化应激和Na+-K+-ATPase、Ca2+-ATPase活性及其相关基因表达的影响。方法雄性Wistar大鼠随机分为正常盐对照组(NS组,n=13)、8%高盐组(HS组,n=24)和8%高盐+替米沙坦干预组(HS+Tel组,n=12),每2 w测量尾动脉压1次,喂养共24 w。比色法测定大鼠大脑皮质丙二醛(MDA)含量和超氧化物歧化酶(SOD)酶活性;用生化酶学法检测大脑皮质Na+-K+-ATPase、Ca2+-ATPase活性;通过实时荧光定量PCR法检测大脑皮质NAPDH、Na+-K+-ATPase α1、细胞质膜钙泵(PMCA)1、钠钙交换蛋白(NCX)1和NADPH 氧化酶亚单位P22phox mRNA表达。结果与NS组比较,HS组MDA含量增加、SOD活性减弱(P<0.05),Na+-K+-ATPase、Ca2+-ATPase活性均降低(P<0.05),NADPH氧化酶亚单位P22phox、Na+-K+-ATPase α1、PMCA1 mRNA表达增加(P<0.05),NCX1mRNA表达无明显变化;与HS组比较,HS+Tel组Na+-K+-ATPase、Ca2+-ATPase活性升高(P<0.05),其他指标无明显改变。结论高盐饮食可引起大鼠大脑皮质氧化损伤及钠钙泵活性降低。
关键词〔〕高盐饮食;大脑皮质;氧化应激;钠钙泵
第一作者:刘婵(1985-),女,硕士,助理研究员,主要从事高盐饮食致器官损害机制的研究。
高盐摄入不仅导致高血压发生,而且可造成脑卒中、冠心病发病危险增加〔1〕。然而盐对心脑血管疾病的致病机制至今仍不清楚。有文献〔2~4〕报道高盐摄入可引起大鼠心、肾脏、主动脉和大脑脑血管氧化应激功能紊乱,还原型辅酶Ⅱ(NADPH)氧化酶表达增高和超氧化物歧化酶(SOD)表达减少。肾素-血管紧张素系统、交感神经系统及细胞膜钠离子跨膜转运功能异常参与盐敏感的发病机制〔5〕。离子泵参与细胞膜结构的维持和细胞膜离子转运,特别是细胞膜Na+、K+和Ca2+的转运。大量研究发现,细胞膜结构及功能改变导致的离子转运缺陷与信号转导异常可能是高血压(尤其是盐敏感性高血压)的发病机制之一,而肾脏和中枢神经系统是和盐敏感性有密切关系的2 个主要器官和系统〔6〕。本实验拟探索慢性高盐负荷下大鼠大脑皮质氧化应激水平与离子泵功能的变化。
1材料与方法
1.1主要材料Na+-K+-ATPase、Ca2+-ATPase活性检测试剂盒,超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒(购于南京建成生物工程研究所)。引物根据相应cDNA序列设计,由TaKaRa生物工程公司合成。见表1。

表1 各目的基因引物序列及扩增片段长度
1.2方法
1.2.1模型的建立及分组Wistar大鼠适应性饲养1 w后,随机分为正常盐对照组(NS组)13只,8%高盐组(HS组)24只,8%高盐+替米沙坦干预组(HS+Tel组)13只。NS组饲以正常盐饲料(0.5%NaCl),HS组饲以8%高盐饲料,HS+Tel组饲以8%高盐饲料,同时给予替米沙坦灌胃,替米沙坦起始剂量2 mg/kg,随后根据血压情况每2 w调整1次剂量,最大剂量至40 mg/kg,使血压尽量控制在正常范围内。各组大鼠均在相同标准环境下饲养,自由饮用自来水,饲养24 w。
1.2.2血压测定用无创测压仪测量大鼠尾动脉压,每只大鼠测量3次,取其平均值,大鼠适应性饲养1 w后开始测压,作为基础压,随后每2 w测量1次,实验结束后测定大鼠颈总动脉压。根据实验终末尾动脉压与基础压的比较及颈动脉压水平,将HS组分为高盐高血压组(HS-HBP组)12只和高盐正常血压组(HS-NBP组)12只,共饲养24 w,高血压大鼠判定标准:处理后血压增加20~30 mmHg并>120 mmHg。
1.2.3氧化应激损伤指标测定24 w后将大鼠断头处死,在低温冰盘上取出分离大脑皮质,制作10%的组织匀浆,按照南京建成生物工程公司试剂盒说明书方法步骤测定,用紫外分光光度计检测MDA含量和SOD酶活性。
1.2.4大脑皮质离子泵活性检测离子泵(ATP酶)活性用酶学比色法测定,其活性以每毫克总蛋白中ATP酶每小时分解ATP产生磷的量表示(μmol·h-1·mg-1)。
1.2.5大脑皮质离子泵相关基因实时荧光定量PCR用Trizol 试剂提取大鼠大脑皮质总RNA,随后按QiagenRNeasyMini Kit 说明书对RNA进行纯化,紫外分光光度计测定样本在260 nm和280 nm的吸光度值(A260和A280),所得A260/A280在1.80~2.20之间认为纯度符合要求,配置40 μl 50 mg/L RNA逆转录液,逆转录合成cDNA后进行PCR反应,结果以目的基因/β-actin的比值进行分析。
1.3统计学方法应用SPSS19.0软件两两比较采用t检验;多组间比较采用方差分析,方差齐使用LSD法,方差不齐使用TamhaneT2法。
2结果
2.1各组大鼠大脑皮质氧化应激损伤比较与NS组比较,HS-HBP组、HS-NBP组MDA水平明显增高,SOD水平明显降低,HS+Tel组MDA水平增高(P<0.05);与高盐组比较,HS+Tel组MDA含量、SOD活性无明显差异。见表1。

表1 各组大鼠大脑皮质SOD活性、MDA含量比较
与NS组比较:1)P<0.05
2.2各组大鼠大脑皮质NAPDH氧化酶亚单位P22phox基因表达比较与NS组(100±13)比较,HS-HBP组NAPDH氧化酶亚单位P22phox基因水平(155±14)明显增高(P<0.05),其他各组间无明显差异(HS-NBP组:99±10,HS+Tel组:90±10)。
2.3各组大鼠大脑皮质离子泵活性比较与NS组比较,HS-HBP组、HS-NBP组大脑皮质Na+-K+-ATPase,Ca2+-ATPase活性明显降低(P<0.05);与高盐组比较,HS-Tel组Na+-K+-ATPase,Ca2+-ATPase活性均明显增加。见表2。
2.4各组大鼠大脑皮质离子泵相关基因表达比较表3可见,与NS组比较,HS-HBP组、HS-NBP组大脑皮质Na+-K+-ATPaseα1、PMCA1基因表达明显增加(P<0.05);与HS组比较,HS+Tel组Na+-K+-ATPaseα1、PMCA1基因表达均无明显差异;大脑皮质NCX1基因表达各组间无明显差异。

表2 各组大鼠大脑皮质Na+-K+-ATPase,Ca2+-ATPase
与NS组比较:1)P<0.05;与HS-HBP组比较:2)P<0.05;与HS-NBP比较:3)P<0.05;下表同

表3 各组大鼠大脑皮质Na+-K+-ATPaseα1,PMCA1和
3讨论
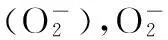

钠泵是由 α 、β和γ亚单位组成的多聚体,其中α亚单位为催化亚单位,其构型决定钠泵的活性,是钠泵的功能单位。α亚单位又有4种异构体:α1 、α2 、α3 和α4 。目前认为高盐摄入引起Ca2+超载的调控机制是高盐摄入引起哇巴因等增加,抑制钠泵活性,使胞内Na+增加,激活Na+-Ca2+交换蛋白(NCX1)反向转运,导致Ca2+升高〔11〕。前期研究表明:高血压患者的淋巴细胞及有高血压家族史子代的脐动脉血管平滑肌细胞(VSMC)和高血压大鼠VSMC质膜钠泵和钙泵活性降低、Ca2+增加;VSMC自分泌血管紧张素Ⅱ(Ang Ⅱ)增加,Ang Ⅱ抑制VSMC两种离子泵活性及其mRNA(钠泵α1、β1亚单位和PMCA亚型1(PMCA1)表达,Ang Ⅱ阻断剂上调VSMC两种离子泵活性及其mRNA表达〔14~16〕。Pulina等〔17〕发现哇巴因显著上调SD大鼠主动脉和肠系膜动脉VSMC钠泵α2亚单位。钠泵α2基因敲出小鼠血管张力增加、NCX1抑制剂阻断该效应并降低盐依赖高血压大鼠的血压,PMCA亚型(PMCA)4过表达能降低主动脉缩窄和AngⅡ灌注导致的Ca2+超载、心肌肥厚和纤维化〔18〕。本实验发现,高盐可使大鼠大脑皮质Na+-K+-ATPaseα1,PMCA1 mRNA表达增加,而大脑皮质Na+-K+-ATPase和Ca2+-ATPase活性却下降,推测在大脑皮质Na+-K+-ATPase α1,PMCA1可能不是决定Na+-K+-ATPase和Ca2+-ATPase活性的催化亚单位。
近年研究显示高盐使循环RAS抑制、组织局部RAS激活,高盐饮食诱导高血压大鼠心血管及肾脏AngⅡ1型(AT1)受体mRNA和密度增加、胶原沉积,AT1受体阻断剂(ARB)替米沙坦能减轻高盐饮食诱导的自发性高血压大鼠靶器官损害〔19〕。Kagiyama等〔20〕最近发现在AT1受体α亚型(AT1αR)基因敲除小鼠,高盐和醛固酮仍能诱导心肌间质和心肌内动脉周围纤维化,而细胞膜NCX和Na+-K+-ATPaseα2亚单位mRNA表达降低,说明高盐和醛固酮诱导心肌纤维化的机制至少部分不依赖Ang Ⅱ和AT1aR,可能还涉及NCX和Na+-K+-ATPase介导的Ca2+内流。本实验结果显示替米沙坦对长期高盐饮食饲养Wistar大鼠的大脑皮质保护作用可能与减少脑细胞内Na+和Ca2+浓度有关。
综上所述,长期高盐饮食饲养诱导Wistar 大鼠大脑皮质损伤与持续的高氧化应激水平和Na+-K+-ATPase、Ca2+-ATPase活性降低有关,替米沙坦可能通过增加钠钙泵活性对大脑皮质起保护作用。
参考文献4
1Umesawa M,Iso H,Date C,etal.Relations between dietary sodium and potassium intakes and mortality from cardiovascular disease:the Japan Collaborative Cohort Study for Evaluation of Cancer Risks〔J 〕.Am J Clin Nutr,2008;88(1):195-202.
2Durand MJ,Lombard JH.Low-dose angiotensin Ⅱ infusion restores vascular function in cerebral arteries of high salt-fed rats by increasing copper/zinc superoxide dimutase expression〔J〕.Am J Hypertens,2013;26(6):739-47.
3Lara LS,Satou R,Bourgeois CR,etal.The sodium-activated sodium channel is expressed in the rat kidney thick ascending limb and collecting duct cells and is upregulated during high salt intake〔J〕.Am J Physiol Renal Physiol,2012;303:F105-9.
4Zhu JX,Mori T,Huang TJ,etal.Effect of high-salt diet on NO release and superoxide production in rat aorta〔J〕.Am J Physiol Heart Circ Physiol,2004;286:H575-83.
5Bragulat E,de la Sierra A,Antonio MT,etal.Endothelial dysfunction in salt-sensitive essential hypertension〔J〕.Hypertension,2001;37(2-2):444-8.
6Orlov SN,Mongin AA.Salt-sensing mechanisms in blood pressure regulation and hypertension〔J〕.Am J Physiol Heart Circ Physiol,2007;293(4):p039-53.
7刘富强,牟建军,卫娜,等.中华慢性盐负荷下自发性高血压大鼠体内氧化应激水平与内皮功能变化〔J〕.中华高血压杂志,2009;17(5):440-3.
8孔祥,张道友,张妍,等.氧化应激在高脂高盐饮食伴高糖饮水诱导的代谢综合征肾病大鼠中的作用〔J〕.中国病理生理杂志,2011;27(11):2160-4.
9Swei A,Lacy F,DeLano FA,etal.Oxidative stress in the Dahl hypertensive rat〔J〕.Hypertension,1997;30(6):1628-33.
10Meng S,Cason GW,Gannon AW,etal.Oxidative stress in Dahl salt-sensitive hypertension〔J〕.Hypertension,2003;41(6):1346-52.
11Iwamoto T.Vascular Na+/Ca2+exchanger:implications for the pathogenesis and therapy of salt-dependent hypertension〔J〕.Am J Physiol Regul Integr Comp Physiol,2006;290:R536-45.
12Jaitovich A,Bertorello AM.Salt,Na+-K+-ATPase and hypertension〔J〕.Life Sci,2010;86(3-4):73-8.
13Hisaki R,Fujita H,Saito F,etal.Tempol attenuates the development of hypertensive renal injury in Dahl salt-sensitive rats〔J〕.Am J Hypertens,2005;18(5-1):707-20.
14方宇,商黔惠,姜黔峰,等.血管紧张素Ⅱ对有高血压家族史人脐动脉血管平滑肌细胞离子泵的影响〔J〕.中华高血压杂志,2010;18(2):153-9.
15张贵海,商黔惠,姜黔峰,等.心钠素对高血压大鼠动脉平滑肌细胞离子泵活性和基因表达的影响〔J〕.中华医学杂志,2009;89(40):2862-4.
16郭玉璜,商黔惠,吴芹,等.赖诺普利对自发性高血压大鼠血管平滑肌细胞离子泵活性及其 mRNA 表达的影响〔J〕.中国动脉硬化杂志,2010;18(6):441-4.
17Pulina MV,Zulian A,Berra-Romani R,etal.Upregulation of Na+and Ca2+transporters in arterial smooth muscle from ouabain-induced hypertensive rats〔J〕.Am J Physiol Heart Circ Physiol,2010;298(1):p63-74.
18Wu X,Chang B,Blair NS,etal.Plasma membrane Ca2+-ATPase isoform 4 antagonizes cardiac hypertrophy in association with calcineurin inhibition in rodents〔J〕.Clin Invest,2009;119(4):976-85.
19Varagic J,Frohlich ED,Susic D,etal.AT1 receptor antagonism attenuates target organ effects of salt excess in SHRs without affecting pressure〔J〕.Am J Physiol Heart Circ Physiol,2008;294(2):H853-8.
20Kagiyama S,Mastsumura K,Fukuhara M,etal.Aldosterone-and-Salt-induced cardiac fibrosis is independent from angiotensin Ⅱ type 1a receptor signaling in mice〔J〕.Hypertens Res,2007;30(10):979-89.
〔2015-01-15修回〕
(编辑袁左鸣)
Effects of high salt diet on oxidative stress and Na+-K+-ATPase and Ca2+-ATPase activities in cerebral cortex of Wistar rats
LIU Chan,CHEN Tao,SHANG Qian-Hui.
Institute of Clinical Medicine, Institute of Cardiovascular Disease and Hypertension Research Lab,Department of Cardiology of Affiliated Hospital, Zunyi Medical College,Zunyi 563003,Guizhou,China
【Abstract】ObjectiveTo study the effects of high salt diet on oxidative stress and Na+-K+-ATPase and Ca2+-ATPase activities and the mRNA expression in cerebral cortex of Wistar rats.MethodsWistar rats were divided into normal salt control(NS)(n=13),high salt(8%) model(HS, n=24) and high salt+telmisartan(HS+Tel) groups(n=12). Tail-cuff artery pressure was determined every 2 weeks. Values of SOD activity and MDA content were determined by colorimetry. The activities and mRNA levels of Na+-K+-ATPase and Ca2+-ATPase in cerebral cortex were determined by enzyme colorimetry and real-time polymerase chain reaction(PCR),respectively.ResultsCompared with those of NS group, activity of SOD was decreased and MDA content was increased. The activities of Na+-K+-ATPase and Ca2+-ATPase were significantly reduced, whereas the mRNA expressions of NAPDH, Na+-K+-ATPase α1 subunit and PMCA1 were increased. After treated with telmisartan, the activities of Na+-K+-ATPase and Ca2+-ATPase became much higher compared with those of HS group.ConclusionsLong-term high-salt diet could lead to oxidative stress and down-regulat activities of Na+-K+-ATPase and Ca2+-ATPase in cerebral cortex.
【Key words】High-salt diet; Cerebral cortex; Oxidative stress; Na+-pump;Ca2+-pump
通讯作者:商黔惠(1960-),女,硕士,教授,硕士生导师,主要从事高血压及其靶器官损害的机制和防治研究。
基金项目:国家自然科学基金资助项目(No.81160041);贵州省社会发展攻关计划项目〔黔科合SY字(2011)3047号〕;贵州省高层次人才科研条件特助项目(TZJF-2009年-42)
中图分类号〔〕R74〔
文献标识码〕A〔
文章编号〕1005-9202(2015)21-6027-04;doi:10.3969/j.issn.1005-9202.2015.21.011
