非肥胖糖尿病鼠的致糖尿病T细胞与年龄的相关性
2016-01-28王璐璐逄曙光田玉玲
王璐璐 逄曙光 田玉玲 于 丽 史 蕊 丁 琳 王 燕
(山东大学附属济南市中心医院,山东 济南 250013)
非肥胖糖尿病鼠的致糖尿病T细胞与年龄的相关性
王璐璐逄曙光田玉玲于丽史蕊1丁琳2王燕2
(山东大学附属济南市中心医院,山东济南250013)
摘要〔〕目的研究非肥胖糖尿病(NOD)鼠是否带有致糖尿病的T细胞及其致糖尿病能力是否随着NOD鼠年龄增长而增加。方法用NOD鼠和NOD背景的转基因鼠为动物模型,通过过继转移将不同周龄的NOD鼠T细胞转移到T细胞缺陷的NOD鼠(即NOD.scid鼠)和在β细胞上表达共刺激分子CD80的NOD.scid鼠(即NOD.scid.Rip.B7鼠)。观察过继转移后诱导受鼠糖尿病的发病率及各受鼠组发病率。结果(1)80%的NOD.scid.Rip.B7鼠在转移脾细胞11 w后发生糖尿病,而NOD.scid受鼠在转移后20 w尚没有1例受鼠发生糖尿病;(2)在转移后同一时间,不同周龄的NOD供鼠在相同受鼠中诱导的糖尿病发病率差异显著(P<0.001);不同周龄的受鼠糖尿病发病率无统计学差异(P>0.05)。结论(1)幼年NOD鼠的胰岛没有淋巴细胞浸润是因为β细胞特异性的T细胞数有限,其致糖尿病能力随着NOD供体鼠年龄的增长而增加;(2)在胰岛炎启动前,新生的和幼年的NOD.scid鼠就已经表达与疾病有关的β细胞自身抗原。
关键词〔〕CD8+T细胞;过继转移;1型糖尿病;NOD小鼠;胰岛炎
1泰山医学院2山东大学医学院
第一作者:王璐璐(1987-),女,硕士,住院医师,主要从事糖尿病发病机制及并发症影响因素的研究。
1型糖尿病(T1DM)是一种由T淋巴细胞进行性损伤胰岛β细胞导致胰岛素生成减少而引起的自身免疫性疾病〔1〕。非肥胖糖尿病(NOD)小鼠是一种模拟人类T1D的动物模型,在发病机制中有细胞免疫和体液免疫的参与,胰岛内有T淋巴细胞和其他免疫细胞浸润〔2〕。研究显示,CD4+T细胞和CD8+T细胞在T1DM发展中起着重要作用,均可作用于胰岛β细胞抗原,使β细胞溶解〔3〕。因此,是T细胞介导了胰岛β细胞的破坏。T1DM的发生同时需要CD4+T和CD8+T细胞的存在〔4〕。亦有研究表明,CD8+T细胞在胰岛炎的发生中起关键作用〔5〕,但是幼年NOD鼠是否带有致糖尿病的T细胞、其致糖尿病能力是否随着供鼠年龄的增长而增加,目前并不十分清楚。本研究拟观察CD8+T细胞致糖尿病能力是否与NOD供鼠年龄呈正相关。
1材料与方法
1.1材料
1.1.1实验动物NOD鼠和NOD.scid鼠购自吉林大学基础医学院实验动物中心和Jackson实验室(BarHarbor,ME),NOD.scid.Rip.B7鼠由Dr.D.Serreze友好提供(Jackson实验室,BarHarbor,ME);NOD.scid鼠是将先天性T、B、NK细胞缺陷的严重联合免疫缺陷(scid)小鼠基因引进NOD背景的小鼠;NOD.scid.Rip.B7转基因鼠是在胰岛的β细胞上大鼠胰岛素促进子(Rip)下游特异性表达B7-1(CD80)基因的NOD.scid鼠。
1.1.2主要试剂红细胞裂解液:Beyotime公司生产,产品编号C3702;磷酸盐缓冲液(PBS):Invitrogen公司生产,货号Cat No.14200-075;蛋白酶K(20 mg/ml):Invitrogen公司生产,货号Cat No.25530-049;上样缓冲液:Invitrogen公司生产,Lot No.1127020;DNA Taq polymerase:Invitrogen公司生产,Cat.No.18038-042。Rip.B7引物序列:Rip.B7-F35:5′-TGA AGC CAT GGG CCA CAC-3′;Rip.B7-R36:5′-GAC ACT GTT ATA CAG GGC-3′。
1.2方法
1.2.1脾细胞的制备将新鲜脾用两块灭菌载玻片的毛边研磨碎,4℃,离心5 min,弃上清;加红细胞裂解液2.5 ml/脾,混匀后立即4℃,离心5 min,弃上清;洗去红细胞裂解液,4℃,离心5 min,去上清;用PBS将白细胞充分悬浮,计数白细胞。
1.2.2小鼠基因型的鉴别利用聚合酶链反应(PCR)的方法鉴定B7基因型;用流式细胞分析技术鉴定NOD、NOD.scid。
1.2.3过继转移试验(1)从14天龄的幼年NOD鼠分离脾细胞,调整悬浮细胞使其浓度为10×107个脾细胞/ml。35只6~8周龄(成年鼠)的NOD.scid.Rip.B7作为受鼠,36只年龄与之匹配的NOD.scid鼠作为对照,取200 μl悬浮的脾细胞(含2×107个脾细胞),分别腹腔注射给每一只受鼠,监测受鼠糖尿病的发生。同样方法,分别将相同数量来自3、4、6周龄NOD鼠的脾细胞过继转移给6~8周龄(成年鼠)的NOD.scid,测定血糖,尾静脉取血监测受鼠糖尿病的发生。(2)从10~12周龄糖尿病前期的NOD鼠分离脾细胞,计数细胞后,用冰PBS悬浮细胞,使细胞浓度为10×107个脾细胞/ml。将新生的(n=30)以及1周龄(n=32)、2周龄(n=34)、3周龄(n=32)、6周龄(n=36)的NOD.scid鼠作为受鼠,取100 μl悬浮的脾细胞(含1×107个脾细胞),分别腹腔注射给每一只受鼠,尾静脉取血监测受鼠糖尿病的发生。
1.2.4糖尿病和胰岛炎的评估当连续2 d测定血糖均>16.7 mmol/L时评定为糖尿病。实验结束时,切除尚未发生糖尿病小鼠的胰腺,用10%甲醛固定,石蜡包埋,每间隔100 μm连续非重叠性切片并HE染色,评定胰岛炎。胰岛评分:正常胰岛(无淋巴细胞浸润),胰岛外周炎(淋巴细胞浸润在胰岛周围),胰岛炎(淋巴细胞浸润至胰岛内)。
1.3统计学分析采用SPSS18.0软件,两样本率的比较采用四格表资料的χ2检验,多样本率的比较采用行×列表资料的χ2检验。
2结果
2.1幼年NOD鼠与致糖尿病T细胞幼年NOD鼠的胰岛内没有淋巴细胞浸润并非因为缺乏内源性自身抗原,而是因为β细胞特异性的T细胞数有限。在转移脾细胞9 w后,当大部分(68.6%)NOD.scid.Rip.B7受鼠发生糖尿病时,在NOD.scid受鼠组尚没有检测到胰岛淋巴细胞浸润。转移脾细胞后11 w,80%的NOD.scid.Rip.B7鼠发生糖尿病,而在NOD.scid对照组,即使转移脾细胞后20 w仍然没有1例受鼠发生糖尿病。
2.2不同年龄NOD鼠T细胞致糖尿病能力T细胞的致糖尿病能力随着NOD供鼠年龄的增长而增加。当2×107个2周龄NOD鼠的脾细胞过继转移给6~8周龄的NOD.scid鼠时,转移后20 w未见有受鼠发生糖尿病(n=36);当将2×107个3周龄NOD鼠的脾细胞过继转移给6~8周龄的NOD.scid鼠时,转移后13 w时开始有受鼠发生糖尿病(5%),转移到15 w时有15%发生糖尿病,到转移后25 w时有约30%的受鼠发生糖尿病(n=35);当将相同数量的4周龄NOD鼠的脾细胞过继转移给6~8周龄的NOD.scid鼠时,转移后12 w时开始有受鼠发生糖尿病(10%),13、15 w时分别有20%、40%的受鼠发生糖尿病,到转移后20 w时有约50%的受鼠发生糖尿病(n=36);而转移相同数量的6周龄NOD鼠的脾细胞时,转移5 w后(36 d)开始有NOD.scid受鼠发生糖尿病(7.5%),到转移7 w时有35%发生糖尿病,转移后9 w时有约65%的受鼠发生糖尿病,转移11、12 w时有80%、90%的受鼠发生糖尿病,转移至13 w时100%受鼠均发生糖尿病(n=37)。
将不同周龄NOD鼠的脾细胞转移给6~8周龄的NOD.scid鼠,2×107脾细胞/受鼠,T细胞的致糖尿病能力随NOD供鼠年龄的增长而增强(P<0.001),见表1。
2.3幼年NOD鼠体内存在β细胞自身抗原的表达从已发生糖尿病的NOD鼠分离脾细胞并注射给新生的(n=30)以及1周龄(n=32),2周龄(n=34),3周龄(n=32),6周龄(n=36)的NOD.scid鼠。所有年龄组的受鼠均在接受转移细胞后5 w左右开始发病,转移后9 w时所有年龄组受鼠100%发病。尽管受鼠的年龄不同,但它们发生糖尿病的时间却相似,见图1,图2,表2。
将已发生糖尿病的NOD鼠的脾细胞转移给新生的以及1、2、3和6周龄的NOD.scid鼠,1×107脾细胞/受鼠。尽管受鼠的年龄不同,但它们发生糖尿病的时间却相似(P>0.05)。
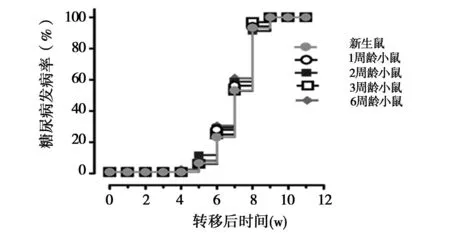
图1 将NOD鼠分离的脾细胞腹腔注射到不同周龄的NOD.scid鼠后糖尿病的发病率
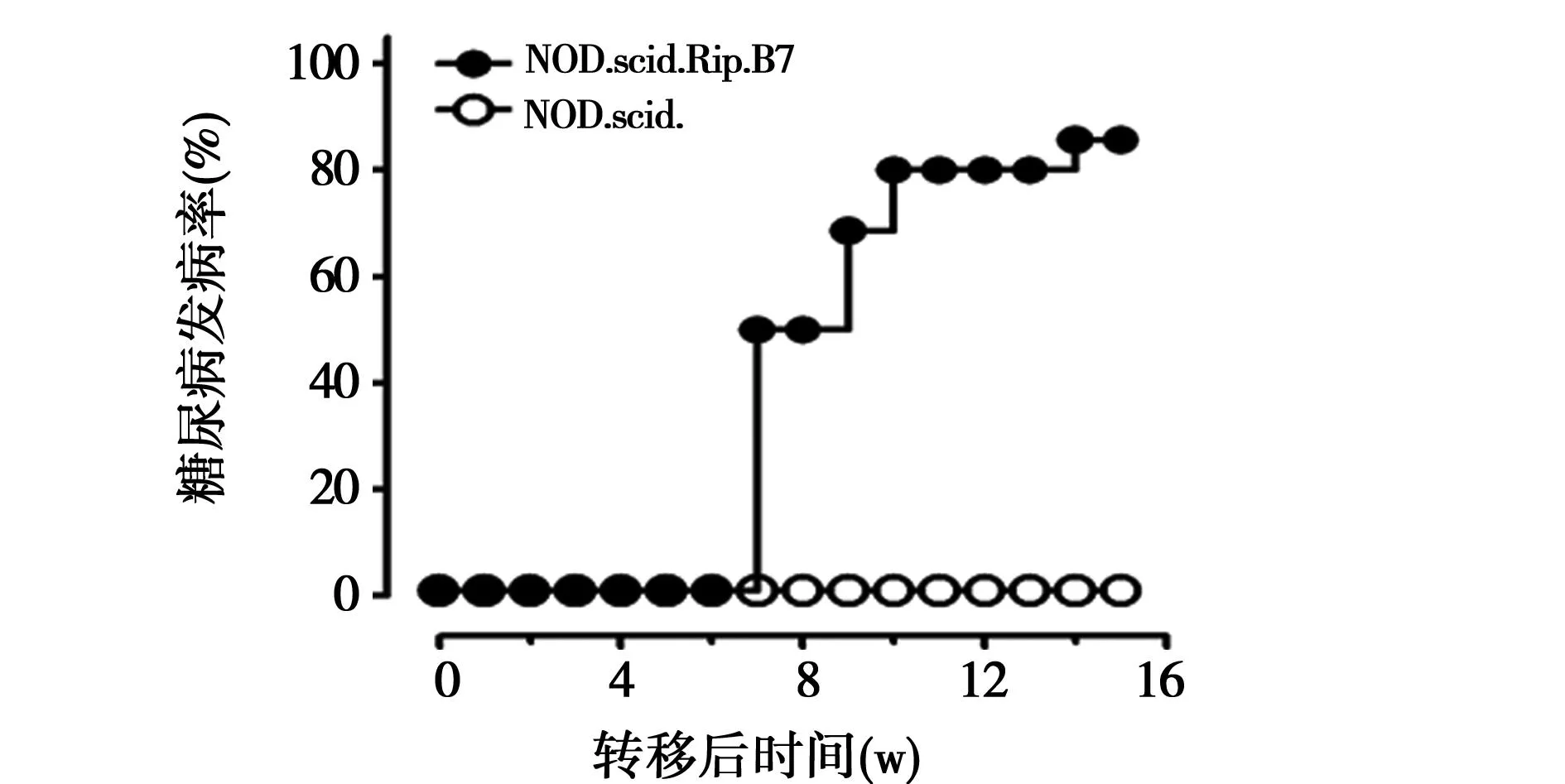
图2 从14天龄的幼年NOD鼠分离脾细胞分别过继转移到NOD.scid.Rip.B7鼠和NOD.scid鼠后观察过的糖尿病发病率
表1不同年龄NOD鼠的脾细胞转移后13、15 w时,多个样本率之间两两比较

组别比较13w样本率之差(%)χ2值P值15w样本率之差(%)χ2值P值3周龄与4周龄-13.733.02240.0821-24.605.48090.01923周龄与6周龄-94.2964.40440.0000-85.7154.36730.00004周龄与6周龄-80.5649.45010.00004-61.1132.36490.0000
表2糖尿病NOD鼠的脾细胞对不同年龄的NOD.scid鼠诱导的糖尿不同时间发生率(%)

受鼠周龄n3周4周5周6周7周8周9周新生鼠30006.723.353.393.31001周龄32006.328.156.393.81002周龄340011.829.458.891.21003周龄32006.32553.196.91006周龄3602.78.330.661.194.4100
3讨论
在T1DM发病中,细胞免疫所起到的作用主要包括T细胞、NK细胞、树突细胞、单核巨噬细胞等对胰岛的浸润,诱发胰岛炎,而T细胞对胰岛的浸润和破坏是T1DM发病的中心环节〔6,7〕。大量研究表明,CD4+和CD8+T细胞是介导破坏β细胞的基础〔4,8,9〕。这两种T细胞协同导致了T1DM的发生。将14天龄NOD鼠的脾细胞转移到NOD.scid鼠时,受鼠既不发生胰岛炎也不发生糖尿病。这可能是由于T细胞总数和(或)致糖尿病性T细胞数有限所致。首先发现,随着时间的推移,NOD.scid受鼠并没有发生糖尿病,而NOD.scid.Rip.B7受鼠的糖尿病发病率呈增长趋势。由于在NOD.scid.Rip.B7鼠中可诱导发生糖尿病,说明14天龄的NOD鼠的脾细胞含有β细胞特异性T细胞。但是,在NOD.scid受鼠中没有胰岛炎和糖尿病,也说明了在幼年NOD鼠中的T细胞数量(或)致糖尿病能力不足以在没有CD80的共同刺激作用时诱导糖尿病的发生。共刺激分子CD80在β细胞上的表达促进NOD.scid.Rip.B7受鼠发生胰岛炎这一事实表明致病性T细胞存在于幼年的NOD鼠,至少14天龄的NOD鼠体内存在致病性T细胞。
然后,我们检验了是否幼年NOD鼠体内缺少β细胞自身抗原的表达。结果表明在胰岛炎启动前,新生的和幼年的NOD.scid鼠就已经表达与疾病有关的β细胞自身抗原。
人类和NOD小鼠的主要组织相容复合物(MHC)-Ⅱ类等位基因与T1DM易感性有强大的基因连锁性〔10〕。在第6号染色体上的HLA-Ⅱ基因多态性被认为是2型糖尿病最主要的遗传位点〔11〕。因此,之前的研究〔12,13〕大多分析CD4+T细胞在糖尿病发病中的作用,在β细胞上表达共刺激分子CD80并不改变β细胞的发育和功能,却显著促进了糖尿病的发展〔14〕。然而,糖尿病发展的加速是否是胰岛炎早期启动和β细胞破坏增强的结果尚不清楚。本研究发现幼年NOD鼠的胰岛没有淋巴细胞浸润并非因为缺乏内源性自身抗原,而是因为β细胞特异性的T细胞数有限,但是其致糖尿病能力随着NOD供体鼠年龄的增长而增加。T1DM的发病是遗传与环境相互作用引发特异性自身免疫反应,选择性破坏胰岛β细胞等一系列过程。自身免疫破坏由多种免疫细胞参与。本文结果并不能完全解释糖尿病的发病机制,CD8+T细胞与其他免疫细胞相互作用对糖尿病发病的影响尚有待进一步研究。最近的研究结果表明T细胞可作为预防T1DM的靶细胞〔15〕。因此,明确T细胞在T1DM发病中的作用机制,将从免疫调节的角度为T1DM的预防和治疗提出新思路。
参考文献4
1Abreu JRF,Roep BO.Immune monitoring of islet and pancreas transplant recipients〔J〕.Curr Diab Rep,2013;13(5):704-12.
2Kachapati K,Adams D,Bednar K,etal.The non-obese diabetic(NOD)mouse as a model of human type 1 diabetes〔J〕.Methods Mol Biol,2012;933(1):3-16.
3Diz R,Garland A,Vincent BG,etal.Autoreactive effector/memory CD4+and CD8+T cells infiltrating grafted and endogenous islets in diabetic NOD mice exhibit similar T cell receptor usage〔J〕.PLoS One,2012;7(12):52054.
4Phillips JM,Parish NM,Raine T,etal.Type 1 diabetes development requires both CD4+and CD8+T cells and can be reversed by non-depleting antibodies targeting both T cell populations〔J〕.Rev Diabet Stud RDS,2009;6(2):97-103.
5Pang S,Zhang L,Wang H,etal.CD8(+)T cells specific for beta cells encounter their cognate antigens in the islets of NOD mice〔J〕.Eur J Immunol,2009;39(10):2716-24.
6王知笑,杨涛,陈家伟.自身免疫性1型糖尿病相关的CD8+T细胞表位〔J〕.免疫学杂志,2011;27(5):437-40.
7Hinman RM,Cambier JC.Role of B lymphocytes in the pathogenesis of type 1 diabetes〔J〕.Curr Diab Rep,2014;14(11):543.
8Coppieters KT,von Herrath MG.Viruses and cytotoxic T lymphocytes in type 1 diabetes〔J〕.Clin Rev Allergy Immunol,2011;41(2):169-78.
9Gutierrez DA,Fu W,Schonefeldt S,etal.Type 1 diabetes in NOD mice unaffected by mast cell deficiency〔J〕.Diabetes,2014;63(11):3827-34.
10De Riva A,Busch R.MHC class Ⅱ protein turn over in vivo and its relevance for autoimmunity in non-obese diabetic mice〔J〕.Front Immunol,2013;4(3):399.
11Xie Z,Chang C,Zhou Z.Molecular mechanisms in autoimmune type 1 diabetes:a critical review〔J〕.Clin Rev Allergy Immunol,2014;47(2):174-92.
12Perez S,Fishman S,Bordowitz A,etal.Selective immunotargeting of diabetogenic CD4 T cells by genetically redirected T cells〔J〕.Immunology,2014;143(4):609-17.
13Unanue ER.Antigen presentation in the autoimmune diabetes of the NOD mouse〔J〕.Ann Rev Immunol,2014;32(5):579-608.
14Wong FS,Du W,Thomas IJ,etal.The influence of the major histocompatibility complex on development of autoimmune diabetes in RIP-B7.1 mice〔J〕.Diabetes,2005;54(7):2032-40.
15王弘珺,李质馨,杨柳,等.Th1细胞在NOD小鼠糖尿病早期的应用〔J〕.中国老年学杂志,2012;32(4):1411-2.
〔2015-02-17修回〕
(编辑李相军)
Association of diabetogenic T lymphocytes and ages in NOD mice
WANG Lu-Lu,PANG Shu-Guang,TIAN Yu-Ling,etal.
Jinan Central Hospital Affiliated to Shandong University,Jinan 250013,Shandong,China
【Abstract】ObjectiveTo investigate whether young non-obese diabetic(NOD)mice contain diabetogenic T lymphocytes and the diabetogenic capacity of T cells increased with the age of NOD mice.MethodsNOD mice and NOD background transgenic mice using genetic engineering were used as animal models.According to adoptive transferred experiments,T cells were transferred from NOD mice and NOD background mice to T cell-deficient NOD mice and T cell-deficient NOD mice with co-stimulating molecules CD80 expressed specific on islets β cells.The incidence of induced diabetes were investigated in the two recipients.ResultsDiabetes was induced in 80% of NOD.scid.Rip.B7 mice by 11 weeks post-transfer.In contrast,none of the NOD.scid recipients developed diabetes even by 20 weeks post-transfer.There was significant difference among the diabetes incidence induced by different age of NOD donor mice by the same time post-transfer(P<0.001). There was no significant difference among different age of recipient mice of the diabetes incidence induced by diabetic NOD donor mice by the same time post-transfer(P>0.05).ConclusionsSpleen cells of young NOD mice contain beta cell-specific T cells,however,the T cell repertoire and/or frequency of diabetogenic T cells are limited.The diabetogenic capacity of T cells is increased with the age of NOD mice.Beta cell antigens have been expressed in young NOD mice before starting the insulitis.
【Key words】CD8+T cells;Adoptive transfer experiments;Type 1 diabetes;Non-obese diabetic(NOD)mice;Insulitis
通讯作者:逄曙光(1966-),女,教授,博士生导师,主任医师,主要从事糖尿病发病机制及并发症影响因素的研究。
基金项目:国家自然科学基金资助项目(81170771,81101183,81270175);山东省科技发展计划项目(2012GSF11803);济南市国际合作计划项目(201011008)
中图分类号〔〕R587.1〔
文献标识码〕A〔
文章编号〕1005-9202(2015)24-6989-04;doi:10.3969/j.issn.1005-9202.2015.24.010
