心外膜脂肪细胞核因子-κB信号途径抑制在抗动脉粥样硬化中的作用
2016-01-28邢杰
邢 杰
(海南省人民医院心脏外科,海南 海口 570311)
心外膜脂肪细胞核因子-κB信号途径抑制在抗动脉粥样硬化中的作用
邢杰
(海南省人民医院心脏外科,海南海口570311)
摘要〔〕目的研究心外膜脂肪细胞核因子(NF)-κB信号途径抑制在抗动脉粥样硬化中的作用。方法建立泡沫细胞模型,分为空白组,转染试剂组,siRNA干扰组,高脂组,高脂+SRT1720组,高脂+SRT1720+siRNA干扰组。采用油红O染色判断模型的建立,采用Western印迹方法进行蛋白表达的分析。结果建立模型成功;与高脂组比较,高脂+SRT1720组SIRT1蛋白表达量升高显著,NF-κB及其下游靶分子肿瘤坏死因子(TNF)-α蛋白表达量下降显著(P<0.05)。与高脂+SRT1720组比较,高脂+SRT1720+siRNA干扰组SIRT 1蛋白表达量下降显著,NF-κB及其下游靶分子TNF-α蛋白表达量升高显著(均P<0.05)。结论泡沫细胞中SIRT1 是 NF-κB信号通路的上游,通过抑制心外膜脂肪组织NF-κB炎症信号途径,参与调节泡沫细胞从动脉粥样硬化斑块中移出,可为防治冠状动脉粥样硬化的治疗提供新的手段。
关键词〔〕NF-κB信号途径;心外膜脂肪细胞;抗动脉粥样硬化;沉默信息调节因子(SIRT)1
第一作者:邢杰(1965-),男,副主任医师,主要从事先天性心脏病、心脏瓣膜病,冠心病及大血管病研究。
心外膜脂肪一般来讲是指在心外膜及心肌外表面间的脂肪组织,在人类的心脏外膜覆盖。与其他白色脂肪组织不一样,心外膜脂肪组织的生理功能多样,作为多种炎性介质的来源,其不仅能够作为脂质的储存库,还发挥内分泌的作用,通过分泌趋化因子、细胞因子、激素等来维持机体的正常功能〔1,2〕。动脉粥样硬化(AS)是一个炎症反应性的慢性病程,患者血管中的单核细胞在各种黏附分子的作用下附着在血管内壁,使得单核细胞趋化因子(MCP)-1与其受体2相结合,加速单核细胞转化为巨噬细胞的速度,最终导致巨噬细胞过多地集聚在动脉粥样斑块的中心,并发展为凋亡而引发坏死脂核〔3,4〕。冠状动脉粥样硬化患者心外膜脂肪致炎因子分泌水平升高,抗炎因子分泌水平降低,过多分泌的致炎因子利用内分泌、旁分泌通路来作用于心肌及冠状动脉,加速冠状动脉病变的形成及发展〔5〕。因此从炎症信号途径出发,探讨通过调控心外膜脂肪的炎症来防治冠状动脉粥样硬化意义重大。本研究探讨心外膜脂肪细胞核因子(NF)-κB信号途径抑制在抗AS中的作用。
1资料与方法
1.1仪器与试剂荧光显微镜(北京中仪光科科技发展有限公司)、全自动生化分析仪(日本OLYMPUS)。人单核细胞株U937购自美国Sciencell,沉默信息调节因子(SIRT)1激动剂、RPMI1640细胞培养基及胎牛血清购自美国GIBCO公司。 NF-κB,肿瘤坏死因子(TNF)-α购自美国Santa Cruz公司。
1.2建立泡沫细胞模型 在含有10%胎牛血清的高糖(约5.0 g/L) RPMI1640培养基中对人单核细胞系U937细胞进行培养,于5%CO2、37℃条件下的培养箱中放置12 h,加入链霉素(100 U/ml)和青霉素(100 mg/ml),孵育12 h,进行巨噬细胞的诱导分化。另取对数生长期细胞,调整浓度至1×106个/ml,接种于6孔板上,每孔约1.5 ml,加终浓度为0.2 mmol/L的软脂酸钠、终浓度为0.08 g/L的ox-LDL,共同孵育24 h,建立诱导的泡沫细胞模型。
1.3实验分组分为空白组,转染试剂组,siRNA干扰组,高脂组,高脂+SRT1720组,高脂+SRT1720+siRNA干扰组。空白组细胞干预为于含高糖(约5.0 g/L) RPMI1640培养基中进行常规培养;转染试剂组是在空白组+5 μl的转染试剂;干扰组为转染试剂组+6 μmol/L的SIRT1干扰siRNA;高脂组为空白组+0.2 mmol/L的软脂酸钠+0.08 g/L的ox-LDL;高脂+SRT1720组为高脂组+5 μmol/L的SIRT1激动剂SRT1720;高脂+SRT1720+干扰组为高脂+SRT1720+6 μmol/L的SIRT1干扰siRNA。siRNA干扰操作过程参考说明书。
1.4油红O染色参照“1.2.1”中操作步骤,在细胞诱导为巨噬细胞的基础上进行细胞玻片制片,采用4%的多聚甲醛固定,行油红O染色。
1.5Western印迹分析蛋白表达采用4℃磷酸盐缓冲液洗细胞两次,1 min/次,加入放射免疫沉淀法(RIPA)细胞裂解液后,刮取相应细胞进行冰上裂解,约半小时后震荡,每5 min进行1次,后给予针头抽吸,每次1 ml左右,重复10次,4℃下12 000 r/min离心,离心30 min,吸上清液,采用二辛可宁酸(BCA)法测蛋白的浓度。并给予十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳试验,10%脱脂牛奶封闭60 min,抗体SIRT1以1∶500、NF-κB以1∶1 000、TNF-α以1∶500的比例在Tris-HCl缓冲盐溶液+Tween(TBST)中进行稀释,4℃下孕育24 h,TBST洗涤,共计3次,每次15 min;二抗以1∶5 000的比例,室温下放置1 h,TBST洗涤,共计3次,每次15 min。电化学发光(ECL)液发光,暗室中曝光,X线显影,采用Quantity One图像分析系统进行分析。
1.6统计学方法采用SPSS20.0统计软件进行t、χ2检验。
2结果
2.1U937巨噬细胞源性泡沫细胞模型的建立采用 PMA诱导U937单核细胞,24 h后发现,诱导下的细胞形态出现明显变化,大部分细胞呈梭形并紧贴壁生长,部分分化良好者出现伪足,此时提示单核细胞已分化为巨噬细胞,见图1。另在显微镜下观察,由于软脂酸钠及ox-LDL的作用,大部分细胞的细胞质内出现明显的红色脂质颗粒,与既定的泡沫细胞形态特点较为一致,见图2,提示建立模型成功。
2.2干扰siRNA对SIRT1的表达影响Western印迹检测表明,siRNA可明显降低SIRT1蛋白的表达水平,见图3。
2.3泡沫细胞模型中NF-κB信号途径及相关因子的Western印迹结果与高脂组比较,高脂+SRT1720组SIRT1蛋白表达量升高显著,NF-κB及其下游靶分子TNF-α蛋白表达量下降显著(均P<0.05 )。与高脂+SRT1720组比较,高脂+SRT1720+siRNA干扰组SIRT 1蛋白表达量下降显著,NF-κB及其下游靶分子TNF-α蛋白表达量升高显著(均P<0.05 )。见图4。
图1 巨噬细胞(×200)
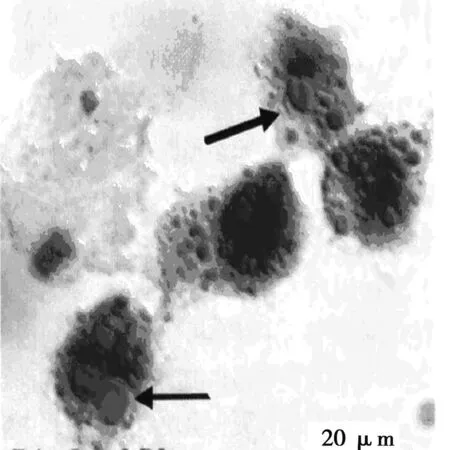
图2 泡沫细胞(箭头处为典型改变,×200)
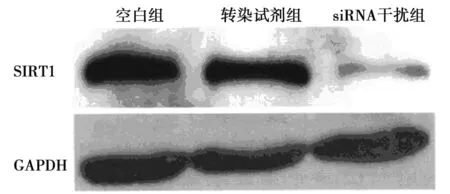
图3 干扰siRNA对SIRT1的表达影响
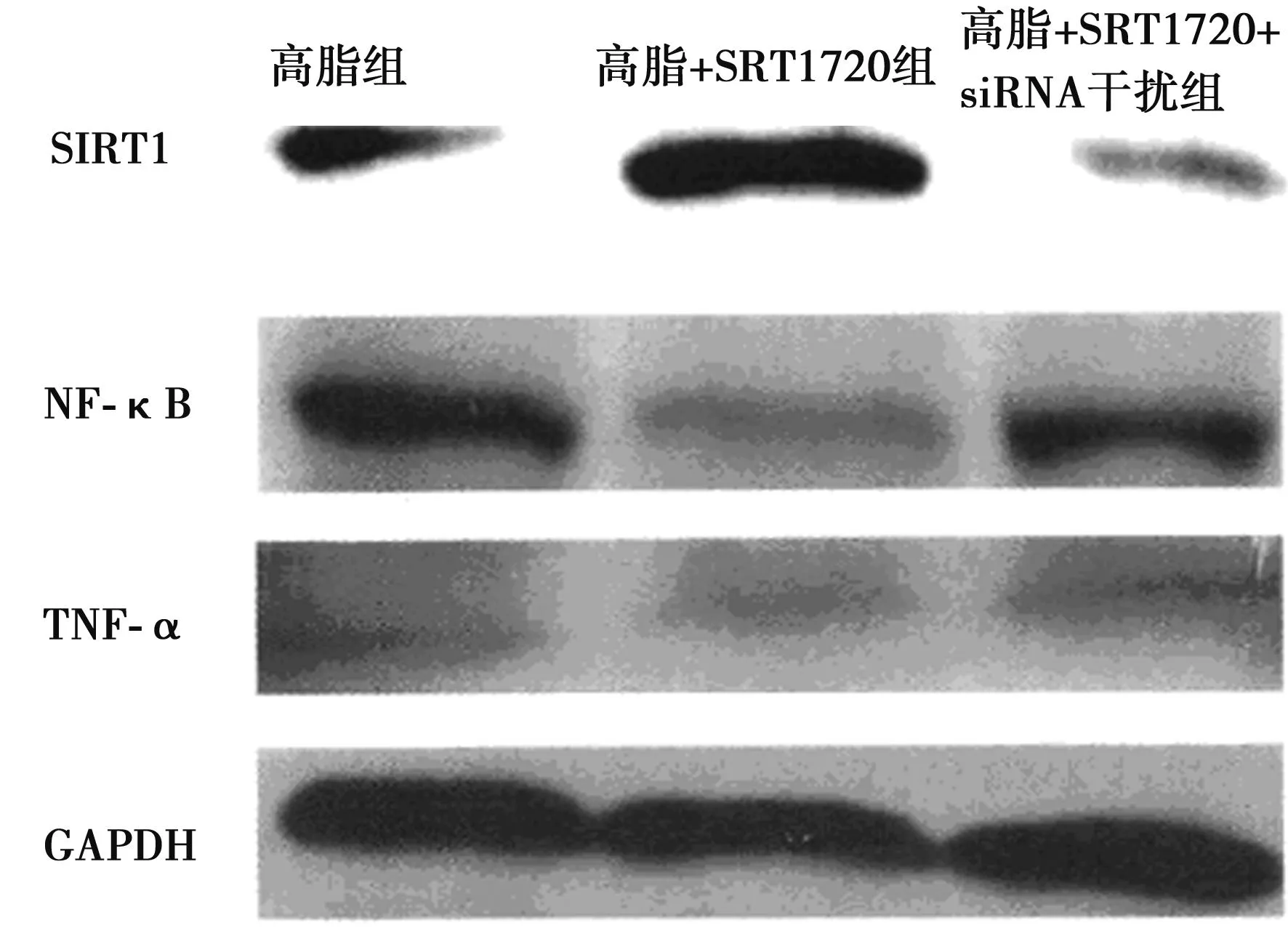
图4 泡沫细胞模型中NF-κB信号途径及相关因子的Western印迹结果
3讨论
AS是在遗传、环境等多种因素共同作用下所出现的一种慢性炎症反应性疾病,其发生的具体机制尚无统一的定论,多数观点认为其发生发展与内皮细胞、血管平滑肌细胞、巨噬细胞、泡沫细胞及炎症反应的关系较为密切〔6,7〕。相关文献报道指出,内脏脂肪组织的功能不单局限于储存能量,还能够发挥内分泌的作用,通过分泌多种脂肪细胞因子来参与并促进AS发生及发展〔8〕。心外膜脂肪作为一个具有免疫活性的器官,参与冠脉周围炎症的发生。作为内脏脂肪组织的一部分,心外膜脂肪组织邻近冠脉,属于棕色脂肪的一部分,通过自身分解为游离脂肪酸为心脏供能,调节心脏温度,保护心脏自主神经起保护作用〔9,10〕。
Motoyama等〔11〕通过比较冠状动脉疾病(CAD)和非CAD(NCAD)患者的心外膜脂肪与腿部脂肪组织,证实了在CAD患者的心外膜脂肪中 NF-κB、TNF-α的表达明显升高 。Hung等〔12〕,心外膜脂肪中的炎性反应在很大程度上是通过脂多糖(LPS)与巨噬细胞表面的Toll样受体(TLR)-2或 4结合,利用NF-κB和JNK信号传导通路来参与AS过程。NF-κB 作为机体较为重要的一种核转录因子,其能够与κB位点的基因启动子特异性结合,加速基因启动子的转录表达,通过诱导其活化,来达到调控转录因子、炎症细胞因子、黏附因子的目的,参与炎性反应〔13〕。目前关于NF-κB 作为多种疾病治疗的分子靶点已引起学术界的广泛关注〔14,15〕。AS过程的产生也是炎症反应发生的过程,本研究结果表明,在泡沫模型细胞中 NF-κB炎症信号通路受到SIRT1的调控,SIRT1是 NF-κB信号的上游,推测,SIRT1可能通过脱乙酰化NF-κB来降低或阻止其促炎症反应信号的传导,来缓解AS斑块形成或促进其消退。既有文献〔15〕报道,在内皮细胞中SIRT1能够利用对NF-κB信号通路的关键步骤的干扰来实现抗炎症反应过程。动物试验也显示,敲除NF-κB的亚基P50可以明显缩小其斑块,且降低斑块内的泡沫细胞〔16〕。本研究结果提示机体通过调控NF-κB信号通路的活性,泡沫细胞中的炎症信号受到调节,进而影响AS斑块的形成及消退 。
参考文献4
1Gaisl T,Schlatzer C,Schwarz EI,etal.Coronary artery calcification,epicardial fat burden and cardiovascular events in chronic obstructive pulmonary disease〔J〕.PLoS One,2015;10(5):e0126613.
2Saad Z,El-Rawy M,Donkol RH,etal.Quantification of epicardial fat:Which method can predict significant coronary artery disease〔J〕?World J Cardiol,2015;7(5):287-92.
3Staff AC,Dechend R,Pijnenborg R.Learning from the placenta:acute atherosis and vascular remodeling in preeclampsia-novel aspects for atherosclerosis and future cardiovascular health〔J〕.Hypertension,2010;56(6):1026-34.
4Wang W,Feng SJ,Li H,etal.Correlation of lower concentrations of hydrogen sulfide with activation of protein kinase CβII in uremic accelerated atherosclerosis patients〔J〕.Chin Med J (Engl),2015;128(11):1465-70.
5Watanabe T,Kawasaki M,Tanaka R,etal.Anti-inflammatory and morphologic effects of pitavastatin on carotid arteries and thoracic aorta evaluated by integrated backscatter trans-esophageal ultrasound and PET/CT:a prospective randomized comparative study with pravastatin (EPICENTRE study)〔J〕.Cardiovasc Ultrasound,2015;13(1):17.
6Katranas SA,Kelekis AL,Antoniadis AP,etal.Differences in stress forces and geometry between left and right coronary artery:a pathophysiological aspect of atherosclerosis heterogeneity〔J〕.Hellenic J Cardiol,2015;56(3):217-23.
7Li C,Wang Z,Wang C,etal.Perivascular adipose tissue-derived adiponectin inhibits collar-induced carotid atherosclerosis by promoting macrophage autophagy〔J〕.PLoS One,2015;10(5):e0124031.
8Eftekhar S,Parsaei H,Keshavarzi Z,etal.The prevention and treatment effects of egg yolk high density lipoprotein on the formation of atherosclerosis plaque in rabbits〔J〕.Iran J Basic Med Sci,2015;18(4):343-9.
9Belen E,Degirmencioglu A,Zencirci E,etal.The association between subclinical hypothyroidism and epicardial adipose tissue thickness〔J〕.Korean Circ J,2015;45(3):210-5.
10Eroglu S.How do we measure epicardial adipose tissue thickness by transthoracic echocardiography〔J〕?Anatol J Cardiol,2015;15(5):416-9.
11Motoyama S,Ito H,Ozaki Y.Can lipid tissues including Epicardial Adipose Tissue (EAT),Visceral Adipose Tissue (VAT) and coronary plaque be moving in the same direction〔J〕?Circ J,2015;79(5):969-71.
12Hung WC,Tang WH,Wang CP,etal.Increased epicardial adipose tissue volume is associated with PR interval prolongation〔J〕.Clin Invest Med,2015;38(1):E45-52.
13Baker AR,Harte AL,Howell N,etal.Epicardial adipose tissue as a source of nuclear factor-kappaB and c-Jun N-terminal kinase mediated inflammation in patients with coronary artery disease〔J〕.J Clin Endocrinol Metab,2009;94(1):261-7.
14Craig EA,Parker P,Austin AF,etal.Involvement of the MEKK1 signaling pathway in the regulation of epicardial cell behavior by hyaluronan〔J〕.Cell Signal,2010;22(6):968-76.
15Sattler KJ,Galili O,Rodriguez-Porcel M,etal.Dietary reversal of experimental hypercholesterolemia improves endothelial dysfunction of epicardial arteries but not of small coronary vessels in pigs〔J〕.Atherosclerosis,2006;188(2):301-8.
16Labarrere CA,Hardin JW,Haas DM,etal.Chronic villitis of unknown etiology and massive chronic intervillositis have similar immune cell composition〔J〕.Placenta,2015;36(6):681-6.
〔2014-12-19修回〕
(编辑苑云杰)
基金项目:海南省应用技术研发与示范推广专项项目(No.ZDXM2015074)
中图分类号〔〕R446.1〔
文献标识码〕A〔
文章编号〕1005-9202(2015)24-6981-03;doi:10.3969/j.issn.1005-9202.2015.24.007
