动、静脉移植骨髓间充质干细胞治疗急性期缺血再灌注大鼠模型的比较
2016-01-28屈新辉王万松吴凌峰张昆南吴晓牧
屈新辉 王万松 吴凌峰 谢 琛 张昆南 吴晓牧
(江西省人民医院神经内科 江西省神经病学研究所,江西 南昌 330006)
动、静脉移植骨髓间充质干细胞治疗急性期缺血再灌注大鼠模型的比较
屈新辉王万松1吴凌峰谢琛张昆南吴晓牧
(江西省人民医院神经内科江西省神经病学研究所,江西南昌330006)
摘要〔〕目的探讨缺血再灌注6 h后经动、静脉途径移植骨髓间充质干细胞疗效的差异。方法将27只大脑中动脉缺血2 h后再灌注SD雌性大鼠模型随机分为颈动脉BMSCs组8只、尾静脉BMSCs组7只、颈动脉PBS组6只和尾静脉PBS组6只。全骨髓贴壁法分离、培养BMSCs,流式细胞仪检测鉴定;取缺血再灌注后6 h为移植时间点;移植后第7天观察改良神经功能损伤评分(mNSS)以评价神经功能恢复和体能恢复,免疫组织化学检测梗死周围组织GFAP、Bax和Bcl-2,TUNEL法检测梗死周围组织细胞凋亡,ELISA检测血清肿瘤坏死因子(TNF)-α。结果BMSCs表面抗原CD90表达率为95.7%、CD29表达率为97.3%、CD106表达率为52.7%、CD11b表达率为6.01%、CD34表达率为2.95%、CD45表达率为2.26%。BMSCs组和PBS组相比较:GFAP阳性细胞数、Bcl-2平均光密度值显著增多;mNSS、血清TNF-α浓度、TUNEL阳性细胞数显著减少;Bax平均光密度值无明显差异。颈动脉BMSCs组和尾静脉BMSCs相比较各项数据无统计学差异。结论在缺血再灌注早期动、静脉途径移植BMSCs疗效无差异,但尾静脉途径因创伤微小、可移植细胞量多,为早期最佳移植途径。
关键词〔〕骨髓间充质干细胞;缺血再灌注;脑梗死;移植;凋亡
1南昌大学医学院(现南昌大学第一附属医院康复科)
第一作者:屈新辉(1970-),男,硕士,硕士生导师,主任医师,主要从事脑血管病和干细胞研究。
骨髓间充质干细胞(BMSCs)因来源稳定、取材方便、易于扩增、低免疫源性且无道德伦理冲突而广泛运用于组织修复和再生领域,其中包括发病率、致死和致残率极高的脑梗死。大量的BMSCs治疗脑梗死实验证明,BMSCs能有效促进脑梗死组织修复和神经功能缺损症状的改善〔1〕,但具体机制仍不明了。目前对于最佳移植时间点和最佳移植途径仍存在争议。本实验拟研究缺血再灌注6 h后分别经动、静脉移植BMSCs的疗效差异和具体机制。
1材料和方法
1.1BMSCs的分离、培养、扩增和鉴定3~4周龄清洁级SD幼鼠脱臼处死,75%医用酒精浸泡10 min,于超净台中分离股骨和胫骨,无菌磷酸盐缓冲液(PBS)清洗残留组织后去除两端骨骺,用无菌注射器吸取适量含10%胎牛血清(FBS)的DMEM/F12培养基混合液反复冲洗骨髓腔,将骨髓吹打均匀后接种于25 cm2细胞培养瓶,置于37℃和5%CO2的细胞孵育培养箱中,24 h后半量换液,2 d后全量换液,以后每2~3 d换液一次。观察细胞密度接近90%时按1∶2传代培养、扩增。
选取第二代细胞用含0.25%乙二胺四乙酸(EDTA)的胰酶消化,4℃条件下1 000 r/min离心,弃去上清液后PBS清洗,PBS调整细胞密度为1×106,行细胞表面抗原CD29、CD90、CD106、CD34、CD45、CD11b(Biolegend公司)及同型对照避光孵育,1 000 r/min离心,弃去上清液,PBS重悬为1 ml上机液行流式检测。
1.2线栓法大鼠脑缺血模型(MCAO)的制作选用体重250~280 g的清洁级SD雌性大鼠(湖南斯莱克景达公司),10%水合氯醛按0.3 ml/100 g剂量腹腔麻醉。仰卧位固定四肢及头部,颈部前正中切口,钝性分离颈总动脉、颈内动脉、颈外动脉和迷走神经。夹闭颈总动脉和颈内动脉,结扎并剪断颈外动脉。采用直径为0.26 mm、线头直径为0.36 mm的尼龙线(北京西浓生物科技有限公司)从颈外动脉残端插入颈内动脉,插入深度约为18 mm,稍遇阻力即停止。阻断大脑中动脉血流2 h后缓慢拔出栓线以解除梗阻再通血流。
1.3移植将MACO模型按随机数字表分为颈动脉BMSCs组(n=8)、尾静脉BMSCs组(n=7)、颈动脉PBS组(n=6)和尾静脉PBS组(n=6)。颈动脉BMSCs组和颈动脉PBS组经如下处理:10%水合氯醛腹腔麻醉大鼠,打开原切口,钝性分离颈总动脉和颈内动脉,将PE50导管由颈外动脉残端插入颈内动脉,分别推注含1×106BMSCs的细胞悬浮液500 μl和PBS 500 μl,棉签按压,缝合切口。尾静脉BMSCs组和尾静脉PBS组处理如下:固定大鼠,温水浸泡鼠尾5 min,酒精反复擦拭,1 ml注射器推注含1×106BMSCs的细胞悬浮液500 μl和PBS 500 μl,棉签按压。所有大鼠自由摄取食物和饮水,移植条件相对无菌,未给予抗生素处理。
1.4神经功能缺损检测在缺血再灌注后6 h和移植后第7天对大鼠行改良神经功能缺损评分(mNSS),总分18分,神经功能缺损越严重得分越高。评分7~12分即纳入实验分组。
1.5免疫组化检测移植后第7天处死大鼠,心尖采血,4%多聚甲醛固定并取脑,4℃ 4%多聚甲醛固定过夜,冠状位将脑梗死部位切为2 mm厚的脑片,脱水并石蜡包埋。将蜡块切为4 μm厚的切片,脱蜡至水,柠檬酸钠修复,3%H2O2灭活,滴加一抗,神经胶质酸性蛋白(GFAP,1∶3 000,abcam)、血管内皮生长因子(VEGF,1∶100,abcam)、B淋巴细胞瘤-2(Bcl-2,1∶100,abcam)基因蛋白、Bcl-2相关x蛋白(Bax,1∶100,abcam),4℃过夜,二抗孵育,二氨基联苯胺(DAB)显色,苏木素核染。脱水透明,封片。
1.6细胞凋亡检测采用商品试剂盒(Roche)检测细胞凋亡,按照说明书操作。
1.7细胞因子检测将心尖采取的血液室温静置2 h,2 000 r/min离心10 min,分装血清于-80℃冻存,检测时室温解冻。按ELISA商品试剂盒(上海西塘)说明书操作。
1.8图片采集和分析采用医学光学显微镜(OLYMPUS,×40物镜)和Image Pro Plus6.0软件采集分析图片,每张玻片于缺血半暗带处取6张图片,计平均光密度值和阳性细胞数。
1.9统计学方法应用SPSS19.0软件行单因素方差分析,若数据方差齐性,采用LSD法行均数两两比较;方差不齐则采用Dunnett T3法分析。
2结果
2.1BMSCs鉴定BMSCs体外呈纺锤状长梭形,贴壁集落生长。细胞表面抗原鉴定结果:CD90表达率为95.7%、CD29表达率为97.3%、CD106表达率为52.7%、CD11b表达率为6.01%、CD34表达率为2.95%、CD45表达率为2.26%。
2.2mNSS测定及比较移植前,颈动脉BMSCs组mNSS为9.35±0.92,尾静脉BMSCs组为9.14±1.06,颈动脉PBS组为9±1.2,尾静脉PBS组为9.17±0.75,四组评分无统计学差异。移植后第7天,颈动脉BMSCs组mNSS(5.13±0.64)显著小于颈动脉PBS组(6.57±0.58),尾静脉BMSCs组mNSS(5.14±0.69)显著小于尾静脉PBS组,颈动脉BMSCs组和尾静脉BMSCs组mNSS无统计学差异。
2.3免疫组化检测结果比较①颈动脉BMSCs组GFAP阳性细胞数(45.38±7.11)显著高于颈动脉PBS组(35.33±3.61),尾静脉BMSCs组(47±6.27)显著高于尾静脉PBS组(34±4.34),颈动脉BMSCs组和尾静脉BMSCs组GFAP阳性细胞数无统计学差异。②颈动脉BMSCs组Bcl-2平均光密度值(222.9±22.63)显著高于颈动脉PBS组(195.26±12.94),尾静脉BMSCs组(224.36±17.24)显著高于尾静脉PBS组(190.63±18.46),颈动脉BMSCs组和尾静脉BMSCs组Bcl-2平均光密度值无统计学差异。③Bax平均光密度值颈动脉BMSCs组(215.09±36.81)、尾静脉BMSCs组(218.29±42.65)、颈动脉BMSCs组(231.47±46.23)和尾静脉PBS组(230.1±52.17)比较,组间无统计学差异,但BMSCs组Bax平均光密度值较PBS组有减小趋势。见图1~图3。
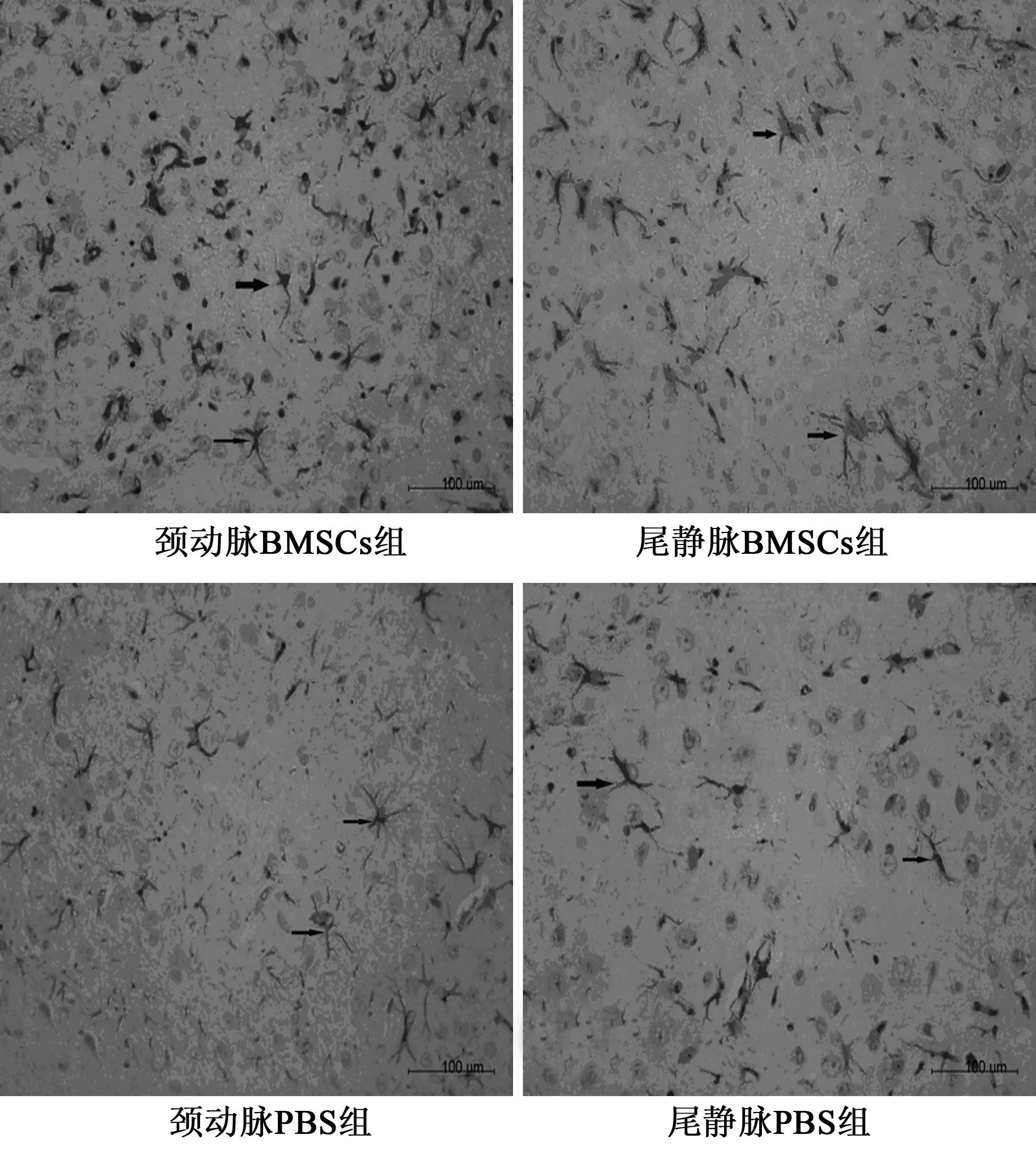
图1 GFAP表达情况(×400)
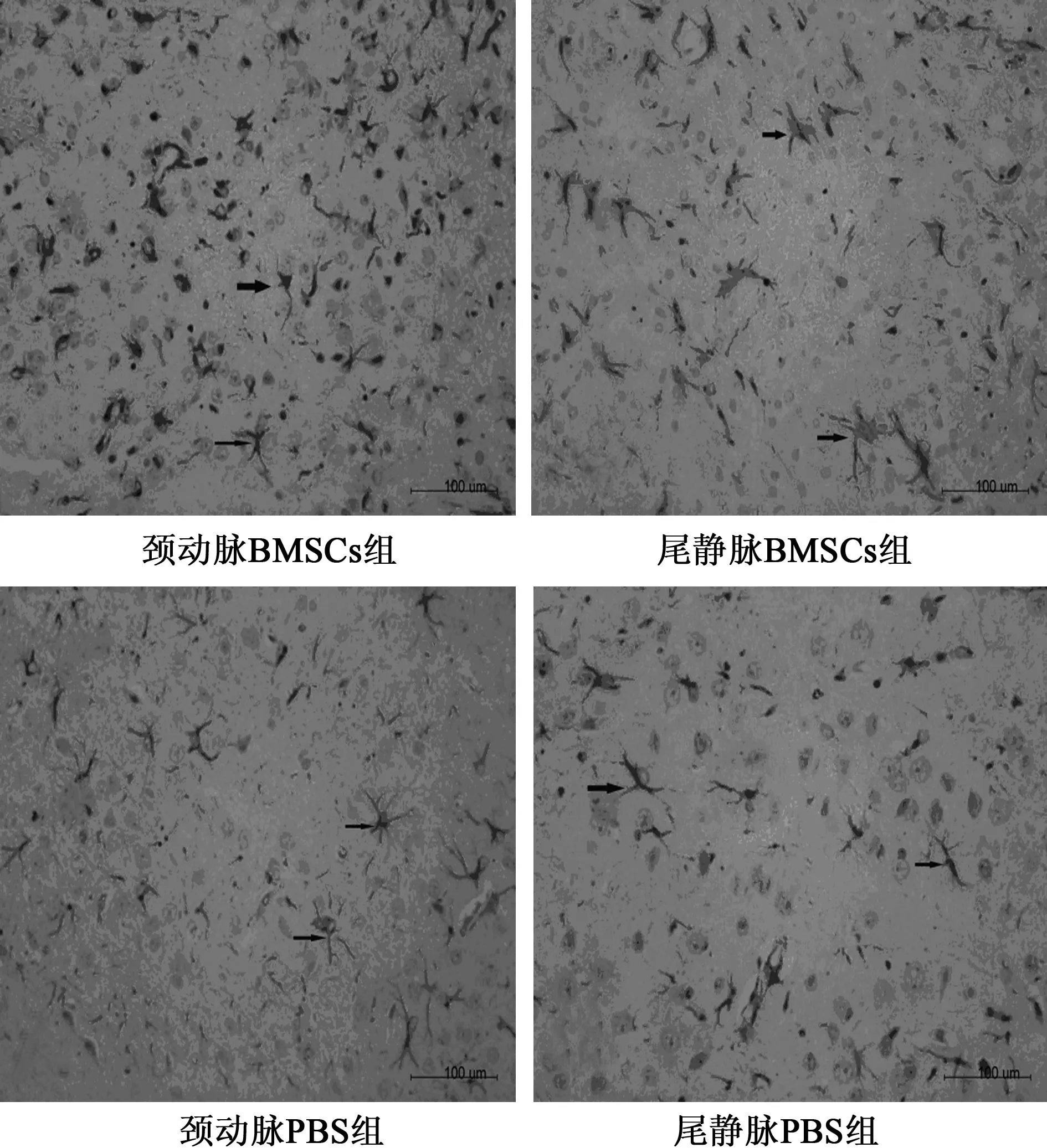
图2 Bcl-2表达情况(×400)
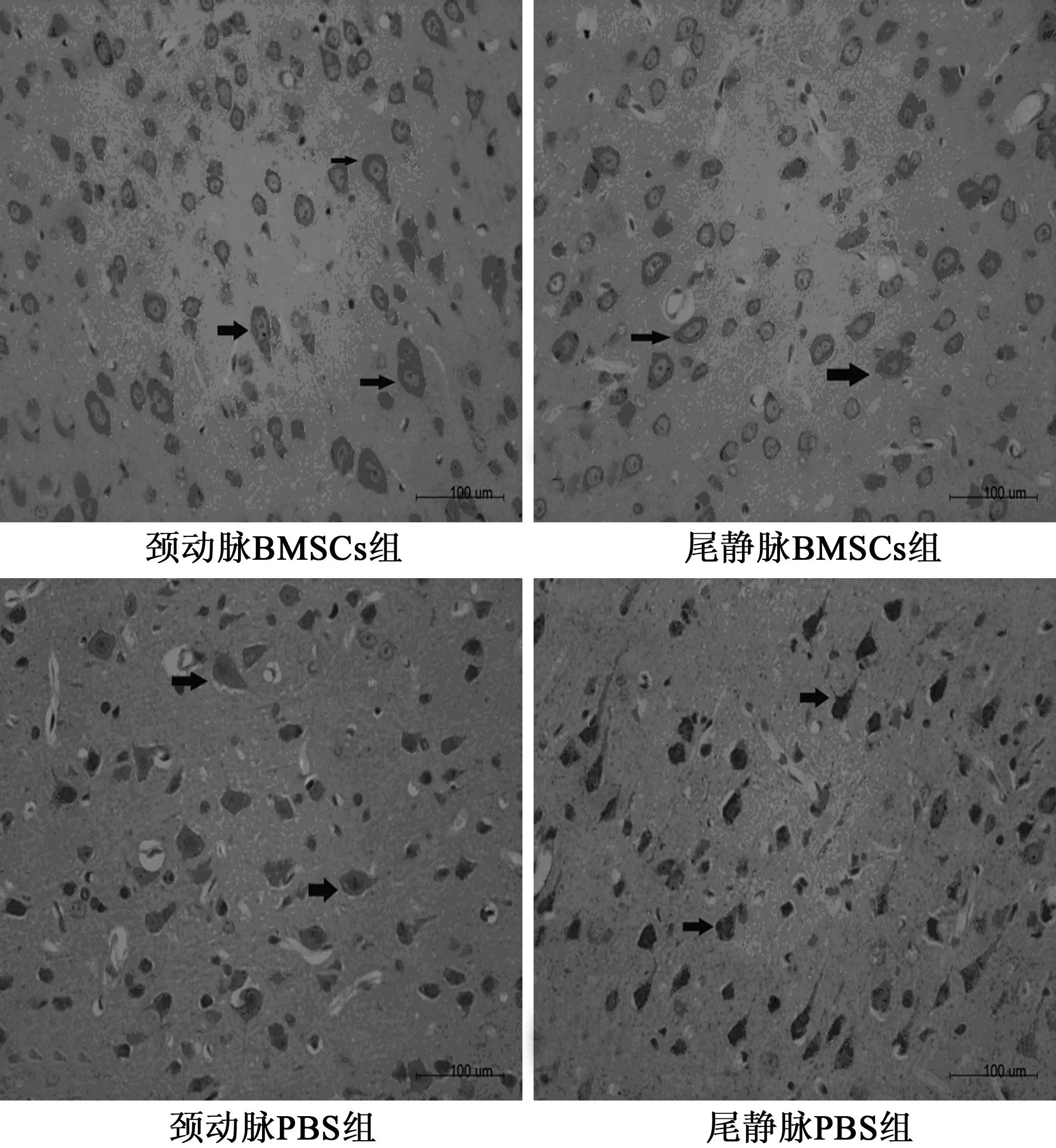
图3 Bax表达情况(×400)
2.4dUTP缺口末端标记测定法(TUNEL)检测结果比较图4可见,颈动脉BMSCs组TUNEL阳性细胞数(60.75±16.27)显著低于颈动脉PBS组(77.5±10.6),尾静脉BMSCs组TUNEL阳性细胞数(58.71±7.16)显著低于尾静脉PBS组(76.67±15.65),颈动脉BMSCs组和尾静脉BMSCs组TUNEL阳性细胞数无统计学差异。
2.5血清肿瘤坏死因子(TNF)-α颈动脉BMSCs组血清TNF-α浓度值〔(31.8±14.72)pg/ml〕显著低于颈动脉PBS组〔(55.31±8.35)pg/ml〕,尾静脉BMSCs组TNF-α浓度值〔(35.36±9.57)pg/ml〕显著低于尾静脉PBS组〔(49.02±9.67)pg/ml〕,颈动脉BMSCs组和尾静脉BMSCs组血清TNF-α浓度值无统计学差异,颈动脉PBS组较尾静脉PBS组血清TNF-α浓度值有增高趋势,但无统计学差异。

图4 TUNEL表达情况(×400)
3讨论
脑梗死是因缺血缺氧导致的缺血级联反应,以梗死中心细胞不可逆坏死和缺血半暗带受损细胞凋亡为特征。缺血再灌注后高水平的兴奋性毒性物质、钙超载、自由基和外周循环炎症细胞的激活、浸润导致二次损伤,加速缺血半暗带处细胞凋亡,促使梗死区的进一步扩大。本课题组前期实验证实缺血再灌注后持续高水平的炎症介质和缺血半暗带处的细胞凋亡密切相关,并加剧神经功能缺损〔2〕。可见,修复缺血半暗带是改善脑梗死预后的重点。
缺血再灌注后,TNF-α主要由活化的小胶质细胞和单核/巨噬细胞分泌〔3〕。作为极其重要的促炎因子,TNF-α可通过多重机制参与脑梗死后炎症的损伤和修复。TNF-α可破坏血脑屏障,诱导血管内皮细胞上调表达黏附分子,易化外周循环炎症细胞渗透浸润病灶〔4〕,加剧损害。Arango-Dvila等〔5〕发现减少TNF-α含量可有效减少梗死体积。但实验亦发现TNF-α具有神经保护作用。Merrill等〔6〕指出TNF-α可刺激星型胶质细胞增生以促进梗死病灶修复。另有文献报道脑梗死后小胶质细胞源性TNF-α通过TNF-p55R这一受体介导神经保护作用,但巨噬细胞源性TNF-α和其他TNF受体并无该作用〔7〕。TNF来源以及TNF受体的差异可能导致了TNF同时具有神经保护和神经损害作用。研究发现体外将BMSCs和活化的巨噬细胞共培养,BMSCs可通过旁分泌具有炎症调节作用的转化生长因子(TGF)-1和前列腺素E2等各种因子显著减少巨噬细胞源性TNF分泌量〔8〕。本实验发现移植BMSCs后TNF-α量显著减少,这可能主要降低了巨噬细胞源性TNF-α,改变了不同来源TNF-α的含量比,从而改善神经功能。而颈动脉PBS组TNF-α浓度增高趋势可能和移植造成的血管损伤及手术创伤有关。
脑梗死后活化的星型胶质细胞高表达巢蛋白、波形蛋白和胶质纤维蛋白,出现特殊的形态和功能改变〔9〕。其可调节K+浓度和酸碱平衡、摄取超量的谷氨酸、对抗谷氨酸的神经毒性〔10〕,改善病灶局部微环境,有利于病灶修复;其还可旁分泌脑源性神经生长因子(BDNF)、神经生长因子(NGF)、VEGF等多种营养和生长因子〔11〕,可营养支持受损细胞,促进神经发生和血管再生。本实验发现移植BMSCs后活化的星型胶质细胞增多,但其具体机制有待进一步探讨。研究表明移植BMSCs后可促进活化的星型胶质细胞分泌胶质细胞源性神经生长因子(GDNF)〔12〕,强化星型胶质细胞的营养支持作用。但星型胶质细胞也可成为损害因素。过量活化的星形胶质细胞亦可释放促炎因子,形成胶质瘢痕,抑制轴突生长。实验发现BMSCs和星型胶质细胞在内毒素环境下共培养可减少TNF-α的分泌〔13〕,还诱导星型胶质细胞增殖周期停止,避免形成过多的胶质瘢痕〔14〕。BMSCs可减少星型胶质细胞对脑梗死的不利影响,增强其对病灶的支持修复功能。
众多学者通过各种途径移植BMSCs治疗脑梗死,虽然都有效改善神经功能缺损症状。但具体机制存在争议。最初认为其关键机制是BMSCs分化为神经细胞以替代缺损的细胞。但实验发现移植后仅少数BMSCs表达神经细胞表面标志物,且尚不能证明其具有相应的功能〔15〕。Heo等〔16〕将BMSCs诱导为神经元样细胞通过立体定向途径移植,却未发现BMSCs分化为神经细胞,但能强烈抑制炎症以促进神经功能恢复。为此,BMSCs可能通过其他机制发挥疗效。本实验也发现移植BMSCs后可减少细胞凋亡,并改善神经功能缺损症状。进一步研究发现移植BMSCs后Bcl-2表达上调。Bcl-2可稳定线粒体外膜,调节钙超载,抑制促凋亡蛋白Bax,遏制凋亡的进展。抗凋亡作用可能是BMSCs的治疗机制之一。文献证实BMSCs可下调Bax的表达〔17〕,但本研究发现BMSCs组和PBS组相比,Bax表达虽有减少趋势,但并无差异,这可能和观察样本数量较少和观察时间稍短相关。
除了BMSCs治疗脑梗死具体机制尚不明了外,最佳移植途径也尚无结论。目前最常用的移植途径主要有立体定向、动脉和静脉途径。立体定向途径虽然可最大程度向病灶提供BMSCs,减少干细胞的流失,但其操作复杂、损伤较大、可有颅内压增高、移植部位水肿压迫等并发症和副作用,较难开展。而动静脉途径可操作性强、创伤较小,临床易于开展和接受。
颈动脉途径的最大优点在于避开外周器官的首过消除作用,进入病灶的细胞数量较尾静脉途径多〔18〕;但其缺点在于移植的细胞易形成细胞栓子,梗阻相应供血区域微小血管,这一潜在风险制约了移植细胞剂量的增多。尾静脉途径的优点在于创伤微小,可移植细胞剂量较大;其最大缺点在于外周器官滞留了大量细胞,进入病灶细胞稀少〔19〕。基于上述优劣比较,Yang等〔20〕发现颈动脉途径疗效优于尾静脉途径。但本实验研究发现颈动脉途径和尾静脉途径移植BMSCs治疗脑梗死疗效并无差异。原因可能是:(1)动静脉途径造成干细胞在病灶内数量的差异并不足以造成疗效的差异;(2)静脉途径移植的干细胞可在血脑屏障破坏和趋化因子的作用下持续迁徙至病灶处并发挥疗效,以弥补首过消除的影响;(3)干细胞可以在外周通过旁分泌抗炎介质和营养因子发挥疗效〔20〕,并不需要进入微环境恶劣的病灶。
综上所述,BMSCs可通过减少缺血半暗带细胞凋亡改善神经功能缺损症状。在缺血再灌注后6 h经颈动脉和尾静脉途径移植BMSCs疗效无差异。但尾静脉途径创伤微小,可移植细胞量多,为脑梗死早期最佳移植途径。
参考文献4
1Wu J,Sun Z,Sun HS,etal.Intravenously administered bone marrow cells migrate to damaged brain tissue and improve neural function in ischemic rats〔J〕.Cell Transplant,2007;16(10):993-1005.
2Wu L,Zhang K,Hu G,etal.Inflammatory response and neuronal necrosis in rats with cerebral ischemia〔J〕.Neural Regen Res,2014;9(19):1753-62.
3Gregersen R,Lambertsen K,Finsen B.Microglia and macrophages are the major source of tumor necrosis factor in permanent middle cerebral artery occlusion in mice〔J〕.J Cereb Blood Flow Metab,2000;20(1):53-65.
4Sharief M,Noori M,Ciardi M,etal.Increased levels of circulating ICAM-1 in serum and cerebrospinal fluid of patients with active multiple sclerosis.Correlation with TNF-α and blood-brain barrier damage〔J〕.J Neuroimmunol,1993;43(1-2):15-21.
5Arango-Dávila CA,Vera A,Londoo AC,etal.Soluble or soluble/membrane TNF-α inhibitors protect the brain from focal ischemic injury in rats〔J〕.Int J Neurosci,2014;2014:1-9.
6Merrill J.Effects of interleukin-1 and tumor necrosis factor-α on astrocytes,microglia,oligodendrocytes,and glial precursors in vitro〔J〕.Dev Neurosci,1991;13(3):130-7.
7Lambertsen KL,Clausen BH,Babcock AA,etal.Microglia protect neurons against ischemia by synthesis of tumor necrosis factor〔J〕.J Neurosci,2009;29(5):1319-30.
8Zimmermann JA,McDevitt TC.Pre-conditioning mesenchymal stromal cell spheroids for immunomodulatory paracrine factor secretion〔J〕.Cytotherapy,2014;16(3):331-45.
9Buffo A,Rite I,Tripathi P,etal.Origin and progeny of reactive gliosis:A source of multipotent cells in the injured brain〔J〕.Proc Nat Acad Sci USA,2008;105(9):3581-6.
10Miao Y,Qiu Y,Lin Y,etal.Protection by pyruvate against glutamate neurotoxicity is mediated by astrocytes through a glutathione-dependent mechanism〔J〕.Mol Biol Rep,2011;38(5):3235-42.
11Schwartz JP,Nishiyama N.Neurotrophic factor gene expression in astrocytes during development and following injury〔J〕.Brain Res Bull,1994;35(5-6):403-7.
12Shen LH,Li Y,Chopp M.Astrocytic endogenous glial cell derived neurotrophic factor production is enhanced by bone marrow stromal cell transplantation in the ischemic boundary zone after stroke in adult rats〔J〕.Glia,2010;58(4):1074-81.
13Schafer S,Calas AG,Vergouts M,etal.Immunomodulatory influence of bone marrow-derived mesenchymal stem cells on neuroinflammation in astrocyte cultures〔J〕.J Neuroimmunol,2012;249(1-2):40-8.
14Cai K,Xu J,Zhang Y.Bone marrow stromal cells induce cell cycle arrest in reactive astrocytes in vitro〔J〕.Neurosci Lett,2012;522(1):62-6.
15Yasuhara T,Matsukawa N,Hara K,etal.Notch-induced rat and human bone marrow stromal cell grafts reduce ischemic cell loss and ameliorate behavioral deficits in chronic stroke animals〔J〕.Stem Cells Dev,2009;18(10):1501-14.
16Heo JS,Choi SM,Kim HO,etal.Neural transdifferentiation of human bone marrow mesenchymal stem cells on hydrophobic polymer-modified surface and therapeutic effects in an animal model of ischemic stroke〔J〕.Neuroscience,2013;238(3):305-18.
17Li Z,Pang L,Fang F,etal.Resveratrol attenuates brain damage in a rat model of focal cerebral ischemia via up-regulation of hippocampal Bcl-2〔J〕.Brain Res,2012;1450(2):116-24.
18Ruan GP,Han YB,Wang TH,etal.Comparative study among three different methods of bone marrow mesenchymal stem cell transplantation following cerebral infarction in rats〔J〕.Neurol Res,2013;35(2):212-20.
19Steiner B,Roch M,Holtkamp N,etal.Systemically administered human bone marrow-derived mesenchymal stem home into peripheral organs but do not induce neuroprotective effects in the MCAO-mouse model for cerebral ischemia〔J〕.Neurosci Lett,2012;513(1):25-30.
20Yang M,Wei X,Li J,etal.Changes in host blood factors and brain glia accompanying the functional recovery after systemic administration of bone marrow stem cells in ischemic stroke rats〔J〕.Cell Transplant,2010;19(9):1073-84.
〔2015-03-17修回〕
(编辑袁左鸣)
·基础研究·
Comparison of intravenous and intracarotid route for bone marrow derived mesenchymal stem cells in the treatment of acute ischemia reperfusion in rat model
QU Xin-Hui,WANG Wan-Song,WU Ling-Feng,etal.
Jiangxi Province People's Hospital,Nanchang 330006,Jiangxi,China
【Abstract】ObjectiveTo investigate the difference between intravenous and intracarotidroute for bone marrow derived mesenchymal stem cells at the treatment of MCAO 6 hours.MethodsTwenty seven female Sprague-Dawley rat models of MCAO were divided randomly into intracarotid BMSCs group(n=8),intravenous BMSCs group(n=7),intracarotid PBS group(n=6)and intravenous PBS group(n=6).BMSCs were isolated and cultured by whole bone marrow adherent culture and identified by flow cytometry.Transplantion was operated at MCAO 6 hours,7 days after transplantation,the neurological function and physical recovery were evaluated the modified neurological severity score(mNSS),GFAP,Bcl-2 and Bax levels were detected by immunohistochemistry,cell apoptosis was detected by TUNEL staining and TNF-α was detected by ELISA.ResultsThe expression of surface antigen CD90,CD29,CD106,CD11b,CD34,CD45 were respectively 95.7%,97.3%,52.7%,6.01%,2.95%,2.26%.Compared with those of PBS groups,the number of GFAP positive cells and Bcl-2 positive cells were significantly increased,the scores of mNSS and the number of TUNEL positive cells and the concentration of serum TNF-α were significantly decreased in BMSCs groups.The number of Bax positive cells was not significantly different among all groups.The difference between intracarotid and intravenous BMSCs group was not showed.ConclusionsThere is no difference between intravenous and intra-arterial route for bone marrow derived mesenchymal stem cells at the treatment of MCAO 6 hours,the intravenous route is optimal for tiny invasion and high dose of cells.
【Key words】BMSCs;Ischemia-reperfusion cerebral infarction;Transplantation apoptosis
通讯作者:吴晓牧(1958-),男,博士,博士生导师,主任医师,主要从事神经免疫和干细胞研究。
基金项目:国家自然科学基金资助课题(No.811160248);江西省自然科学基金资助课题(No.20114BAB205061)
中图分类号〔〕R74.3〔
文献标识码〕A〔
文章编号〕1005-9202(2015)24-6965-05;doi:10.3969/j.issn.1005-9202.2015.24.001
