真核细胞翻译延伸因子2参与神经生长因子诱导的大鼠嗜铬细胞瘤细胞的分化
2016-01-28李荣双范淑玲李立平
李荣双 范淑玲 李立平
(内蒙古阿荣旗中蒙医院,内蒙古 阿荣旗 162750)
真核细胞翻译延伸因子2参与神经生长因子诱导的大鼠嗜铬细胞瘤细胞的分化
李荣双范淑玲1李立平2
(内蒙古阿荣旗中蒙医院,内蒙古阿荣旗162750)
摘要〔〕目的研究神经生长因子(NGF)诱导大鼠嗜铬细胞瘤细胞系PC12细胞分化途径中,细胞突触生长的起始和延伸步骤中的关键蛋白质,寻找其中可能的药物靶点。方法50 ng/ml NGF诱导PC12细胞6 h和12 h,显微镜下观察PC12细胞的形态变化;应用二维凝胶电泳、DeCyder软件分析及基质辅助激光解析/电离-飞行时间质谱,研究其差异蛋白质组学变化。结果NGF作用于PC12细胞6 h后,细胞出现神经突起;12 h,神经突起进一步生长,蛋白质分析提示真核细胞翻译延伸因子(eEF)2含量减少,α微管蛋白和β肌动蛋白表达增加。结论NGF诱导PC12细胞发生神经突触生长,eEF-2的减少与细胞骨架蛋白增加与细胞的形态学变化一致,提示突触生长过程中,eEF-2可能起到关键性作用。
关键词〔〕大鼠嗜铬细胞瘤细胞系细胞;神经生长因子;神经分化
1北京沙河95820部队卫生队2北京沙河95906部队航医室
第一作者:李荣双(1972-),女,副主任医师,主要从事心血管疾病研究。
神经生长因子(NGF)是最早被发现和纯化的多肽生长因子,是神经营养因子(NT)家族的典型代表。NGF可促进神经元的生长及增进其分化〔1〕,并且能够引导神经生长锥的移动,决定神经轴突延伸方向〔2〕。因此,NGF具有巨大的治疗神经损伤疾病的潜力〔3〕。深入了解NGF对神经细胞作用的机制,发现其信号转导通路中的成员,可以为NGF的临床应用提供思路和方向〔4〕。本研究应用NGF对PC12细胞分化进行诱导,进行蛋白质组学研究,以探索神经细胞形态学变化的分子生物学机制。
1材料与方法
1.1试剂与仪器PC12细胞购买自中国科学院的上海细胞库,DMEM购买自Gibco公司,神经生长因子购买自厦门北大之路生物工程有限公司。CyDye荧光标记物(包括Cy2、Cy3及Cy5)、二甲基甲酰胺、甘油、十二烷基磺酸钠、甘氨酸、琼脂糖、蛋白酶抑制剂和蛋白质组学耗材购买自GE Healthcare-Biosciences公司。
1.2NGF诱导PC12细胞分化PC12细胞培养于DMEM培养基中,培养温度为37℃,CO2浓度为5%。细胞接种密度为2×105/ml,培养1 d。细胞贴壁之后,加入终浓度50 ng/ml的NGF,对照组中加入培养液,6 h和12 h后进行吖啶橙(AO)和溴化乙啶(EB)(100 μg/mL)染色,观察细胞形态变化。
1.3蛋白质组学分析留取4组不同代数的细胞,按上述方法处理后,获得对照组及实验组细胞。4℃下,500 r/min离心5 min后,进行细胞裂解。室温下,25 000 r/min再次离心30 min,吸取上清。蛋白质定量试剂盒测定蛋白浓度,每个样品取50 μg蛋白,按实验操作规范,避光冰浴标记相应样品30 min。标记好的蛋白质样品进行混合后,上样至胶槽中,放置固相pH梯度干胶条,置于Ettan IPGphor Ⅱ电泳仪上,经过水化与等电聚焦,胶条转移至SDS-PAGE胶上端,进行常规电泳。激光扫描仪扫描后,专用软件进行分析,找到差异蛋白质点。
1.4鉴定差异蛋白质取实验组和对照组蛋白质,制作制备胶,考染。切胶仪切取相应的差异蛋白质点,37℃下20 ng/μl胰蛋白酶作用2 h。点样后,测定肽质量指纹谱数据,NCBI蛋白质数据库检索。
2结果
2.1NGF诱导PC12细胞分化配制好的50 ng/ml NGF加入PC12细胞中,作用6 h,经AO和EB的双重染色,镜下观察发现:未分化PC12细胞为散在生长或者聚团生长的圆形(图1A);NGF加入后,PC12细胞发生了形态学改变,胞体开始出现突起(图1B);随着NGF作用时间延长,细胞的突起进一步延长,开始的向神经细胞分化,部分突起连接成网络(图1C)。
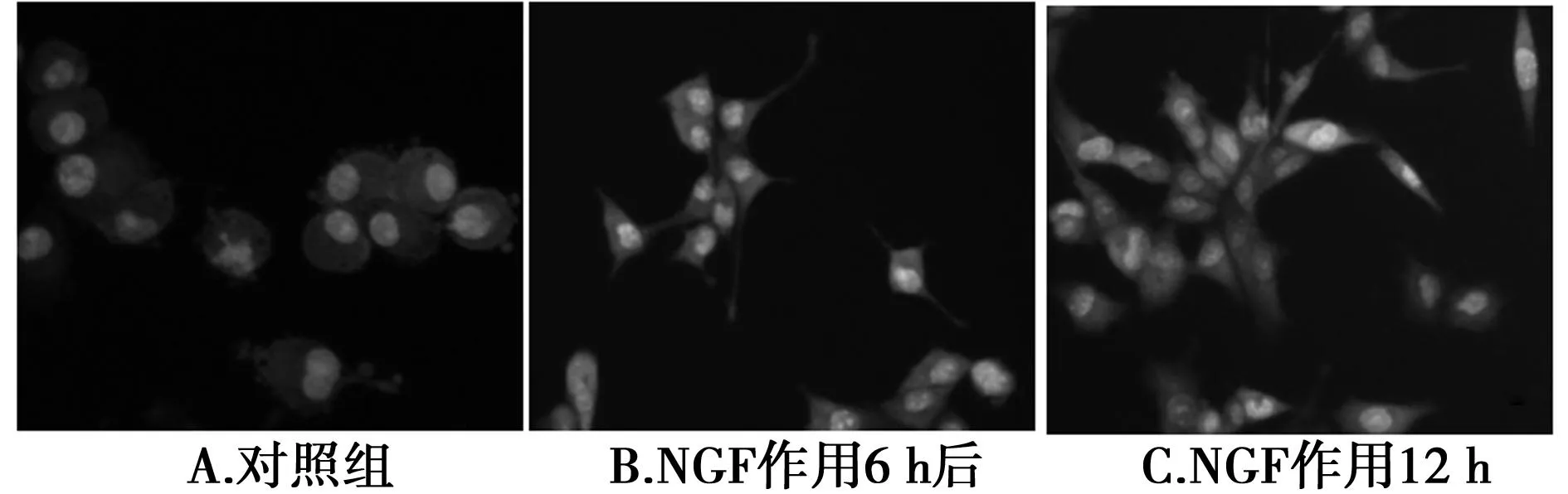
图1 NGF处理后PC12细胞的形态改变(×200)
2.2NGF诱导的PC12细胞分化后的蛋白质组学研究PC12细胞经过NGF作用后,经细胞蛋白提取,应用电泳进行分离,二维电泳胶图见图2;DeCyder软件分析PC12细胞的蛋白质组变化;基质辅助激光解析/电离-飞行时间质谱仪成功鉴定了3个差异表达蛋白:真核细胞翻译延伸因子(eEF)-2、α微管蛋白和β肌动蛋白。NGF作用后,前者的表达量减少,作用后6 h和12 h分别为对照组的82%(P<0.01)和71%(P<0.01),其中α微管蛋白增加至对照组的129%(P<0.01)和131%,而β肌动蛋白增加至对照组的125%(P<0.01)和140%。图3为α-微管蛋白的肽质量指纹图谱,横轴为质核比(m/z),y轴为相对丰度。
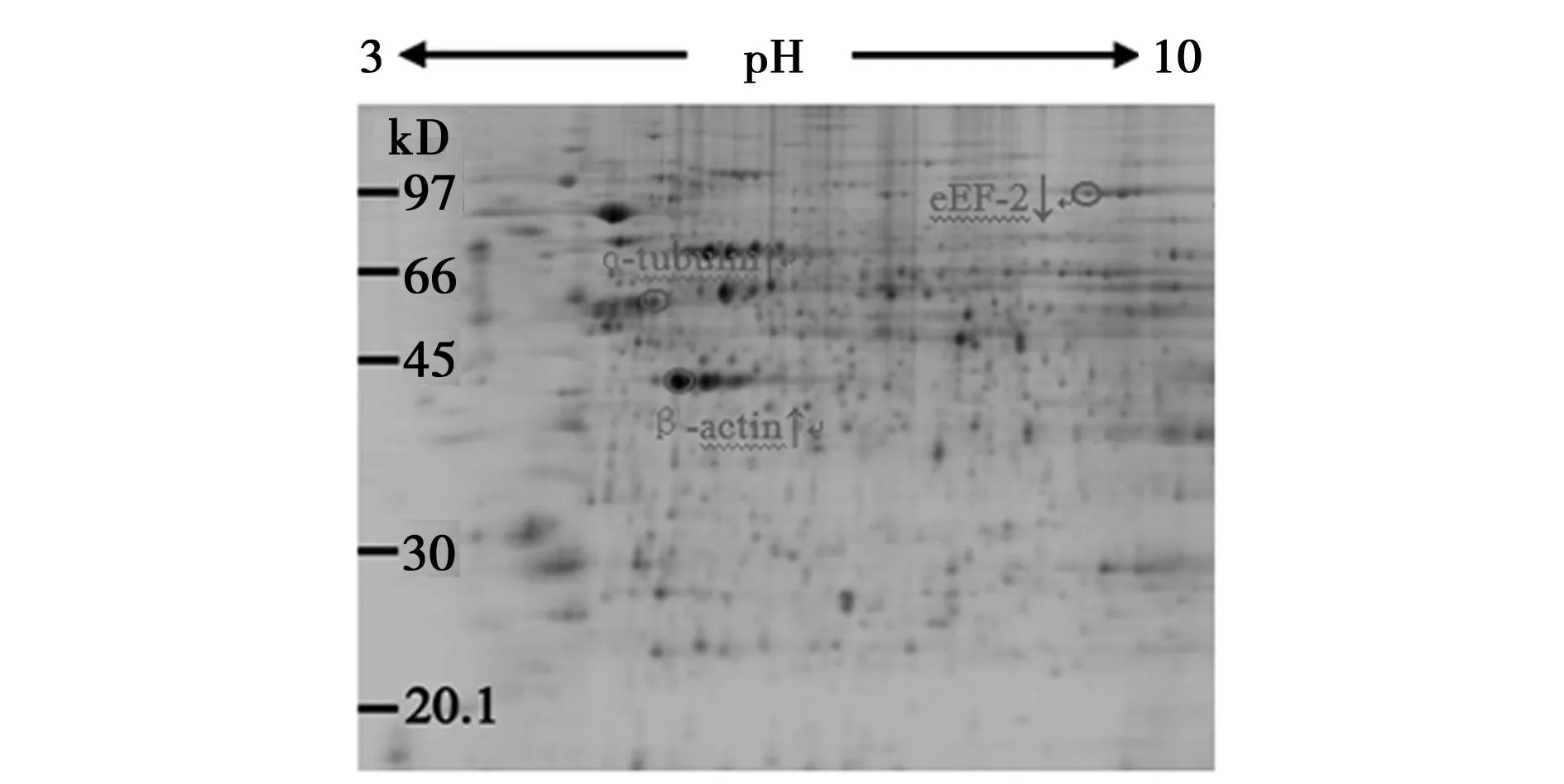
图2 质谱鉴定的PC12细胞分化后的差异表达蛋白
3讨论
2000年,人类基因组序列测定的完成,标志着后基因组时代的到来。但从基因到蛋白质存在着转录、翻译及翻译后修饰等多个水平的调控机制,基因产物是否及何时被破译、基因产物的表达量、蛋白的相互作用等多种信息都无法从基因水平进行判断。因此,要精确阐明生命的生理及病理机制,只有将功能基因组学与蛋白质组学相结合〔5〕。蛋白质组学采用蛋白质分离手段结合蛋白质的鉴定技术,全景式地研究在某一特定环境下细胞或组织的全部蛋白质。它能够高通量、高分辨率地研究蛋白质,能够为探讨疾病的发病机制、新药开发提供理论基础〔6,7〕。
NGF是到目前为止最有潜力应用于神经系统损伤性疾病治疗的药物之一,探究其对神经细胞的作用机制,有助于对该药物的临床应用进行指导,寻找药物治疗的靶点。本研究将NGF应用于PC12细胞,诱导细胞突触生长,进行差异蛋白质组学研究,鉴别3种差异表达蛋白质,分别为表达减少的eEF-2、表达增加的α微管蛋白和β肌动蛋白。
eEF-2是一种延伸因子,在蛋白质合成中占据重要的位置,通过催化核糖体沿mRNA迁移而推动和控制蛋白质合成〔8〕,eEF-2激酶催化完成此过程。NGF作用于PC12细胞后,eEF-2激酶的活性被很快降低〔9〕。有报道证实,胃肿瘤细胞敲除eEF2后,细胞停滞于G2/M期〔10〕。本实验检测到NGF作用6 h后,PC12细胞的eEF-2表达明显减少,而作用12 h后,该蛋白表达进一步减少。其原因是,NGF处理前,PC12细胞处于增殖状态,而NGF处理后,PC12细胞开始了分化途径,蛋白质的组成和数量发生改变,在此过程中eEF-2可能发挥着细胞蛋白质合成的重要作用,与细胞出现神经突起的形态学变化一致。
微管(MT)、微丝(MF)和中间丝(IF)组成了神经元的细胞骨架。α和β微管蛋白两个亚单位构成了微管,细胞内的囊泡、细胞器和蛋白质的交通运输依赖微管。肌动蛋白是微丝的基本构成单位,而中间丝则是由多种不同来源的纤维状蛋白组成。上述多个蛋白聚合所构成的彼此连接的网络,共同参与维持神经元的形态和功能〔11〕。NGF作用于PC12细胞之后,细胞形态发生明显变化,细胞突起明显增多延伸,向神经细胞的方向发展。伴随此形态变化,细胞的蛋白质构成发生了变化,除eEF-2表达减少外,细胞骨架蛋白中的α微管蛋白和β肌动蛋白明显增加,与细胞的形态学变化一致,进一步证实了NGF的诱导PC12细胞分化的作用。
参考文献4
1Boyce VS,Mendell LM.Neurotrophins and spinal circuit function〔J〕.Front Neural Circuits,2014;8:59.
2Muller WA.发育生物学〔M〕.黄秀英,劳为德,郑瑞珍,译.北京:高等教育出版社,方普林格出版社,1998:184-94.
3Zhang H,Wu F,Kong X,etal.Nerve growth factor improves functional recovery by inhibiting endoplasmic reticulum stress-induced neuronal apoptosis in rats with spinal cord injury〔J〕.J Transl Med,2014;12:130.
4Terda K,Kojima Y,Watanabe T,etal.Inhibition of nerve growth factor- induced neurite outgrowth from PC12 cells by dexamethasone:signaling pathways through the gulcocorticoid receptor and phosphorylated Akt and ERK1/2 〔J〕.PLoS One,2014;9:e93223.
5Wu X,Hasan MA,Chen JY.Pathway and network analysis in proteomics〔J〕.J Theor Biol,2014;362:44-52.
6Beretov J,Wasomg ER VC,Graham PH,etal.Proteomics for breast cancer urine biomarkers〔J〕.Adv Clin Chem,2014;63:123-67.
7Pelaia G,Terracciano R,Vatrella A,etal.Application of proteomics and peptidomics to COPD〔J〕.Biomed Res Int,2014;2014:764581.
8Heise C,Gardoni F,Culotta L.Elongation factor-2 phosphorylation in dendrites and the regulation of dendritic mRNA translation in neurons〔J〕.Front Cell Neurosci,2014;8(1):35.
9Nairn AC,Nichols RA,Brady MJ,etal.Nerve growth factor treatment or cAMP elevation reduces Ca2+/calmodulin-dependent protein kinase Ⅲ activity in PC12 cells〔J〕.J Biol Chem,1987;262:14265-72.
10Nakamura J,Aoyagi S,Nanchi I,etal.Overexpression of eukaryotic elongation factor eEF2 in gastrointestinal cancers and its involvement in G2/M progression in the cell cycle〔J〕.Int J Oncol,2009;34:1181-9.
11Lariviere RC,Julien JP.Functions of intermediate filaments in neuronal development and disease〔J〕.J Neurobiol,2004;58:131-148.
〔2014-10-29修回〕
(编辑曲莉)
中图分类号〔〕Q503〔
文献标识码〕A〔
文章编号〕1005-9202(2015)23-6720-02;doi:10.3969/j.issn.1005-9202.2015.23.033
