氨丙基硅三烷改性介孔二氧化硅及对痕量镉(Ⅱ)的分离富集性能研究
2016-01-27王延梅袁海宽
王延梅,袁海宽
(1.潍坊科技学院 化工与环境学院,山东 潍坊 262700;2.浙江工业大学 化学工程学院,浙江 杭州 310014)
氨丙基硅三烷改性介孔二氧化硅及对痕量镉(Ⅱ)的分离富集性能研究
王延梅1*,袁海宽2
(1.潍坊科技学院化工与环境学院,山东潍坊262700;2.浙江工业大学化学工程学院,浙江杭州310014)
摘要:以氨丙基硅三烷作为改性剂,对介孔二氧化硅表面进行修饰,制备了氨基化介孔二氧化硅吸附材料,采用透射电镜和傅立叶红外光谱仪对其进行表征,并用于水样中痕量镉的富集,建立了氨基化介孔二氧化硅分离预富集/火焰原子吸收光谱法测定痕量镉的方法。考察了溶液pH值、样品流速、洗脱剂类型、干扰离子和吸附容量等对痕量镉分离富集的影响,以及该吸附材料对痕量镉(Ⅱ)的吸附性能。结果表明,溶液pH 7.0,样品流速8 mL/min时镉离子能被制备材料高效吸附,吸附的镉(Ⅱ)用5.0 mL 2 mol/L HNO3完全洗脱,火焰原子吸收法测定。在最佳实验条件下,方法的线性范围为0.6~20 ng/mL,定量下限为0.5 ng/mL,富集倍数为50倍,对10 ng/mL Cd2+测定的相对标准偏差(n=11)为0.92%,加标回收率为98.8%~104.5%。该方法的抗干扰能力较好,富集柱可循环使用12次以上,可用于环境水样中镉(Ⅱ)的测定。
关键词:氨基化介孔二氧化硅;分离富集;火焰原子吸收;镉
镉可随着食物链传递和富集[1],对人体健康危害明显,其在我国环境中的污染日益严重。由于环境水样中镉离子的含量较低,且受环境中其他因素的干扰和仪器检出限的限制,进行检测时通常需要预先分离富集[2-3]。
介孔二氧化硅纳米颗粒(MSN)由于具有均一的多孔性,大的比表面积,良好的生物相容性和热稳定性,稳定的物理和化学性质,以及内外表面易修饰等优点[4-5],已成为纳米科学与技术领域的研究热点[6-9]。尽管介孔二氧化硅的负载量较高,但介孔材料的吸附动力学较慢且选择性较差[10],为了提高吸附能力,通常利用具有功能基团的化合物对其进行修饰[11-13],如以3-氨丙基三乙氧基硅烷[14]改性MSN的内表面,可以提供与金属离子形成配合物的官能团,但是这种改性方法需要较长的反应时间和较高的温度。而本文以合成的氨丙基硅三烷(APS)作为改性剂,对MSN内外表面进行修饰,制备了氨基化介孔二氧化硅(MSN-NH2),相较于传统的改性方法,该方法在水溶液中进行,无需使用有机溶剂,也无需加热,缩短了反应时间,具有反应速度快、操作简便、无污染等优点。以MSN-NH2作为重金属离子镉(Ⅱ)的吸附材料,具有很好的稳定性和抗干扰能力,可实现对水样中镉(Ⅱ)的分离富集与测定。
1实验部分
1.1仪器与试剂
TAS-990原子吸收分光光度计(北京普析通用仪器有限责任公司);镉空心阴极灯(北京有色金属研究总院);78HW-3恒温磁力搅拌器(杭州仪表电机有限公司);PHS-3D型酸度计(上海雷磁仪器厂);SHA-C型超级恒温振荡器(常州国华电器有限公司);SHB-Ⅲ台式循环水式真空泵(郑州长城科工贸有限公司);MOLATOM1810D纯水仪(上海摩勒科学仪器有限公司);DG-204型恒温干燥箱(天津天宇实验仪器有限公司);JEM-3010型高分辨透射电子显微镜(日本电子光学研究所);FT-IR傅立叶变换红外光谱仪(美国PE公司);Adventurer电子天平(OHAUS 美国)。所用玻璃仪器使用前均用20%的HNO3浸泡过夜,反复冲洗干净后,70 ℃烘干备用。
正硅酸乙酯(TEOS,广东汕头市西陇化工厂),十六烷基三甲基溴化铵(CTAB,北京鼎国试剂公司),三乙醇胺(湖北金山化工有限公司),3-氨基丙基三乙氧基硅烷(APTES,Alfa Aesar 公司),缓冲溶液(pH 7.0):0.1 mol/L 磷酸二氢钠溶液用0.2 mol/L氢氧化钠调至pH 7.0,以上试剂均为分析纯,实验用水为超纯水(≥18.2 MΩ·cm)。Cd标准液(1.000 0 g/L):称取1.000 0±0.000 1 g高纯金属镉于250 mL锥形瓶中,加入30 mL HNO3使之溶解,滴加双氧水至溶液呈无色,以除去NO2,冷却后转移至1 L容量瓶中,加水稀释至刻度,摇匀备用。测定时用水稀释至所需浓度。
1.2实验方法
1.2.1MSN的制备取240 mL水置于500 mL圆底烧瓶中,加入0.05 g CTAB 和4 mL 2.00 mol/L NaOH溶液后充分搅拌使其溶解,恒温80 ℃。随后逐滴加入5.00 mL TEOS,磁力搅拌2 h至有白色沉淀产生,分离固体粗产物,洗涤后真空干燥得到MSN。称取1.0 g MSN颗粒加至2 mL 37.2% HCl和200 mL甲醇混合溶液中,加热回流8 h以除去CTAB,过滤产物并充分洗涤,置于60 ℃真空条件下,除去残留的溶剂。

图1 APS的合成原理Fig.1 The principle about synthesis of APS
1.2.2APS的制备量取 4.4 mL 3-氨基丙基三乙氧基硅烷、1.57 mL 三乙醇胺、14.2 mL甲醇、1 mL丁醇、50 mL甲苯混合,60 ℃冷凝回流3 h,将产物减压蒸馏得到白色APS晶体,备用,其合成原理如图1所示。
1.2.3MSN的改性取 0.50 g MSN均匀分散在40 mL含0.1 g APS的水中,室温下反应30 min,离心,用水洗涤3次以除去未反应的APS,得到MSN-NH2,反应机理如图2所示。

图2 MSN氨基化修饰机理Fig.2 Schematic representaion of the MSN modification process
1.2.4分离柱的制备用钝化后的玻璃棉填充胶头滴管(直径0.5 cm,长约8 cm)下端,称取0.2 g MSN-NH2装入柱内,然后在MSN-NH2上部再填充钝化后的玻璃棉。用水将分离柱冲洗至中性,用pH值7.0的缓冲溶液平衡酸碱度。
1.2.5实验方法实验前,先用10 mL 2 mol/L HNO3溶液清洗分离柱,水洗至流出液呈中性,再用缓冲溶液冲洗至分离柱pH值为7.0。取含镉(Ⅱ)的待测溶液(C0),调节溶液至pH 7.0后加入8 mL缓冲溶液,以8 mL/min的流速,用流动注射仪向分离柱注入待测溶液,4 mL缓冲溶液清洗管道后,用5 mL 2 mol/L HNO3溶液以2 mL/min流速洗脱吸附的镉(Ⅱ),FAAS法测定洗脱液中的镉含量(C)。按以下公式求算回收率(R)。
R=C/(50×C0)×100%

图3 MSN(A)及MSN-NH2(B)的TEM图(标尺50 nm)Fig.3 TEM diagrams of MSN(A) and MSN-NH2(B)(scale bar 50 nm)

图4 改性前后吸附材料的红外光谱图Fig.4 Infrared spectra of the adsorbent
2结果与讨论
2.1MSN-NH2的表征
对合成的MSN-NH2进行扫描电镜(图3)和红外光谱(图4)测定。由MSN(图3A)和MSN-NH2(图3B)的电镜扫描图可知,改性前MSN的孔道清晰,孔径约为2.1 nm,而改性后的MSM-NH2孔径较模糊,说明孔道变窄,孔径约为1.5 nm。改性后的MSN-NH2孔径变小,使得体积大的分子不能被孔道吸附,从而提高了吸附的选择性。红外光谱测定前,用水对MSN-NH2充分清洗,70 ℃烘干后KBr压片法测定,由图4可知,MSN和MSN-NH2样品在1 073 cm-1处的吸收峰为Si—O—Si的反对称伸缩振动,3 430 cm-1处的吸收峰为各种Si—OH 的羟基振动峰。改性后在1 511 cm-1处出现的新峰为NH2的剪式振动峰,这表明APS已成功地连接到MSN上。
2.2溶液酸度对吸附效率的影响
溶液的酸度对MSN-NH2的吸附具有非常明显的影响,将10 ng/mL镉(Ⅱ)配制成不同酸性溶液,按实验方法考察不同酸度下MSN-NH2对镉(Ⅱ)的吸附性能。由图5可知,pH 7.0时镉的吸附效率已达到97%以上,具有很好的吸附性能,因此实验选择pH 7.0进行吸附操作。
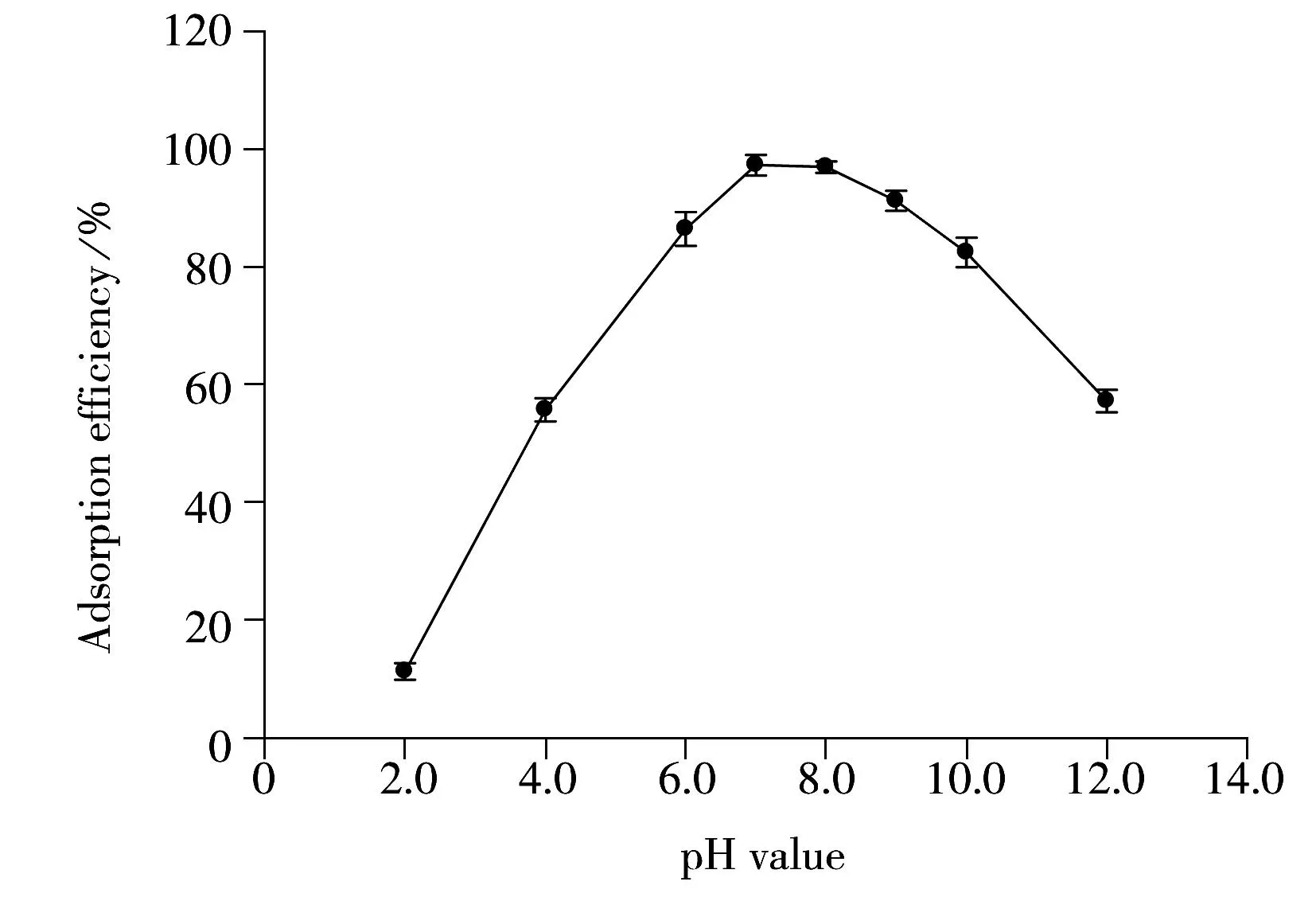
图5 pH值对吸附效率的影响(n=3)Fig.5 Effect of pH value on adsorption efficiency(n=3)

图6 洗脱剂对回收率的影响(n=3)Fig.6 Effect of eluent on recovery(n=3)
2.3样品流速对回收率的影响
样品流速直接影响MSN-NH2与镉(Ⅱ)的接触时间,从而影响回收率。在实验条件下,改变样品的流速,按实验方法进行回收率的测定,结果显示,流速在2 ~8 mL/min范围内,Cd2+的吸附回收率均可达97%以上。为了节省分析时间,实验选择流速为8 mL/min。
2.4洗脱剂对回收率的影响
在实验条件下,考察了不同浓度的HAc(1,2 mol/L)、HCl(1,2,4 mol/L)、HNO3(1,2,4 mol/L)作为洗脱剂时对镉(Ⅱ)回收率的影响(见图6)。结果显示,HNO3的洗脱效果优于HAc和HCl,且HNO3的浓度为2 mol/L和4 mol/L时,镉(Ⅱ)的回收率均达97%以上。为了节省试剂,本实验采用2 mol/L HNO3溶液作为洗脱剂。
洗脱剂用量也会影响待测物的回收率。通常洗脱剂用量越大,回收率越高,但会影响富集效果,浪费药品和实验时间;反之当洗脱剂用量少时,镉(Ⅱ)离子不能充分脱附,回收率低。因此选用适量的洗脱剂显得非常必要。实验考察了2 mol/L HNO3溶液体积在2.0 ~15.0 mL变化时对镉(Ⅱ)离子回收率的影响,结果显示,当洗脱剂体积达到5.0 mL时回收率最高,且继续增加洗脱剂体积时,回收率不再变化,因此实验选用洗脱剂的最佳用量为5.0 mL。
2.5洗脱剂流速对回收率的影响
将5.0 mL 2 mol/L HNO3作为洗脱剂,以不同的流速(0.5~3.5 mL/min)对吸附在微柱中的镉(Ⅱ)离子进行洗脱,根据实验方法测定回收率。当流速为2 mL/min时,回收率达到97%以上,因此实验选用流速为 2 mL/min。
2.6共存离子的影响

2.7分离柱的再生与使用寿命、富集倍数
为了考察MSN-NH2材料的重复使用性,将装有MSN-NH2材料的分离柱解吸,用水、乙醇、水、2 mol/L HNO3、水彻底洗涤后循环使用。结果表明,分离柱在实验条件下使用多次(n=12)后,镉的回收率仍在95% 以上。
将含500 ng镉的溶液稀释至不同体积(50,100,250,500 mL),按实验方法测定回收率的变化。MSN-NH2可从稀溶液中对痕量镉进行富集,其富集倍数达50倍(体积为250 mL)时回收率仍在97%以上。
2.8MSN-NH2对Cd的吸附容量
称取20 mg MSN-NH2装入分离柱,配制含镉(Ⅱ) 1 μg/mL的待测溶液,按实验方法将待测溶液通过分离柱,每隔10 min取样,采用FAAS测定镉(Ⅱ)的浓度,直至流出液中镉(Ⅱ)的浓度不再变化,按下列公式计算吸附容量Q[15]。
式中,Q(mg/g)为吸附容量,v(mL/min)为流速,t(min)为取样时间,i为取样次数,C(μg/mL)为流出液浓度,C0(μg/mL)为初始浓度,m(mg)为MSN-NH2质量。实验计算得出MSN-NH2的动态吸附容量为41.9 mg/g。
2.9分析特性及样品分析
按实验方法对不同浓度的镉(Ⅱ)离子溶液进行测定,其线性范围为0.6~20 ng/mL,线性回归方程为A=0.040 2C(ng/mL)+0.001 2(A为吸光度,C为待测液浓度),相关系数(r)为 0.999 7,定量下限(S/N=10)[16]为0.5 ng/mL。对10 ng/mL的镉(Ⅱ)平行测定11次,相对标准偏差(RSD) 为0.92%。
在250 mL水样中加入1 mol/L HNO3进行酸化并加热煮沸,冷却至室温后,所得水样经0.22 μm滤膜过滤后静置,用氨水调至pH 7.0,加入缓冲溶液,按照实验方法对水样中的痕量镉进行测定,同时进行加标回收实验,测定结果如表1所示。自来水中镉的浓度为2.34 ng/mL,符合国家《生活饮用水卫生标准》,加标回收率为98.8%~104.5%,RSD为1.0%~2.2%;河水中镉的浓度为7.36 ng/mL,高于国家《生活饮用水卫生标准》,加标回收率为99.3%~102.3%,RSD为1.6%~2.0%。

表1 水样中镉的测定及加标回收实验(n=7)
3结论
本研究合成了氨基化介孔二氧化硅吸附材料,并将其用于水样中镉(Ⅱ) 的分离富集,富集倍数可达50倍,方法的定量下限为0.5 ng/mL,回收率为98.8%~104.5%,以该材料制备的富集柱可重复使用12次以上。本方法具有样品处理简单、富集效率高、定量下限低、稳定性好等特点,可为水样中镉(Ⅱ)的检测提供新的方法。
参考文献:
[1]Zhou Q L,Lei Y Q,Guo P R,Pan J C,Wang G H.J.Instrum.Anal.(周巧丽,雷永乾,郭鹏然,潘佳钏,王冠华.分析测试学报),2015,34(2):221-226.
[2]Li W S,Zhou F Q,Liu L,Qu D F.J.Anal.Sci.(李文山,周方钦,刘琳,屈东方.分析科学学报),2015,34(2):221-226.
[3]Tang Y,Zhang W D.J.Instrum.Anal.( 唐跃,张伟德.分析测试学报),2013,32(12):1443-1447.
[4]Slowing I I,Trewyn B G,Giri S,Lin Y.Adv.Funct.Mater.,2007,17(8):1225-1236.
[5]Trewyn B G,Slowing I I,Giri S,Chen H T,Lin V S Y.Acc.Chem.Res.,2007,40(9):846-853.
[6]Vallet-Regí M,Balas F,Arcos D.Angew.Chem.Int.Ed.,2007,46(40):7548-7558.
[7]Wu W S,Fan Q H,Lu S,Niu S,Wang X M.Adsorpt.Sci.Technol.,2006,24(7):601-610.
[8]Anirudhan T S,Bringle C D,Rijith S.J.Environ.Radioact.,2009,101(3):267-276.
[9]Chen C L,Wang X K,Nagatsu M.Environ.Sci.Technol.,2009,43(7):2362-2367.
[10]Vidya K,Dapurkar S E,Selvam P,Badamall S K,Gupta N M.MicroporousMesoporousMater.,2001,50:173-179.
[11]Li X H,Wang Z,Li Q,Ma J X,Zhu M Z.Chem.Eng.J.,2015,273:630-637.
[12]Tadjarodi A,Jalalat V,Zare-Dorabei R.Mater.Res.Bull.,2015,61:113-119.
[13]Idris S A,Alotaibi K,Peshkur T A,Anderson P,Gibson L T.J.ColloidInterfaceSci.,2012,386(22):344-349.
[14]Yang N,Zhu S M,Zhang D.Chin.J.Inorg.Chem.(杨娜,朱申敏,张荻.无机化学学报),2007,23(9):1627-1630.
[15]Baral S S,Das N,Ramulu T S,Sahoo S K,Chaudhury G R.J.Hazard.Mater.,2009,161(2):1427-1435.
[16]Chen X H,Wei X Q,Cai M Q,Zhao Y G,Pan S D,Jin M C.J.Instrum.Anal.(陈晓红,魏晓琴,蔡美强,赵永纲,潘胜东,金米聪.分析测试学报),2014,33(6):648-652.

Separation and Preconcentration of Trace Cadmium(Ⅱ) in Water with Aminopropyl Silatrane Immobilized on Mesoporous SilicaWANG Yan-mei1*,YUAN Hai-kuan2
(1.School of Chemical Engineering and Environmental Science,Weifang University of Science and Technology,Weifang
262700,China;2.College of Chemical Engineering,Zhejiang University of Technology,Hangzhou310014,China)
Abstract:An adsorbent,aminated mesoporous silica was synthesizmg via aminopropyl silatrane functionalizing mesoporous silica.The characterization of this adsorbent was investigated by transmission electron microscopy(TEM) and fourier transform infrared spectroscopy(FT-IR).A new method was developed for the determinaon of trace cadmium by flame atomic absorption spectrometry(FAAS) after separation/preconcentration with the aminated mesoporous silica material as adsorbent.The influencies of various analytical parameters on cadmium extraction,such as pH value,flow rate of sample,type and amount of eluent,adsorption capacity of adsorbent and interfering ions were investigated.The results indicated that cadmium could be well absorbed at pH 7.0 and a sample flow rate of 8 mL/min.After adsorption,Cd(Ⅱ) was eluented with 5.0 mL 2.0 mol/L HNO3,and determined by FAAS.The linear range of Cd(Ⅱ) ranged from 0.6 ng/mL to 20 ng/mL.The limits of quantitation(LOQ) was 0.5 ng/mL,and the enrichment factor for the present method was obtained to be 50.The RSD(n=11) for 10 ng/mL Cd(Ⅱ) standard solution was 0.92%.The spiked recoveries of Cd(Ⅱ) were in the range of 98.8%-104.5%.The modified mesoporous silica demonstrated an excellent anti-interference capacity,and the adsorption/desorption process remained effective for at least twelve consecutive cycles.The method was applicable for the determination of trace Cd(Ⅱ) in environmental water samples with satisfactory results.
Key words:aminated mesoporous silica;separation/preconcentration;flame atomic absorption spectrometry;cadmium
中图分类号:O562.3;O614.242
文献标识码:A
文章编号:1004-4957(2015)12-1382-05
doi:10.3969/j.issn.1004-4957.2015.12.009
通讯作者:*王延梅,硕士,讲师,研究方向:水质检测与处理,Tel:0536-5231829,E-mail:wymhouse@126.com
基金项目:潍坊市科学技术发展计划(2014RKX056)
收稿日期:2015-05-26;修回日期:2015-07-05
