QuEChERS样品前处理方法联合在线GPC/GC-MS测定水果中15种三唑类农药残留量方法评估
2016-01-27李海飞聂继云徐国锋李志霞毋永龙匡立学
李海飞,聂继云,徐国锋,李 静,闫 震,李志霞,毋永龙,匡立学
(中国农业科学院果树研究所,农业部果品质量安全风险评估实验室(兴城),农业部果品及
苗木质量监督检验测试中心(兴城),辽宁 兴城 125100)
QuEChERS样品前处理方法联合在线GPC/GC-MS测定水果中15种三唑类农药残留量方法评估
李海飞,聂继云*,徐国锋,李静,闫震,李志霞,毋永龙,匡立学
(中国农业科学院果树研究所,农业部果品质量安全风险评估实验室(兴城),农业部果品及
苗木质量监督检验测试中心(兴城),辽宁兴城125100)
摘要:比较了3种QuEChERS方法(未加缓冲盐的原创QuEChERS方法、加乙酸盐的AOAC 2007.01方法以及加柠檬酸缓冲盐的CEN 15662方法)提取水果中15种三唑类农药的有效性,考察了乙二胺-N-丙基硅烷(PSA)和C18吸附剂的净化效果,以提取后添加法评估了苹果、梨、桃、葡萄、樱桃、香蕉及橙子中各目标化合物的基质效应。结果表明,3种QuEChERS方法的回收率无明显差异,但原创QuEChERS方法操作简单、成本较低,且有较好的回收率和较低的基质效应。联合使用PSA和C18吸附剂的净化效果优于单独使用PSA或C18的净化效果。15种三唑类农药在7种基质中均存在基质增强效应。采用原创QuEChERS方法结合在线凝胶渗透色谱串联气相色谱-质谱(GPC/GC-MS),实现了在线净化与分析检测的自动化,缩短了分析时间,弥补了原创QuEChERS方法去除干扰不彻底的缺陷,同时利用PTV大体积进样和进样口程序升温方式提高了检测灵敏度。15种农药在7种基质3个加标水平(20,50,100 μg/kg)下的平均回收率为85.7%~120.1%,相对标准偏差(RSD)为0.2%~11.5%,在10~400 μg/L 范围内线性关系良好,相关系数(r)大于0.998;检出限为0.9~9.5 μg/kg。该方法简便快速、准确可靠、经济环保,适用于水果中三唑类农药多残留的快速检测。
关键词:QuEChERS;在线凝胶渗透色谱串联气相色谱-质谱;三唑类农药残留;基质效应;水果
三唑类农药属于有机杂环类化合物,种类很多,可作为杀菌剂、杀虫剂和植物生长调节剂,因其作用机制独特且药效满意,并具有广谱、内吸、低毒等优良特性,在应用方面越来越受到人们的重视[1]。目前三唑类农药在水果的种植过程中被广泛应用且施用量逐渐加大,由其引发的残留问题也日益受到关注。为了保证消费者安全,许多发达国家及国际组织对不同水果中三唑类农药残留进行了严格限量,最大残留限量为0.01 mg/kg[2-3]。
样品前处理是农药残留分析过程最为关键和耗时的环节,在很大程度上决定了分析结果的准确性,并且高效的前处理技术还能大大减少分析成本和时间。QuEChERS方法最早由Anastassiades等[4]于2003年提出,因其在水果蔬菜农药残留分析中具有快速、简单、便宜、有效、可靠和安全等优势,已在世界很多国家和地区得到验证和推广[5-7],并改进形成了AOAC 2007.01、CEN 15662和NY/T 1380-2007标准方法。目前对水果中三唑类农药残留的测定已有报道[1,8-9],但采用QuEChERS前处理方法提取水果中三唑类农药残留的报道较少[10-13]。
QuEChERS方法采用分散固相萃取净化,在应用气相色谱-质谱检测时往往因出现衬管和柱前端严重污染而导致色谱峰丢失或拖尾、背景高、基质效应严重,从而影响了一些农药的定性和定量检测[6]。近年来,在线凝胶渗透色谱/气相色谱-质谱(GPC/GC-MS)已应用于复杂基质中农药残留的分析[5,13-15],在线GPC/GC-MS系统中GPC可有效去除样品基质中可能干扰目标化合物检测的大分子量的油脂、色素等组分,从而降低背景和改善峰形,减少基质效应,弥补了QuEChERS方法去除干扰不彻底的缺陷。同时采取样品在线处理、大体积进样和气相色谱进样口的程序升温方式提高了检测灵敏度和选择性,缩短了分析时间,减少了溶剂用量,降低了有机试剂对分析者和环境的危害。目前采用QuEChERS前处理方法联合在线GPC/GC-MS对水果中多种三唑类农药残留进行测定的研究尚未见报道。
本研究以果树生产中常用的三唑酮、烯效唑、戊唑醇等14种三唑类农药以及中华人民共和国农业部公告第199号中规定的在果树上不得使用的氯唑磷农药为目标物,比较了3种QuEChERS样品前处理方法(即未加入缓冲盐的原创QuEChERS方法[4]、加入乙酸盐缓冲盐的AOAC 2007.01方法[16]以及加入柠檬酸缓冲盐的CEN 15662方法[17])提取水果中15种三唑类农药的有效性,考察了乙二胺-N-丙基硅烷(PSA)及C18吸附剂对15种三唑类农药的净化效果,以及目标化合物在不同水果中的基质效应。通过原创QuEChERS前处理方法结合GPC/GC-MS检测方法,实现了在线净化与分析检测的自动化。该方法简便快速、经济环保、结果准确可靠,适用于水果中三唑类农药残留的定性定量分析。
1实验部分
1.1仪器与试剂
GPC/GC-MS 2010Ultra在线凝胶色谱串联气相色谱-质谱联用仪(日本岛津公司);立式大容量高速离心机(日本 Hitachi公司);N-EVAT24氮吹仪(美国Organomation Associatews)。
乙腈、丙酮、环己烷(HPLC级,Fisher公司);乙酸、甲苯(HPLC级,美国J.T.Baker公司);PSA 、C18吸附剂(粒径范围40~60 μm,天津艾杰尔公司);无水硫酸镁、氯化钠、无水乙酸钠、柠檬酸钠(分析纯,天津市科密欧公司),柠檬酸氢二钠(分析纯,美国Alfa Aesar公司);微孔滤膜(0.22 μm,天津津腾公司)。
氟硅唑、丙环唑标准品(纯度≥97%,德国DR公司) 分别以丙酮配制成浓度为1 000 mg/L的标准溶液;烯效唑、己唑醇、腈菌唑(规格100 μg/mL,农业部环境保护研究所);其余农药标样均购于农业部环境质量监督检验测试中心(天津),规格为1 000 mg/L。15种农药根据需要用丙酮-环己烷(3∶7)配成合适的混合标准工作溶液,于-20 ℃冰箱中保存。基质标准溶液:用空白样品基质溶液配成不同浓度的基质混合标准溶液,用于制作标准工作曲线,现配现用。
1.2样品前处理
1.2.1原创QuEChERS方法(即未加缓冲盐的QuEChERS方法)准确称取匀浆后的水果样品10 g(精确至0.01 g)于50 mL塑料离心管中,加入10.0 mL乙腈溶液、1.0 g NaCl、4.0 g无水MgSO4,振摇1 min,以8 000 r/min高速离心5 min,吸取1.0 mL上层清液转入装有25 mg PSA、150 mg无水MgSO4的10 mL离心管中,涡旋混匀1 min,静置,上清液过0.22 μm滤膜后,待测。
1.2.2AOAC 2007.01方法(即加乙酸盐缓冲盐的QuEChERS方法)准确称取匀浆后的水果样品15 g(精确至0.01 g)于50 mL塑料离心管中,加入15.0 mL 1% 乙酸-乙腈溶液、1.5 g NaCl、6.0 g无水MgSO4、1.5 g无水乙酸钠,振摇1 min,以8 000 r/min高速离心5 min,吸取1.0 mL上层清液转入装有50 mg PSA、150 mg 无水MgSO4的10 mL离心管中,涡旋混匀1 min,静置,上清液过0.22 μm滤膜后,待测。
1.2.3CEN 15662方法(即加柠檬酸缓冲盐的QuEChERS方法) 准确称取匀浆后的水果样品10 g(精确至0.01 g)于50 mL塑料离心管中,加入10.0 mL乙腈后振摇1 min,加入1.0 g NaCl、4.0 g无水MgSO4、1.0 g柠檬酸钠、0.5 g柠檬酸氢二钠,振摇1 min,其余操作与“1.2.1”一致。
1.3色谱-质谱条件
1.3.1GPC条件净化柱:Shodex EV-200凝胶色谱柱(150 mm×2.1 mm);检测波长:210 nm;流动相:丙酮-环己烷(3∶7),流速:0.1 mL/min;柱温:40 ℃;进样量:10 μL。
1.3.2GC-MS分析条件色谱柱:惰性毛细管柱(5 m×0.53 mm),预柱 Rtx-5 ms(5 m×0.25 mm×0.25 μm),分析柱Rtx-5 ms(25 m×0.25 mm×0.25 μm),3根柱子通过两通和三通串联使用;PTV进样口:不分流恒压模式,程序升温:120 ℃保持5 min,以80 ℃/min升至250 ℃,保持36 min;柱温箱程序升温:82 ℃保持5 min,以9 ℃/min升至280 ℃,保持10 min;载气:氦气,总流速:30.0 mL/min;柱流速:1.75 mL/min。
离子源温度:200 ℃;GC-MS接口温度:250 ℃;溶剂延迟时间:9.5 min;检测电压:0.79 kV;质谱检测模式:选择离子扫描模式(SIM)。每种化合物分别选择1个定量离子,2个定性离子,具体SIM离子参数见表1。

表1 15种农药的保留时间、选择离子、线性方程、相关系数及检出限
(续表1)

No.CompoundRetentiontime(min)Selectedion(m/z)Linearrange(μg/kg)LinearequationrLOD(μg/kg)9Diniconazole(烯唑醇)24.85268*,270,23210~400y=10542.9x+2115.70.99977.310Triazophos(三唑磷)25.34162*,161,25710~400y=4380.4x-107402.70.99854.011Propiconazole(丙环唑)25.65,25.80259*,261,17310~400y=2651.4x-10869.10.99994.312Tebuconazole(戊唑醇)26.07250*,252,16310~400y=6938.6x+59113.30.99987.913Epoxiconazole(氟环唑)26.48192*,138,18310~400y=9246.0x-9304.30.99999.514Fenbuconazole(腈苯唑)29.83139*,125,19810~400y=302.7x+740.60.99908.315Difenoconazole(苯醚甲环唑)32.25,32.37323*,265,32510~400y=6130.7x-2160.90.99995.0
*quantitative ion;x:concentration of standard solution(μg/L);y:peak area(μV·s)

图1 GPC/GC-MS系统流路图Fig.1 The flow diagram of GPC/GC-MS system
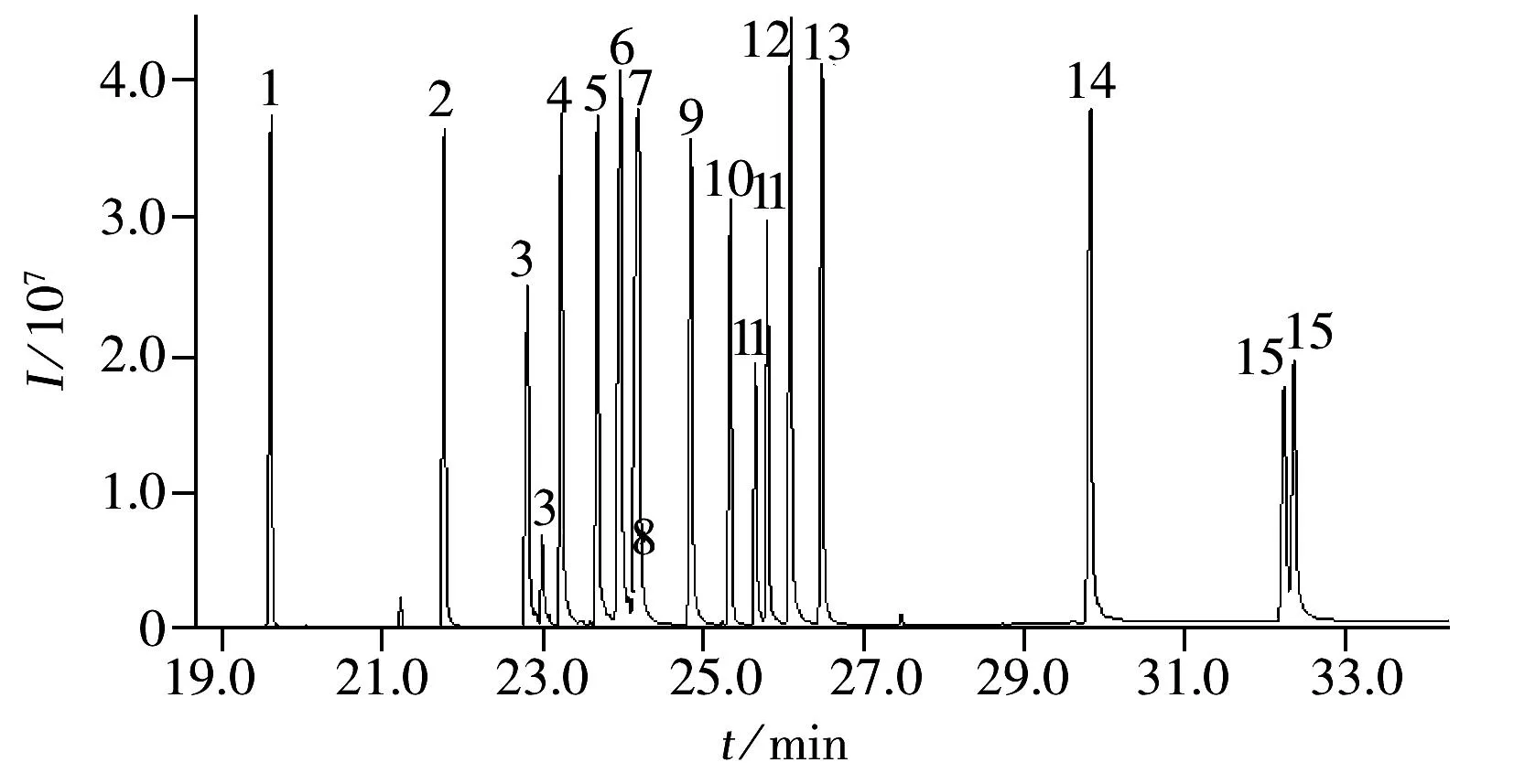
图2 15种农药(1 mg/L)的总离子流图Fig.2 TIC chromatogram of 15 triazole pesticides(1 mg/L)compound No.(1-15) correspond to the numbers in Table 1
2结果与讨论
2.1GPC/GC-MS在线净化
GPC/GC-MS分析农药残留时,在GPC色谱柱中根据体积排阻的原理,样品中分子量较大的脂肪和色素先从色谱柱中流出,通过六通阀的转换将这些基质干扰物排出系统,截取含有农药成分的部分导入试样定量捕集环路(200 μL),再进行PTV进样和GC-MS分离检测,实现了全自动的前处理和仪器分析测定的在线分析(图1)。而合理的截取时间是影响目标农药定性和定量的关键,若截取时间过早,色素和油脂的去除效果降低,若截取时间过晚,分子量大的目标农药丢失,所以在GPC/GC-MS分析中必须根据实际分析对象选择最佳截取时间。在GPC软件中通常采用氟胺氰菊酯和灭螨猛标准品的保留时间来确定农药的收集开始和结束时间,本文15种三唑类农药中苯醚甲环唑的分子量最大为406.26,小于氟胺氰菊酯的分子量(502.9),所以采用氟胺氰菊酯的保留时间作为干扰物和分析对象的切割时间,图2为优化截取条件下15种农药的总离子流(TIC)色谱图。此外,GPC/GC-MS系统的进样量为10~20 μL,比单独的GC-MS高5~10倍,样品提取液经分散固相萃取净化后再利用在线GPC进一步去除干扰物质,弥补了QuEChERS方法去除干扰不彻底的缺陷,之后采用进样口程序升温的方式提高检测灵敏度和选择性,从而获得更低的检出限。
2.23种QuEChERS方法回收率的比较
原始QuEChERS方法对稳定性差的农药回收率较低,其结果与基质的pH值有关[5]。加入乙酸盐缓冲盐体系和柠檬酸缓冲盐体系的QuEChERS方法,其样品提取液的pH值分别为4.8~5.5和5.0~5.5,一些对酸碱敏感的农药可获得高回收率。本文以苹果、梨、桃、樱桃、葡萄、香蕉和橙子7种水果为基质,在100 μg/kg加标水平下分别采用3种QuEChERS方法进行前处理。结果显示,采用原创QuEChERS方法,15种农药在上述7种基质中的回收率分别为:87.3%~103.8%,87.2%~106.1%,82.5%~100.5%,93.1%~101.9%,87.2%~102.5%,88.8%~106.2%和85.3%~107.3%;采用AOAC 2007.01方法,15种农药的回收率分别为87.6%~108.5%,90.2%~104.0%,92.8%~102.8%,93.1%~110.7%,82.2%~99.8%,90.8%~110.9%和96.5%~102.4%;采用CEN 15662方法,15种农药的回收率分别为:87.9%~113.6%,83.9%~111.6%,91.8%~109.4%,93.8%~113.3%,81.1%~106.6%,89.9%~102.2%和87.8%~114.7%。表2列出了苹果、梨、桃、樱桃4种基质的萃取回收率。3种方法的回收率均满足残留检测的要求,方法间无显著差异(p>0.05),分析其原因是目标化合物在中性或酸性介质中较稳定,其次采用原创QuEChERS方法前处理时,其提取液pH值为4.5~5.8,接近于缓冲盐体系QuEChERS方法的pH值。原创QuEChERS方法与两种缓冲盐体系QuEChERS方法相比,因无其他物质的加入,引入杂质的几率较小,且操作更方便、成本更低。因此,在分析水果中三唑类农药的残留量时,原创QuEChERS方法优于两种缓冲盐体系QuEChERS方法。

表2 3种QuEChERS方法在4种基质中的回收率比较
2.3基质效应
基质效应是指样品分析液中分析物以外的共流出组分改变了分析物的响应值,从而影响定量分析的准确度和重现性[5]。本文以基质匹配校准曲线斜率/纯溶剂标准曲线斜率比来确定基质效应,斜率比越接近1,基质效应越小,斜率比在0.80~1.20 之间则认为无基质效应[5]。与两种缓冲盐体系QuEChERS方法相比,原创QuEChERS方法的基质效应整体略低于前两种方法。图3为采用原创QuEChERS方法处理的基质效应图。结果显示,同一化合物在不同基质中的基质效应不同,不同化合物在同一基质中的基质效应也各不相同,15种三唑类农药在7种基质中均显示基质增强效应,因此本实验采用基质匹配标准溶液进行定量,以补偿基质效应对定量结果的影响。
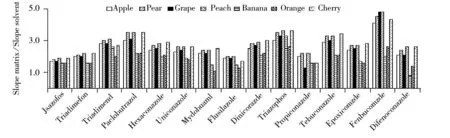
图3 15种农药在7种水果中的基质效应Fig.3 Matrix effects of 15 pesticides in 7 matrixes
2.4分散吸附剂的选择
QuEChERS方法中最常用的吸附剂有PSA和C18。PSA因化学结构中含有两个氨基,具有较强的离子交换能力,能与基质中的脂肪酸、糖类、甾醇等分子中的羟基形成共价键氢键而将其除去,但当待检农药分子中含有较多羟基时,则应考虑PSA对该农药的吸附。C18是在硅胶末端键合十八烷基,由于十八烷基的非极性较强,因此易吸附非极性物质如维生素、脂肪、甾醇、挥发油等。本实验采用原创QuEChERS前处理方法,以苹果、葡萄、桃为基质,在100 μg/kg 加标水平下,以回收率和净化效果为主要指标,比较以下4种净化方式的净化效果:Ⅰ.25 mg PSA+150 mg无水MgSO4;Ⅱ.25 mg C18+150 mg无水MgSO4;Ⅲ.25 mg PSA+25 mg C18+150 mg无水MgSO4;Ⅳ.50 mg PSA+150 mg无水MgSO4。结果显示:①通过比较净化前后提取液的颜色发现,C18对色素的去除能力明显差于PSA,PSA+C18与PSA无明显差异;②从图4可知,PSA去除杂质的效果明显优于单独使用C18的去除效果,而净化方式Ⅲ的净化效果最佳;③从回收率结果可知,15 种农药在4种净化方式下的回收率均为83.4%~108.7%,无明显差别。因此,综合考虑净化剂对色素的吸附能力、去除杂质的效果以及对回收率的影响等因素,本文最终采用方式Ⅲ(25 mg PSA+25 mg C18+150 mg无水MgSO4)作为净化剂。

2.5定容溶液的选择
采用GC-MS或GC-MS/MS检测农药时,由于QuEChERS方法最终上机测定的溶剂为乙腈溶液,而乙腈溶液的极性较强,对玻璃衬管和毛细管色谱柱前端损伤较重,容易出现色谱峰丢失或拖尾、背景高等情况,需经常更换衬管和惰性毛细管色谱柱,增加了检测成本;再者GPC凝胶柱一般采用丙酮/环己烷或丙酮/乙酸乙酯为流动相,使用乙腈会降低其使用寿命,因此,本文将乙腈转溶为丙酮/环己烷。在100 μg/kg 加标水平下,以苹果中多效唑和苯醚甲环唑为例,采用乙腈定容时多效唑和苯醚甲环唑的回收率分别为103.7%和100.7%,将乙腈转溶为丙酮/环己烷定容时,多效唑和苯醚甲环唑的回收率分别为101.4%和100.5%,二者的回收率相近,所以本文最终采用丙酮/环己烷为定容溶液。
2.6方法评价
在优化条件下,考察了15 种三唑类农药的线性范围及相关系数。结果显示,在10~400 μg/L范围内,目标化合物的纯溶剂标准溶液浓度(x,μg/L)与对应的峰面积(y,μV·s)呈良好线性关系,相关系数为0.998 5~0.999 9,以20 μg/kg纯溶剂标准溶液的定量离子对应色谱信号的3倍信噪比(S/N)确定方法的检出限为0.9~9.5 μg/kg(表1)。采用原创QuEChERS前处理方法,在20,50,100 μg/kg 3个加标水平下,15种农药在7种水果基质中的回收率为85.7%~120.1%,相对标准偏差(RSD)为0.2%~11.5%(表3),方法符合农药残留的检测要求。

表3 15种农药在7 种基质的加标回收率及相对标准偏差(n=6)
(续表3)

CompoundSpiked(μg/kg)ApplePearGrapePeachBananaCherryOrangeR/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%R/%sr/%100101.68.6105.86.799.51.9100.91.9104.71.1105.61.0104.03.6Paclobutrazol20101.28.1110.31.396.73.7101.05.3108.22.5101.010.7100.75.65099.12.7120.13.3116.13.3100.74.2104.21.186.611.4101.66.1100100.57.3101.19.9103.03.096.91.4106.61.7103.58.590.54.6Hexaconazole20103.05.5102.23.7109.84.0109.82.0106.47.497.23.898.08.55093.95.4116.52.8111.82.4102.04.8102.52.998.31.696.95.010096.86.5103.81.594.91.1101.01.8101.91.396.72.298.81.3Uniconazole2097.50.796.94.7101.86.2103.15.4103.16.298.34.299.25.65098.71.3112.52.7111.31.897.53.398.92.699.02.798.54.9100100.06.8100.72.396.12.9101.91.3100.71.697.33.2100.53.2Myclobutanil20105.83.096.84.4110.64.9106.31.6102.70.2101.51.3101.58.450100.02.1105.65.6115.32.2103.56.8102.00.9100.91.4100.95.4100100.38.797.31.895.44.6100.11.6103.01.6102.20.6100.61.3Flusilazole20100.24.3110.26.2107.94.798.55.5101.45.898.71.4102.98.55096.61.3104.55.9112.82.899.53.9101.10.798.31.197.13.410099.75.597.66.098.14.1104.81.1102.10.699.20.599.22.2Diniconazole2095.23.799.93.0101.14.896.05.7101.32.6101.72.194.69.450105.59.9111.53.2113.92.299.74.1102.73.1101.12.196.52.1100102.06.5103.45.999.93.7100.41.5105.81.4102.10.9101.02.1Triazophos2098.33.8104.12.499.86.497.13.7101.53.4100.85.9100.97.05092.81.5105.65.4104.82.293.84.4102.32.697.711.599.84.410099.34.199.00.793.63.7105.62.799.02.399.02.597.59.9Propiconazole2096.54.6100.01.3101.43.4101.42.699.94.298.11.997.18.15097.93.0110.43.3111.42.193.12.798.51.798.81.197.89.2100100.45.099.71.996.23.9105.42.5100.21.698.30.5100.32.1Tebuconazole2098.31.6100.81.3102.35.5103.93.299.86.9101.01.898.75.15098.92.5105.03.8110.71.2103.74.694.39.998.35.599.96.110096.41.696.93.695.67.0103.32.4102.03.0101.11.096.05.4Epoxiconazole20105.54.496.41.5105.95.5103.42.6100.02.997.91.7106.19.05096.33.199.94.8106.81.3102.36.9103.41.798.71.098.65.210099.86.593.11.795.25.7108.44.399.73.197.40.5100.22.1Fenbuconazole2096.55.086.13.2106.99.896.57.697.88.9100.49.3100.69.65095.21.3106.24.0106.13.8101.94.295.33.496.83.690.99.510088.81.896.69.792.77.0113.83.597.14.0102.97.196.02.5Difenoconazole2089.71.8113.69.395.71.7102.62.1101.82.696.01.1100.55.350101.03.3108.44.1119.02.4102.00.7100.72.094.82.094.57.410096.71.493.34.1107.94.5104.60.9104.02.496.40.697.86.5
3结论
由于农药结构和性质的多样性以及样品种类的多样性,最佳样品前处理方法需能适用于更多基质及更多农药,操作简单、经济环保并有较高的回收率。提取水果中三唑类农药残留时,原创QuEChERS方法与2种缓冲盐体系QuEChERS前处理方法相比,具有操作简单、成本较低、回收率较好、基质效应较低等特点,结合在线GPC/GC-MS分析方法,可弥补原创QuEChERs方法去除干扰不彻底的缺陷,同时缩短了分析时间,降低了有机溶剂用量及对操作者和环境的危害,并提高了检测的灵敏度和选择性。该方法简便快速、灵敏准确、经济环保,适用于水果中三唑类农药残留的检测。
参考文献:
[1]Li J G,Wang Y F,Shi J W,Jiang L,Yao X P,Fang L Y.Chin.J.Chromatogr.(李继革,王玉飞,施家威,蒋丽,姚浔平,方兰云.色谱),2012,30(3):262-266.
[2]GB2763-2014.National Food Safety Standard.Maximum Residue Limits for Pesticides in Food(食品安全国家标准 食品中农药最大残留限量).
[3]Wang N N.TheMainTradeCountriesandRegionsFoodPesticideandVeterinaryDrugResidueLimits.2nd ed.Beijing:Standards Press of China(王霓霓.主要贸易国家和地区食品中农兽药残留限量标准.2 版.北京:中国标准出版社),2010.
[4]Anastassiades M,Lehotay S J,Stajnbaher D,Schenck F J.J.AOACInt.,2003,86(2):412-431.
[5]Wang L Z,Zhou Y,Chen Y,Wang R L,Lin Z X,Lin D J,Zheng S H.Chin.J.Chromatogr.(王连珠,周昱,陈泳,王瑞龙,林子旭,林德娟,郑少惠.色谱),2012,30(2):146-153.
[6]Lu D S,Xiong L B,Wen Y M,Qiu X L,Wang G Q.J.Chin.MassSpectrom.Soc.(卢大胜,熊丽蓓,温忆敏,邱歆磊,汪国权.质谱学报),2011,32(4):229-235.
[7]Wang L Z,Huang X Y,Chen Y,Lin Z X,Wang G F,Zhou Y.J.Instrum.Anal.(王连珠,黄小燕,陈泳,林子旭,王根芳,周昱.分析测试学报),2014,33(10):1102-1108.
[8]Wu L,Chen M X,Mou R X,Ying X H,Cao Z Y.J.Instrum.Anal.(吴俐,陈铭学,牟仁祥,应兴华,曹赵云.分析测试学报),2009,28(7):846-848,854.
[9]Ge N,Liu X M,Li X M,Huang X Z,Wu Y P,Li J,Liu Y M.J.Instrum.Anal.(葛娜,刘晓茂,李学民,黄学者,吴艳萍,李金,刘永明.分析测试学报),2011,30(12):1351-1355.
[10]Sun X,Ding Y,Wang J L,Wang D L,Shen Y,Liu X J.FoodSci.(孙星,丁悦,汪佳蕾,王冬兰,沈燕,刘贤金.食品科学),2014,35(8):76-79.
[11]Yan H F,Li Y J,Wang M L,Dai H,Zhang Y,Huang Z Q.Anal.Test.Technol.Instrum.(颜鸿飞,李拥军,王美玲,戴华,张莹,黄志强.分析测试技术与仪器),2012,18(4):204-207.
[12]Xiao Y,Peng J D,Zhang J,Tang J X.J.SouthwestUniv.:Nat.Sci.Ed.(肖颖,彭敬东,张晶,唐金霞.西南大学学报:自然科学版),2013,35(5):102-106.
[13]Costa F P,Caldas S S,Primel E G.FoodChem.,2014,165:587-593.
[14]Huang Y H.J.Instrum.Anal.(黄永辉.分析测试学报),2014,28(2):217-221.
[15]Jia W,Ling Y,Hao J,Zhang F,Jiang P P,Yong W,Feng F,Huang J R,Chu X G.J.Instrum.Anal.(贾玮,凌云,郝静,张峰,蒋萍萍,雍炜,冯峰,黄峻榕,储晓刚.分析测试学报),2012,31(10):1217-1222.
[16]Lehotay S J,Mastovská K,Lightfield A R.J.AOAC.Int.,2005,88(2):615-629.
[17]Lehotay S J,Son K A,Kwon H,Koesukwiwat U,Fu W,Mastovska K,Hoh E,Leepipatpiboon N.J.Chromatogr.A,2010,1217(16):2548-2560.

研究报告
Evaluation of QuEChERS Method for the Analysis of 15 Triazole Pesticides Residues in Fruits by Online Gel Permeation Chromatography Gas Chromatography-Mass SpectrometryLI Hai-fei,NIE Ji-yun*,XU Guo-feng,LI Jing,YAN Zhen,LI Zhi-xia,WU Yong-long,KUANG Li-xue
(Quality Inspection and Test Center for Fruit and Nursery Stocks,Ministry of Agriculture;Laboratory of Quality
and Safety Risk Assessment for Fruit(Xingcheng),Ministry of Agriculture;Institute of Pomology
of Chinese Academy of Agricultural Sciences,Xingcheng125100,China)
Abstract:A comparison was made among three versions of QuEChERS sample preparation methods for the extraction of 15 triazole pesticides in fruits.The three QuEChERS methods were the original method without buffer,the AOAC Official Method 2007.01 with acetate buffer,and the CEN 15662 Method with citrate buffer.The clean-up effects of primary secondary amine(PSA) sorbent and C18sorbent on 15 triazole pesticides were studied.The addition method after extraction was used to evaluate the matrix effects of triazole pesticide in matrix of apple,pear,peach,grape,cherry,banana and orange during gel permeation chromatography coupled to gas chromatography-mass spectrometry(GPC/GC-MS) analysis.As a result,the QuEChERS method without buffer gave good recoveries for 15 triazole pesticides.The cleaning up effect of PSA plus C18is superior to that of C18or PSA sorbent.The matrix effects were intensive in the 7 kinds of fruits.In this article,15 triazole pesticides were extracted by the QuEChERS method without buffer,and analysed by using matrix-matched standard calibration as the external standard method with gas chromatography-mass spectrometry in selective ion monitoring(SIM) mode.Moreover,a large volume of sample was allowed to be injected using the program of GPC programmed temperature vaporizer of gas chromatography to improve the sensitivity of measurements.The recoveries of 15 residues in 7 matrixes at three spiked levels of 20,50,100 μg/kg ranged from 85.7% to 120.1% with relative standard deviations of 0.2%-11.5%.The calibration curves were linear(r>0.998) in the range of 10-400 μg/L for all the pesticides.The limits of detection(LOD) for the pesticides in fruits ranged from 0.9 μg/kg to 9.5 μg/kg.Based on these results,the analytical method was proved to be highly efficient,robust and sensitive,and was suitable for monitoring 15 triazole pesticides residues in fruits.
Key words:QuEChERS;online gel permeation chromatography/gas chromatography-mass spectrometry(GPC/GC-MS);triazole pesticides;matrix effects;fruits
中图分类号:O657.63;F767.2
文献标识码:A
文章编号:1004-4957(2015)12-1331-08
doi:10.3969/j.issn.1004-4957.2015.12.001
通讯作者:*聂继云,博士,研究员,研究方向:果品质量安全,Tel:0429-3598178,E-mail:jiyunnie@163.com
基金项目:国家农产品质量安全风险评估计划(GJFP2014002,GJFP2015002);中央级科研院所基本科研业务费专项(0032014013);中国农业科学院科技创新工程(CAAS-ASTIP)
收稿日期:2015-05-26;修回日期:2015-06-25
