自制羊膜提取液在兔眼准分子激光屈光性角膜切削术后的应用研究
2016-01-27张斌
张斌
(沈阳何氏眼科医院,辽宁沈阳110032)
自制羊膜提取液在兔眼准分子激光屈光性角膜切削术后的应用研究
张斌
(沈阳何氏眼科医院,辽宁沈阳110032)
摘要目的:探讨自制羊膜提取液对兔眼准分子激光屈光性角膜切削术(photorefractive keratectomy,PRK)后角膜上皮下雾状混浊(Haze)的影响。方法:常规方法获取新鲜健康人羊膜,保留上皮细胞,反复冻融、过滤,获得羊膜匀浆液,室温下保存备用。选择健康新西兰大白兔27只,在相同条件下,双眼行PRK,术后实验动物随机分为实验组、对照组、空白组,每组9只兔,18只眼。术后双眼给予局部抗生素眼药水,术后48 h实验组滴用羊膜提取液,对照组用0.1%磷酸地塞米松眼液,空白组用不含羊膜提取液的赋形剂。分别于术后1、2、4、8周记录角膜Haze情况并按Fantes等级标准进行评分,行眼前节照相记录Haze的形态。随机每组选择3只兔作为病理观察用,分别于术后1、4、8周各处死1只,摘除眼球做病理切片检查,观察术区角膜、炎症细胞及成纤维细胞情况。结果:PRK术后早期,3组动物角膜荧光素钠染色均为阳性,但多数角膜上皮缺损均在术后3 d修复。PRK术后Haze的发生率为100%,所有术眼均在术后1周左右开始出现程度不同的Haze,术后4周时Haze尤其明显,直至术后8周。实验组和对照组角膜Haze形成程度相似,且明显低于空白组,差异有统计学意义(P<0.05)。结论:羊膜提取液具有促进兔角膜上皮修复的作用,并能减少PRK术后兔Haze的形成。
关键词羊膜提取液;角膜上皮;准分子激光屈光性角膜切削术;兔
准分子激光屈光性角膜切削术(photorefractive keratectomy,PRK)所用的是氩氟(ArF)混合物产生的波长为193 nm的准分子激光,它是一种超紫外线冷激光,准确度非常高,能使组织分子气化而周围不产生热效应,因而能对角膜进行精确切削且对角膜的构造不产生不良影响。PRK是角膜屈光手术的重大进展,从1983年Trokel等推出至今,因安全、高效、可预测而得到全世界广泛应用,但是PRK术后仍然存在一些难以克服的问题,角膜上皮下雾状混浊(Haze)是其主要并发症之一。Haze是准分子激光术后切削区上皮和基质交界面出现的混浊。通常在术后10 d即可见到,3~6个月达到高峰,以后逐渐减轻[1]。病理上表现为浸润的炎症细胞、增生的成纤维细胞及排列紊乱的胶原纤维。Haze的存在,不仅影响视力,还是造成屈光回退的主要原因,影响了PRK的安全性和稳定性,因此探索预防和治疗角膜Haze的方法,成为眼科界关注的焦点。
近年来,羊膜作为一种生物组织移植材料,已广泛应用于眼表疾病的治疗,在眼表重建中发挥了重要的作用[2-3]。随着人们对羊膜作用机制的深入研究,羊膜已被证实有抗炎、抗纤维化的作用,羊膜在眼科领域的应用得到进一步的发展,逐步向准分子激光手术的治疗领域扩展。但由于羊膜保存时间短,运输不方便,且不能随时满足临床要求,限制了临床医生对羊膜的使用。羊膜提取液技术的应用使得羊膜可以在常温下保存,并方便运输及应用,但是否仍能保证临床应用的效果需进一步验证。
为探讨羊膜提取液在PRK术后抑制Haze生成的作用,本研究采用自制羊膜提取液进行动物实验研究,比较PRK术后应用羊膜提取液、激素和单纯PRK的术后效果,为临床提供治疗的理论依据。
1材料与方法
1.1羊膜提取液的制备
1.1.1羊膜的来源选择无传染性疾病(病毒性肝炎、艾滋病、梅毒等)和全身性疾病,并行剖宫产的产妇新鲜胎盘,在无菌条件下,从胎盘上剥取羊膜,用生理盐水冲洗干净羊膜表面的血迹;用含抗生素的无菌生理盐水浸泡10 min(抗生素混合液的浓度为含50 μg/ml青霉素、50 μg/ml链霉素、100 μg/ml新霉素和2.5 μg/ml两性霉素B)。保留羊膜上皮层、基底膜、实质层。本研究经本院伦理委员会批准,并获得产妇知情同意。
1.1.2羊膜提取液的制备将羊膜用生理盐水洗净、剪碎,加入等量生理盐水,加入组织匀浆机在4 ℃条件下,10 000 r/min匀浆5次,每次1 min,将匀浆液置于-20 ℃快速冻存至完全冻结,然后在不高于42 ℃的条件下隔水彻底融化,如上条件反复冻融5次,按常规涂片显微镜观察,证明细胞完全破碎,在1~4 ℃的条件下自然沉降10 h,吸取上清液,用3~4层无菌纱布过滤,去除沉渣和蛋白絮状物,在4 ℃条件下,500 g离心30 min,取上清液,用过滤膜在正压或负压条件下过滤获得的上清液,截留分子量大于20万Da以上的大分子物质,使过滤液中的蛋白和多肽类物质的分子量小于20万Da,0.22 μm微孔滤膜过滤法除菌,4 ℃条件下保存。
1.2动物实验分组成年健康新西兰大白兔27只(雄性,沈阳医学院实验动物中心提供),体重2.0~2.5 kg。随机分为实验组、对照组、空白组,各9只18眼,实验组使用羊膜提取液;对照组使用0.1%磷酸地塞米松眼液,空白组使用不含羊膜提取液的赋形剂。随机每组选择3只兔作为病理观察用。
1.3手术方法实验动物采用3%戊巴比妥钠(30 mg/kg)耳缘静脉注射麻醉,1%爱尔卡因表面麻醉,按常规方法将兔双眼施行PRK。输入切削深度80 μm,光学消融直径5.6 mm。激光能量密度120 mJ/cm2,频率50 Hz。手术由同一熟练手术医生完成。术后2 d内每日双眼滴可乐必妥眼药水6次,晚间涂红霉素眼膏。
1.4PRK术后活体观察指标
1.4.1Haze分别于术后第1、2、4、8周的同一时间点用裂隙灯观察并记录Haze情况(依据Fantes分级标准,0级:角膜完全透明无混浊;Ⅰ级:在裂隙灯下用斜照法才能发现轻度点状混浊;Ⅱ级:在裂隙灯下容易发现角膜混浊,但不影响观察虹膜纹理;Ⅲ级:角膜混浊,影响观察虹膜纹理;Ⅳ级:角膜明显混浊,不能窥见虹膜纹理)。
1.4.2并发症术后每日观察有无角膜上皮损伤、结膜充血、前房出血等并发症。
1.5病理检查分别于术后1、4、8周采用心脏内注气每组随机处死用于病理检查的实验兔1只,并迅速摘除手术眼,取手术区10 mm×10 mm范围全层角膜组织,于10%甲醛液中固定24 h。作垂直于12点角膜表面的垂直切片,做胶原染色及HE染色,显微镜下观察术区角膜上皮愈合情况、胶原聚集排列情况、炎症细胞及成纤维细胞情况。
1.6统计学分析采用SPSS 14.0软件进行统计学分析,多组间比较采用Kruskal-Wallis H检验,两两比较采用Wilcoxon检验,P<0.05为差异有统计学意义。
2结果
2.1羊膜提取液显微镜观察结果羊膜提取液离心前按常规涂片显微镜观察,可见细胞完全破碎,细胞碎片均匀分布。
2.2PRK术后Haze观察结果术后8周实验组Haze等级为Ⅰ级;对照组Haze等级为Ⅱ级;空白组Haze等级为Ⅲ级,见图1。术眼均在PRK术后1周左右开始出现程度不同的Haze,其发生率为100%,术后4周时Haze尤其明显,直至术后8周。实验组与对照组Haze等级情况进展比较缓慢,均未出现Ⅲ级,空白组Haze等级情况进展比较迅速,在术后1周时未出现Ⅲ级,而在术后8周时,2眼进展到Ⅲ级,见表1。术后各时间点实验组和对照组Haze等级进展情况低于空白组,除术后1周实验组、对照组与空白组Haze等级进展情况差异无统计学意义(P>0.05)外,其余各时间点实验组与空白组、对照组与空白组差异均有统计学意义(P<0.01或0.05)。实验组与对照组术后各时间点Haze等级情况差异均无统计学意义(P>0.05),见表2。

A:羊膜提取液组;B:0.1%磷酸地塞米松眼液;C:不含羊膜提取液的赋形剂组图1 3组实验动物术后8周裂隙灯下Haze情况

组别术后时间术后Haze等级0级Ⅰ级Ⅱ级Ⅲ级Ⅳ级实验组1周0111002周0111004周0102008周09300对照组1周0111002周0102004周084008周08410空白组1周084002周057004周038108周001020

表2 实验动物术后各时间点Haze情况比较
2.3并发症PRK术后早期,3组动物角膜荧光素钠染色均为阳性,但多数角膜上皮缺损均在术后3 d修复,且羊膜组角膜上皮愈合速度较其他2组要快。3组动物均有结膜充血,多数在术后3~5 d恢复。均未发生角膜上皮持续缺损、角膜溃疡等并发症。
2.4术区病理切片检查结果术后1周,实验组角膜上皮完整,切削边缘上皮稍厚,角膜细胞无明显增生,上皮下可见少量成纤维细胞,见图2A1、2A1′;对照组角膜上皮完整,角膜细胞无明显增生,上皮和实质层存在局限性散在裂隙,上皮下可见少量成纤维细胞,见图2A2、2A2′;空白组角膜上皮基本完整,上皮水肿、增厚,基底膜及浅层基质厚薄不均,上皮下可见大量成纤维细胞,见图2A3、2A3′。术后4周,实验组角膜上皮完整,切削边缘上皮稍厚,角膜细胞无明显增生,上皮下可见少量成纤维细胞,见图2B1、2B1′;对照组角膜上皮完整,角膜细胞无明显增生,上皮和实质层存在局限性散在裂隙,上皮下可见少量成纤维细胞,见图2B2、2B2′;空白组角膜上皮基本完整,上皮水肿、增厚,基底膜及浅层基质厚薄不均,上皮下可见大量成纤维细胞,纤维排列紊乱,见图2B3、2B3′。术后8周,实验组角膜上皮完整,上皮下潜在腔隙,可见中少量成纤维细胞,见图2C1、2C1′;对照组角膜上皮完整,角膜上皮轻度水肿、增厚,基底膜不连续,厚薄不均,上皮下可见中等量成纤维细胞,见图2C2、2C2′;空白组角膜上皮基本完整,上皮水肿、增厚,基底膜及浅层基质厚薄不均,上皮下可见大量成纤维细胞,纤维排列紊乱,可见大量瘢痕形成,见图2C3、2C3′。
3讨论
3.1PRK术后Haze形成的原因及解决办法PRK是角膜屈光手术的重大进展,从1983年Trokel等推出至今,因安全、高效、可预测而得到全世界广泛应用,但是PRK术后仍然存在一些难以克服的问题,角膜Haze是其主要并发症之一。
Haze是准分子激光术后切削区上皮和基质交界面出现的混浊。通常在术后10 d即可见到,3~6个月达到高峰,以后逐渐减轻[1]。Haze的存在,不仅影响视力,还是造成屈光回退的主要原因,因此影响PRK的安全性和稳定性。
PRK术后Haze形成的主要原因:(1)手术创伤早期引起炎症细胞浸润,瘢痕形成的细胞因子大量表达,细胞因子相互作用造成成纤维细胞大量增殖、瘢痕形成,这是Haze生成的最直接原因[4-6]。(2)角膜上皮的机械性损伤可引起角膜表层基质细胞凋亡,凋亡的基质细胞可在几天内由后层及周围的基质细胞通过增生和迁移来代偿,活化的基质细胞产生大量排列紊乱的胶原,导致角膜透明度的下降,瘢痕收缩,导致Haze形成及屈光改变的病理变化[7-10]。

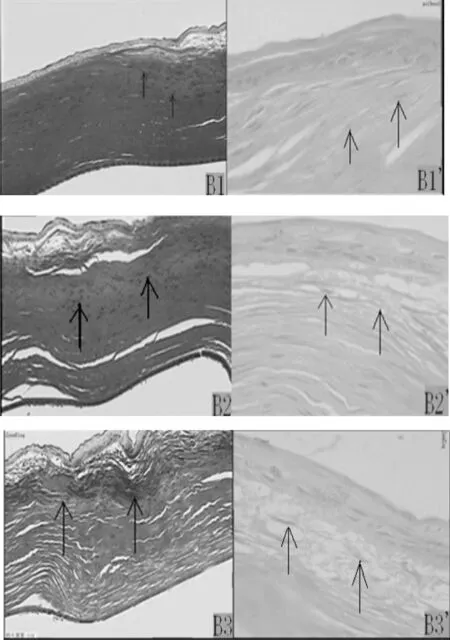

A1~C1、A1′~C3′:实验组;A2~C2、A2′~C2′:对照组;A3~C3、A3′~C3′:空白组。A1~A3、A1′~A3′:术后1周;B1~B3、B1′~B3′:术后4周;C1~C3、C1′~C3′:术后8周。A1~A3、B1~B3、C1~C3:胶原染色×100,A1′~A3′、B1′~B3′、C1′~C3′为HE染色×400;箭头所指为成纤维细胞
图2PRK术后手术区病理组织学切片结果
针对以上原因,为了减少PRK术后Haze的形成,目前有许多药物用于PRK术后,降低了术后Haze的发生率及其程度。如肾上腺皮质激素、非甾体抗炎药、抗代谢药物。PRK术后局部应用糖皮质激素是最早也是应用最普遍的治疗Haze的药物[11],其作用机制主要是减少DNA及蛋白质合成,降低角膜细胞活性及透明质酸含量,抑制成纤维细胞增生,同时还能够抑制磷脂酶A产生,减少前列腺素的释放,从而抑制炎性反应,阻止Haze的形成[12]。大量临床实践都证实了糖皮质激素的有效性。但是,也有研究对糖皮质激素的作用提出疑义,他们认为,角膜中氨基葡萄糖占主要成分,胶原蛋白相对缺乏,糖皮质激素对术后Haze的抑制作用非常有限,并且,长期应用糖皮质激素,会引起眼压升高、白内障等并发症,因此,糖皮质激素的使用仍存在争议[13]。非甾体抗炎药能抑制环氧化酶的活性,降低前列腺素浓度,减少花生四烯酸的产生,阻止成纤维细胞的生长、增生。PRK术后应用非甾体药物,能避免应用激素引起的并发症。Nassaralla等[14]通过实验证实,双氯芬酸能明显减轻Haze的发生。关于非甾体抗炎药的疗效,各家说法不一,有研究认为,双氯芬酸优于糖皮质激素;而另一些研究认为,双氯芬酸不如糖皮质激素作用明显,但两药合用,效果更佳。但其缺点是局部刺激症状较重。抗代谢药物通过烷基化作用抑制细胞内DNA、RNA和蛋白质的合成,它能抑制成纤维细胞的增生和分化。丝裂霉素C(MMC)是临床上研究最多、应用最广的抗代谢药物[15-16]。许多研究证实,MMC能有效抑制角膜细胞和成纤维细胞的增殖,明显减轻Haze,提高角膜的透明度[17-18]。还有一些人主张,MMC与糖皮质激素合用,疗效更明显。但MMC不良反应大,在局部和全身应用均能产生严重并发症,在翼状胬肉和青光眼滤过手术的应用中,有许多关于MMC引起角膜上皮糜烂、剧烈疼痛、角膜溶解、巩膜软化、白内障、青光眼、眼内炎、低眼压及黄斑变性的报道。对于MMC在PRK术中给药的浓度、时间、给药方法,各家报道不一,目前大多研究者采用在术中一次性用0.02%的MMC,但其安全性有待进一步证实[19]。
3.2目前羊膜在眼科中的应用及存在的问题人体的羊膜是胎盘的最内层,是体内最厚的基底膜。众多研究表明其具有抗炎、抗纤维增殖、抗新生血管和促进上皮化等作用,又因为其无血管和淋巴组织,具有低免疫原性的特点。羊膜已被广泛应用于眼表疾病的治疗及眼表重建、结膜囊成形等手术中[2-3]。现今,国内外有术者将新鲜或低温保存羊膜用于PRK术后以期抑制Haze的形成,已经取得了肯定的效果,扩大了羊膜在眼科中的应用范畴。
目前眼科临床中对于羊膜的应用十分普遍,每年约有近百万的眼表疾病患者受益于羊膜的使用。但因为新鲜羊膜难以随时获取,尤其对于没有妇产科室的眼病专科医院更是如此;而目前羊膜的保存方法主要是保护液存在下的深低温冷藏,大多数医疗机构难以负担昂贵的冷藏设备。此外,由于新鲜羊膜和低温保存羊膜都难以做到完全的消毒灭菌,存在着潜在的病毒及其他微生物感染的危险。这些均在一定程度上限制了其在眼科临床中的应用。
3.3自制羊膜提取液实验结果分析羊膜提取液的制备技术可以在保持生物制品中有效活性成分的同时使其可以较方便的保存,本研究利用该技术制备羊膜提取液,4 ℃条件下保存用于PRK术后,进而评估其在抑制Haze方面的效果。
结果发现羊膜提取液蛋白质浓度高,保留了分子量相对较小的大分子物质更利于作用于术区,促进术后上皮愈合,减轻炎性反应和自由基反应。并将4 ℃条件下保存的羊膜提取液用于兔眼PRK术后,观察其抑制Haze形成及减小Haze程度中的作用。
本实验结果显示PRK术后,所有术眼均在术后1周开始出现程度不同的Haze,其发生率为100%,术后4周时Haze尤其明显,直至术后8周。实验组与对照组Haze等级情况进展比较缓慢,激素与羊膜提取液在抑制术后Haze形成作用上,有相似的正向作用(各时间点比较差异均无统计学意义)。与空白组相比较,实验组术后抑制Haze形成及进展速度作用明显,差异有统计学意义(P<0.05),表明羊膜提取液的存在可以起到一定的抑制Haze形成的作用。PRK术后早期,3组动物角膜上皮缺损均在术后3 d修复,且实验组角膜上皮愈合速度较其他2组快。3组动物均有结膜充血,多数结膜充血在术后3~5 d恢复,均未发生角膜上皮持续缺损、角膜溃疡等并发症。说明自制的羊膜提取液在有效抑制Haze的同时,无可见并发症的发生。且实验组术区病理检查显示,未发生明显的炎症反应。
3.4羊膜提取液在抑制Haze形成中起作用的可能机制羊膜含有Ⅳ型胶原质、层粘连蛋白、整合素等多种成分,可能促进正常上皮化,上皮细胞与基质细胞通过细胞因子的相互作用,可以抑制成纤维细胞形成。羊膜成分与上皮基底膜和Bowman膜成分极其相似,对于维持角膜正常结构和功能具有重要作用。它在促进术后上皮愈合,减轻炎性反应和自由基反应,保护角膜基质细胞免受凋亡,减少成纤维细胞增生及细胞外基质合成,减轻Haze的形成可能有作用[20-22]。
3.5本项实验的不足及进一步的研究方向本研究的初步结果表明自制羊膜提取液应用于兔眼PRK术后可在一定时期内有效抑制Haze的发生及程度。
本项研究还存在较多不足之处,本研究仅使用0.22 μm微孔滤膜过滤除菌,但不能排出潜在病毒感染的风险;如用于临床,一种较好的临床消毒方法有待进一步探讨。
参考文献:
[1]李秀文.准分子激光屈光性角膜手术学[M].北京:北京科学技术文献出版社,2000:114.
[2]Lee SH,Tseng SC.Amniotic membrane transplantation for persistent epithelial defects with ulceration[J].Am J Ophthalmol,1997,123(3):303-305.
[3]Tseng SC,Prabhasawat P,Lee SH.Amniotic membrane transplantation for conjunctival surface reconstruction[J].Am J Ophthalmol,1997,124(6):765-774.
[4]O’Brien TP,Li Q,Ashraf MF,et al.Inflammatory response in the early stages of wound healing after excimer laser keratectomy[J].Arch Ophthalmol,1998,116(11):1470-1474.
[5]Wilson SE,Kim WJ.Keratocyte apoptosis:implications on corneal wound healing,tissue organization,and disease[J].Ophthalmol Vis Sci,1998,39(22):220-226.
[6]Azar DT,Hahn TW,Jain S,et al.Matrix metalloproteinases are expressed during wound healing after excimer laser keratectomy[J].Cornea,1996,15(1):18-24.
[7]Helena MC,Baerveldt F,Kim JC,et al.Keratocyte apoptosis after corneal surgery[J].Invest Ophthalmol Vis Sci,1998,39(2):276-283.
[8]Li Q,Ashraf MF,Bekoe NA,et al.The role of apoptosis in the early corneal wound healing after excimer laser keratectomy in the rat[J].Graefes Arch Clin Exp Ophthalmol,2000,238(10):853-860.
[9]Wilson SE,Liang Q,Kim WJ.Lacrimal gland HGF,KGF and EGF mRNA levels increase after corneal epithelial wounding[J].Invest Ophthalmol Vis Sci,1999,40(10):2185-2190.
[10]Wilson SE,Liu JJ,Mohan RR.Stromal-epithelial interactions in the cornea[J].Prog Retin Eye Res,1999,18(3):293-309.
[11]张立军,张繁友,于春晶,等.高浓度大剂量糖皮质激素治疗LASEK术后严重Haze的临床效果[J].中国实用眼科杂志,2007,25(9):1122-1124.
[12]Weber BA,Gan L,Fagerholm PP,Short-term impact of corticosteroids on hyaluronan and epithelial hyperplasia in the rabbit cornea afa r photo refratectomy [J].Cornea,2001,20(4):321-324.
[13]You X,Bergmanson JP,Zheng XM,et al. Effect of corticosteroids on Rabbits corneal keratocytes after photorefractive keratectomy[J].Refract Surg,1995,11(6):460-467.
[14]Nassaralla BA,Szerenyi K,Wang XW,et al.Effect of diclofenac on corneal haze after photorefractive keratectomy in rabbits[J].Ophthalmology,1995,102 (3):469-474.
[15]Kim TI,Lee SY,PAK JH,et al.Mitomycin C,ceramide,and 5-fluorouraeil inhibit corneal haze and apoptosis after PRK [J].Cornea,2006,25(1):55-60.
[16]Bedei A,Marahotti A,Giannecchini I,et al.PRK in high myopic defects with or without intraoperative mitomycin C:1-year results [J].Eur J Ophthalmol,2006,16(2):229-234.
[17]周予兰,王保君,彭坤,等.LASEK术中应用丝裂霉素C预防Haze的临床观察[J].中国实用眼科杂志,2007,25(9):980-982.
[18]邓德向,袁小江,王凤娥.丝裂霉素C对高度近视患者EK术后Haze形成的影响[J].眼科新进展,2006,26(6):454-455.
[19]Carones F,Vigo L,Scandola E,et al.Evaluation of the prophylactic use of mitomycin-C to inhibit haze formation after photorefractive keratectomy[J].J Cataract Refract Surg,2002,28(12):2088-2095.
[20]康凤英,陶靖,李前进,等.准分子激光屈光性角膜切削术后兔角膜基质细胞凋亡及其防治的研究[J].中华眼科杂志,2002,38(7):433-437.
[21]Shimazaki J,Shinozaki N, Tsubota K.Transplantation of amniotic membrane and limbal autograft for patients with recurrent pterygium associated with symblepharon[J].Br J Ophthalmol,1998,82(3):235-240.
[22]张鹏举,胡燕华,黄琼,等.羊膜移植对家兔PRK术后伤口愈合作用的研究[J].眼外伤职业眼病杂志,2003,25(3):151-153.
Application of Self-made Amniotic Membrane Extraction in Rabbits after Photorefractive Keratectomy
ZHANG Bin
(Shenyang He Eye Hospital,Shenyang 110032,China)
AbstractObjective:To establish the model of photorefractive keratectomy(PRK) in rabbits,and to investigate the effect of self-made amniotic membrane extraction on corneal fog opacity(Haze) after PRK.Methods:The healthy human amniotic membrane was prepared according to the routine reference, epithelial cell was reserved,and to freeze thawing repeatedly and filter to obtain amniotic membrane extraction,then stored at the room temperature.A total of 54 eyes of 27 New Zealand white rabbits were operated by PRK in the same condition.All of the rabbits were randomly divided into experimental group,control group and blank group.There were 18 eyes of 9 rabbits in each group.Antibiotic eye drops were given for each group’s rabbits after PRK.Amniotic membrane extraction were given for experimental group’s rabbits,0.1% dexamethasone phosphate eye drops were given for control group’s rabbits and diluents bases without amniotic membrane extraction were given for blank group’s rabbits 48 h later.Postoperative clinical examine was done everyday.The Haze information was measured as the Fantes standard at 1,2,4,8 weeks.And 3 rabbits were selected randomly from each group for the pathologic examination,1 rabbit was killed in each group at 1,4,8 weeks after operation and extirpated the eyeball for pathologic observation,the information of the cornea,inflammatory cells and desmocyte were observed.Results:In the earlier period after PRK,the staining of cornea with fluorescein sodium in 3 groups were positive,but most of the corneal epithelium defection were repaired at 3 days after PRK.The incidence rate of Haze was 100% after PRK,all the eyes started to appear the Haze in 1 week after opertion,especially from 4 weeks to 8 weeks were severe.The degree of Haze in experimental group and control group were obviously less than the degree of Haze in blank group after operation(P<0.05).Conclusion:Amniotic membrane extraction has the role of promoting corneal epithelium recover,and can reduce the degree of Haze after PRK in rabbits.
Key wordsamniotic membrane extraction;corneal epithelium;photorefractive keratectomy;rabbits
收稿日期2015-06-16
doi:10.3969/j.issn.1008-2344.2015.04.003
中图分类号R779.63
文献标识码A
文章编号1008-2344(2015)04-0200-06
