二斑叶螨抗甲氰菊酯种群解毒酶基因表达分析
2016-01-27杨顺义岳秀利王进军刘长仲沈慧敏沈一凡郭金梅
杨顺义,岳秀利,王进军,刘长仲,沈慧敏*,沈一凡,郭金梅
(1.甘肃农业大学草业学院,草业生态系统省部共建教育重点实验室,中-美草地畜牧业可持续发展中心,甘肃 兰州 730070;
2.西南大学植物保护学院,昆虫学及害虫控制工程重点实验室,重庆400716)
二斑叶螨抗甲氰菊酯种群解毒酶基因表达分析
杨顺义1**,岳秀利1**,王进军2,刘长仲1,沈慧敏1*,沈一凡1,郭金梅1
(1.甘肃农业大学草业学院,草业生态系统省部共建教育重点实验室,中-美草地畜牧业可持续发展中心,甘肃 兰州 730070;
2.西南大学植物保护学院,昆虫学及害虫控制工程重点实验室,重庆400716)
摘要:基因mRNA水平相对表达量的显著变化是二斑叶螨对拟除虫菊酯类药剂产生抗性的重要机制。为了揭示二斑叶螨对甲氰菊酯抗性产生的解毒酶分子机理,本研究采用实时荧光定量PCR(quantitative real time PCR, qRT-PCR)方法分析二斑叶螨实验室敏感(SS)和田间种群(LZ-R、GN-R、WW-R、TS-R和LX-R)主要解毒酶谷胱甘肽转移酶(glutathione s-transferases, GSTs)、细胞色素P450单加氧酶(cytocheome P450 monooxygenases, P450s) 及羧酸酯酶(carboxyl/cholinesterases, CCEs)基因mRNA水平相对表达量的差异。结果表明,二斑叶螨不同种群不同解毒酶基因的相对表达量不同。WW-R和TS-R种群中TuGSTd05以及LX-R种群中TuGSTd01和 TuGSTd06基因表达量均显著上调,为SS种群的1.42~2.34倍,而GN-R种群中TuGSTd04,LZ-R种群中TuGSTd05 和GSTd09表达量显著下调,为SS种群的0.41~0.70倍;P450s基因CYP406A1 和CYP4CL1表达量在LZ-R、GN-R以及WW-R种群中均显著上调,分别为SS种群的1.80~4.88倍,此外,CYP387A1在LZ-R种群中显著上调2.19倍,而在LX-R种群中显著下调0.42倍;CCEs基因TuCCE-35表达量在WW-R和TS-R种群中显著上调,分别为SS种群的2.82和3.09倍,而TuCCE-36基因在所有种群中的表达量均不显著。二斑叶螨不同种群中解毒酶基因GSTs、P450s 和CCEs的显著上调或下调可能与甲氰菊酯的抗性形成有关。
关键词:二斑叶螨;甲氰菊酯; 解毒酶; 表达水平; qRT-PCR
DOI:10.11686/cyxb2014321http://cyxb.lzu.edu.cn
杨顺义, 岳秀利, 王进军, 刘长仲, 沈慧敏, 沈一凡, 郭金梅. 二斑叶螨抗甲氰菊酯种群解毒酶基因表达分析. 草业学报, 2015, 24(8): 150-158.
Yang S Y, Yue X L, Wang J J, Liu C Z, Shen H M, Shen Y F, Guo J M. Gene expression of a detoxification enzyme inTetranychusurticaeresistant to fenpropathrin. Acta Prataculturae Sinica, 2015, 24(8): 150-158.
收稿日期:2014-07-21;改回日期:2015-01-14
基金项目:公益性行业(农业)科研专项 (201103020)和国家自然科学基金项目(31260442)资助。
作者简介:杨顺义(1972-),男,甘肃礼县人,副教授,硕士。E-mail:yangshy@gsau.edu.cn。岳秀利(1988-),男,山东滕州人,硕士。E-mail:yuexiuli.01@163.com.**共同第一作者These authors contributed equally to this work.
通讯作者*Corresponding author. E-mail: ndshm@gsau.edu.cn
Gene expression of a detoxification enzyme inTetranychusurticaeresistant to fenpropathrin
YANG Shun-Yi1**, YUE Xiu-Li1**, WANG Jin-Jun2, LIU Chang-Zhong1, SHEN Hui-Min1*, SHEN Yi-Fan1, GUO Jin-Mei1
1.CollegeofPrataculture,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystemEducationMinistry,TheSino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.CollegeofPlantProtection,SouthwestUniversity,ChinaKeyLaboratoryofEntomologyandPestControlEngineering,Chongqing400716,China
Abstract:The variation of mRNA gene expression is an important pyrethroid insecticide resistance mechanism in Tetranychus urticae. To identify the molecular mechanism for producing detoxification enzymes in T. urticaein response to fenpropathrin, the mRNA expression levels of glutathione s-transferases (GSTs), cytochrome (P450s) and carboxyl/cholinesterases (CCEs) genes in laboratory fenpropathrin susceptible (SS), fenpropathrin resistant (Sp-R) and field strains (LZ-R, GN-R, WW-R, TS-R and LX-R) of T. urticae were measured using quantitative real time PCR (qRT-PCR). The results showed that relative expression levels of different detoxification enzyme genes varied with different strains of T. urticae. Compared with the SS strain, the expression levels of TuGSTd05 in the WW-R and TS-R strains, TuGSTd01 and TuGSTd06 in the LX-R strain were significantly up-regulated,1.42-2.34 times greater than the SS strain, while TuGSTd04 in the GN-Rstrain, TuGSTd05 and TuGSTd09 in the LX-R strain were significantly down-regulated, 0.41-0.70 that of the SS strain. The expression levels of P450s genes CYP406A1 and CYP4CL1 in the LZ-R, GN-R and WW-R strains were significantly up-regulated, 1.80-4.88 times that of the SS strain. The expression level of P450s genes CYP387A1 in the LZ-R strain was also significantly higher (2.19 times) than the SS strain whereas that in the LX-R strain was significantly lower (0.42 times) than the SS strain. Similarly, the expression levels of CCEs gene TuCCE-35 in the WW-R and TS-R strains was significantly higher than the SS strain. However, the gene expression levels of TuCCE-36 did not change in all strains. The significant up-regulation or down-regulation of detoxification enzyme genes (GSTs, p450s and CCEs) among different strains of T. urticae may be associated with the formation of resistance to fenpropathrin.
Key words:Tetranychus urticae; fenpropathrin; detoxification enzymes; expression level; qRT-PCR
二斑叶螨(Tetranychusurticae)是一种重要的杂食性世界害螨,除危害粮食作物、果树、花卉、蔬菜等以外,还可危害城市绿地植物及牧草等超过140科1100多种植物[1-3]。近年来,由于农药的大量且不合理使用,该物种对有机磷类、氨基甲酸酯类、拟除虫菊酯类等多种杀虫、杀螨剂的抗性发展十分迅速,并且产生了严重的抗性和交互抗性,被认为是节肢动物中最易产生抗性的害螨之一[4]。目前,二斑叶螨是甘肃省蔬菜和农作物上的第一大害螨,严重影响着农业经济的发展。
二斑叶螨对外源化合物解毒能力的增强是其对农药产生抗药性的重要机制。参与代谢抗性的解毒酶系主要包括谷胱甘肽转移酶(glutathione s-transferase, GSTs),细胞色素P450单加氧酶(cytocheome P450 monooxygenases, P450s) 及羧酸酯酶(carboxylesterases, CCEs)等。Van Leeuwen等[5-6]研究表明酯酶(esterases, ESTs)和P450s解毒能力的增强介导着田间二斑叶螨抗联苯菊酯种群高水平的抗药性,也可能是二斑叶螨对阿维菌素敏感性降低的重要抗性机理[7];Van Pottelberge等[8]报道二斑叶螨抗螺螨酯种群中GSTs活性显著增加,为敏感种群的2.5倍。在分子水平上,二斑叶螨对甲氰菊酯的靶标抗性研究也有所报道[9-10],而二斑叶螨基因组的成功测序[1]更是促进了其抗性分子机制研究。Demaeght等[11]研究报道在二斑叶螨田间抗性种群中,ESTs基因TuCCE04以及P450s基因CYP392E7和CYP392E10相对表达量均显著上调,并且螺螨酯能诱导CYP392E10基因的高表达,而CYP392E10基因对螺螨酯也有代谢作用。本实验室高新菊和沈慧敏[12]以及段辛乐等[13]从生理生化方面研究表明二斑叶螨对甲氰菊酯产生抗性可能与解毒酶活性的增强有关。因此,本实验在对甘肃地区5个二斑叶螨不同田间种群解毒酶活性研究的基础上,根据已报道的与二斑叶螨或昆虫抗性相关的关键解毒酶基因[11],选取了二斑叶螨GSTs、P450s以及CCEs中共14个基因,采用qRT-PCR的方法,从生理生化和分子水平深入探讨了其mRNA水平相对表达量的变化,旨在揭示二斑叶螨对甲氰菊酯产生抗性过程中主要解毒酶的分子机理,为二斑叶螨对拟除虫菊酯类农药的抗性治理提供理论依据。
1材料与方法
1.1 供试螨类
实验室种群:敏感种群(susceptible strain, SS),2007年6月采自甘肃省兰州市兴隆山国家级森林公园[12]。
田间种群:2012年8月采自甘肃省5个不同地区的二斑叶螨种群,分别为兰州种群(LZ-R)、甘南种群(GN-R)、武威种群(WW-R)、天水种群(TS-R)以及临夏种群(LX-R)。
二斑叶螨SS、LZ-R、GN-R、WW-R、TS-R、LX-R种群饲养在养虫室盆栽的豇豆(Vignaunguiculata)苗上。控制条件:温度(26±1)℃,相对湿度(75±5)%,光照14 h,黑暗10 h。
1.2 主要的试剂
考马斯亮蓝G-250(Fluka),牛血清蛋白(上海源聚生物科技有限公司),1-氯-2,4-二硝基苯(上海生工生物科技有限公司),还原性谷胱甘肽(上海生工生物科技有限公司),α-萘酚(天津光复精细化工研究所),固蓝B盐(上海源叶生物科技有限公司),RNA提取试剂盒RNeasy®Plus Micro Kit(Qiagen公司),反转录试剂盒PrimerScript®RT Reagent Kit Perfect Real time(Takara公司),荧光染料GoTaq®qPCR Master Mix(Promega公司)。
1.3 毒力测定方法
二斑叶螨不同种群对甲氰菊酯的毒力测定方法采用FAO[14]推荐的玻片浸渍法(slide-dip method)并加以改进。每个处理重复3次,分别计算出各种群致死中浓度(LC50),并以SS种群为对照,计算出LZ-R、GN-R、WW-R、TS-R和LX-R种群的抗性倍数,抗性倍数=抗性种群LC50/敏感种群LC50。
1.4 解毒酶活性分析
二斑叶螨不同种群的酶源蛋白含量测定参照Bradford[15]的方法,GSTs活性测定参照Clark等[16]的方法,P450s活性测定参照Hansen和Hodgson[17]的方法,CCEs活性测定参照Van Asperen[18]的方法。每个处理设3个重复和对照,采用酶标仪进行OD值的测定。
1.5 总RNA提取及第一链cDNA的合成
分别选取二斑叶螨SS、LZ-R、GN-R、WW-R、TS-R和LX-R共6个种群雌成螨约400头,按照RNeasy®Plus Micro Kit试剂盒说明书提取各种群总RNA。对总RNA进行1%的琼脂糖电泳胶电泳检测完整性。选取OD260/280在1.8~2.2之间的RNA反转录合成第一链cDNA,具体步骤参照PrimerScript®RT Reagent Kit Perfect Real time试剂盒说明书进行。
1.6 引物的设计
参照二斑叶螨在线基因组信息(http://bioinformatics.psb.ugent.be/orcae/overview/Tetur)设计用于GSTs、P450s及CCEs相关解毒酶基因qRT-PCR研究的引物,引物序列见表1。

表1 本研究所用的qRT-PCR定量引物及相关信息
注:“F”表示正向序列,“R”表示反向序列。
Note: “F” and “R” indicate forward and reverse sequence, respectively.
1.7 qRT-PCR分析
qRT-PCR反应体系为:10 μL荧光染料GoTaq®qPCR Master Mix,7 μL 双蒸水,上下游引物各1 μL,cDNA模版1 μL。反应条件为:95℃预变性2 min;然后95℃变性15 s,60℃退火30 s,72℃延伸15 s共40个循环;最后60℃到95℃为熔解曲线过程。然后将cDNA模板按1∶3梯度稀释成5个浓度梯度进行标准曲线分析,并计算不同引物的扩增效率(表1)。对照用已经处理过的灭菌水代替cDNA模板当做空白对照,每个处理3次重复。
1.8 数据统计与分析
采用DPS 6.05软件对二斑叶螨LZ-R、GN-R、WW-R、TS-R和LX-R种群的酶活性进行单因素方差分析,并用Duncan新复极差法(DMRT,P<0.05)进行多重比较;采用比较Ct值的方法[19],以SS种群的相对表达量为对照样品,分别计算其不同种群解毒酶基因相对表达量的差异,利用SPSS 19.0软件对数据进行独立样本t检验(Independent-samplestTest,P<0.05)。
2结果与分析
2.1 二斑叶螨不同种群抗性倍数测定
二斑叶螨不同地理种群的采集信息及生物测定结果如表2所示,相对于SS种群,在田间采集的5个种群中,GN-R的抗性倍数最大,达到60.53倍,而LZ-R,WW-R,TS-R和LX-R种群的抗性倍数相对较低,为22.50~27.38倍。
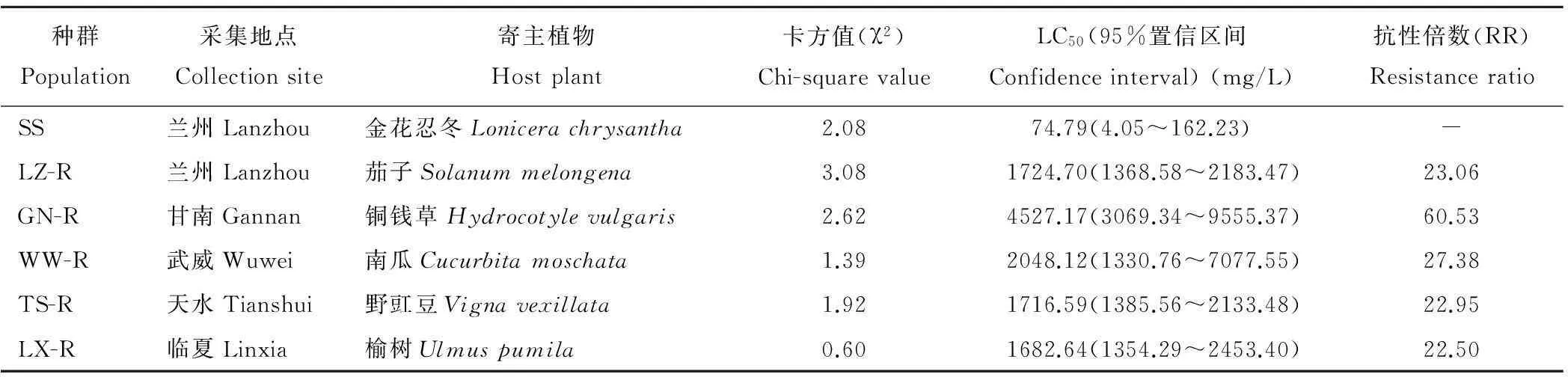
表2 二斑叶螨所有种群来源及抗性倍数
2.2 二斑叶螨不同种群解毒酶活性的变化
2.2.1不同种群GSTs活性测定结果GSTs活性测定结果见表3。对田间采集的5个种群及室内SS种群GSTs总活力进行比较,发现TS-R种群GSTs总活力最高,为1.62 μmol/min;GN-R种群GSTs总活力最低,为0.72 μmol/min;与SS种群相比,LZ-R和GN-R种群的总活力均低于SS种群;而其他种群GSTs总活力显著高于SS种群(P<0.05)。
TS-R和LX-R种群GSTs比活力分别为1331.69和1342.56 μmol/(mg·min),彼此之间差异不显著,但显著高于SS种群,为SS种群的1.34和1.35倍。同SS种群相比,LZ-R、GN-R和WW-R种群的GSTs比活力没有显著变化(P>0.05)。
2.2.2不同种群P450s活性测定结果P450s活性测定结果见表4。TS-R种群P450s总活力和比活力最高,分别为0.0020 nmol/min和0.0109 nmol/(mg·min);LZ-R种群的总活力和比活力最低,分别为0.0013 nmol/min和0.0074 nmol/(mg·min)。DMRT分析显示,TS-R种群P450s比活力显著高于其他种群,其中与SS种群的相对比值为1.47;而其他田间种群与SS种群相比差异不显著(P>0.05)。
2.2.3不同种群CCEs活性测定结果CCEs活性测定结果见表5。与SS种群相比,5个田间种群的CCEs总活力和比活力均有显著性升高,而田间5个种群之间的总活力和比活力差异不显著(P>0.05)。CCEs总活力从大到小依次为:LZ-R种群、LX-R种群、WW-R种群、TS-R种群、GN-R种群、SS种群,但TS-R种群的CCEs的比活力在5个田间种群中最低,为18.75 nmol/(mg·min)。LZ-R种群、GN-R种群、WW-R种群、TS-R种群和LX-R种群CCEs比活力同SS种群的相对比值分别为1.56,1.36,1.45,1.33和1.44。

表3 二斑叶螨不同地理种群GSTs活性测定
注:同列数据后标注不同小写字母代表存在显著性差异(Duncan新复极差法,P<0.05)。下同。
Note: Data followed by different letters within the same column indicate significantly different at 0.05 level by using the method of Duncan’s multiple range test. The same below.

表4 二斑叶螨不同地理种群P450s活性测定

表5 二斑叶螨不同地理种群CCEs活性测定
2.3 二斑叶螨不同种群解毒酶基因相对表达量的变化
2.3.1不同种群GSTs基因相对表达量的测定以α-tubulin为内参基因[20],分析二斑叶螨不同种群Delta家族GSTs基因TuGSTd01、TuGSTd04、TuGSTd05、TuGSTd06、TuGSTd09和TuGSTd16 mRNA水平相对表达量,敏感种群的表达量默认为1,结果如图1所示。TuGSTd01表达量在LX-R种群中显著升高,为SS种群的1.63倍;TuGSTd05表达量在WW-R和TS-R种群中显著升高1.42和1.49倍,而在LZ-R种群中却显著降低;TuGSTd06表达量在LX-R种群中显著升高2.34倍;TuGSTd04 和TuGSTd09表达量分别在GN-R种群和LZ-R种群中显著降低,分别为SS的0.41和0.46倍;TuGSTd16的表达量在所有种群中没有显著变化。

图1 二斑叶螨不同种群GSTs基因相对表达量Fig.1 The GSTs gene relative expression levels in different strains of T. urticae “*”表示显著水平(P<0.05);“**”表示极显著水平(P<0.01)。“*” and “**”indicate significantly correlation at the level of 0.05 and 0.01 respectively. 下同。The same below.
2.3.2不同种群P450s基因相对表达量的测定
二斑叶螨不同种群P450s基因相对表达量的结果如图2 所示,CYP406A1、CYP4CL1和CYP387A1基因属于CYP4家族,CYP392A6、CYP392D8和CYP392E10基因属于CYP2家族。CYP406A1 和CYP4CL1表达量在LZ-R、GN-R以及WW-R种群中均显著升高,分别为SS种群的2.82,1.85,3.37和4.88,1.80,3.88倍,CYP387A1表达量在LZ-R种群中显著升高2.19倍,但在LX-R种群中却显著下调0.42倍;然而,CYP2家族的3个基因在所有的种群中均没有显著的变化。
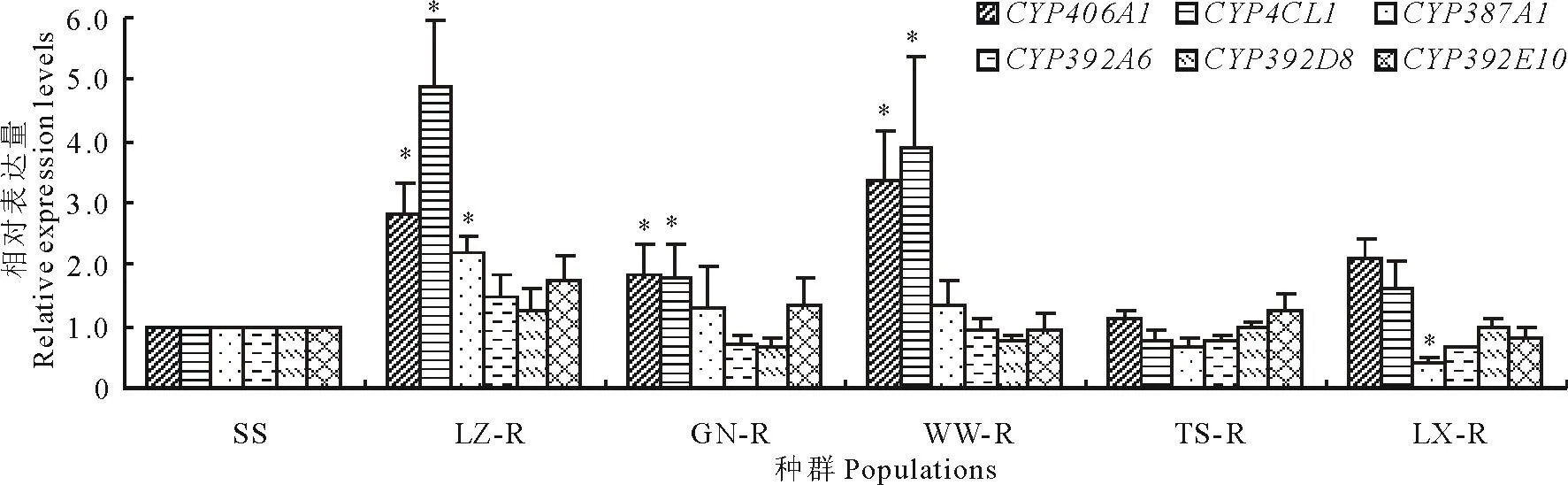
图2 二斑叶螨不同种群P450s基因相对表达量Fig.2 The P450s gene relative expression levels in different strains of T. urticae
2.3.3不同种群CCEs基因相对表达量的测定二斑叶螨不同种群CCEs基因相对表达量的结果如图3 所示,TuCCE-35和TuCCE-36基因均属于羟基胆碱酯酶。在所有种群中,只有WW-R和TS-R种群的TuCCE-35基因表达量显著升高,为SS种群的2.82和3.09倍,在LX-R种群中更是达到了5.05倍,但差异不显著;TuCCE-36基因在所有种群中的表达量均不显著。

图3 二斑叶螨不同种群CCEs基因相对表达量Fig.3 The CCEs gene relative expression levels in different strains of T. urticae
3讨论
代谢抗性是害螨(昆虫)对杀螨(虫)剂敏感性降低的重要抗性机制,而涉及与代谢抗性相关的主要解毒酶类包括GSTs、P450s和CCEs等。本研究通过对田间5个不同种群主要解毒酶活性的分析,发现解毒酶活性的高低与各地理种群的抗性水平之间没有明显的相关性,但与室内SS种群相比,TS-R和LX-R种群GSTs比活力、TS-R种群P450s比活力以及所有田间种群CCEs的比活力均显著升高(P<0.05),这与本实验室前期研究发现二斑叶螨对甲氰菊酯抗性的产生与相应的解毒酶活力增强有关结果一致[12]。Van Pottelberge等[8]通过酶活测定发现酯酶、GSTs和P450s参与了对螺螨酯的解毒代谢。同样,解毒酶活性的增强在Tirello等[21]研究二斑叶螨抗吡螨胺、阿维菌素等种群中也有相关报道。Niu等[22]在研究柑橘全爪螨(Panonychuscitri)9个不同地理种群与哒螨灵敏感性中发现,GSTs参与了其对哒螨灵的田间抗性。He等[23]在研究朱砂叶螨(Tetranychuscinnabarinus)对阿维菌素的抗性机制中也发现3种解毒酶解毒活力的增强在其抗性发展过程中起着重要作用。Zhong等[24]指出中华按蚊(Anophelessinensis)对溴氰菊酯的抗性产生与靶标击倒抗性和P450s的活性有关,并且P450s的作用尤为明显。随着现代分子生物学的快速发展,对害螨及昆虫抗药性相关的GSTs、P450s和CCEs的研究已逐步深入到基因表达及功能上。本研究qRT-PCR结果也表明不同田间种群GSTs、P450s和CCEs各家族部分基因的表达量有所升高,与生理生化水平上对解毒酶的活性变化研究结果基本一致。Demaeght等[11]采用基因芯片技术比较了二斑叶螨敏感和抗螺螨酯种群,发现CCEs、P450s以及脂笼蛋白基因表达量均显著的上调,其中CYP392E10在催化代谢螺螨酯的过程中起着关键作用。Riveron等[25]研究不吉库蚊(Anophelesfunestus)对氯菊酯抗性的产生主要是由于CYP6P9a和CYP6P9b基因的过量表达引起的,功能分析表明重组的CYP6P9b蛋白对I型和II型的拟除虫菊酯类农药均有代谢作用。
目前,随着二斑叶螨基因组的成功测序[1],其靶标抗性[26]和代谢抗性的研究逐渐上升到分子水平研究领域,极大地促进了害螨的防治及抗性治理[27],并且基于高通量测序的转录组分析[28]和全基因组[29]分析在其他物种作用机制的研究中也逐渐得到大量应用。然而,二斑叶螨基因组中有32个GSTs,86个P450s及 71个CCEs基因[1],本试验只是研究了其中的14个解毒基因,虽然结果不能反应全部解毒酶家族mRNA表达水平的变化,但是为进一步研究二斑叶螨抗甲氰菊酯解毒酶的分子机理提供了依据。
本研究分别从生理生化水平和分子水平分析二斑叶螨不同地理种群GSTs、P450s和CCEs超家族酶的活性变化及基因的表达差异,发现抗性种群GSTs、P450s和CCEs的活性和基因表达量均发生不同程度的变化。GSTs基因TuGSTd01、TuGSTd04、TuGSTd05、TuGSTd06和TuGSTd09,P450s基因CYP406A1、CYP4CL1和CYP387A1以及CCEs基因TuCCE-35基因表达的显著上调或下调可能参与了抗性的分子解毒作用,与二斑叶螨对甲氰菊酯的抗性形成有关。
References:
[1]Grbic M, Van Leeuwen T, Clark R M,etal. The genome ofTetranychusurticaereveals herbivorous pest adaptations. Nature, 2011, 479(7374): 487-492.
[2]Zhang T W, Shen H M, Qian X J,etal. Effects ofTetranychusurticaefeeding on the chlorophyll content and two kinds of protective enzyme of white clover. Chinese Journal of Applied Entomology, 2013, 50(2): 395-400.
[3]He D H, Zhao X P, Jin Q H,etal. Dispersion of two spotted spider mite,TetranychusurticaeKoch, and its selection of host plants on farmland in Ningxia. Chinese Journal of Applied and Environmental Biology, 2001, 7(5): 447-451.
[4]Van Leeuwen T, Vontas J, Tsagkarakou A,etal. Acaricide resistance mechanisms in the two-spotted spider miteTetranychusurticaeand other important Acari: A review. Insect Biochemistry and Molecular Biology, 2010, 40(8): 563-572.
[5]Van Leeuwen T, Tirry L. Esterase-mediated bifenthrin resistance in a multiresistant strain of the two-spotted spider mite,Tetranychusurticae. Pest Management Science, 2007, 63(2): 150-156.
[6]Van Leeuwen T, Van Pottelberge S, Tirry L. Comparative acaricide susceptibility and detoxifying enzyme activities in field-collected resistant and susceptible strains ofTetranychusurticae. Pest Management Science, 2005, 61(5): 499-507.
[7]Yorulmaz S, Ay R. Multiple resistance, detoxifying enzyme activity, and inheritance of abamectin resistance inTetranychusurticaeKoch (Acarina: Tetranychidae). Turkish Journal of Agriculture and Forestry, 2009, 33(4): 393-402.
[8]Van Pottelberge S, Van Leeuwen T, Khajehali J,etal. Genetic and biochemical analysis of a laboratory-selected spirodiclofen-resistant strain ofTetranychusurticaeKoch (Acari: Tetranychidae). Pest Management Science, 2009, 65(4): 358-366.
[9]Kwon D H, Clark J M, Lee S H. Cloning of a sodium channel gene and identification of mutations putatively associated with fenpropathrin resistance inTetranychusurticae. Pesticide Biochemistry and Physiology, 2010, 97(2): 93-100.
[10]Tsagkarakou A, Van Leeuwen T, Khajehali J,etal. Identification of pyrethroid resistance associated mutations in the para sodium channel of the two-spotted spider miteTetranychusurticae(Acari: Tetranychidae). Insect Molecular Biology, 2009, 18(5): 583-593.
[11]Demaeght P, Dermauw W, Tsakireli D,etal. Molecular analysis of resistance to acaricidal spirocyclic tetronic acids inTetranychusurticae:CYP392E10 metabolizes spirodiclofen, but not its corresponding enol. Insect Biochemistry and Molecular Biology, 2013, 43(6): 544-554.
[12]Gao X J, Shen H M. Resistance selection of fenpropathrin and the change of detoxification enzyme activities inTetranychusurticaeKoch (Acari: Tetranychidae). Acta Entomologica Sinica, 2011, 54(1): 64-69.
[13]Duan X L, Zhang Z G, Gao X J,etal. Selection ofTetranychusurticaeresistant to fenpropathrin and spirodiclofen and the synergistic action of the synergists to the resistant population. Plant Protection, 2011, 37(5): 106- 109.
[14]Dittrich V, Cranham J E, Jepson L R,etal. Revised method for spider mites and their eggs (egTetranychusspp. andPanonychusulmiKoch). FAO Method No. 10a. FAO Plant Production and Protection Paper, 1980, 21: 49-53.
[15]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72(1): 248-254.
[16]Clark A G, Dick G L, Smith J N. Kinetic studies on a glutathione S-transferase from the larvae ofCostelytrazealandica. Biochemical Journal, 1984, 217(1): 51-58.
[17]Hansen L G, Hodgson E. Biochemical characteristics of insect microsomes: N-and O-demethylation. Biochemical Pharmacology, 1971, 20(7): 1569-1578.
[18]Van Asperen K. A study of housefly esterases by means of a sensitive colorimetric method. Journal of Insect Physiology, 1962, 8(4): 401-416.
[19]Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): 2002-2007.
[20]Gao X J. Resistance Molecular Mechanism ofTetranychusurticae(Koch) to Fenpropathrin[D]. Lanzhou: Gansu Agricultural University, 2012.
[21]Tirello P, Pozzebon A, Cassanelli S,etal. Resistance to acaricides in Italian strains ofTetranychusurticae: toxicological and enzymatic assays. Experimental and Applied Acarology, 2012, 57(1): 53-64.
[22]Niu J Z, Liu G Y, Dou W,etal. Susceptibility and activity of glutathione S-transferases in nine field populations ofPanonychuscitri(Acari: Tetranychidae) to pyridaben and azocyclotin. Florida Entomologist, 2011, 94(2): 321-329.
[23]He L, Xue C H, Wang J J,etal. Resistance selection and biochemical mechanism of resistance to two Acaricides inTetranychuscinnabarinus(Boiduval). Pesticide Biochemistry and Physiology, 2009, 93(1): 47-52.
[24]Zhong D B, Chang X L, Zhou G F,etal. Relationship between knockdown resistance, metabolic detoxification and organismal resistance to pyrethroids inAnophelessinensis. PLoS ONE, 2013, 8(2): 1-10.
[25]Riveron J M, Irving H, Ndula M,etal. Directionally selected cytochrome P450 alleles are driving the spread of pyrethroid resistance in the major malaria vector Anopheles funestus. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(1): 252-257.
[26]Yang S Y, Yue X L, Wang J J,etal. Testing two methods to detect voltage-gated sodium channels gene mutation inTetranychusurticae. Acta Prataculturae Sinica, 2014, 23(5):153-160.
[27]Van Leeuwen T, Dermauw W, Grbic M,etal. Spider mite control and resistance management: does a genome help. Pest Management Science, 2013, 69(2): 156-159.
[28]Jia X P, Ye X Q, Liang L J,etal. Transcriptome characteristics ofPaspalumvaginatumanalyzed with Illumina seguencing technology. Acta Prataculturae Sinica, 2014, 23(6): 242-252.
[29]Zhang J, Song L L, Guo D L,etal. Genome-wide identification and investigation of the MADS-box gene family inMedicagotruncatula. Acta Prataculturae Sinica, 2014, 23(6): 233-241.
参考文献:
[2]张廷伟, 沈慧敏, 钱秀娟, 等. 二斑叶螨刺吸胁迫对白三叶叶绿素含量和两种保护酶的影响. 应用昆虫学报, 2013, 50(2): 395-400.
[3]贺达汉, 赵晓萍, 靳巧红, 等. 宁夏地区二斑叶螨的寄主植物选择及其季节转移. 环境与应用生物学报, 2001, 7(5): 447-451.
[12]高新菊, 沈慧敏. 二斑叶螨对甲氰菊酯的抗性选育及解毒酶活力变化. 昆虫学报, 2011, 54(1): 64-69.
[13]段辛乐, 张志刚, 高新菊, 等. 二斑叶螨对甲氰菊酯和螺螨酯的抗性选育及增效剂的增效作用. 植物保护, 2011, 37(5): 106-109.
[20]高新菊. 二斑叶螨对甲氰菊酯的抗性机理研究[D]. 兰州:甘肃农业大学, 2012.
[26]杨顺义, 岳秀利, 王进军, 等. 两种方法在二斑叶螨电压门控钠离子通道基因突变检测中的应用. 草业学报, 2014, 23(5):153-160.
[28]贾新平, 叶晓青, 梁丽建, 等. 基于高通量测序的海滨雀稗转录组学研究. 草业学报, 2014, 23(6):242-252.
[29]张军, 宋丽莉, 郭东林, 等. MADS-box基因家族在蒺藜苜蓿的全基因组分析. 草业学报, 2014, 23(6):233-241.
