酸、铝胁迫对苜蓿种子发芽和幼苗生长的影响
2016-01-27杨丹娜骆夜烽谢家琪张钦杨烈
杨丹娜,骆夜烽,谢家琪,张钦,杨烈*
(1.安徽农业大学农学院,安徽 合肥 230036;2.安徽农业大学林学与园林学院,安徽 合肥 230036)
酸、铝胁迫对苜蓿种子发芽和幼苗生长的影响
杨丹娜1,骆夜烽2,谢家琪1,张钦1,杨烈1*
(1.安徽农业大学农学院,安徽 合肥 230036;2.安徽农业大学林学与园林学院,安徽 合肥 230036)
摘要:本试验采用水培法,以金皇后品种的紫花苜蓿为材料,探讨了酸(pH 3.0,4.5,6.0,7.5)、Al3+(0,50,100,200 mg/L)胁迫处理对苜蓿种子发芽和幼苗生长的影响。结果表明,随着酸度的增加对苜蓿种子发芽和幼苗生长的抑制作用增强,微酸(pH 6.0)环境下几乎没有抑制作用,甚至有促进作用。溶液铝含量在0,50 mg/L时,苜蓿生长正常,发芽率、发芽势、发芽指数、茎长、根长等均明显高于其他处理(P<0.05);当铝含量在100~200 mg/L时,苜蓿种子发芽和幼苗生长受到严重抑制,发芽率、发芽势、发芽指数、茎长、根长等均显著低于(P<0.05)其他处理。酸、铝共同胁迫对苜蓿种子发芽和幼苗生长的影响大于单一胁迫对它的影响,当pH<4.5、Al3+浓度达到50 mg/L以上时,即可对苜蓿芽苗的生长产生明显的抑制作用。
关键词:苜蓿;酸胁迫;铝胁迫;种子发芽;幼苗生长
DOI:10.11686/cyxb2014362http://cyxb.lzu.edu.cn
杨丹娜,骆夜烽,谢家琪,张钦,杨烈. 酸、铝胁迫对苜蓿种子发芽和幼苗生长的影响. 草业学报, 2015, 24(8): 103-109.
Yang D N, Luo Y F, Xie J Q, Zhang Q, Yang L. Effects of acidity and/or aluminum stress on seed germination and seedling growth of alfalfa. Acta Prataculturae Sinica, 2015, 24(8): 103-109.
收稿日期:2014-08-26;改回日期:2014-10-15
基金项目:国家自然科学基金(31101760,31360579),安徽省高等教育省级振兴计划项目“作物学科高水平教师团队建设”,安徽省省级学科建设重大项目-草学(皖教秘科[2014]28号)和安徽农业大学2014年度“学科骨干培育计划”资助。
作者简介:杨丹娜(1989-),女,浙江台州人,在读硕士。E-mail:yangdanna1989@163.com
通讯作者*Corresponding author. E-mail:yanglie2000@163.com
Effects of acidity and/or aluminum stress on seed germination and seedling growth of alfalfa
YANG Dan-Na1, LUO Ye-Feng2, XIE Jia-Qi1, ZHANG Qin1, YANG Lie1*
1.AgronomyCollege,AnhuiAgriculturalUniversity,Hefei230036,China; 2.SchoolofForestryLandscapeArchitecture,AnhuiAgriculturalUniversity,Hefei230036,China
Abstract:Alfalfa seeds (cv.Golden empress) were treated with acidic (pH 3.0, 4.5, 6.0, 7.5) and aluminum (0, 50, 100, 200 mg/L Al3+) solutions to study the effects of pH and Al3+stresses on seed germination and seedling growth. The results showed that acidity significantly inhibited germination and seedling growth of alfalfa; lower pH had a greater effect than higher pH. Germination rate, germination potential, germination index, stem length and root length of untreated seeds (control) and seeds treated with 50 mg/L Al3+were significantly higher (P<0.05) than all other treatments. Germination and seedling growth were seriously reduced by higher Al3+treatments (100 mg/L or 200 mg/L) which resulted in a significant decrease in the growth index (P<0.05). The combination of acidity and aluminum stress on germination and seedling growth of alfalfa were greater than those of either stress in isolation. Even the treatment of pH<4.5 and Al3+>50 mg/L had a significant negative effect on seed germination and growth.
Key words:alfalfa; acid stress; aluminum stress; germination; seedling growth
紫花苜蓿(Medicagosativa)是豆科苜蓿属深根性多年生优质豆科牧草,有“牧草之王”的称号,也是改良土壤、保持水土的重要植物[1]。由于国内畜牧业的发展,近年来我国苜蓿的种植面积不断扩大,但主要集中在北方地区,而南方地区种植面积相对较少。究其原因,主要由于紫花苜蓿适应在中性至微碱性土壤上种植,不适应强酸、强碱性土壤。2000年初,我国酸性土壤总面积为2.03×107hm2,占全国土地总面积的21%[2],长江以南的热带和亚热带地区,红黄壤土地占很大面积,土壤呈酸性,具有脱硅富铝化的成土过程[3],造成铝毒害增强。铝是地壳中含量最丰富的金属元素,占其质量的7%左右。在自然条件下,它主要以铝硅酸盐形式存在,生物可利用性很小。近年来由于农业化肥的使用及酸雨影响,使土壤酸化,铝的溶出增加[4],可溶性铝的浓度上升,而多数植物对铝又极为敏感,使得铝成为酸性土壤中抑制植物生长的一个重要因素[5]。高浓度铝对植物的生长发育造成很大威胁,在微克分子量下60 min内即能抑制根系的生长[6],根系是植物吸收、转化和储藏养分的重要器官,它的生长发育状况直接影响地上生物量;同时根茎也是产生枝条的重要部位,直接影响苜蓿生产性能和可持久性利用,如再生性、耐寒性、抗旱性和抗病性等[7-8],因此目前紫花苜蓿的种植面积在南方地区并不大[1]。
目前国内外对于苜蓿的研究较多,但对耐酸铝性等方面研究较少。国内外相关研究发现铝毒对植物根系的毒害最初的表现是抑制根的伸长和根毛的形成[6],而南丽丽等[8]研究发现不同根型苜蓿的根系特性差异明显;罗献宝[9]以pH 4.5条件为基础,对酸铝胁迫下苜蓿初生根的影响进行了研究,结果发现,3 μmol/L铝处理8 h对初生根伸长的抑制率超过50%;李智燕等[10]研究铝和酸胁迫对苜蓿根瘤菌生长和抗氧化酶系的影响,发现天蓝苜蓿根瘤菌较之紫花苜蓿根瘤菌有较强的耐酸、耐铝性;Mary等[11]采用RFLP(restriction fragment length polymorphism,限制性内切酶片段长度多态性)技术对二倍体紫花苜蓿耐铝性进行QTL定位,获得了4个(UGAC782,UGAC141,UGAC44,UGAC053)和耐铝性有关的标记。
种子萌发是植物生活史中的关键过渡阶段(从种子到幼苗),它决定着植物萌发后所面临的生存环境和自然选择压力[12]。目前酸铝综合胁迫对紫花苜蓿萌发和幼苗生长发育的研究尚未见报道。本试验以供试的金皇后品种的紫花苜蓿种子为材料,研究酸、铝胁迫对苜蓿发芽及幼苗和茎生长特性的影响,以期能够为南方酸性土壤环境下紫花苜蓿栽培提供理论依据和参考。
1材料与方法
1.1 供试材料
1.1.1种子供试的紫花苜蓿种子品种为金皇后,由安徽省畜牧推广总站提供。
1.1.2化学试剂用浓H2SO4、硝酸铝、蒸馏水配制出16个不同溶液以供试验,分别为pH 3.0对应Al3+浓度0,50,100,200 mg/L;pH 4.5对应Al3+浓度0,50,100,200 mg/L;pH 6.0对应Al3+浓度0,50,100,200 mg/L和pH 7.5对应Al3+浓度0,50,100,200 mg/L。
1.2 方法
1.2.1种子萌发试验试验于2013年9月在安徽农业大学草业科学试验基地的温室内进行。挑选颗粒均一且饱满的种子,经0.2%的高锰酸钾溶液消毒5 min后用蒸馏水冲洗干净。用不同浓度的酸铝浸种12 h,然后转移到铺有两层滤纸的干净培养皿中,每个处理滴加等量的混合液 (对应pH值和铝离子浓度), 至基质湿润即可, 每天观察时对应加等量的混合液, 保持基质湿润。置于温室下培养10 d,取样测定分析。每个处理100 粒种子,重复 3 次。室内环境设置为25℃恒温,光照8 h。
1.2.2测量指标参照《GB/T3543-1995农作物种子检验规程》[13]。于种子放入培养皿中发芽开始,每天定时观察种子发芽和幼苗生长的情况,并记录每天发芽的种子数(芽长为种子的50%),发芽率按10 d计算。按毕辛毕等[14]的方法计算和测定如下:
发芽率(GR)=∑Gt/T×100%
发芽势(GP)=∑Gt′/T×100%
发芽指数(GI)=∑Gt/Dt
活力指数(VI)=GI×S
式中,Gt为10日内的发芽数,T为供试种子数,Gt′为4日内的发芽数,Dt为发芽的日数,S为单株幼苗平均鲜重。
根、茎长:种子发芽第10天,从每个培养皿中随机取出10株,用游标卡尺测定并记录,计算单株平均值。
鲜重:种子发芽第10天,从每个培养皿中随机取出10株,测量并记录10株幼苗的重量,计算单株均值。
实验室中用相关仪器测量每个培养皿中种子发芽10 d后植株的叶绿素含量(乙醇提取法)[15]、丙二醛含量(分光光度法)[15]和过氧化物酶POD活性(愈创木酚法)[15]。
1.3 数据分析
采用Excel和DPS 7.05软件的新复极差法进行相关数据分析。
2结果与分析
2.1 酸胁迫对紫花苜蓿种子活力与幼苗生长的影响
2.1.1酸胁迫对紫花苜蓿种子发芽的影响由表1可知,金皇后品种的紫花苜蓿种子的发芽率、发芽势、发芽指数和活力指数基本上随pH的降低而降低。在溶液浓度pH 6.0和7.5时,苜蓿种子的发芽率等发芽指标基本相同,其次为溶液浓度pH 4.5,pH 3.0为最低。其中pH 3.0处理显著低于pH 4.5,6.0,7.5处理(P<0.05),而pH 4.5,6.0和7.5处理间差异不显著(P>0.05)。
2.1.2酸胁迫对紫花苜蓿幼苗生长的影响金皇后幼苗的茎长随着pH的降低而降低(表1),其长度顺序为pH 7.5=6.0(均为2.19 cm)>4.5(2.04 cm)>3.0(1.94 cm),但处理间差异均不显著(P>0.05)。金皇后幼苗根长在pH 6.0处理时最长(2.06 cm),pH 7.5时次之(1.95 cm),均显著高于pH 3.0处理(0.75 cm,P<0.05)。金皇后幼苗鲜重随着pH的降低而降低(表1),在pH 6.0(0.025 g)和pH 7.5处理(0.025 g)时最重,pH 4.5处理次之(0.023 g),三者间差异不显著,但pH 6.0,7.5处理均显著高于pH 3.0处理(0.020 g,P<0.05)。
综上所述,酸胁迫抑制了紫花苜蓿幼苗的生长,对幼苗根长、鲜重的影响比茎长大。
2.1.3酸胁迫对紫花苜蓿幼苗生理指标的影响总体而言,金皇后品种的苜蓿幼苗叶绿素含量、POD活性随溶液pH的降低而降低,MDA含量随pH的降低而升高(表1)。其中pH 7.5处理的叶绿素含量比pH 3.0高0.69 mg/g,比pH 3.0处理高77.53%,差异极显著(P<0.01)。幼苗丙二醛含量随着pH的降低而升高,溶液pH 3.0和4.5差异不显著(P>0.05),pH 6.0,7.5差异不显著(P>0.05),但pH 3.0处理显著高于pH 6.0,7.5(P<0.05)。幼苗POD活性大小顺序为溶液pH 6.0>7.5>4.5>3.0。
综上所述,苜蓿种子发芽和幼苗生长基本表现为:随着酸性的增强抑制作用越强。微碱(pH 7.5)和微酸(pH 6.0)条件下各类指标较为接近,且明显优于其他两组酸性溶液,在pH 4.5时下降较慢,而当pH 3.0时下降较快;说明微酸性环境对于紫花苜蓿种子发芽和幼苗生长的抑制作用很小,个别指标甚至高于pH 7.5处理。当pH低于4.5时其抑制作用逐渐表现出来,并随酸度的增强而加强。
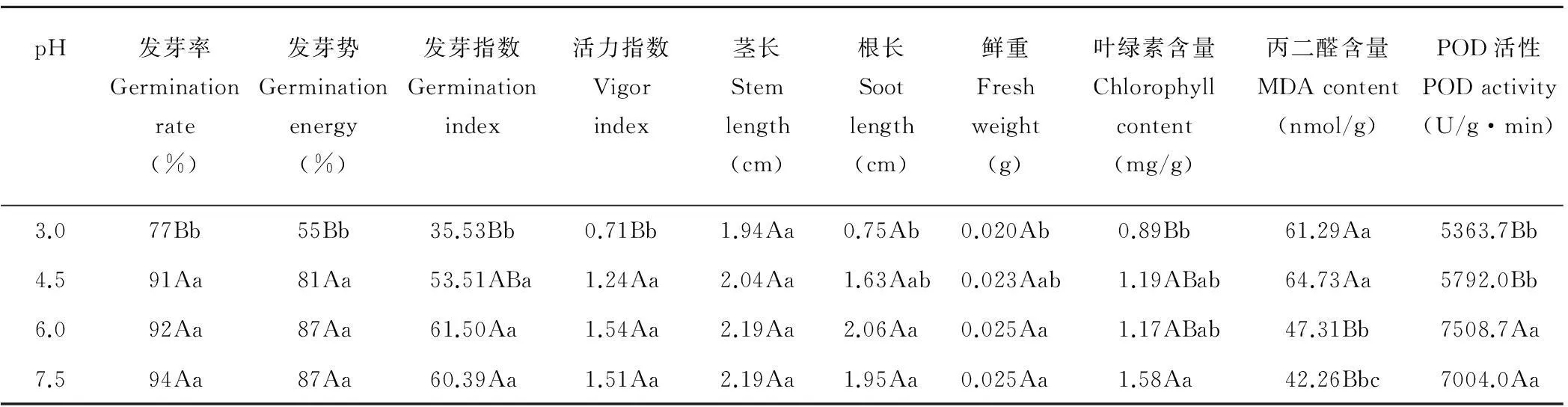
表1 酸胁迫对种子发芽和幼苗生长的影响
注:表中同列小写和大写字母分别表示在0.05和0.01水平上差异显著,下同。
Note: Different capital and lowercase letters in the same columns represent significant difference atP<0.01 andP<0.05 level respectively, the same below.
2.2 铝胁迫对紫花苜蓿种子活力和幼苗生长的影响
2.2.1铝胁迫对紫花苜蓿种子发芽的影响由表2可知,随着Al3+浓度的增加,金皇后种子发芽受害程度也随之增加。金皇后品种的发芽率、发芽势、发芽指数和茎长在Al3+浓度为0,50 mg/L时差异不显著(P>0.05),但0 mg/L处理的活力指数则均显著高于50 mg/L处理(P<0.05),同时二者处理的所有指标均显著高于100和200 mg/L处理(P<0.05)。可见Al3+浓度为0,50 mg/L对苜蓿发芽没有显著影响,Al3+浓度为100 mg/L时铝毒害作用显著显现,Al3+浓度为200 mg/L时铝毒害作用迅速加强,严重影响种子的发芽。
2.2.2铝胁迫对紫花苜蓿幼苗生长的影响从表2可知,金皇后幼苗生长受抑制程度随着Al3+浓度的增加而增加。金皇后苜蓿的幼苗茎长在Al3+浓度为0 mg/L处理最长(2.10 cm),Al3+浓度为50 mg/L处理次之(1.98 cm),二者差异不显著(P>0.05),但显著长于其他两组高Al3+浓度处理(P<0.05)(表2),其中浓度为200 mg/L处理最短(0.74 cm)。根长和鲜重随Al3+浓度增加而显著下降,且处理间差异均显著(P<0.05)。其中根长在Al3+浓度为0 mg/L处理时最长(1.60 cm),200 mg/L处理最短(0.19 cm);鲜重在铝胁迫条件下均差异显著(P<0.05),在Al3+浓度为0 mg/L处理时最重(0.0230 g),50 mg/L处理次之(0.0196 g),200 mg/L处理最轻(0.0124 g)。
以上数据还表明幼苗根长和鲜重对Al3+浓度的变化较为敏感,铝毒害对根长影响更加显著,在高浓度铝害(100,200 mg/L)下,其根重分别仅为对照水平的25.0%和11.9%。这与目前较一致的结论——铝对植物主要毒害症状为抑制根伸长生长[9]相似。
2.2.3铝胁迫对紫花苜蓿幼苗生理指标的影响铝胁迫对叶绿素含量、POD活性的影响表现一致,均为50 mg/L处理>0 mg/L处理>100 mg/L处理(表2)。叶绿素含量在Al3+浓度为0,50 mg/L处理时差异不显著(P>0.05),均显著高于100 mg/L Al3+处理(P<0.05);POD活性则显示为处理间差异均极显著(P<0.01),在Al3+浓度为100 mg/L处理时活性最低。丙二醛含量则均显示为差异不显著(P>0.05)。说明对于苜蓿幼苗的上述生理指标而言,Al3+浓度0~50 mg/L时最适合幼苗的生长,当Al3+浓度达100 mg/L时则对紫花苜蓿生长有抑制作用。
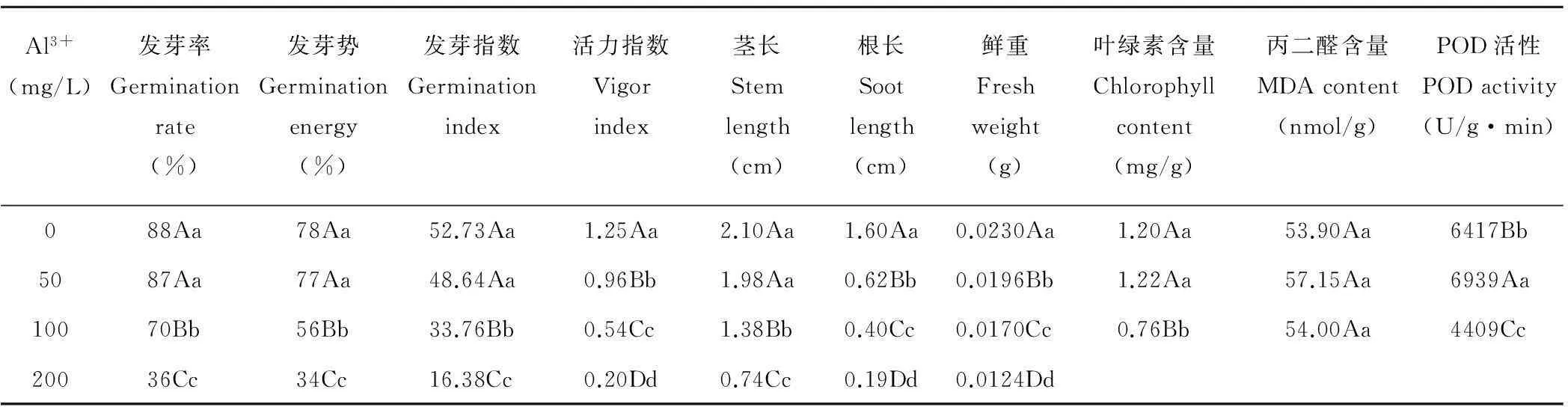
表2 铝胁迫对种子发芽和幼苗生长的影响
2.3 酸、铝胁迫共同对紫花苜蓿种子活力和幼苗生长的影响
2.3.1酸、铝胁迫对紫花苜蓿种子发芽的影响由表3可知,在pH 6.0和7.5条件下,Al3+浓度为0,50,100 mg/L处理的发芽能力较高,且处理间均差异不显著(P>0.05)。而在pH 3.0和4.5时,Al3+浓度大于50 mg/L就会产生较大影响,表明在微酸、微碱下,金皇后苜蓿发芽对铝害具有较高的耐受性,而随着酸性的增强,苜蓿种子的发芽对Al3+浓度敏感度加强。
金皇后种子的发芽率和发芽势最佳处理为pH 6.0,Al3+浓度0,50 mg/L,最差处理为Al3+浓度为200 mg/L下pH 4.5和pH 3.0处理。
2.3.2酸、铝胁迫对紫花苜蓿幼苗生长的影响表3中,从总体数值上看,苜蓿幼苗的茎长在pH 7.5、Al3+浓度0 mg/L处理时最佳(2.915 cm),pH 4.5、Al3+浓度200 mg/L处理最差(0.543 cm)。幼苗根长在pH 6.0、Al3+浓度0 mg/L处理时最佳(2.058 cm),无论哪个酸度值只要在Al3+浓度200 mg/L处理时均最差。说明幼苗的根长比茎长对酸、铝综合胁迫更加敏感。
上述可知,在pH 6.0、Al3+浓度100,200 mg/L处理下,其生长发芽和生长状况优于其他Al3+浓度为100~200 mg/L处理,表明微酸环境有利于紫花苜蓿抵御铝危害。
酸铝交互作用极为显著(P<0.01),0,50 mg/L Al3+处理幼苗生长最佳,pH 6.0,7.5处理幼苗生长最佳,与单一酸胁迫或铝胁迫趋势相似。但值得注意的是,当pH 4.5时,50 mg/L Al3+就能对幼苗生长造成不利影响。
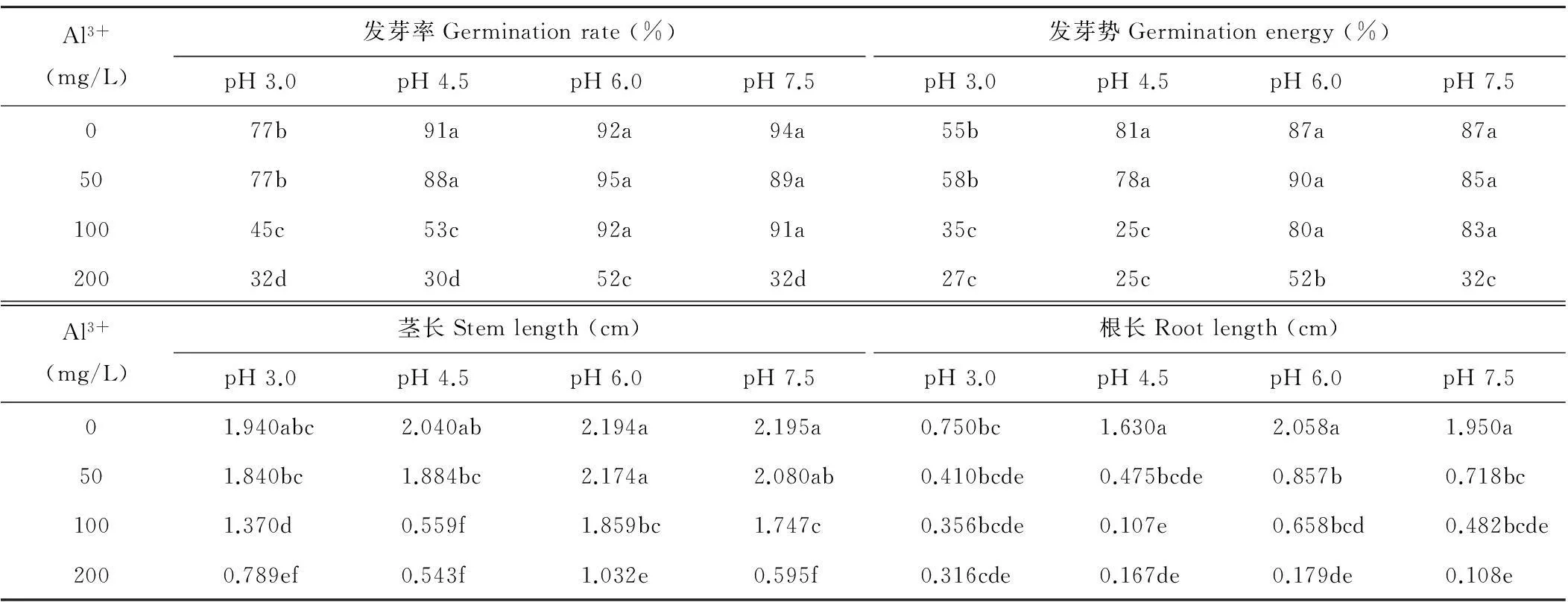
表3 酸、铝胁迫对种子发芽和幼苗生长的影响
注:不同字母表示同一指标下所有处理间差异显著(P<0.05)。下同。
Note: Different letters in the same index represent significant difference atP<0.05 level. The same below.
2.3.3酸、铝胁迫对紫花苜蓿幼苗生理指标的影响由表4可知,苜蓿幼苗的叶绿素含量在pH 3.0,7.5处理时,随着Al3+浓度的升高而降低,而在pH 4.5,6.0处理时则随Al3+浓度升高而先升高再快速降低。在pH 6.0和7.5处理时,幼苗叶绿素的含量在3个Al3+浓度下变化不大,且均大于1.0;在pH 3.0处理时,无论Al3+浓度变化多少,幼苗叶绿素含量始终在1.0以下;说明苜蓿幼苗叶绿素含量在微酸、微碱下,随Al3+浓度值的变化较小,在中强酸(pH 4.5,3.0)条件下叶绿素含量受Al3+浓度值影响较大。

表4 酸、铝胁迫对幼苗生理特性的影响
幼苗的丙二醛含量在pH 3.0和4.5处理时,随着Al3+浓度的上升而增加,且均明显大于pH 6.0,7.5处理组;在pH 6.0和7.5处理时,均随着Al3+浓度的升高而降低(pH 7.5、Al3+浓度为50 mg/L处理除外);丙二醛含量在pH 6.0和7.5、Al3+浓度为100 mg/L处理时最少,在pH 3.0和4.5、Al3+浓度为100 mg/L处理时最大,说明中强酸利于丙二醛的产生,加速了幼苗细胞膜的破坏。
幼苗POD活性无论Al3+浓度值怎么变化,pH 6.0和7.5均大于 pH 3.0和4.5;在pH 3.0和4.5、Al3+浓度为100 mg/L处理时POD活性最低,在pH 6.0和7.5、Al3+浓度为50 mg/L处理时活性最高,说明在pH<4.5条件下,较高浓度铝(Al3+浓度为100 mg/L)对POD活性影响较大,在微酸、微碱条件下,低浓度铝(Al3+浓度<100 mg/L)对POD活性没有影响。
3讨论
不同的酸性环境对紫花苜蓿种子的发芽和幼苗生长差异较大。在pH≥4.5时,紫花苜蓿的发芽率、发芽势、茎长、根长等生长指标均显著高于强酸性环境(pH=3.0),其中又以pH=6.0的生长指标总体较好,这说明弱酸能促进苜蓿种子发芽和幼苗的生长而强酸则是起到抑制作用,这与李剑锋等[16]研究环境酸度对紫花苜蓿早期生长和生理的影响的结论相近。在pH 6.0~7.5处理下苜蓿的发芽率、发芽指数、根长等生长指标显著地高于其他处理或区间,表明pH在6.0~7.5区间为较为适宜苜蓿萌发与幼苗生长。当pH=3.0时,苜蓿的发芽率、发芽势、茎长和根长等生长指标受到了严重影响,说明强酸条件下,严重抑制了苜蓿的发芽与生长发育。苜蓿根长在pH 3.0, 4.5,6.0,7.5分别对应的长度(cm)为0.75,1.63,2.06,1.95,尤以强酸条件下根长最短,随着pH的提高根长也逐渐生长,在pH=6.0时出现了一个小高峰之后下降,这说明苜蓿对酸敏感主要是因为根生长受酸的抑制,根长可以作为耐酸性评价的一项指标,可以鉴定苜蓿的耐酸性。
单一铝胁迫条件下,根据试验数据可以将苜蓿种子发芽和幼苗生长对培养环境铝含量的适合性分为3个区间: 即最适生长区间(Al3+浓度为0~50 mg/L)、中适生长区间(Al3+浓度为50~100 mg/L)和低适生长区间(Al3+浓度大于100 mg/L);分区结果与宫家珺等[17]研究得出苜蓿生长对土壤铝含量的耐受性分为3个区间相似;同时,苜蓿的根长差异在试验中是最直接的,这就与张芬琴和于金兰[18]的研究结论“高浓度的铝对紫花苜蓿幼苗的生长有明显的抑制作用,其中对根伸长的抑制作用较强”相同。
单一酸胁迫对苜蓿生长的影响总体上没有单一铝胁迫影响大,而两者胁迫共同影响的作用极显著(P<0.01)。Stoutd[19]研究表明,在土壤pH值低于5.15时Al3+才会有毒害作用。但本试验结果发现在pH=6.0,Al3+浓度0,200 mg/L处理时,苜蓿根长分别为2.05和0.18 cm;表明如果Al3+过高(100,200 mg/L),在适宜的pH下依然会对紫花苜蓿萌发和幼苗生长带来显著不利影响。而在pH 3.0和4.5、Al3+浓度50 mg/L处理时,其种子发芽和幼苗生长的表现均相对较差,说明中浓度Al3+在较低pH环境中即可抑制苜蓿种子发芽和幼苗生长。pH=3.0,Al3+浓度0,200 mg/L处理时,苜蓿根长分别为0.75和0.30 cm,说明在酸性条件下铝浓度的提高对苜蓿造成了毒害,使得苜蓿的根系伸长明显受到抑制,大大影响了苜蓿的生长。
叶绿素含量是反映叶片的生长、发育情况的重要生理指标;丙二醛是膜脂过氧化的终产物,是植物对逆境胁迫的一种生理反应,也是植株体内细胞膜是否被破坏的重要生理指标[20];过氧化物酶(POD)广泛存在于植物体中,是酶促防御系统的保护酶类,逆境中保护酶活性增强或维持较高水平,防止其对生物膜结构和功能的破坏。试验结果表明,叶绿素含量、POD活性在适宜pH、低Al3+胁迫下更高,MDA含量更低,反之,酸性越强、Al3+浓度越高,叶绿素含量越低,POD活性越弱,MDA含量越高,这与相关研究一致[16-18]。
4结论
随着酸度的增强对苜蓿种子发芽和幼苗生长的抑制作用增强,微酸环境下几乎没有抑制作用,甚至个别指标高于对照处理。
低浓度铝(<50 mg/L)对种子发芽影响较小,溶液铝含量在0,50 mg/L时,苜蓿生长正常,发芽率、发芽势、发芽指数、茎长、根长等均明显高于其他处理(P<0.05);但当铝含量在100和200 mg/L时,苜蓿发芽和幼苗生长受到严重抑制。
酸、铝共同胁迫对苜蓿种子发芽和幼苗生长的影响大于单一胁迫对它的影响,当pH<4.5,Al3+浓度达到50 mg/L以上时,即可对苜蓿芽苗的生长产生明显的抑制作用。
References:
[1]Yue C Y, Guo J L, Wang H S. Planting forage grass improvement of saline and oil. Shangdong Animal Husbandry and Veterinary Medicine, 2001, 6: 49-50.
[2]Yang A, Sun B, Zhao Q G. China acid rain distribution, causes and effects on soil. Soil, 1999, 1: 13-18.
[3]Li R Q, Wang J B. Plant Tology and Physiology In Environment Stress[M]. Wuhan: Wuhan University Press, 2002: 286.
骨髓抑制是细胞毒化疗药物的常见不良反应之一,是大多细胞毒药物的剂量限制性毒性。化疗药物种类、剂量强度、白蛋白、肾功能、既往化疗放疗等是影响骨髓抑制的重要因素[2]。本组患者发生Ⅳ度骨髓抑制大多为既往接受过多次化疗或放疗,共99例/次(75.3%),此类患者机体骨髓储备能力降低,比既往未接受放化疗患者更易发生Ⅳ度骨髓抑制。出现Ⅳ度骨髓抑制时若不予以积极干预,不仅影响化疗方案的实施及临床治疗效果,甚至引起严重感染、贫血、出血及心力衰竭等并发症,相前研究表明与Ⅳ度骨髓抑制有关的治疗相关性病死率达4%-12%[3]。
[4]Uexküll H R, Muter E. Global extent, development and economic impact of acid soils. Plant and Soil, 1995, 171(1): 1-15.
[5]Foy C D, Chaney R L, White M C. The physiology of metal of toxicity in plants. Annual Review of Plant Physiology, 1978, 29: 511-566.
[6]Delhaize E, Ryan P R. Aluminum toxicity and tolerance in plants. Plant Physiology, 1995, 107(2): 315-321.
[7]Peng L Q, Li X Y, Qi X,etal. The relationship of root traits with persistence and biomass in 10 alfalfa variteies. Acta Prataculturae Sinica, 2014, 23(2): 147-153.
[8]Nan L L, Shi S L, Zhang J H. Study on root system development ability of different root-type alfalfa. Acta Prataculturae Sinica, 2014, 23(2): 117-124.
[9]Luo X B. Effect of Acidity and/or Aluminum Stress on Elongation of Alfalfa Primary Root[D]. Nanning: Guangxi University, 2003: 49.
[10]Li Z Y, Xing X F, Tang H,etal. Effects of aluminum and acid stresses on the growth and antioxidant enzyme activities of rhizobia isolated fromMedicagolupulinaandM.sativa. Acta Prataculturae Sinica, 2013, 22(3): 146-153.
[12]Zhang J N, Liu K. Mechanisms for plants detecting the optimum time and place to germinate. Acta Prataculturae Sinica, 2014, 23(1): 328-338.
[13]State Technical Supervision Bureau. Procedure of inspection crop seeds GB/T3543-1995[S]. Beijing: Standards Press of China, 1995.
[14]Bi X B, Dai X W, Lin B. Seed Science[M]. Beijing: China Agriculture Press, 1993.
[15]Zhao H Q. The Guidance of the Basic Biology Experiments[M]. Beijing: China Agricultural University Press, 2008: 25-80.
[16]Li J F, Shi S L, Zhang S Q. Effects of the pH value of an acid environment on early growth and physiology ofMedicagosativaW525. Acta Prataculturae Sinica, 2010, 19(2): 47-54.
[17]Gong J J, Li J F, An Y. Effects of aluminumin acid soil on growth and physiology of alfalfa. Chinese Journal of Grassland, 2008, 30(3): 52-58.
[18]Zhang F Q, Yu J L. Effects of aluminium treatment on the seed germination ofMedicagosativaand its physiological characteristics of seedlings. Acta Prataculturae Sinica, 1999, 8(3): 61-65.
[19]Stoutd G. Growth of Alfalfa on Acid Soils When Established with Pre-inoculated Coated Seed[M]. Canada: Agriculture and Food, 1994: 87-110.
[20]Huo P H, Li J F, Shi S L,etal. Effects of altra-drying and accelerated aging on vigor and physiological activity of alfalfa seeds. Chinese Journal of Grassland, 2011, 33(3): 28-34.
参考文献:
[1]岳常彦, 郭金龙, 王洪水. 种植牧草改良盐碱地和油污地. 山东畜牧兽医, 2001, 6: 49-50.
[2]杨昂, 孙波, 赵其国. 中国酸雨的分布、成因及其对土壤环境的影响. 土壤, 1999, 1: 13-18.
[3]利容千, 王建波. 植物逆境细胞及生理学[M]. 武汉: 武汉大学出版社, 2002: 286.
[7]彭岚清, 李欣勇, 齐晓, 等. 紫花苜蓿品种根部特性与持久性和生物量的关系. 草业学报, 2014, 23(2): 147-153.
[8]南丽丽, 师尚礼, 张建华. 不同根型苜蓿根系发育能力研究. 草业学报, 2014, 23(2): 117-124.
[9]罗献宝. 酸、铝胁迫对苜蓿初生根伸长的影响[D]. 南宁: 广西大学, 2003: 49.
[10]李智燕, 邢学峰, 唐华, 等. 铝和酸胁迫对苜蓿根瘤菌生长和抗氧化酶系的影响. 草业学报, 2013, 22(3): 146-153.
[12]张佳宁, 刘坤. 植物调节萌发时间和萌发地点的机制. 草业学报, 2014, 23(1): 328-338.
[13]国家技术监督局. 农作物种子检验规程GB/T3543-1995[S]. 北京: 中国标准出版社, 1995.
[14]毕辛毕, 戴心维, 林斌. 种子学[M]. 北京: 中国农业出版社, 1993.
[15]赵海泉. 基础生物学实验指导[M]. 北京:中国农业大学出版社, 2008: 25-80.
[16]李剑锋, 师尚礼, 张淑卿. 环境酸度对紫花苜蓿早期生长和生理的影响. 草业学报, 2010, 19(2): 47-54.
[17]宫家珺, 李剑峰, 安渊. 酸性土壤中铝离子对紫花苜蓿生长和生理的影响. 中国草地学报, 2008, 30(3): 52-58.
[18]张芬琴, 于金兰. 铝处理对苜蓿种子萌发及其幼苗生理生化特性的影响. 草业学报, 1999, 8(3): 61-65.
[20]霍平慧, 李剑锋, 师尚礼, 等. 超干及老化处理对紫花苜蓿种子活力和生理变化的影响. 中国草地学报, 2011, 33(3): 28-34.
