油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究
2016-01-27宋吉轩李金还刘美茹牛建行王冉吕俊宗学凤王三根
宋吉轩,李金还,刘美茹,牛建行,王冉,吕俊,宗学凤,王三根*
(1.西南大学农学与生物科技学院,三峡库区生态环境教育部重点实验室,南方山地农业教育部工程研究中心,
重庆400715;2.贵州省生物技术研究所,贵州 贵阳 510006)
油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究
宋吉轩1,2,李金还1,刘美茹1,牛建行1,王冉1,吕俊1,宗学凤1,王三根1*
(1.西南大学农学与生物科技学院,三峡库区生态环境教育部重点实验室,南方山地农业教育部工程研究中心,
重庆400715;2.贵州省生物技术研究所,贵州 贵阳 510006)
摘要:受全球气候变化影响,我国牧区干旱现象日益严重,极大限制了草原生产力的提高。本文采用盆栽人工控水的方法,研究不同浓度油菜素内酯(BR)处理对羊草生长和抗旱特性的影响。结果表明干旱显著抑制植株的生长,而BR能有效减缓干旱胁迫对羊草造成的伤害。经过不同浓度的BR处理后,与干旱胁迫相比,株高、叶面积、干重、含水量、叶绿素a、叶绿素b、类胡萝卜素、根系活力、脯氨酸、可溶性蛋白、可溶性糖和5种抗氧化酶活性均随浓度增加而升高,但高浓度下又有降低的趋势,而丙二醛(MDA)和叶片电导率则相反,其中以BR浓度为0.1 mg/L时的抗旱效果最好。研究发现适当浓度的BR提高羊草株高、叶面积和光合色素含量,促进干物质积累和根系活力,与其降低膜脂过氧化产物MDA与质膜透性,提高脯氨酸、可溶性蛋白、可溶性糖等渗透调节物质含量,增强超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)等抗氧化酶活性密切相关。
关键词:油菜素内酯(BR);羊草;干旱胁迫;渗透调节;抗氧化酶
DOI:10.11686/cyxb2015001http://cyxb.lzu.edu.cn
宋吉轩,李金还,刘美茹,牛建行,王冉,吕俊,宗学凤,王三根. 油菜素内酯对干旱胁迫下羊草渗透调节及抗氧化酶的影响研究. 草业学报, 2015, 24(8): 93-102.
Song J X, Li J H, Liu M R, Niu J H, Wang R, Lv J, Zong X F, Wang S G. Effects of brassinosteroid application on osmotic adjustment and antioxidant enzymes inLeymuschinensisunder drought stress. Acta Prataculturae Sinica, 2015, 24(8): 93-102.
收稿日期:2015-01-05;改回日期:2015-03-30
基金项目:国家重点基础研究发展计划973项目(2014CB138806)和中国111计划作物种质资源利用创新基地建设项目(104510-205001)资助。
作者简介:宋吉轩(1978-),男,贵州思南人,副研究员,在读博士。E-mail:songjx1025@163.com
通讯作者*Corresponding author. E-mail: wangsg@swu.edu.cn
Effects of brassinosteroid application on osmotic adjustment and antioxidant enzymes inLeymuschinensisunder drought stress
SONG Ji-Xuan1,2, LI Jin-Huan1, LIU Mei-Ru1, NIU Jian-Hang1, WANG Ran1, LV Jun1, ZONG Xue-Feng1, WANG San-Gen1*
1.CollegeofAgronomyandBiotechnology,SouthwestUniversity,KeyLaboratoryofEco-environmentsinThreeGorgesReservoirRegion,MinistryofEducation,EngineeringResearchCenterofSouthUplandAgriculture,MinistryofEducation,Chongqing400715,China;2.GuizhouInstituteofBiotechnology,Guiyang510006,China
Abstract:Droughts have become increasingly severe in pastoral areas of China and have greatly constrained the productivity of grassland. The influence of brassinosteroids(BR) on the growth and drought tolerance of Leymus chinensis has been studied under controlled soil and water conditions using a pot experiment design. The results showed that drought stress substantially disrupted plant growth and development but that BR could effectively alleviate this damage. The most effective concentration of BR was 0.1 mg/L. Plant height, leaf area, dry weight, water content, chlorophyll a, chlorophyll b, carotenoids, root activity, proline, soluble protein, soluble sugar and 5 kinds of enzyme activity increased with all BR concentrations except for the highest concentration level. BR decreased malondialdehyde (MDA) content and leaf electrical conductivity. The optimal concentration of BR increased the content of photosynthetic pigment and promoted the accumulation of dry matter and root activity compared to the drought control. These changes might be closely related to the decrease of membrane lipid peroxidation production, MDA content and membrane permeability. Also significant may be the increase of osmotic adjustment substances such as proline, soluble protein, soluble sugar, and the enhancement of antioxidase activities such as superoxide dismutase, catalase, peroxidase, ascorbate peroxidase and glutathione reductase.
Key words:brassinosteroids(BR); Leymus chinensis; drought stress; osmoregulation; antioxidant enzymes
羊草(Leymuschinensis)为禾本科赖草属,繁殖能力强,适口性好,具有较高的营养价值、饲用价值和经济价值,是我国牧区重要的牧草之一[1]。受全球气候变化影响,我国大部分草原区面临着不良环境特别是干旱的威胁,在一定程度上限制了羊草生产力的提高。
干旱胁迫会使植物产生一系列的生理生化变化,会破坏植物体内活性氧的产生和清除系统之间的平衡,细胞内活性氧增多,从而影响到植物生长发育,如膜系统受到破坏、叶绿素含量降低、丙二醛含量升高,渗透调节及抗氧化能力下降[2-4]。为了降低和消除氧化胁迫,植物细胞内出现了抗氧化防御系统,包括由SOD、POD及CAT等组成的抗氧化酶系统[5]。渗透调节物质(如可溶性糖、游离脯氨酸和可溶性蛋白等)的积累是植物防御干旱等胁迫最直接的方式之一,它们的积累可以降低植物细胞内的水势,防止水分外流,而且还起到保护细胞内大分子结构的作用[6]。因此,开展降低干旱胁迫对羊草的伤害、增强羊草抗旱性的研究,对提高草原生产力、发展当地畜牧业具有重要的意义。
利用外源物质对植物进行处理,是目前提高植物抗逆性简便、可行的方法之一。油菜素内酯(BR)属甾醇类植物激素,是被公认的活性强的植物生长调节类物质,在很低的浓度下就对植物表现出很强的生理生化效应。BR一方面具有促进植物生长的作用,另一方面还可改善植物的生理代谢、提高抗逆性,在农林业生产中被广泛应用[7]。干旱下外源施加BR 可增加脯氨酸和可溶性糖等渗透调节物质的质量分数,从而保持膨压,减轻植物在干旱胁迫下受到的伤害[8-9]。BR对干旱胁迫的草莓(Eragariaananassa)有促进生长和增加干物质积累的作用,BR处理后再经干旱胁迫,草莓叶片中的SOD和POD活性显著高于对照,MDA含量显著低于对照[10]。用BR喷施玉米(Zeamays)幼苗叶片,对其生理特性及植株的形态特征有明显的调节作用,增加了株高和叶面积,提高了脯氨酸、叶绿素含量和相对含水量,增强了植株的抗旱性[11]。在羊草的不同生育期喷施不同浓度的BR,在一定程度上提高了羊草的产量与品质[12]。BR对3种苗木抗旱性均有效提高[13]。与喷施清水比较,喷施适当浓度BR溶液的木薯(Manihotesculenta)苗叶片的Pro含量、SOD和POD活性均得到有效提高[14]。也有关于BR提高羊草抗旱力的报道[15]。但BR提高羊草抗旱性与渗透调节及抗氧化特性之间的关系如何,尚需系统研究。本文在干旱胁迫条件下施用不同浓度的BR,探讨其对羊草生长的影响,解析其生理效应,为在生产实践中利用BR提高羊草的抗旱性提供依据。
1材料与方法
1.1 试验设计
供试羊草种子于2013年11月采集于锡林浩特的中国科学院内蒙古生态系统定位站附近。种子在室温下晾干后装入透气布袋中,放在4℃冰箱内保存、备用。试验于2014年6-11月于西南大学进行。选取籽粒饱满、大小一致和无病虫害的羊草种子,用浓度为1.0%次氯酸钠溶液进行消毒处理10 min左右,然后用蒸馏水冲洗3~5次,将种子均匀铺入有双层滤纸的培养盘中进行种子发芽试验。种子在培养箱中(25±1)℃恒温培养,光照时间设为14 h/10 h(昼/夜),光照强度为2500 lx。1周后将长势一致的羊草幼苗移栽到盆钵里,利用称重法每天监测土壤的水分含量[16],并及时补充各处理消耗的水分。
模拟干旱胁迫试验,以土壤相对含水量80%为对照(CK1),土壤相对含水量50%作干旱胁迫处理。当羊草幼苗生长至18~21 cm时,对干旱胁迫处理幼苗喷施不同浓度的BR溶液,浓度分别为0.01 mg/L(T1)、0.1 mg/L(T2)和1.0 mg/L(T3),其中以喷施等量的清水为对照(CK2)。每个处理40株幼苗,3次重复。为避免光照对BR的效果造成影响,处理时间均为傍晚,连续3 d。处理15 d后取样测定,取样时选取植株中等大小的功能叶片。测量指标包括形态指标、叶片光合色素、可溶性糖含量、可溶性蛋白含量、丙二醛(malondialdehyde, MDA)含量、脯氨酸、根系活力、叶片电导率、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、过氧化物酶(peroxidase, POD) 、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)和谷胱甘肽还原酶(glutathione reductase, GR)活性。
1.2 形态指标测定
样品将泥土去除干净分别称量地上部分与地下部分的鲜重,植株用自来水冲洗,再用蒸馏水冲洗2~3遍,用滤纸吸去附着的水分后放于105℃烘箱内杀青15 min,然后在65℃恒温下烘干至恒重,最后称量其干重。叶长、叶宽及叶面积利用MSD-971叶面积扫描仪进行测量。
含水量采用Yang等[17]的方法,采取鲜叶立即在室内称取鲜重,再浸入水中24 h,取出后吸干表面水分称吸涨重,在80℃烘箱内烘干48 h,称取干重,计算叶片相对含水量。相对含水量=(鲜重-烘干重)/(吸涨重-烘干重)×100%。
1.3 生理生化分析
光合色素含量采用Arnon[18]的方法。将所测定叶片洗净去主脉,剪成4~8 mm的小叶片或叶条混匀后,加入95%乙醇 20 mL,并用塞子塞住,减少挥发,放置暗处1 d,期间振摇2~3次,绿色溶液经准确定容,用于比色。在665,649,470和652 nm下分别测定吸光度。
可溶性蛋白质含量采用考马斯亮蓝法[19]。准确吸取样品提取液0.1 mL,加入5 mL 100 mg/L考马斯亮蓝G-250试剂,振荡混匀,放置2 min后,在595 nm波长下比色。以牛血清蛋白为标准蛋白作标准曲线。
可溶性糖含量采用蒽酮比色法[20]。取样品研磨匀浆,静置30~60 min,在4000 r/min离心20 min,称取0.1 g蒽酮溶于100 mL稀硫酸,取1 mL提取液,加入5 mL蒽酮-硫酸试剂,空白取1 mL蒸馏水,加入5 mL蒽酮-硫酸试剂,在沸水浴中10 min,取出后冷水冷却,于620 nm波长测吸光度。
丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法[21]。取鲜样加入2 mL 10% TCA和少量石英砂,研磨至匀浆,加入8 mL TCA进一步研磨,匀浆离心10 min。吸取离心的上清液2 mL(对照加2 mL蒸馏水),加入2 mL 0.6% TBA溶液,混合物于沸水浴上反应15 min,迅速冷却后再取上清液测定532,600和450 nm波长下的吸光度。
脯氨酸含量采用水合茚三酮法[22]。取鲜样加入10 mL 3%磺基水杨酸,沸水浴10 min后,冷水浴,吸取上清液2 mL,空白管加入2 mL蒸馏水,2 mL冰乙酸,3 mL显色液,沸水浴40 min。将溶液进行冷水浴,各管加入5 mL甲苯充分振荡,以萃取红色物质。静置待分层后吸取甲苯层在520 nm下比色。
根系活力采用TTC法[23]。取根尖投入盛有2.5 mL pH 7.5磷酸缓冲液中,再加入2.5 mL 0.4%TTC,充分混合,并使根完全浸入反应液中,37℃水浴,并在黑暗中进行2 h。取出后,在每管中加入1 mL 1 mol/L H2SO4终止反应。待反应后,将水倒掉,向管中的根中加入5 mL丙酮提取液,避光提取8 h。待根无色后,用丙酮补至5 mL,485 nm下测其吸光度。
叶片电导率(EC)采用电导仪测定[24]。将叶片切成0.5 cm长的小片,用蒸馏水浸洗30 min,再用重蒸馏水冲洗3次,吸干水分,取样品放到10 mL玻璃试管中,加重蒸水3 mL,真空渗入5 min,静置30 min,在室温下用DDS-307型电导仪测定电导率(R1),然后将样品在沸水浴中煮沸5 min,冷却至室温后再测总电导率(R2)。相对电导率=R1/R2×100%。
叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)活性采用李忠光等[25]的单一提取方法。准确称取样品加入预冷的提取液3 mL和少许石英砂,充分冰浴研磨后,转入离心管中,再用2 mL提取液洗研钵,合并提取液并于4℃下,离心20 min,将上清液分装,分别进行酶活性测定。
1.4 数据统计分析
采用Excel和SPSS软件进行数据统计分析。利用DPS 19.0软件进行单因素方差分析,以Duncan’s 新复极差法比较各处理间的差异性。
2结果与分析
2.1 BR对干旱胁迫下羊草植株生长的影响
由表1可以看出,经干旱胁迫(CK2)后的羊草幼苗株高、叶面积、干重及含水量均显著降低,与CK1相比差异达显著水平。植株经几种浓度BR处理后,生长指标与CK2相比都有一定的增加,其中株高、干重和含水量与CK2相比均达到差异显著水平。当BR浓度为0.1 mg/L时,各个指标都达到最大值,有的指标甚至超过或与CK1相当(株高、叶面积和含水量),说明BR对干旱胁迫羊草有很好的缓解作用。在BR浓度为0.1 mg/L时与对照CK2相比较,其株高、叶面积、干重和含水量分别增加了53.50%,103.60%,25.90%和7.49%。总之,不同浓度的BR对在干旱胁迫下的羊草幼苗生长具有一定的促进作用,增强了其幼苗的抗旱能力,其中以施用BR浓度为0.1 mg/L时的效果最好。
2.2 BR对干旱胁迫下羊草植株光合色素与根系活力的影响
由表2可以看出,经CK2处理后的羊草幼苗叶绿素a、叶绿素b、类胡萝卜素和根系活力均降低,并且与CK1相比均达到差异显著水平。在经过不同浓度的BR处理后,叶绿素a、叶绿素b、类胡萝卜素和根系活力与CK2相比都有一定程度的增加。当BR浓度为0.01 mg/L时,叶绿素b和根系活力与CK2相比差异达显著水平;当BR浓度为1.0 mg/L时,几项指标与CK2相比差异均达显著水平。当BR浓度为0.1 mg/L时的施用效果最佳,叶绿素a、叶绿素b、类胡萝卜素和根系活力相对于CK2来说分别提高了22.00%,63.16%,81.25%和91.60%,均达到了显著水平,说明各个指标均得到很好的恢复。
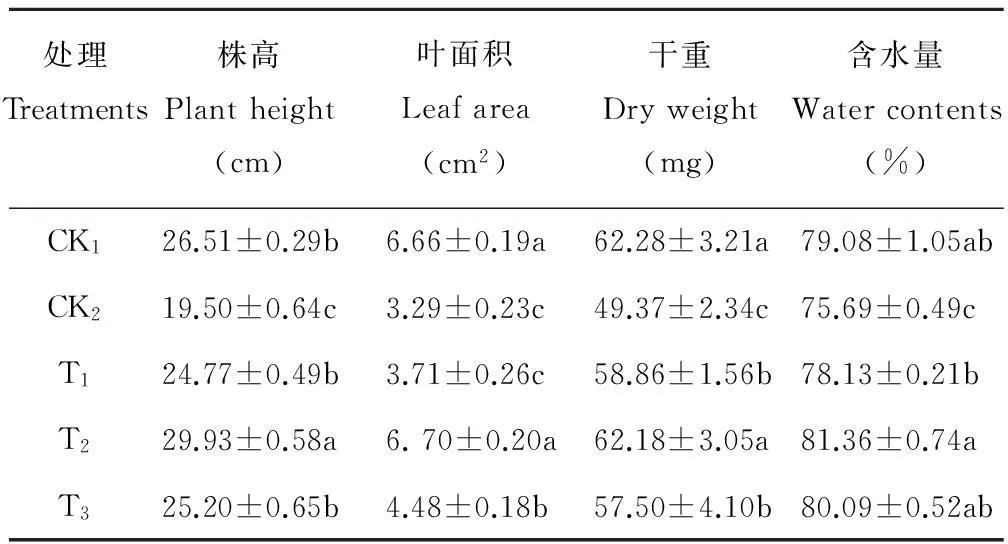
表1 BR对干旱胁迫下羊草生长的影响
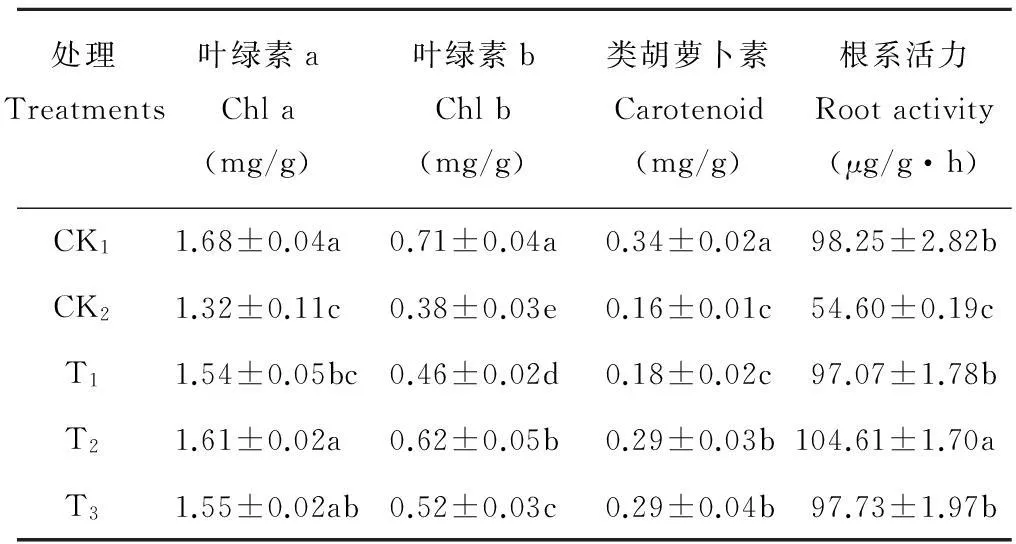
表2 BR对干旱胁迫下羊草植株光合色素与根系活力的影响
同列不同字母表示差异达显著水平(P<0.05),下同。Different letters mean significant difference at 0.05 level. The same below.
2.3 BR对干旱胁迫下羊草丙二醛、脯氨酸、可溶性蛋白、可溶性糖含量和叶片电导率的影响
由图1可以看出,经CK2处理后,羊草幼苗膜脂过氧化产物丙二醛(MDA)和膜伤害的指标叶片电导率(EC)均显著增加,并且与CK1相比差异达显著水平。在经过不同浓度的BR处理后,丙二醛和叶片电导率相对于CK2来说均有所降低,且与CK2相比差异达显著水平,其中浓度为0.1 mg/L的BR处理效果最佳,相对于对照CK2来说,丙二醛和叶片电导率分别降低了41.39%和38.33%。

图1 BR对干旱胁迫下羊草植株叶片丙二醛(MDA)和电导率(EC)的影响Fig.1 Effect of BR on leaf malondialdehyde (MDA) and electrical conductivity (EC) of L. chinensis under drought stress图中不同字母表示差异达显著水平(P<0.05),下同。Different letters mean significant difference at 0.05 level. The same below.
由图2可知,干旱胁迫(CK2)下羊草植株的渗透调节物质脯氨酸、可溶性蛋白和可溶性糖均显著增加,并且与CK1相比差异达显著水平。但在经过不同浓度的BR处理后,脯氨酸、可溶性蛋白、可溶性糖与CK2相比都进一步的提高,其中浓度为0.1 mg/L的BR处理效果最佳,且与对照CK2相比差异达显著水平,其脯氨酸、可溶性蛋白和可溶性糖分别比对照CK2增加了138.84%,16.65%,38.84%。
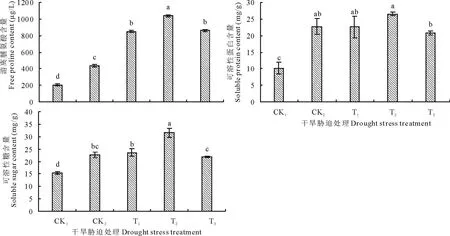
图2 BR对干旱胁迫下羊草植株叶片脯氨酸、
2.4 BR对干旱胁迫下羊草植株抗氧化酶活性的影响
由图3可以看出,CK2处理刺激了羊草幼苗5种抗氧化酶活性的提高,其中SOD活性、POD活性和CAT活性与对照CK1相比差异达到显著水平。但经过不同浓度的BR处理后,5种抗氧化酶活性都进一步增强,并且在BR浓度为0.1 mg/L时,5种酶活性均达到最大值,而且与CK2相比差异达到显著水平,分别比对照CK2增加了9.28%,20.09%,58.43%,54.24%和116.47%。虽然BR浓度为0.01和1.0 mg/L时对干旱胁迫伤害的恢复效应不如0.1 mg/L处理,但是SOD、POD和CAT这3种抗氧化酶活性仍显著高于对照处理CK2,其他GR和APX这两种酶与CK2相比活性也有一定的增强。
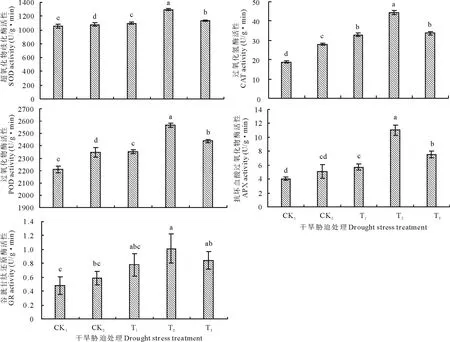
图3 BR对干旱胁迫下羊草植株抗氧化酶活性的影响
3讨论
在干旱胁迫下植株的生长发育和生理特性均受到影响[26-27]。本试验研究表明,干旱胁迫使羊草的株高和叶面积等受到明显抑制,喷施BR可逐渐恢复生长,这与韩德复等[15]研究外源BR改善干旱胁迫下羊草幼苗的生长状况的结果一致。叶片相对含水量(RWC)是植株叶片细胞水分生理状态的体现,在一定程度上反映了植物水分亏缺程度[28]。本试验研究表明,采用不同浓度的BR处理过后,羊草植株含水量呈现出先增高后降低的趋势,当BR浓度为0.1 mg/L时,含水量恢复最好,说明植株保水能力升高,从而缓解干旱胁迫。
根系活力是植物根系吸收、合成以及代谢能力的综合体现,它影响地上部的生长和营养状况,是一种较客观地反映根系生命活动的生理指标[29]。本试验研究表明,干旱胁迫下羊草幼苗植株根系活力下降,外施不同浓度的BR使根系活力上升,其中BR浓度为0.1 mg/L时根系活力达到最大值。光合色素含量的高低在一定程度上反映植物的光合能力,与植物产量的形成密切相关,光合色素的变化不仅能反映出植物在胁迫条件下进行同化作用的能力,还被看作植物受到干旱胁迫的敏感程度[30]。本试验研究表明,干旱胁迫处理后,羊草植株叶片光合色素含量大幅度减少,这与其干物质积累降低相一致;喷施BR后,光合色素含量升高, BR减缓光合色素降低的趋势又与干物质增加的趋势相吻合。
在正常环境条件下,植物体内活性氧反应处于不断生成与消除的平衡状态中,不易产生膜脂过氧化反应[31-32]。丙二醛(MDA)是膜脂过氧化作用后的主要产物之一,也是膜脂过氧化的体现,其含量的高低和质膜透性的大小都是膜质过氧化强弱和质膜受损程度的重要指标[33]。叶片相对电导率是植物质膜透性的表现,被认为是植物受害的敏感指标之一[34]。本实验结果表明,羊草幼苗受到干旱胁迫后,MDA含量显著升高,同时叶片电导率也升高,这说明细胞质膜发生了过氧化作用,引起质膜正常的生理功能发生变化。但经过喷施BR处理过后,MDA含量下降明显,说明BR对干旱胁迫所造成的伤害有积极的缓解作用,当BR浓度为0.1 mg/L时缓解效果最好。与此相关联的是当喷施一定浓度的BR后,叶片电导率也下降,说明BR的确在一定程度上缓解了干旱胁迫对羊草细胞膜造成的伤害。
植物在适应干旱逆境条件的进化过程中逐渐形成了相应的生理调节机制,其中渗透调节作用是重要的生理反应,渗透调节能力与渗透调节物质的含量高低有密切的关系。植物体内积累的脯氨酸和可溶性糖等是重要的渗透调节剂,其含量的增加对提高细胞汁液浓度、降低细胞水势、增加植物的吸水能力有利[35]。一般抗旱性强的植物可溶性蛋白含量上升较大,反之则抗性减弱[36]。本试验研究表明,在干旱胁迫下植株可溶性糖和可溶性蛋白含量都有增加,表明羊草可通过此方式提高其吸保水能力;但本研究进一步发现,适当浓度的BR处理加强了这种调节机制,从而减轻干旱胁迫造成的伤害。脯氨酸不仅是一种渗透调节物质,还可以作为一种贮藏形式的氮源,当植物逆境胁迫解除后可参与叶绿素等物质的合成,当植物受到干旱胁迫时,通过积累大量的脯氨酸来提高细胞的渗透调节能力,从而保证组织水势下降时细胞膨压获得保持[37]。本试验研究表明,干旱胁迫下经过BR处理过后,羊草幼苗体内游离脯氨酸含量与干旱胁迫对照处理相比显著升高,这进一步维持了细胞较低的渗透势,提高细胞内溶质的浓度,降低水势,更显著地缓解了干旱胁迫所带来的伤害。
干旱胁迫是影响植物生长和代谢的主要逆境因素之一,干旱胁迫可诱导植物细胞内活性氧(ROS)的产生,与生物大分子发生氧化反应,生成具有强氧化性的膜质过氧化物和各种小分子的降解物,导致膜质过氧化,破坏膜的完整性,降低保护酶的活性[38]。植物细胞在长期进化过程中形成了防御活性氧毒害的保护酶系统,即超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)等,以维持植物体内活性氧离子代谢的动态平衡[39]。其中SOD可特异性清除氧自由基,是植物体内活性氧自由基清除系统的第一道防线,其活性的高低影响到逆境下叶绿素、蛋白质的降解速度及叶片功能期。APX是叶绿体中解毒过氧化氢的关键酶,它通过催化抗坏血酸-谷胱甘肽循环来发挥作用。GR能使谷胱甘肽还原,从而缓解生物大分子对细胞的毒害作用。POD在植物体内可清除过氧化氢,并将其分解为O2和H2O,保护细胞免受毒害作用。CAT是植物体内重要的活性氧清除酶,负责清除光呼吸或脂肪酸氧化过程中形成的H2O2,CAT活力的升高有助于清除细胞代谢所产生的过氧化氢。活性氧增加导致的不可逆膜脂过氧化是植物细胞膜受损的主要因素[40]。SOD、POD、CAT、GR和APX具有协同作用,从而有效清除植株体内过多的自由基,提高了植物适应干旱胁迫的能力[41]。杜润峰等[42]研究结果表明在干旱胁迫条件下可使达乌里胡枝子(Lespedezadavurica)的SOD、POD、CAT和APX的酶活性高于对照。季杨等[43]研究结果表明在干旱胁迫条件下,鸭茅(Dactylisglomerata)根系和叶片中的SOD、CAT、POD、APX活性也呈现先增强后下降的趋势。本试验研究表明,在干旱胁迫条件下羊草幼苗的SOD、POD、CAT、GR和APX活性上升,喷施不同浓度的BR后,5种酶活性均呈现进一步升高的趋势,当BR浓度为0.1 mg/L时,羊草幼苗植株体内保护酶活性达到最高。对干旱胁迫下的羊草施加BR,几种浓度处理后均可提高抗氧化酶的活性,联系到本研究中经过BR处理后膜脂过氧化产物MDA含量明显下降,推断BR的这种保护作用,与其通过增强抗氧化酶活性进而有效地清除活性氧(ROS)的能力是密切相关的。本研究同时还发现SOD、POD、CAT、GR和APX的变化规律基本一致,说明在干旱胁迫下,5种保护酶活性具有一定的协同作用,从而有效清除植株体内过多的自由基,提高了羊草适应干旱胁迫的能力。
4结论
适当浓度的BR可提高羊草株高、叶面积和光合色素含量,促进物质积累和根系活力,减轻干旱胁迫对羊草幼苗造成的伤害,这与BR能够减缓膜质过氧化作用,稳定膜系统的结构和功能,维持较高的渗透调节物质,增强保护酶活性等生理效应密切相关。本试验条件下,BR最适宜的喷施浓度为0.1 mg/L。相关机理值得进一步研究。
References:
[1]Li H, Yang Y F. Effect of restorative measures on quantitative characters of reproduction forLeymuschinensispopulation in the degenerated grassland. Chinese Journal of Applied Ecology, 2004, 15(5): 819-823.
[2]Li W, Cao K F. Effects of drought stress on photosynthetic characteristics and chlorophyll fluorescence parameters in seedlings of terminthia paniculata grown under different light level. Acta Botanica Boreali-occidentalia Sinica, 2006, 26(2): 266-275.
[3]Ding Y M, Ma L H, Zhou X G,etal. Effects of drought stress on free proline and malonaldedyde contents in potato leaves and correlation analysis of drought-tolerant level among different varieties. Southwest China Journal of Agricultural Sciences, 2013, (1): 106-110.
[4]Hendry G A F. Oxygen free radical process and seed longevity. Seed Science Research, 1993, 3: 141-153.
[5]Sairam R K, Vasanthan B, Ajay A. Calcium regulatesGladiolusflower senescence by influencing antioxidative enzymes activity. Acta Physiologiae Plantarum, 2011, 33: 1897-1904.
[6]Mustapha E, hmadou M V, Hahib K. Osmoregulation and osmoprotection in the leaf cells of two olive cultivars subjected to severe water deficit. Acta Physiologiae Plantarum, 2009, 31: 711-721.
[7]Ma G R, Hou Y. Plant Growth Regulator Safely Administered Guide[M]. Beijing: China Agriculture Press, 2008: 109-125.
[8]Feng C H, Li K R, Zhang P W,etal. Effects of brassinolide on antioxidant enzymes activities and antioxidants contents ofXanthocerassorbifoliaBunde seedlings under drought stress. Agricultural Research in the Arid Areas, 2008, 26(4): 152-155.
[9]Vardhini B V, Rao S S R. Amelioration of osmotic stress by brassinosteroids on seed ger-mination and seedling growth of three varieties of sorghum. Plant Growth Regul, 2003, 41(1): 25-31.
[10]Wu S H. Effect of BR and KT on physiological metabolism of strawberry under drought stress. Fujian Journal of Agricultural Sciences, 2001, 16(2): 56-58.
[11]Zhou T, Hu Y J, Zhang L H,etal. Effect of brassinolide on drought resistance of maize seedlings. Journal of Changchun Teachers College, 2003, 22(2): 66-68.
[12]Hu Y J, Han D F, Guo J X. Effect of brassinolide on the quality and the yield ofLeymuschinensisgrowing in the sown grassland. Journal of Changehun Normal University(Natural Science), 2007, 26(7): 61-64.
[13]Han G, Sun N, Li K R. Comprehensive evaluation of effect of brassonolide on drought resistance of seedlings of three tree species. Agricultural Aesearch in the Arid Areas, 2007, 25(2): 92-97.
[14]Li Y P, Liu Z F, Huang J,etal. Effects of salicylic acid and brassionlide on physiological characteristics of cassava seedling under water stress. Acta Agriculture Jiangxi, 2010, 22(7): 25-28.
[15]Han D F, Hu Y J, Guo J X,etal. The effect of brassinolide for the drought resistance ofLeymuschinensis. Journal of Changchun Normal University (Natural Science), 2007, 26(6): 51-53.
[16]Gao H Y, Wang S G, Zong X F,etal. Effects of combined high temperature and drought stress on amylose and protein contents at rice grain-filling stage. Chinese Journal of Eco-agriculture, 2012, 20(1): 40-47.
[17]Yang C W, Chong J N, Li C Y,etal. Osmotic adjustment and ion balance traits of an alkali resistant halophyte kochia sieversiana during adaptation to salt an dalkali conditions. Plant Soil, 2007, 294(2): 263-276.
[18]Arnon D L. Copper enzymes in isolated chloroplasts polyphenoloxidase inBetavulgaris. Plant Physiological, 1949, 24(1): 1-15.
[19]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 1976, 72: 248-254.
[20]Zhu W Z, Cao M, Wang S G,etal. Seasonal dynamics of mobile carbon supply inQuercusaquifolioidesat the upper elevational limit. Plos One, 2012, 7(3): e34213.
[21]Vos C H, Schat H, Waal M A,etal. Increased resistance to copper-induced damage of the root cell plasmalemma in copper tolerantSilenecucubalus. Physiological Plantarum, 1991, 82: 523-528.
[22]Bates L S, Waldren R P, Teare I D. Rapid determinatin of free proline for water-stress studies. Plant Soil, 1973, 39: 205-207.
[23]Higa A, Mori Y, Kitamura Y. Iron deficiency induces changes in riboflavin secretion and the mitochondrial electron transport chain in hairy roots of hyoscyamusalbus. Plant Physiological, 2010, 167(11): 870-878.
[24]Nayyar H, Bains T S, Kumar S. Chilling stressed chickpea seedlings: effect of cold acclimation, calcium and abscisic acid on cryoprotective solutes andoxidative damage. Environmental and Experimental Botany, 2005, 54: 275-285.
[25]Li Z G, Li J H, Du C K,etal. Simultaneous measurement of five antioxidant enzyme activities using a single extraction system. Journal of Yunnan Normal University (Natural Sciences Edition), 2002, 22(6): 44-48.
[26]Wang X, Yuan H P. Plant adapation on physiology under drought stress, Arid Zone Research, 2001, 18(2): 42-46.
[27]Li M, Wang G X. Effect of drought stress on activities of cell defense enzymes and lipid peroxidation inGlycyrrhizauralensisseedlings. Acta Ecologica Sinica, 2002, 22(4): 503-507.
[28]Han J Q, Wang X F, Zhang Z G. Effects of surface soil drought on root spatial distribution and activity of white clovers. Chinese Agricultural Science Bulletin, 2007, 23(3): 458-461.
[29]Wang J C, Yu B, Wang R,etal. Evolution and genetic analysis of yield characters of wheat varieties in Shandong Province. Shandong Agricultural Sciences, 2007, (2): 77-79.
[30]Kaiser W M. Effects of water deficit on photosynthetic capacity. Plant Physiological, 2006, 71(1): 142-149.
[31]Li J X, Ding F Z, Yuan Y B. Effects of different drought stress on malondiadehyde content and cell membrane permeability in tobacco leaves. Guizhou Agricultural Sciences, 2008, 36(4): 34-35.
[32]Sun G R, Guan Y, Yan X F. Effect of Na2CO3stress on defensive enzyme system ofPuccinelliatenuifloraseedlings. Acta Agrestia Sinica, 2001, 9(1): 34-38.
[33]Asish K P, Anath B D. Salt tolerance and salinity effects on plants: a review. Ecotoxicology and Environmental Safety, 2005, 60: 324-349.
[34]Sharma P, Dubey R S. Drought induced oxidative stress and enhances the activities of antioxidant enzymes in growing rice seedlings. Plant Growth Regulation, 2005, 16: 209-221.
[35]Liu J H, Zhao H C, Ren Y F,etal. Change of osmotica in oat leaf under soil moisture stress. Acta Botanica Boreali-occidentalia Sinica, 2009, 29(7): 1432-1436.
[36]Liu Z C, Bao D E. Effect of water stress on growth and physiological indexes in Jinguang plum seedlings. Journal of Agricultural University Of Hebei, 2007, 30(5): 28-31.
[37]Neela M M, Ajay K G. Effect of salt stress on praline metabolism in two high yielding genotypes of green gram. Plant Science, 2005, 169: 331-339.
[38]Wang Z. Plant Physiology[M].Beijing: China Agriculture Press, 2010: 422-439.
[39]Shi L R, Liu Z H. Influences of drought stress on antioxidative activity and osmoregulation substance of sonchus brachyotus DC. Acta Agrestia Sinica, 2010, 18(5): 673-677.
[40]Aror A A, Sairam R K, Srivastava G C. Oxidative stress and antioxidative system in plants. Current Science, 2002, 82: 1227-1238.
[41]Ahang J X, Kirkhan M B. Drought stress induced changes in-actibities of super oxided ismutase, catalase and perosidaes in wheat species. Plant Cell Physiology, 1994, 35(5): 785-791.
[42]Du R F, Hao W F, Wang L F. Dynamic responses on anti-oxidative defense system and lipid peroxidation ofLespedezadavuricato drought stress and re-watering. Acta Prataculturae Sinica, 2012, 21(2): 51-61.
[43]Ji Y, Zhang X Q, Peng Y,etal. Effects of drought stress on lipid peroxidation,osmotic adjustment and activities of protective enzymes in the roots and leaves of orchardgrass. Acta Prataculturae Sinica, 2014, 23(3): 144-151.
参考文献:
[1]李红, 杨允菲. 恢复措施对退化草地羊草种群有性生殖数量特征的影响. 应用生态学报, 2004, 15(5): 819-823.
[2]李伟, 曹坤芳. 干旱胁迫对不同光环境下的三叶漆幼苗光合特性和叶绿素荧光参数的影响. 西北植物学报, 2006, 26(2): 266-275.
[3]丁玉梅, 马龙海, 周晓罡, 等. 干旱胁迫下马铃薯叶片脯氨酸、丙二醛含量变化及与耐旱性的相关性分析. 西南农业学报, 2013, (1): 106-110.
[7]马国瑞, 侯勇. 常用植物生长调节剂安全施用指南[M]. 北京:中国农业出版社, 2008: 109-125.
[8]冯朝红, 李凯荣, 张鹏文, 等. 干旱胁迫下油菜素内酯对文冠果苗木抗氧化酶活性和抗氧化剂含量的影响. 干旱地区农业研究, 2008, 26(4): 152-155.
[10]吴少华. BR和KT对草莓抗旱性的影响. 福建农业学报, 2001, 16(2): 56-58.
[11]周天, 胡勇军, 张丽辉, 等. 油菜素内酯对玉米幼苗抗旱性的影响. 长春师范学院学报:自然科学版, 2003, 22(2): 66-68.
[12]胡勇军, 韩德复, 郭继勋. 油菜素内酯对羊草人工草地产量及其品质的影响. 长春师范学院学报: 自然科学版, 2007, 26(7): 61-64.
[13]韩刚, 孙楠, 李凯荣. 油菜素内酯对三个树种苗木抗旱性影响的综合评价. 干旱地区农业研究, 2007, 25(2): 92-97.
[14]李一萍, 刘子凡, 黄洁,等. 水杨酸和油菜素内醋对木薯苗抗旱生理特性的影响. 江西农业科学, 2010, 22(7): 25-28.
[15]韩德复, 胡勇军, 郭继勋, 等. 油菜素内酯对羊草抗旱性的影响. 长春师范学院学报, 2007, 26(6): 51-53.
[16]高焕晔, 王三根, 宗学凤, 等. 灌浆结实期高温干旱复合胁迫对稻米直链淀粉及蛋白质含量的影响. 中国生态农业学,2012, 20(1): 40-47.
[25]李忠光, 李江鸿, 杜朝昆, 等. 在单一提取系统中同时测定五种植物抗氧化酶. 云南师范大学学报(自然科学版), 2002, 22(6): 44-48.
[26]王霞, 袁侯平. 植物对干旱胁迫的适应机理. 干旱区研究, 2001, 18(2): 42-46.
[27]李明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响. 生态学报, 2002, 22(4): 503-507.
[28]韩建秋, 王秀峰, 张志国. 表土干旱对白三叶根系分布和根活力的影响. 中国农学通报, 2007, 23(3): 458-461.
[29]王江春, 于波, 王荣, 等. 山东省小麦品种演变及产量性状的遗传分析. 山东农业科学, 2007, (2): 77-79.
[31]李继新, 丁福章, 袁有波. 不同强度干旱胁迫对烤烟叶片质膜透性和丙二醛含量的影响. 贵州农业科学, 2008, 36(4): 34-35.
[32]孙国荣, 关杨, 阎秀峰. 盐胁迫对星星草幼苗保护酶系统的影响. 草地学报, 2001, 9(1): 34-38.
[35]刘景辉, 赵海超, 任永峰, 等. 土壤水分胁迫对燕麦叶片渗透调节物质含量的影响. 西北植物学报, 2009, 29(7): 1432-1436.
[36]刘遵春, 包东娥. 水分胁迫对金光杏梅幼苗生长及其生理指标的影响. 河北农业大学学报, 2007, 30(5): 28-31.
[38]王忠. 植物生理学[M]. 北京:中国农业出版社, 2010: 422-439.
[39]时丽冉, 刘志华. 干旱胁迫对苣荬菜抗氧化酶和渗透调节物质的影响. 草地学报, 2010, 18(5): 673-677.
[42]杜润峰, 郝文芳, 王龙飞. 达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应. 草业学报, 2012, 21(2): 51-61.
[43]季杨, 张新全, 彭燕, 等. 干旱胁迫对鸭茅根、叶保护酶活性、渗透物质含量及膜质过氧化作用的影响, 草业学报, 2014, 23(3): 144-151.
