低分子肝素和肝素钠对大鼠切除术后肝再生情况影响①
2016-01-26张旭,丁隆
张 旭,丁 隆
(佳木斯大学附属第一医院普外二科,黑龙江 佳木斯154003)
低分子肝素和肝素钠对大鼠切除术后肝再生情况影响①
张旭,丁隆
(佳木斯大学附属第一医院普外二科,黑龙江 佳木斯154003)
摘要:目的:观察低分子肝素和肝素钠对于肝再生情况及肝再生终止因子TGF-β1在大鼠肝再生的表达及其与肝再生的关系。方法:选取正常的清洁级雄性Wistar大鼠50只,随机分成5组,每组10只。5组均为切除50%肝叶的大鼠,肝切除术后3h,A组为对照组(生理盐水注射),B组为给予肝素钠(1000U/kg),C组为皮下注射肝素(1000U/kg),D组为给予肝素+TGF-β抑制剂,E组为给予肝素+TGF-β激动剂。于术后3d、5d、7d各组分别随机选择7只解剖,取其肝脏并秤取肝脏重量并计算肝再生速率,采用流式细胞仪方法分析计算肝细胞再生指数,术后免疫组织化学检测各组增殖细胞核抗原PCNA,RT-PCR检测TGF-β的表达。结果: 5组大鼠于术后第3天、5天、7天后肝再生速率和肝细胞再生指数比较差异均有统计学意义(P<0.05),通过比较分析显示,B组、C组和D组均高于A组(P<0.05),A组和E组无差异(P>0.05)。结论:肝素钠和低分子肝素均可促进大鼠50%肝切除术后肝再生,通过抑制HGF信号通路细胞进展期TGF-β的作用,影响肝再生,提高肝细胞再生指数,两者促进肝再生有待于进一步研究。
关键词:低分子肝素;肝素钠;肝再生;TGF-β
在临床治疗上,肝素钠和低分子肝素广泛用于预防血栓形成和栓塞性疾病及各种原因引起的弥散性血管内凝血的治疗,也用于其他操作的处理,如血液标本和器械的抗凝处理,血液透析、体外循环、导管术等操作的应用。既往研究证实,低分子肝素和肝素钠能够促进肝再生,本文对其是否能够促进肝再生进行了研究。肝再生涉及细胞结构功能重建等一系列生理生化活动,其中包括细胞激活、增殖及其调控。在肝再生中起到重要作用的是肝脏的主要实质细胞—肝细胞,大约占肝脏细胞总数的65%、总肝量的70%~80%。本次试验研究肝素钠和低分子肝素对大鼠切除术后肝再生率,探讨肝素钠和低分子肝素对肝再生指数的提高。现将结果报道如下。
1 材料与方法
1.1动物模型制作及分组
实验动物选用正常清洁级雄性Wistar大鼠50只,体重为230~290g,由佳木斯大学动物实验中心提供。大鼠肝切除术前在较恒定的环境中选用固定食料喂养,自由进食水。手术前禁食不禁水。所有手术动物均在相对无菌条件下,乙醚开放吸入麻醉,尽量在上午8~12点同一个时间手术。按照Higgins法行肝切除术,即切除尾状叶、左侧叶,约占肝脏的50%。在手术后不同时期(3d、5d、7d)三组大鼠各组分别有一定数量动物被杀死,将Wistar大鼠50只随机分成5组,即A、B、C、D、E组,每组10只。5组均为切除50%肝叶的大鼠,肝切除术后3h,A组为对照组(生理盐水注射),B组为给予肝素钠(1000U/kg),C组为皮下注射肝素(1000U/kg),D组为给予肝素+TGF-β抑制剂,E组为给予肝素+TGF-β激动剂。
1.2实验指标检测
于术后3d、5d、7d各组分别随机选择7只解剖,获取标本进行相关指标检测:
1.2.1肝脏再生速率评估:依据公式为X=(W2-W1) /W1,计算肝再生速率,其中W1为肝切除术后剩余肝重,W2为处死时肝重。
1.2.2肝细胞再生指数(PI):用眼科剪在大鼠处死后立即取左中叶,机械法制作取得肝脏单细胞悬液,在倒置显微镜下调整细胞数为1×105/mL,染色后应用流式细胞仪计算肝细胞再生指数。
1.2.3免疫组织化学法检测各组增殖细胞核抗原PCNA。
1.2.4RT-PCR检测TGF-βmRNA的表达
(1)Trizol法提取肝脏组织总RNA (2)将提取的RNA适当稀释后,分光光度计260nm测定RNA的浓度、分光光度计测A260/A280比值测定RNA的纯度(l.8~2.2),甲醛变性琼脂糖凝胶电泳观察RNA完整性。所有RNA样品置-20℃保存备用。
引物设计:
TGF-β1 F 5’-TGG CGT TAC CTT GGT AAC C-3’
R 5’-GGT GTT GAG CCC TTT CCA G-3’
β-actin F 5’-ACC CTT AAG GCC AAC CGT GAA AAG-3’
R 5’-TCA TGA GGT AGT CTG TCA GGT-3’
采用荧光定量PCR仪进行mRNA定量检测,反应条件为:94℃205,60℃40s,扩增40个循环。目的基因RNA相对表达量采用2△ct表示,即目的基因△Ct=靶基因Ct-β-actinCt, △△Ct=△Ct—平均△Ct,相对表达量为2-平均△ct 。
1.3统计学方法
采用SPSS 19.0软件包处理,计量资料用“均数±标准差”表示,组间比较采用方差分析,以α=0.05作为检验水准,P<0.05差异有统计学意义。
2 结果
2.1各组大鼠肝再生速率
于术后第3天、5天、7天后三组大鼠肝再生速率比较差异均有统计学意义,通过比较分析显示,B组、C组和D组均高于A组(P<0.05),A组和E组无差异(P>0.05)。见表1。
表1 各组大鼠肝再生速率比较±s)
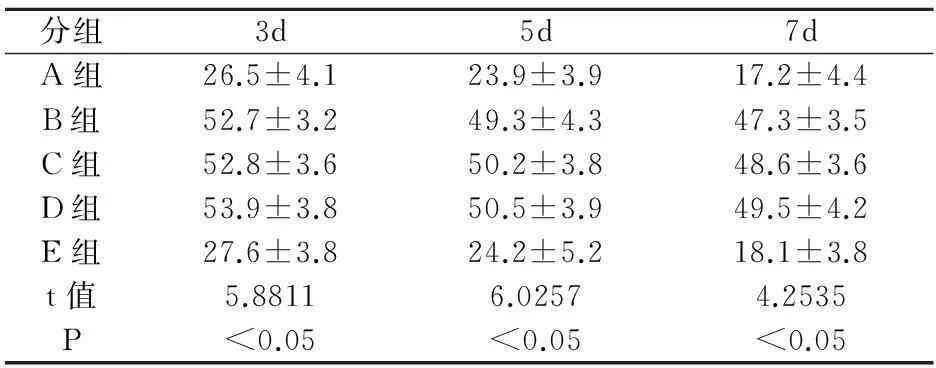
分组3d5d7dA组26.5±4.123.9±3.917.2±4.4B组52.7±3.249.3±4.347.3±3.5C组52.8±3.650.2±3.848.6±3.6D组53.9±3.850.5±3.949.5±4.2E组27.6±3.824.2±5.218.1±3.8t值5.88116.02574.2535P<0.05<0.05<0.05
2.2各组大鼠肝细胞再生指数
于术后第3天、5天、7天后三组大鼠肝细胞再生指数比较差异均有统计学意义,通过比较分析显示,B组、C组和D组均高于A组(P<0.05),A组和E组无差异(P>0.05)。见表2。
表2 各组大鼠肝细胞再生指数比较±s)
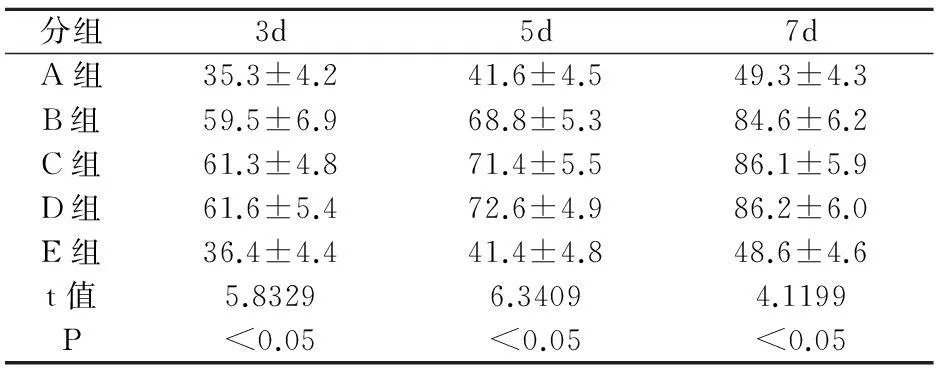
分组3d5d7dA组35.3±4.241.6±4.549.3±4.3B组59.5±6.968.8±5.384.6±6.2C组61.3±4.871.4±5.586.1±5.9D组61.6±5.472.6±4.986.2±6.0E组36.4±4.441.4±4.848.6±4.6t值5.83296.34094.1199P<0.05<0.05<0.05
2.3免疫组织化学检测各组增殖细胞核抗原PCNA
各实验组分别于术后3、5、7天行肝穿肝组织,用10%中性福尔马林固定, 进行免疫组织化学检测,检测方法按照说明书进行。免疫组化阳性结果判定标准:PCNA 以细胞核呈界限清楚的棕色反应为阳性,B、C、D组以细胞浆中出现明显的棕色反应为阳性。见图1~3。
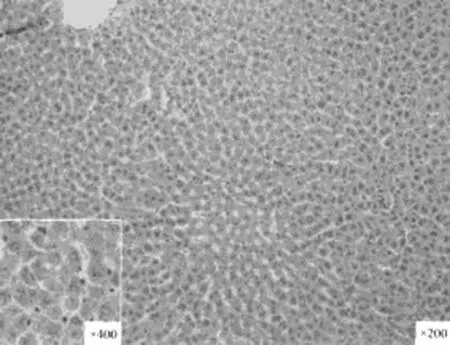
图1对照组
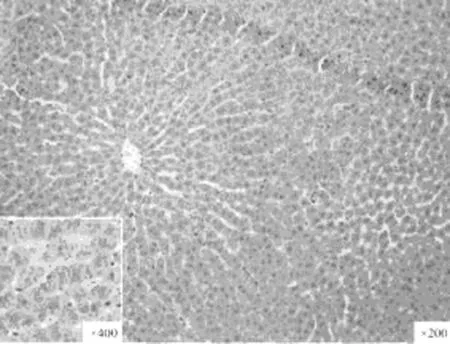
图2 肝素+TGF-β抑制剂
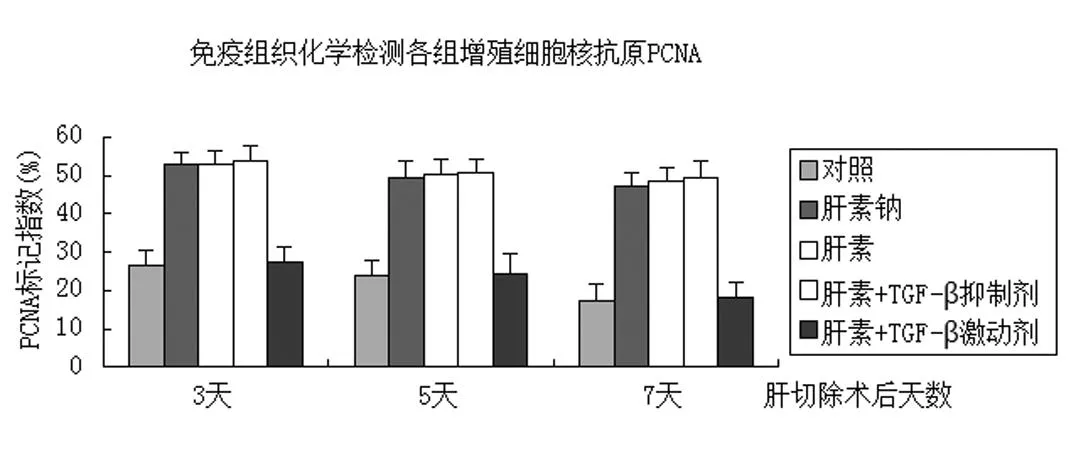
图3 免疫组织化学检测各组增值细胞核抗原PCNA
2.4RT-PCR检测TGF-β1mRNA的表达
见图4。

图4 大鼠肝细胞TGF-β1 PCR产物电泳图
4 讨论
在临床活体肝移植术中,通常用普通肝素、低分子肝素钠和低分子肝素钙等药物做早期预防及治疗肝动脉血栓的形成,本文主要探讨体内注射普通肝素对移植肝或供体残肝肝再生的相关影响,以及肝再生终止因子TGF-β1在肝再生中的表达及其与肝再生的关系。参考国外文献所述,肝素对肝再生的影响观点尚不一致,早在1996年,Kunio M[1]等报道,体外培养的细胞,如成纤维细胞、脐静脉内皮细胞等受到肝素刺激后,能使分泌的肝细胞生长素(HG)升高,高出3~6倍,与剂量有密切关系,而且大鼠血循环中的HGF水平与以往相比较,亦往高出2~2.5倍,但却无法促进体外原代培养中肝细胞的DNA合成。基于上述情况,本实验探讨在临床活体实验中,肝素是否能够促进肝再生进行研究。为避免再生节律对肝再生的影响,保证每天14时以前切除大鼠50%肝脏,建立肝损伤后再生模型。于术后3h给予肝素钠和低分子肝素,目的是避免肝断面出血。有学者报道[2,3]腹膜注射给予肝素效果优越,而我们为了避免了多次腹腔注射会损伤肠道及腔静脉,选择皮下给药。我们实验结果显示,肝素钠和低分子肝素在肝切除术后早中期对肝再生有明显的促进作用。而给予肝素钠和低分子肝素后大鼠肝再生速率无差异,通过实验数据可以看出给予低分子肝素后肝再生率略高于肝素钠。
肝再生大体可分为三个阶段,启动阶段:G0-G1期;增殖阶段:G1-S期;终止阶段:G1-G0期。肝细胞再生不同于各种干细胞增殖,当干细胞受到增殖信号刺激时可直接进行DNA合成和细胞分裂,而肝细胞增殖需要已成熟分化的肝细胞重新活化,才能启动后续的增殖过程,即肝细胞由细胞周期的G0期转化至G1期。TGF-β1可以抑制肝细胞进入G1期,血清TGF--β1浓度可以影响HGF调节肝再生,维持肝切除后的内环境稳定。TGF-β1被认为是肝再生过程从增生阶段进入终止阶段的重要因子[5]。阻断TGF-β1表达的作用可以促进肝细胞增殖。本实验研究低分子肝素和肝素钠是通过阻断TGF-β1的表达,TGF-β1mRNA的表达下降,从而促进肝再生。而使用TGF-β1激动剂后,TGF-β1对肝再生有抑制作用,因此可以推测肝素和肝素钠是通过抑制TGF-β因子影响肝再生的。香港Li等[6]发现对切除70%肝脏的大鼠,肝素对其肝再生无明显影响,且对肝功能恢复亦无促进作用。原因可能是切除70%肝脏的大鼠创伤太大,影响大鼠的肝再生,本次研究发现,肝素钠和低分子肝素均可促进大鼠50%肝切除术后肝再生,通过抑制HGF信号通路细胞进展期TGF-β的作用,影响肝再生,提高肝细胞再生指数, 肝素和肝素钠是通过抑制TGF-β因子影响肝再生的。
综上,本实验初步结果显示肝素钠和低分子肝素均可促进大鼠50%肝切除术后肝再生,通过抑制HGF信号通路细胞进展期TGF-β1的作用,影响肝再生,增加肝细胞再生指数,两者促进肝再生效果有待于进一步研究。
参考文献:
[1] 赵丽娜.78 例肝脏损伤CT临床分析[J].黑龙江医药科学,2011,34(1):112
[2] Moreno E,Meneu J,Calle A, et al. Modulation of hepatocyte growth factor plasma levels in relation to the dose of exogenous heparin administered:an experimental studying rats[J].Transplantation Proceedings,2005, 37: 3943-3947
[3]Teizo N,Shigeki A,Masayuki I, et al. Heparin accelerates liver regeneration following portal branch ligation in normal and cirrhotic rats with increased plasma hepatocyte growth factor levels[J]. Journal of Hepatology,2002, 37: 87-92
[4]Xu X,Jha AK,Jia X, et al. Heparin - decorated,hyaluronic acid -based hydrogel particles for the controlled release of bone morphogeneticprotein 2[J]. Acta Biomater,2011,7( 4) : 1508-1514
[5]Go DP,Gras SL,Connor AJ,et al. Multilayered microspheres for the controlled release of growth factors in tissue engineering[J]. Biomacromolecules,2011,12( 5) : 1494-1503
[6]张玉萍, 侯霞, 江清林, 等. Surviv in基因在肝组织、肝硬化和肝癌中的表达及其临床意义 [ J]. 黑龙江医药科学, 2011, 34(4): 1-2
Low molecular heparin and heparin
on liver regeneration after resection of rats
ZHANGXu,DINGLong
(The Second General Surgery Department,the First Affiliated Hospital to Jiamusi University,Jiamusi 154003,China)
Abstract:Objective:To Oobserveation of low molecular heparin and sodium heparin for liver regeneration and liver regeneration termination factor TGF - beta 1 expression in rat liver regeneration and its relations with liver regeneration. Methods: 50 Select normal grade clean male Wistar rats provided by jiamusi university center for animal experiment were selected, with only 50 rats weight is 230~290 grams, provided by jiamusi university center for animal experiment. They were Rrandomly divided into 5 groups, namely, A, B, C, D, E group, with 10 in each group. 5 groups were resected 50% lobe of rats, and 3 h after liver resection, to give physiological saline group A, group B to give (1000 U/kg), heparin sodium for subcutaneous injection heparin group C (1000U/kg), group D to give heparin + TGF - beta inhibitor, to give heparin group E + TGF - beta agonist. In three days, five days, 7 days each group were randomly selected 7 anatomy, only take the liver and scale take liver weight and liver regeneration rate was calculated by adopting the method of flow cytometry instrument analysis and calculation of liver cell regeneration index, postoperative PCNA PCNA immunohistochemical detection of each group, rt-pcr to detect the expression of TGF - beta. Results:5 groups of rats in 3 days, five days, 7 days after liver regeneration rate and index of liver cell regeneration comparative differences are statistically significant (P<0.05). Through the comparative analysis showsed that group B, C and D group were higher than group A (P<0.05). There was no difference between group A and group E no difference (P>0.05). Conclusion:Heparin and low molecular heparin can promote rat liver regeneration after liver resection, 50% by inhibiting HGF signaling pathways progress TGF - the role of beta cells, which affect the liver regeneration, improve the index of liver cell regeneration., bBoth promote liver regeneration and remains to be further research.
Key words:low molecular heparin; heparin sodium;liver regeneration
中图分类号:R657.3
文献标识码:B
文章编号:1008-0104(2015)06-0143-03
作者简介:①张旭(1987~)女,黑龙江鹤岗人,在读硕士研究生。
通讯作者:丁隆(1978~)女,黑龙江佳木斯人,博士,副主任医师。E-mail:398746446@qq.com。
(收稿日期:2015-03-02)
