人脑胶质瘤组织ABCG2蛋白的表达变化及其意义
2016-01-25王明国王向鹏杨智勇段奎甲宋晓斌邓兴力
王明国,王向鹏,杨智勇,段奎甲,宋晓斌,邓兴力
(昆明医科大学第一附属医院,昆明650032)
人脑胶质瘤组织ABCG2蛋白的表达变化及其意义
王明国,王向鹏,杨智勇,段奎甲,宋晓斌,邓兴力
(昆明医科大学第一附属医院,昆明650032)
摘要:目的观察人脑胶质瘤组织中ABCG2蛋白的表达变化,并探讨其意义。方法采用免疫组织化学法检测59例份人脑胶质瘤组织,5例份正常脑组织中的ABCG2蛋白,并分析其与脑胶质瘤患者年龄、性别、病理分级、肿瘤部位临床病理参数的关系。结果人脑胶质瘤组织ABCG2蛋白阳性细胞百分比为19.27%±16.80%,正常人脑组织为0,两者比较,P<0.05。WHO Ⅰ、Ⅱ、Ⅲ、Ⅳ级人脑胶质瘤组织中ABCG2蛋白阳性细胞百分比分别为6.40%±2.77%、11.13%±8.69%、17.25%±10.90%、31.94%±20.32%,WHO Ⅲ、Ⅳ级与WHO Ⅰ、Ⅱ 级比较,P<0.05。年龄≤45岁、>45岁者ABCG2蛋白阳性细胞百分比分别为15.02%±12.07%、25.06%±20.52%,两者比较,P<0.05。结论 ABCG2蛋白在人脑胶质瘤组织高表达,其表达与肿瘤病理分级、年龄有关,可能有助于判断胶质瘤生物学行为、预后、化疗效果。
关键词:脑肿瘤;胶质瘤;ABCG2蛋白
脑胶质瘤多呈高度浸润性生长,预后较差,极易复发。手术仍是脑胶质瘤最主要的治疗方式,术后常需辅助化疗,但随着肿瘤多药耐药性(MDR)的出现,化疗药物作用的敏感性降低,而化疗抵抗是引起患者预后不良的重要因素之一[1,2]。因此,探索胶质瘤MDR的相关作用机制及其有效逆转策略成为脑肿瘤研究的热点[3]。研究发现,ABCG2在多种耐药肿瘤细胞株中过度表达,提示ABCG2作为一种半分子转运蛋白,在肿瘤化疗的多药耐药中具有重要作用。本研究观察了人胶质瘤组织中ABCG2蛋白的表达变化,并探讨其意义。
1材料与方法
1.1组织标本人胶质瘤组织标本来自昆明医科大学第一附属医院神经外科2014年6月~2015年6月手术切除并经病理诊断确定的59例份胶质瘤组织,标本收集前均经患者及家属同意,术前均未行任何其他辅助治疗。59例患者中男28例、女31例,年龄14~77岁、中位年龄46岁。WHO病理分级Ⅰ级11例、Ⅱ级9例、Ⅲ级19例、Ⅳ级20例。另收集取自本科室各种手术入路及手术减压术中切除的正常脑组织标本5例份作为对照。
1.2主要试剂小鼠抗人ABCG2单克隆抗体(美国abcam公司);Super Vision超敏两步法免疫组化试剂盒,DAB显色试剂盒(武汉博士德生物工程公司)。
1.3ABCG2蛋白检测方法采用免疫组化染色法。所有组织标本经4%甲醛固定,常规石蜡包埋后作5 μm厚组织切片。组织切片经二甲苯、梯度乙醇脱蜡水化,并进行抗原热修复,3% H2O2灭活内源性过氧化物酶活性,5% BSA封闭后,滴加稀释好的ABCG2于4 ℃孵育过夜,次日用PBS漂洗数次后,滴加聚合HRP标记IgG。DAB试剂盒显色5~10 min(光学显微镜下控制显色程度),脱水、透明、封片后观察。PBS代替一抗作空白对照。染色结果判定标准:ABCG2主要表达于细胞膜,部分表达于细胞质,染成棕褐色。于低倍光学显微镜下(×100)寻找细胞阳性区域后,在高倍镜(×400)下分别计数随机5个视野中的平均阳性细胞数和细胞总数,以平均阳性细胞数与平均细胞总数的比值百分比计算ABCG2蛋白阳性细胞百分比。

2结果
人脑胶质瘤组织ABCG2蛋白阳性细胞百分比为19.27%±16.80%,正常人脑组织为0,两者比较,P<0.05。ABCG2阳性细胞在脑胶质瘤中呈非均匀分布,部分区域可见阳性细胞密度较高,聚集分布,阳性细胞形态不规则,大小不一致,有时可见阳性细胞成条索状排列、类似毛细血管的结构。ABCG2蛋白表达与脑胶质瘤临床病理参数的关系见表1。WHO Ⅲ、Ⅳ级较WHO Ⅰ、Ⅱ级人脑胶质瘤组织中ABCG2蛋白阳性细胞百分比高(P<0.05)。年龄>45岁者较年龄≤45岁者ABCG2蛋白阳性细胞百分比高(P<0.05)。
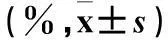
表1 ABCG2蛋白表达与脑胶质瘤临床病理
3讨论
恶性胶质瘤是我国最常见的脑肿瘤之一,其预后极差,严重威胁人类的生命健康。目前手术仍是其最主要的治疗方式,结合分子靶向治疗及同步放化疗的综合治疗策略在胶质瘤的诊疗中显现出明显优势[4,5]。然而肿瘤的化疗耐药限制了恶性肿瘤患者的首次治疗效果,一线治疗方案失败后的补救治疗效果亦很差[6,7]。与其他各部位肿瘤化疗一样,肿瘤细胞对抗癌化疗药物的多药耐药是脑恶性肿瘤化疗效果差的最重要原因。
Zhou等[8]报道,ABCG2基因可以作为一种通用的干细胞鉴定标志物。且已有大量研究表明,在肿瘤组织中也存在着肿瘤干细胞并携有ABCG2半转运体的表达,相关ABCG2半转运体在肿瘤干细胞中的生物学功效研究已成为近年癌症治疗研究中的热点问题[9]。研究主要集中于ABCG2肿瘤干细胞的分选功能及其多药耐药功能[10,11]。将该基因转染非耐药的乳腺癌细胞株,转染细胞获得了与耐药细胞株MCF-7/AdrVp相似的耐药特征,对甲氨蝶呤、米托蒽醌、柔红霉素、阿霉素拓扑替康及其半合成物耐药[3,12]。肿瘤干细胞或肿瘤中的侧群细胞因表达ABCG2而产生耐药的生物学特性,导致术后化疗效果极差,是恶性肿瘤难以根除的原因之一[13].
本研究结果显示,正常人脑组织中未见ABCG2蛋白表达,而在各分级胶质瘤组织中均有不同程度的表达,且病理分级WHO Ⅲ、Ⅳ级较WHO Ⅰ、Ⅱ级人脑胶质瘤组织中ABCG2蛋白阳性细胞百分比高。而只有处于干细胞阶段的细胞才表达ABCG2,提示病理分级高的胶质瘤组织存在更多的脑肿瘤干细胞,其临床侵袭性更高,患者出现化疗耐药的可能性较大,与储亮等[14]的研究结果一致。在本研究中,ABCG2免疫阳性细胞呈条索状排列,部分区域可见阳性细胞密度较高,聚集分布。提示脑胶质瘤的发生可能是以少数的脑肿瘤干细胞为生发根源,逐渐增殖分化并向临近微环境迁移整合,历经此生物学过程,大量脑肿瘤干细胞分化成肿瘤细胞,仅少数细胞仍保持其干细胞特性。术后残存的肿瘤干细胞可通过自我更新及多分化潜能,在人脑胶质瘤的发生、发展、复发、耐药过程中起关键作用。此外,本研究还发现人脑胶质瘤中ABCG2的表达与患者的性别、肿瘤生长部位无关,而与患者的年龄密切相关,提示ABCG2的高表达可能源于细胞基因突变在脑肿瘤干细胞内的长期积累。以上研究结果提示,脑肿瘤干细胞使肿瘤具有对周围脑组织的侵润能力和对放化疗的抵抗性,是脑胶质瘤高致死率和高复发率的根源。
相关研究[15]结果表明,黑色素瘤细胞中ABCG2的异常表达是细胞对Vemurafenib出现耐药的重要分子机制之一,在人黑色素瘤A375细胞中敲低ABCG2可显著改善Vemurafenib的药物敏感性,证实ABCG2异常表达是机体对靶向药物产生耐药反应的重要分子机制之一。因此,有可能通过干预ABCG2在肿瘤干细胞中的表达来调控肿瘤干细胞增殖分化从而达到治愈癌症的目的。ABC转运蛋白抑制剂能够增加化疗药物在脑内的积累。gefitinib的口服给药能够增加topotecan在神经系统胶质瘤中的药物浓度。这些研究都说明了通过抑制ABC跨膜转运蛋白,能够增高ABC转运蛋白底物谱中的药物穿过血脑屏障的概率,增加这些药物在神经系统的积累,可用于治疗神经系统疾病[16]。
综上所述,人胶质瘤组织ABCG2蛋白表达增高,其表达与肿瘤病理分级、年龄有关。深入探究ABCG2的表达与肿瘤MDR及与肿瘤干细胞分化调控的相关作用机制[17],将会对寻找新的癌症治疗策略提供新思路。ABCG2蛋白可能有助于判断胶质瘤生物学行为、预后、化疗效果,并可作为生物靶向治疗的有效靶点。
参考文献:
[1] Weiler M, Blaes J, Pusch S, et al. mTOR target NDRG1 confers MGMT-dependent resistance to alkylating chemotherapy[J]. Proc Natl Acad Sci U S A, 2014,111(1):409-414.
[2] Sørensen MD, Fosmark S, Hellwege S, et al. Chemoresistance and chemotherapy targeting stem-like cells in malignant glioma[J]. Adv Exp Med Biol, 2015,853:111-138.
[3] 孙臻峰,沈斌,张佳,等.耐药基因MDR1(P-gp)和ABCG2在Hep-2细胞耐药中的作用研究[J].临床耳鼻咽喉头颈外科杂志,2015,29(11):1016-1019.
[4] Nakano I. Stem cell signature in glioblastoma: therapeutic development for a moving target[J]. J Neurosurg, 2015,122(2):324-330.
[5] 王小刚,吴国斌,袁绍纪,等.大脑胶质瘤病研究现状[J].临床神经外科杂志,2014,11(6):478-480.
[6] Quezada C, Garrido W, Oyarzún C, et al. 5′-ectonucleotidase mediates multiple-drug resistance in glioblastoma multiforme cells[J]. J Cell Physiol, 2013,228(3):602-608.
[7] Noguchi K, Katayama K, Sugimoto Y. Human ABC transporter ABCG2/BCRP expression in chemoresistance: basic and clinical perspectives formolecular cancer therapeutics[J]. Pharmgenomics Pers Med, 2014,7:53-64.
[8] Bruttel VS, Wischhusen J. Cancer stem cell immunology: key to understanding tumorigenesis and tumor immune escape[J]. Front Immunol, 2014,5:360.
[9] Blaylock RL. Cancer microenvironment, inflammation and cancer stem cells: A hypothesis for a paradigm change and newtargets in cancer control[J]. Surg Neurol Int, 2015,6:92.
[10] Chen Z, Liu F, Ren Q, et al. Suppression of ABCG2 inhibits cancer cell proliferation[J]. Int J Cancer, 2010,126(4):841-851.
[11] Szepesi A, Matula Z, Szigeti A, et al. ABCG2 is a selectable marker for enhanced multilineage differentiation potential in periodontal ligament stemcells[J]. Stem Cells Dev, 2015,24(2):244-252.
[12] Jani M, Ambrus C, Magnan R, et al. Structure and function of BCRP, a broad specificity transporter of xenobiotics and endobiotics[J]. Arch Toxicol, 2014,88(6):1205-1248.
[13] Ciurea ME, Georgescu AM, Purcaru SO, et al. Cancer stem cells: biological functions and therapeutically targeting[J]. Int J Mol Sci, 2014,15(5):8169-8185.
[14] 储亮,黄强,张全斌,等.脑肿瘤干细胞耐药基因ABCG2的实验研究[J].中国药学杂志,2009,57(10):754-758.
[15] Wu CP, Sim HM, Huang YH, et al. Overexpression of ATP-binding cassette transporter ABCG2 as a potential mechanism of acquired resistance tovemurafenib in BRAF(V600E) mutant cancer cells[J]. Biochem Pharmacol, 2013,85(3):325-334.
[16] Sanchez-Covarrubias L, Slosky LM, Thompson BJ, et al. Transporters at CNS barrier sites: obstacles or opportunities for drug delivery[J]. Curr Pharm Des, 2014,20(10):1422-1449.
[17] Castillo V, Valenzuela R, Huidobro C, et al. Functional characteristics of cancer stem cells and their role in drug resistance of prostate cancer[J]. Int J Oncol, 2014,45(3):985-994.
收稿日期:(2015-11-02)
通信作者:邓兴力
基金项目:云南省自然科学基金(2007C244M);云南省卫生厅科研 (2012ws0024)。
中图分类号:R739.41
文献标志码:B
文章编号:1002-266X(2015)47-0038-03
doi:10.3969/j.issn.1002-266X.2015.47.014
