丙烯腈降解菌的筛选及应用研究
2016-01-22林春绵,杨浩,魏敏等
丙烯腈降解菌的筛选及应用研究
林春绵,杨浩,魏敏,郭亚萍
(浙江工业大学 生物与环境工程学院,浙江 杭州 310014)
摘要:从处理丙烯腈废水的活性污泥中,以丙烯腈为惟一的氮源逐步富集,筛选到一株具有丙烯腈降解能力的菌株YH-5,通过菌落形态、生理生化指标以及细菌16S rDNA分子鉴定,初步确定该菌株为节杆菌属.对菌株的培养条件进行优化,结果表明:葡萄糖20 g/L,酵母浸膏5 g/L,己内酰胺4 g/L,K2HPO4 0.5 g/L,KH2PO4 0.5 g/L,MgSO4 0.5 g/L,初始pH 7.0,在30 ℃,150 r/min下,培养60 h,菌体酶活为15.44 U/g DCW;在该条件下,对初始质量浓度分别为341.4,624.9,1 205.1,1 829.8 mg/L的丙烯腈均具有较好的降解效果.
关键词:丙烯腈;节杆菌;生物降解
收稿日期:2015-04-23
基金项目:国家自然科学基金青年项目(51108416);浙江省科技厅重大专项国际合作项目(2011C14023)
作者简介:林春绵(1962—),男,浙江温州人,教授,研究方向为污染控制,E-mail:lcm@zjut.edu.cn.
中图分类号:TQ085`+.4
文献标志码:A
文章编号:1006-4303(2015)05-0527-05
Abstract:An acrylonitrile isolate named YH-5 through enrichment screening from the activated sludge of treating acrylonitrile wastewater was identified as Arthrobacter spby analyzing the colony morphology, physiological and biochemical characteristics, and 16S rDNA sequence.The medium composition and the culture conditions were optimized and the results were as follows:glucose 20 g/L,yeast extract 4 g/L,caprolactam 5 g/L, K2HPO4 0.5 g/L, KH2PO4 0.5 g/L, MgSO4 0.5 g/L ,initial pH value 7.0, 30 ℃, 150 r/min.When cultured under the above conditions after 60 h, the nitrile hyddratase activity could reach 15.44 U/g DCW and when the initial concentration of acrylonitrile was 341.4, 624.9, 1 205.1 or 1 829.8 mg/L, the degradation effect was preety good.
Keywords:acrylonitrile; Arthrobacter sp; biodegradation
Screening of an acrylonitrile degradation strain and its application
LIN Chunmian, YANG Hao, WEI Min, GUO Yaping
(College of Biological and Environmental Engineering, Zhejiang University of Technology, Hangzhou 310014, China)
丙烯腈是三大工业合成材料生产中最重要的一种单体.2013年我国丙烯腈总产能为138万t/a,产量约为128万吨,而丙烯腈总消费量约为180万吨[1].随之而来的是,丙烯腈废水排放的问题越来越严重,如不对其加有效处理,将会对环境造成严重的污染,危害人类健康.丙烯腈废水是一种难降解的高浓度的有机废水,如何有效地处理一直是丙烯腈企业的困扰[2].相比于丙烯腈废水处理的物化法,生物法处理有着反应条件温和,处理能耗低,二次污染少等优点,但是因为丙烯腈废水的成分复杂且多数污染物具有生物毒性,可能对微生物产生较大的冲击,使得处理效果不稳定.因此,获得能降解丙烯腈的菌种有利于提高生物法处理的耐冲击性,使整个处理系统能稳定运行.
自上世纪60年代由Thiman等从大麦叶中发现腈水解酶以来,越来越多能产腈水解酶的细菌相继报道,主要包括红球菌、诺卡式菌、假单胞杆菌、克雷伯氏菌属、产碱杆菌属、节杆菌属等,可见其分布广泛.在已有报道中,对一些高效的产腈水解酶菌株如R.rhodochrousJl[3],Rhodococcussp. NDB 1165[4],Alcaligenessp. ECU0401[5],AlcaligenesfaecalisWT10[6]等的研究,均表明了腈水解酶在生物催化方面的巨大应用潜力.目前,有关于腈水解酶细菌的研究主要针对其在生物合成领域的应用,而针对含腈废水的处理方面研究尚未见报道.本文通过以丙烯腈为唯一氮源进行富集培养,然后进行分离和纯化,得到一株能合成腈水解酶的丙烯腈降解菌,对其进行了鉴定和优化了其培养条件,并初步考察了其降解丙烯腈废水的效果.
1实验部分
1.1实验材料
土样:从浙江宁波市镇海区某化工厂采集的废水处理活性污泥用以菌种筛选.
主要仪器和试剂:高压蒸汽灭菌锅,数显电热生化培养箱,恒温振荡摇床,高速冷冻离心机,Agilent气相色谱仪,电子分析天平,pH计等,丙烯腈(99%).
1.2培养基
实验所用各种培养基[7]如下:富集培养基:葡萄糖5 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,MgSO40.5 g/L,pH 7.0,121 ℃下灭菌20 min,丙烯腈于灭菌后加入;平板培养基:富集培养基中加入20 g/L的琼脂;斜面培养基:牛肉膏5 g/L,蛋白胨10 g/L, NaCl 5g/L,琼脂20 g/L,pH 7.0;发酵培养基:葡萄糖20 g/L,酵母浸膏4 g/L,己内酰胺5 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L,MgSO40.5 g/L,pH 7.0.
1.3实验方法
1.3.1丙烯腈降解菌的筛选
称取5 g污泥于装有50 mL富集培养基的摇瓶中,其中丙烯腈体积分数为0.1%,摇床培养3~4 d.移取2 mL培养液接至新的富集培养基中,其中丙烯腈的体积分数为0.2%,摇床培养3~4 d.重复培养4次后,将最后一次富集液梯度稀释并均匀涂布于平板,置于生化培养箱中培养,直至长出单菌落.
从平板上挑取单菌落,将其转接至发酵培养基中,摇床培养3 d后,取20 mL发酵液,于4 ℃,12 000 r/min离心8 min后,磷酸盐缓冲液洗涤2次,收集菌体待用.菌株的降解实验在50 mL的具口锥形瓶中进行,反应体系为10 mL的0.05 mol/L磷酸盐缓冲液(pH=7),30 μL的丙烯腈,反应一定时间后,滴加6 mol/L的盐酸溶液终止反应.将反应液离心取上清液,0.45 μm水膜过滤后进气相检测丙烯腈的残余量,计算丙烯腈的降解率.
1.3.2检测方法
采用气相色谱法[8],色谱柱:FFAP毛细管柱(30 m×320 μm×0.25 μm),色谱条件:进样口260 ℃,柱温190 ℃,FID检测器260 ℃,氢气流量40 mL/min,空气流量450 mL/min,氮气尾吹气流量40 mL/min,进样量0.2 μL,分流比为50∶1.
1.3.3生理生化特征及16S rDNA测序
细菌生理生化鉴定参考《常见细菌系统鉴定手册》[9],细菌16S rDNA的测序工作委托上海生工测序公司完成.
1.3.4生物量及酶活的测定
采用干重法测定菌体的生物量.取10 mL发酵培养液,于4 ℃,10 000 r/min下离心10 min,置于烘箱中60 ℃下烘干至恒重,计算得出1 L发酵液中菌体的生物量.
酶活单位(U)的定义:在30 ℃、pH 7.0下,单位时间内转化丙烯腈生成1 μmol丙烯酸所需要的酶量定义为1个酶活单位(U).比酶活的定义:每1 g干菌体中所含有的的酶活单位,用U/g DCW表示(DCW为细菌干重).丙烯腈转化实验于50 mL的具口锥形瓶中进行.取20 mL发酵培养液,磷酸盐缓冲液洗涤2次,收集菌体并转移至50 mL的具口锥形瓶中,反应体系总体积10 mL,30 μL丙烯腈,盖上玻璃塞,30 ℃,150 r/min下反应2.5 h.反应结束后气相测定丙烯酸产量,计算酶活.
1.3.5丙烯腈降解实验
细菌发酵培养60 h后,向发酵液中分别加入体积分数为0.05%,0.1%,0.2%,0.3%的丙烯腈,进行丙烯腈降解实验,定时取样GC检测丙烯腈残余量,每组实验重复3次.
2结果与讨论
2.1菌种筛选
通过以丙烯腈为惟一氮源进行四轮富集培养后,将最后一次富集培养液梯度稀释后涂布于富集平板培养基上,置于生化培养箱中30 ℃培养,直至长出单菌落后,挑取颜色形态各不相同的单菌落,进行复筛,最终得到一株丙烯腈降解菌YH-5.
2.2菌种初步鉴定
细菌在平板上的菌落形态呈乳白色,边缘规则,菌落表面凸起且光滑,其生理生化鉴定结果结果如表1所示.

表1 生理生化试验结果
细菌16S rDNA PCR扩增产物琼脂糖凝胶电泳(图1),回收PCR产物进行基因测序公司,测得菌株YH-5的16S rDNA实际长度为1 403 bp.将该序列与GeneBank中的数据库进行BLAST比对,利用ClustalX和MEGA软件[10]制作系统发育树(图2),结果表明菌株YH-5的16S rDNA序列与节杆菌属的较多细菌的同源性最高.结合菌落形态及生理生化特征,可初步判断该菌株为节杆菌(Arthrobactersp).在已有报道中,Shen等[11]也已发现一株节杆菌属内能产腈水解酶的细菌.

图1 16S rDNA基因PCR产物琼脂糖电泳图 Fig.1 Agarose gel electrophoresis of 16S rDNA PCR amplication products. Left: PCR amplication products Right:DNA Maker

图2 菌株YH-5的系统发育树 Fig.2 Phylogenetic tree by strain YH-5
2.3菌株YH-5培养条件的优化
2.3.1碳源质量浓度对细菌培养的影响
碳源质量浓度对细菌的生长有一定的影响,浓度过低时,随着细菌生长的葡萄糖越来越少,导致后期缺少必需的营养而使其生长受到抑制;质量浓度过高时,可能导致细菌胞外渗透压高于胞内而不利于生长,也有可能会抑制其他所需酶量的合成.图3显示了葡萄糖质量浓度分别为5,10,15,20,25,30 g/L时细菌的生物量和相对酶活(以葡萄糖质量浓度为20 g/L时为基准).当葡萄糖质量浓度低于20 g/L时,随着质量浓度的升高,细菌的生长量和酶活都逐渐提高,当葡萄糖的质量浓度为20 g/L时,细菌生物量和酶活都相对较高,继续提高葡萄糖的质量浓度,对细菌生长和酶活略有下降,说明葡萄糖质量浓度过高的确对细菌产生了抑制作用.
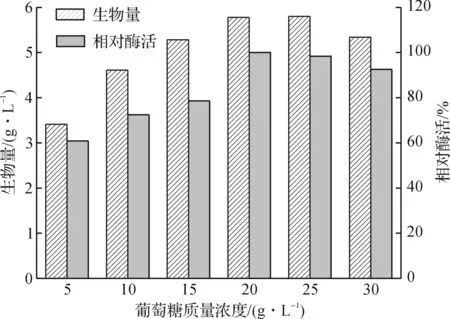
图3 葡萄糖质量浓度对细菌培养的影响 Fig.3 Effects of glucose concentration on the bacteria growth and nitrilase activity
2.3.2氮源浓度对细菌培养的影响
以酵母浸膏为氮源,分别配制酵母浸膏质量浓度为2.5,5.0,7.5,10,12.5,15 g/L的发酵培养基,葡萄糖质量浓度为20 g/L.如图4所示,在酵母浸膏质量浓度低于5.0 g/L时,细菌生长以及产酶都在比较高的水平;当酵母浸膏质量浓度为7.5 g/L时,细菌生物量和酶活都出现急剧下滑,并在较高的质量浓度时,细菌生长和产酶都维持在一个相对较低的水平,因此说明,酵母浸膏质量浓度不宜过高,否则会严重抑制细菌的生长以及产酶.

图4 酵母浸膏质量浓度对细菌培养的影响 Fig.4 Effects of yeast extract concentration on the bacteria growth and nitrilase activity
2.3.3添加诱导剂对细菌培养的影响
在培养基中添加合适的诱导剂,往往能使细菌产酶能力增加.据文献报道,腈水解酶常用的诱导剂有底物、产物或其结构类似物如己内酰胺等[12].当向实验中添加丙烯酸时,培养过程中培养基始终澄清,细菌基本不生长;当添加体积分数为0.1%,0.2%,0.3%的丙烯腈以及2,4,6 g/L的己内酰胺时,空白组不添加任何诱导剂.图5表明:与对照组对比,添加丙烯腈时,细菌生物量以及酶活都变化不大;当添加己内酰胺时,细菌生物量也基本稳定在同一水平,但是酶活得到了提高,当己内酰胺质量浓度为4 g/L时,细菌酶活比对照组提高了29.2%.

图5 诱导剂对细菌培养的影响 Fig.5 Effects of inducer on the bacteria growth and nitrilase activity
2.3.4初始pH值对细菌培养的影响
本实验配制了初始pH分别为5.5,6.0,6.5,7.0,7.5,8.0,8.5,9.0的发酵培养基,图6表明:当pH值为6.5~7.5时,生物量较高且相对稳定,说明在此范围内,细菌生长较好;当pH为7.0时,酶活达到最高值,偏碱或偏酸的环境均不利于细菌产酶.
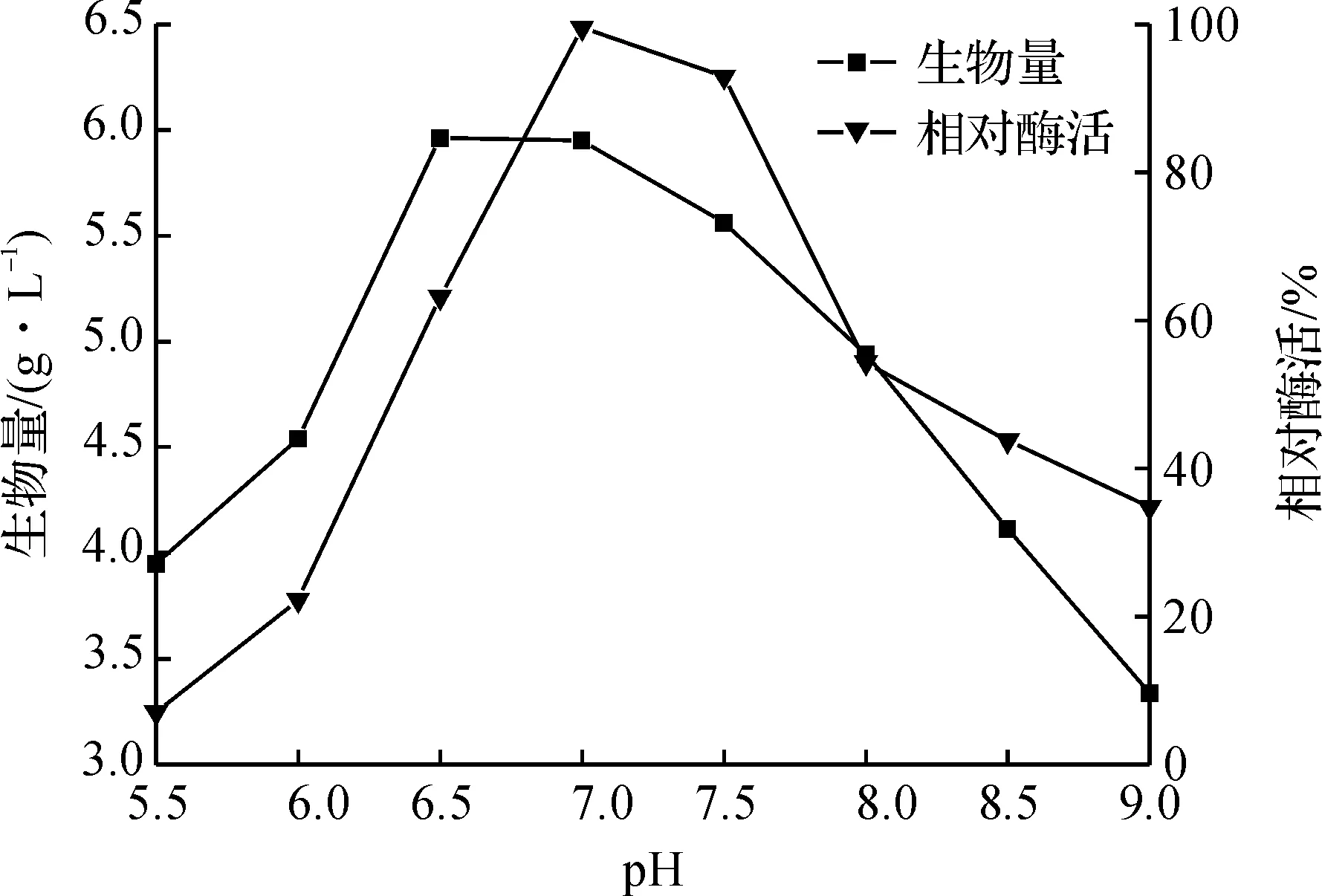
图6 初始pH值对细菌培养的影响 Fig.6 Effects of pH value on the bacteria growth and nitrilase activity
2.3.5细菌生长曲线的测定
菌株从种子培养基以3%的接种量接种至发酵培养基,在30 ℃,150 r/min下连续培养,每隔一定时间测定细菌的生物量和酶活.如图7所示,在0~24 h时,细菌能迅速适应环境,生物量几乎成对数增长,细菌处于对数期;24 h之后细菌生物量基本维持在一个较为平稳的水平,细菌进入稳定期;发酵前期,由于营养物质充分,细菌增殖优先于产酶,细菌达到稳定期后,酶活继续增加,60 h时酶活达到最高.为了选择合适的发酵时间,既能使细菌充分生长和产酶,又避免发酵时间过长,根据上述生长曲线,发酵时间为60 h左右最合适.

图7 菌株YH-5生长及产酶曲线 Fig.7 The growth of strain YH-5 and nitrilase activity changes during the culture time
2.4细菌对不同浓度丙烯腈的降解效果
细菌经摇瓶发酵培养60 h后,加入丙烯腈并测得初始质量浓度分别为341.4,624.9,1 205.1,1 829.8 mg/L.如图8所示,在经过120 h后,丙烯腈的降解率分别为63.47%,60.33%,70.19%,73.12%.比较不同浓度的降解曲线可以看出初始降解速率随着丙烯腈质量浓度的增加而增大,从酶反应动力学的角度来说,在较低浓度范围内,底物丙烯腈的增加能加快反应速率.随着反应的进行,反应速率慢慢减小,96 h之后丙烯腈不再继续减少,产物丙烯酸也不再增加.最终降解率停留在60%~70%左右,造成这一现象的原因,可能是由于丙烯腈的转化产物丙烯酸本身也是一种具有生物毒性的有机物,随着丙烯酸的积累,会对细菌生长造成不利影响;另一方面,丙烯酸还是一种有机酸,它的积累会使体系的pH值下降,这对于酶活性的影响是不利的,导致酶活下降.

图8 细菌对不同质量浓度丙烯腈的降解 Fig.8 The biodegradation of different acrylonitrile concentration by bacteria
3结论
本实验从丙烯腈废水处理的活性污泥中筛选得到一株具有丙烯腈降解能力的菌株.结合菌株YH-5的菌落形态、生理生化指标以及细菌16S rDNA分子的鉴定,初步鉴定其为节杆菌属(Arthrobactersp).通过对培养基组分及培养条件的优化,结果表明:葡萄糖20 g/L,酵母浸膏5 g/L,己内酰胺4 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L,MgSO40.5 g/L,初始pH 7.0,30 ℃,150 r/min,最适发酵时间为60 h左右.在此最适培养条件下培养得到的细菌,酶活为15.44 U/g DCW,比优化前提高了约52%.还研究了菌株YH-5在最适培养条件下扩培之后,对不同质量浓度丙烯腈的降解情况.当丙烯腈质量浓度分别为341.4,624.9,1 205.1,1 829.8 mg/L时,在经过120 h的降解后,降解率分别为63.47%,60.33%,70.19%,73.12%.
参考文献:
[1]黄金霞,陆书来,纪立春.2013年丙烯腈生产与市场分析[J].化学工业,2014(4):36-40.
[2]倪明.丙烯腈生产废水处理技术研究进展[J].水处理技术,2010,36(6):1-4.
[3]MATHEW C D, NAGASAWA T, KOBAYASHI M, et al. Nitrilase-catalyzed production of nicotinic acid from 3-cyanopyridine in Rhodococcus rhodochrous J1[J]. Applied and Environmental Microbiology,1988,54(4):1030-1032.
[4]PRASAD S, MISRA A, JANGIR V P, et al. A propionitrile-induced nitrilase of Rhodococcus sp. NDB 1165 and its application in nicotinic acid synthesis[J]. World Journal of Microbiology and Biotechnology,2007,23(3):345-353.
[5]HE Yucai, XU Jianhe, XU Yi, et al. Biocatalytic synthesis of (R-(—)-mandelic acid from racemic mandelonitrile by a newly isolated nitrilase-producer Alcaligenes sp. ECU0401[J]. Chinese Chemical Letters,2007,18(6):677-680.
[6]XUE Yaping, XU Saizhen, LIU Zhiqiang, et al. Enantioselective biocatalytic hydrolysis of (R, S)-mandelonitrile for production of (R)-(—)-mandelic acid by a newly isolated mutant strain[J]. Journal of Industrial Microbiology & Biotechnology,2011,38(2):337-345.
[7]ZHENG Yuguo, CHEN Jing, LIU Zhiqiang, et al. Isolation, identification and characterization ofBacillussubtilisZJB-063, a versatile nitrile-converting bacterium[J]. Applied Microbiology and Biotechnology,2008,77 (5):985-993.
[8]郭亚萍,王青青,魏敏,等.水样中丙烯腈(酸)快速测定方法的研究[J].浙江工业大学学报,2014,42(6):646-649.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10]李霞,高谦.16S rRNA基因序列分析在临床微生物学中的应用[J].微生物与感染,2006,1(3):184-186.
[11]SHEN Mei, ZHENG Yuguo, SHEN Yinchu. Isolation and characterization of a novelArthrobacternitroguajacolicusZJUTB06-99, capable of converting acrylonitrile to acrylic acid[J]. Process Biochemistry,2009,44(7):781-785.
[12]KHANDELWAL A K, NIGAM V K, CHOUDHURY B, et al. Optimization of nitrilase production from a new thermophilic isolate[J]. Journal of Chemical Technology and Biotechnology,2007,82(7):646-651.
(责任编辑:刘岩)
