烷基化吡咯并吡咯二酮(DPP)衍生物的合成
2016-01-21唐梁斌
韩 亮,王 滨,唐梁斌
(浙江工业大学 化学工程学院,浙江 杭州 310014)
烷基化吡咯并吡咯二酮(DPP)衍生物的合成
韩亮,王滨,唐梁斌
(浙江工业大学 化学工程学院,浙江 杭州 310014)
摘要:以丁二酸二甲酯和对溴苯腈为原料合成对溴苯基取代的DPP衍生物,对其反应条件进行了优化.系统地探究了反应物配比、催化剂和反应时间等因素对反应收率的影响,得到了较优的工艺条件:当投料配比为n(丁二酸二甲酯)∶n(对溴苯腈)=2.4,催化剂叔丁醇钾5当量,叔戊醇中110 ℃反应5 h,收率68.5%.在此基础上以2-噻吩甲腈和丁二酸二甲酯合成了噻吩取代的DPP.进一步对DPP上的N进行烷基化,分别引入甲基、丁基和辛基,合成了五个N-烷基化DPP目标产物.对合成得到的DPP目标产物用核磁氢谱进行了结构鉴定,并测定了紫外吸收光谱和荧光发射光谱.所合成得到的N-烷基化DPP衍生物紫外最大吸收出现在460~550 nm之间,荧光发射光谱主要出现在520~560 nm之间.
关键词:吡咯并吡咯二酮;烷基化;合成;紫外光谱;荧光光谱
小分子杂环类有机染料是一类很有发展前途的重要染料,近年来合成的杂环染料主要以含氮、硫、氧等杂原子为主,它们大多色泽鲜艳,应用性强,具有广阔的发展前景[1-3].其中吡咯并吡咯二酮(DPP)类染料发色值高、色泽鲜艳、具有优良的耐候性、流动性、遮盖能力和耐化学品能力[4-5].自问世以来,吡咯并吡咯二酮类染料就备受青睐,广泛应用于油墨、车漆、金属制品和塑料等高级染料[6-7].近年来,随着电子工业、激光科学和新能源等领域的快速发展,功能性染料的作用愈发显得重要.作为新型的功能性染料,关于吡咯并吡咯二酮类染料的研究受到了广泛关注.研究发现,吡咯并吡咯二酮类化合物分子具有良好的光电性能,吸收光能力强、光化学稳定[8-11].另外,吡咯并吡咯二酮由于其合成方法简单、光谱吸收范围宽、激发寿命长、荧光量子效率高以及电子容易激发,也经常作为结构单元引入染料敏化剂分子中[12-13].得益于DPP的结构特性,通过改变N原子上的取代基团,或者对2,5位的芳香单元及其取代基进行改变,可根据需要调控改变吸收光谱的范围.
DPP合成的方法多种多样,主要有以下三条线路:1) 溴乙酸乙酯路线[14]:溴乙酸乙酯和苯腈类化合物在金属锌的催化下反应合成二苯基DPP,收率较低;2) 丁二酸二酰胺路线[15]:N,N-二甲基苯酰胺与乙醛反应后,再与丁二酰在强碱条件下合成DPP;3) 丁二酸二酯路线[16]:丁二酸二甲酯和苯腈类化合物在强碱条件下发生缩合反应制备DPP.其中在强碱条件下利用丁二酸二烷基酯与苯腈类化合物进行缩合反应的合成路线是最具工业价值的,通常将丁二酸二烷基酯和苯腈在含醇钠的溶剂中,经过加成、闭环、脱醇三个步骤形成DPP分子.三个步骤可以在同一反应器内完成,反应过程操作简单,收率高.笔者以丁二酸二甲酯为原料,分别与对溴苯腈缩合得到二芳基取代的DPP,优化了合成工艺.在此基础上合成了两类二芳基取代的DPP,并对N上烷基进行烷基化,合成得到了五个烷基化DPP衍生物,测定了其紫外光谱和荧光光谱,分析了其构效关系.
1实验
试剂:对溴苯腈、噻吩甲腈、碘甲烷、叔丁醇钾及其他常用试剂均为化学纯试剂.
仪器:X-4数字显示显微熔点测定仪;BrukerAvance III 500 MHz型核磁共振仪;Shimadzu UV-2550紫外-可见光谱仪;日本岛津RF-5301PC荧光分光光度计.
1.12,5-二氢-3,6-二(对溴苯基)吡咯并[3,4-c]吡咯-1,4-二酮Ia的合成
叔丁醇钾(7.67 g,68.5 mmol),对溴苯腈(5.98 g,32.9 mmol),在氮气保护下,于叔戊醇(100 mL)中90 ℃搅拌溶解,保持1 h;缓慢滴加丁二酸二甲酯(2 g,13.7 mmol)的叔戊醇(10 mL)溶液,加完后,升温至110 ℃,反应5 h;然后降温至60 ℃左右,加入甲醇(50 mL)稀释,回流10 min,滴加冰乙酸(20 mL)中和,升温至85 ℃,回流3 h;抽滤,滤饼用热甲醇洗涤三次,干燥后得到红色粗产物,收率68.5%,无需提纯即可用作下一步烷基化的原料.
1.22,5-二氢-3,6-二噻吩基吡咯并[3,4-c]吡咯-1,4-二酮Ib的合成
叔丁醇钾(9.2 g,82.1 mmol),噻吩甲腈(5.9 g,54 mmol),在氮气保护下,于叔戊醇(100 mL)中90 ℃搅拌溶解,保持1 h;缓慢滴加丁二酸二甲酯(3 g,20.5 mmol)的叔戊醇(10 mL)溶液,加完后,升温至110 ℃,反应5 h;然后降温至60 ℃左右,加入甲醇(50 mL)稀释,回流10 min,滴加冰乙酸(20 mL)中和,升温至85 ℃,回流3 h;抽滤,滤饼用热甲醇洗涤三次,干燥后得到黑色粗产物,收率93.2%.无需提纯即可用作下一步烷基化的原料.
1.32,5-二甲基-3,6-二(对溴苯基)吡咯并[3,4-c]吡咯-1,4-二酮II-1的合成
Ia(8.03 g,18 mmol)和叔丁醇钾(2.47 g,22 mmol),溶于N-甲基吡咯烷(100 mL),升温到60 ℃,缓慢滴加碘甲烷(8.5 g,60 mmol),加完后于60 ℃反应24 h.反应结束后,降温至室温,加入乙酸乙酯(100 mL)淬灭反应,水洗,饱和食盐水洗,除去N-甲基吡咯烷酮.旋干后,按照V(石油醚)∶V(乙酸乙酯)=10∶1进行柱层析分离黄色固体,收率23.5%.m.p.>300 ℃;1H NMR(500 MHz,CDCl3):δ7.75(d,J=8.5 Hz,4H,Ar-H),7.65(d,J=8.5 Hz,4H,Ar-H),3.32(s,6H,CH3).
1.42,5-二辛基-3,6-二(对溴苯基)吡咯并[3,4-c]吡咯-1,4-二酮II-2的合成
Ia(4.46 g,10 mmol)和叔丁醇钾(6.44 g,57.5 mmol)溶于N-甲基吡咯烷酮(80 mL),常温搅拌2 h,缓慢滴加溴代正辛烷(27.8 g,144 mmol),加完后升温至85 ℃,反应30 h.反应结束后,降温至室温,将反应物倒入水中,析出固体,二氯甲烷萃取,旋干后,按照V(石油醚)∶V(乙酸乙酯)=10∶1进行柱层析分离得到橙色固体,收率46.2%.m.p.>300 ℃;1H NMR(500 MHz,CDCl3):δ7.82(d,J=8 Hz,4H,Ar-H),7.54(d,J=8 Hz,4H,Ar-H),3.75(t,J=7.5 Hz,4H,NCH2),1.64~1.60(m,4H,NCH2CH2),1.27~1.20(m,20H,N(CH2)3CH2),0.86(t,J=7 Hz,6H,CH3).
1.52.5-二甲基-3,6-二噻吩基吡咯并[3,4-c]吡咯-1,4-二酮II-3的合成
Ib(0.6 g,2 mmol)和碳酸钾(1.1 g,8 mmol)溶于N-甲基吡咯烷酮(150 mL),氮气保护下常温搅拌30 min,缓慢滴加碘甲烷(1 mL,16 mmol),加完后85 ℃反应24 h.降温至室温,加入乙酸乙酯(100 mL)淬灭反应,水洗,饱和食盐水洗除去N-甲基吡咯烷酮,旋干溶剂后,按照V(石油醚)∶V(二氯甲烷)=4∶1进行柱层析分离得到棕色固体,收率32%.m.p.145~148 ℃;1H NMR (500 MHz,CDCl3):8.88(d,J=4.0 Hz,2H,Ar-H),7.65(d,J=5 Hz,2H,Ar-H),7.29(dd,J=8.9,4.1 Hz,2H,Ar-H),3.61(s,6H,CH3).
1.62,5-二丁基-3,6-二噻吩基吡咯并[3,4-c]吡咯-1,4-二酮II-4的合成
Ib(0.3 g, 1 mmol)和碳酸钾(0.55 g,4 mmol)加入DMF(50 mL),氮气保护下,145 ℃搅拌30 min,缓慢滴加溴代正丁烷(0.54 g,5 mmol),加完后145 ℃反应24 h.冷却至室温,加入乙酸乙酯(50 mL)淬灭反应,水洗,饱和食盐水洗除去DMF,旋干溶剂后,按照V(石油醚)∶V(二氯甲烷)=4∶1进行柱层析分离得到棕色固体,收率35.4%.m.p.143~146 ℃;1H NMR (500 MHz,CDCl3)∶δ8.94(dd,J=3.8,0.9 Hz,2H,Ar-H),7.65(dd,J=5.0,0.9 Hz,Ar-H),7.30(dd,J=4.9,4.1 Hz,2H,Ar-H),4.10(t,J=8 Hz,4H,NCH2),1.78~1.72(m,4H,NCH2CH2),1.50~1.43(m,4H,N(CH2)2CH2),0.98(t,J=7.4 Hz,6H,CH3).
1.72,5-二辛基-3,6-二噻吩基吡咯并[3,4-c]吡咯-1,4-二酮II-5的合成
Ib(0.3 g,1 mmol)和碳酸钾(0.55 g,4 mmol)加入DMF(100 mL),氮气保护下60 ℃搅拌30 min,缓慢滴加溴代正辛烷(1.93 g,10 mmol),加完后60 ℃反应24 h.降温至室温,加入乙酸乙酯(50 mL)淬灭反应,水洗,饱和食盐水洗除去DMF,旋干溶剂后,按照V(石油醚)∶V(二氯甲烷)=4∶1进行柱层析分离得到棕色固体,收率30.5%.m.p.140~145℃;1H NMR(500 MHz,CDCl3):δ8.94(dd,J=3.9,1.0 Hz,2H,Ar-H),7.65(dd,J=5.0,0.9 Hz,2H,Ar-H),7.30(dd,J=4.9,4.0 Hz,4H,Ar-H),4.08(t,J=8 Hz,4H,NCH2),1.76(dt,J=15.5,7.7 Hz,4H,NCH2CH2),1.46~1.40(m,4H,NCH2CH2CH2),1.38~1.28(m,16H,N(CH2)3CH2),0.88(t,J=6.9 Hz,6H,CH3).
2结果与讨论
2.1工艺优化
首先选择对溴苯腈和丁二酸二乙酯为原料,碱催化下缩合生成2.5-二氢-3,6-二(对溴苯基)吡咯并[3,4-c]吡咯-1,4-二酮Ia,从原料配比、催化剂用量以及反应时间等方面对工艺进行了优化,以期提高反应收率,其反应式为

2.1.1原料投料比对反应收率的影响
选取丁二酸二甲酯当量反应,改变对溴苯腈的投料量,于叔丁醇钾为5当量,110 ℃反应5 h,获得的收率数据列于表1.

表1 原料配比的优化探究
由表1可知:当对溴苯腈和丁二酸二甲酯当量反应,即对溴苯腈投料量为丁二酸二甲酯的两倍时,收率较低,仅为31.7%,而当对溴苯腈投料量增加到丁二酸二甲酯的2.4倍时,收率增加到68.5%.继续增加对溴苯腈的量,收率反而降低,因而选择原料投料比为n(对溴苯腈)∶n(丁二酸二甲酯)=2.4为较优的投料比.
2.1.2催化剂用量对反应收率的影响
选取原料投料比为n(对溴苯腈)∶n(丁二酸二甲酯)=2.4,于110 ℃反应5 h,考察了催化剂用量对反应收率的影响,其结果列于表2.

表2 催化剂用量的优化探究
此缩合反应对叔丁醇钾的用量要求较多,当叔丁醇钾用量低于4当量时,收率很低,叔丁醇钾用量4当量时,收率38%.进一步增加叔丁醇钾用量到5当量时,产物收率提高到68.5%.再继续增加叔丁醇钾用量,产物收率变化不明显,而当叔丁醇钾用量增加到6当量时,产物收率反而下降.因而叔丁醇钾用量为5当量较优.
2.1.3反应时间对反应收率的影响
选取原料投料比为n(对溴苯腈)∶n(丁二酸二甲酯)=2.4,叔丁醇钾为5当量时,110 ℃进行反应,考察了反应时间对反应收率的影响,其结果列于表3.可以看到:随反应时间的增长,反应收率增加,反应5 h时,反应收率最高,达到68.5%,进一步增加反应时间,收率变化不大.因而选择反应时间5 h为较优反应时间.
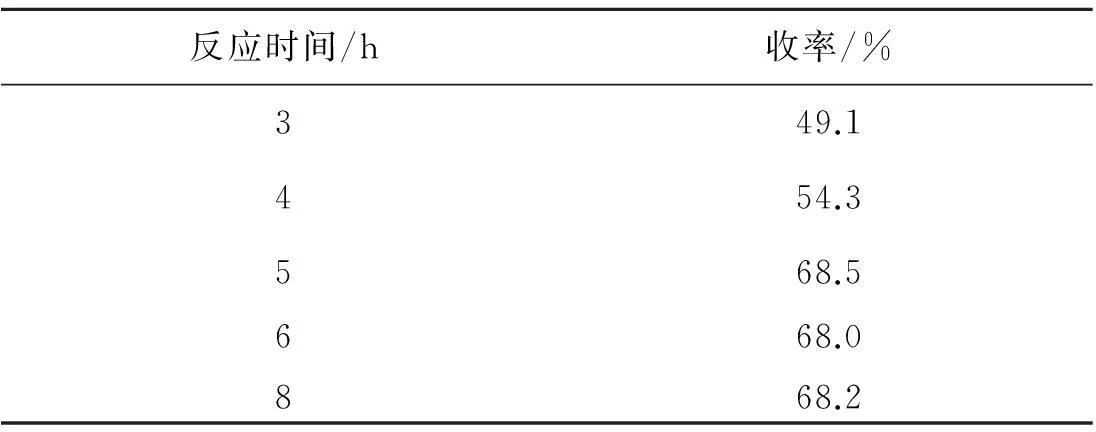
表3 反应时间的优化探究
综上所述,对丁二酸二甲酯和对溴苯腈缩合合成DPP反应的原料配比、催化剂用量和反应时间进行了工艺优化,结果表明:当反应投料比n(对溴苯腈)∶n(丁二酸二甲酯)=2.4,催化剂叔丁醇钾用量为5当量,110 ℃反应5 h时,收率较优,为68.5%.
2.2底物拓展
在上述工艺优化的基础上,我们合成了对溴苯基DPP和噻吩DPP两个中间体,并进一步用不同碳链长度的卤代烷对其进行烷基化,合成了五个烷基化DPP,且结果列于表4中,其反应式为
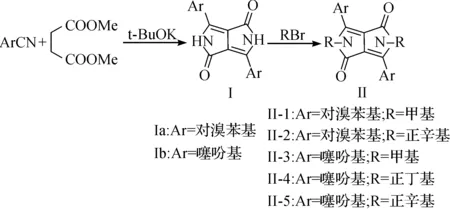
由表4可以看出:当将对溴苯腈换成噻吩甲腈后,收率提高,后者DPP收率达93%.但烷基化收率均不高,化合物II的收率约为20%~50%.另外,无论对溴苯基取代还是噻吩取代的DPP,溶解性能均较差,烷基化后,溶解性能有所改善.
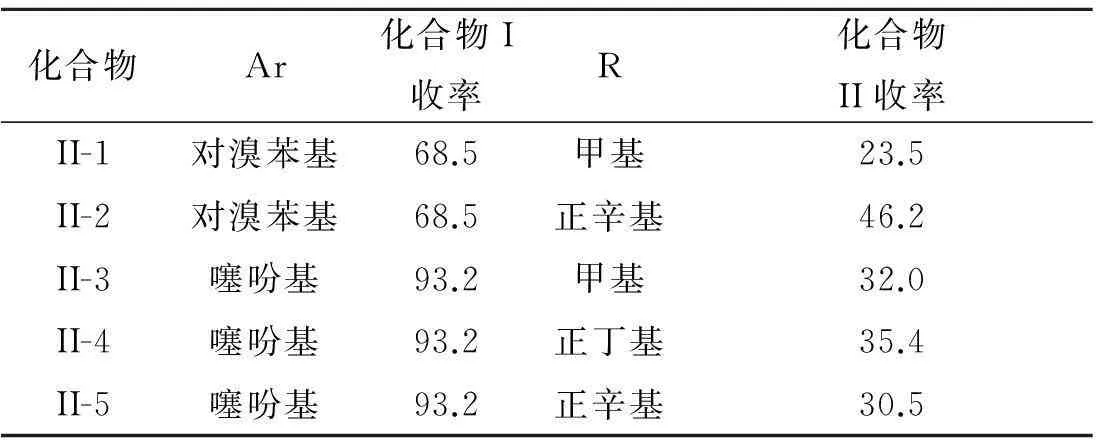
表4 烷基化DPP的合成
2.3光谱性能研究
对所合成的五个化合物进行了紫外吸收光谱和荧光发射光谱测试,其结果见图1和表5.
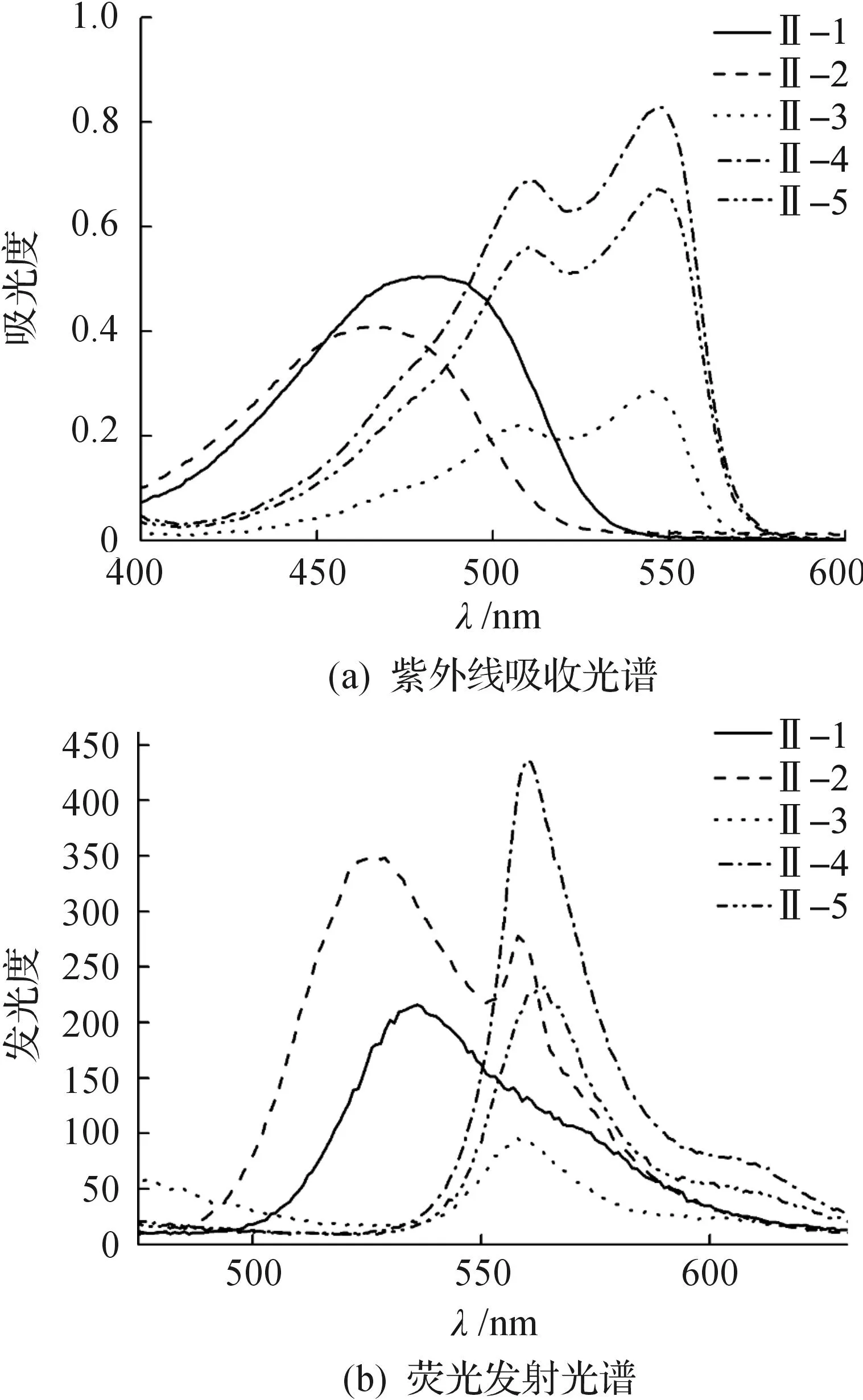
图1 烷基化DPP的光谱性能Fig.1 Spectral properties of alkylated DPP
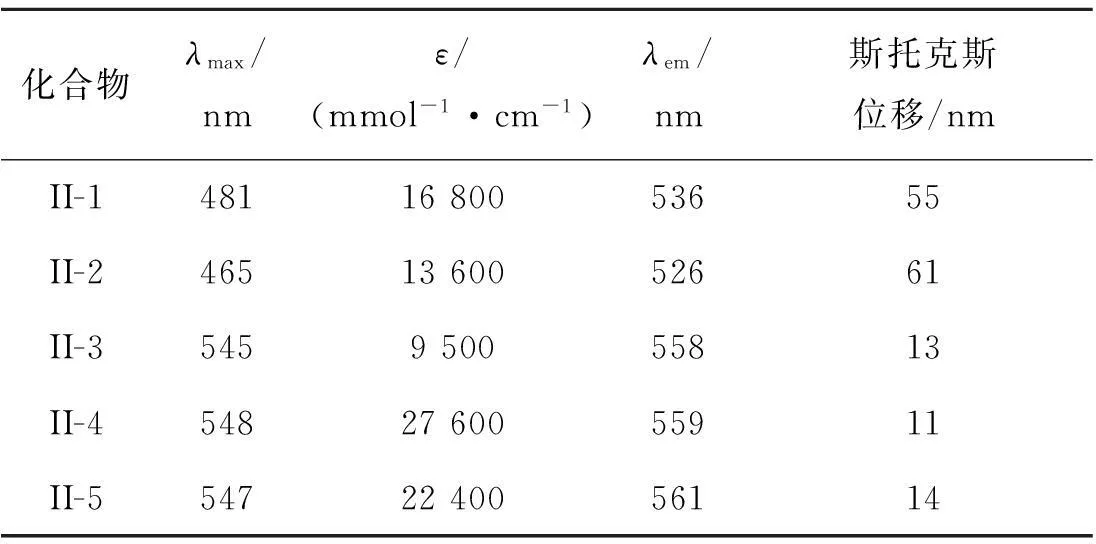
化合物λmax/nmε/(mmol-1·cm-1)λem/nm斯托克斯位移/nmII-14811680053655II-24651360052661II-3545950055813II-45482760055911II-55472240056114
注:1) 溶剂为CH2Cl2-CH3OH,V(CH2Cl2)∶V(CH3OH)=10∶1.
比较五个化合物的紫外吸收光谱可知:由于富电子的噻吩基的引入,II-3~II-5的最大吸收峰较含苯环的II-1~II-2红移了70~90 nm.这是由于富电子噻吩的引入,有利于降低分子的LUMO,从而使HOMO到LUMO的跃迁能级减小,最大吸收波长红移.但N上取代基变化仅影响摩尔吸光吸收大小,对最大吸收波长影响不大.烷基化DPP的荧光发射光谱也受到母体DPP上所连芳香环的影响,噻吩基较对溴苯基使得烷基化DPP的发射波长红移了20~35 nm.但噻吩环取代的烷基化DPP Stokes位移约10~15 nm,而苯基取代的烷基化DPP Stokes位移为50~60 nm,较前者明显增大.
3结论
以对溴苯腈和丁二酸二乙酯合成2.5-二氢-3,6-二(对溴苯基)吡咯并[3,4-c]吡咯-1,4-二酮的反应为模型反应,从原料配比、催化剂用量以及反应时间等方面对工艺进行了优化.当反应投料比n(对溴苯腈)∶n(丁二酸二甲酯)=2.4,催化剂叔丁醇钾用量为5当量,110 ℃反应5 h时,收率较优,为68.5%.在此基础上合成了对溴苯基DPP和噻吩DPP两个中间体,并进一步用不同碳链长度的卤代烷对其进行烷基化,合成了五个烷基化DPP.对其紫外吸收光谱和荧光发射光谱研究表明,富电子噻吩的引入,使得紫外吸收光谱和荧光发射光谱红移.
参考文献:
[1]屠军飞,贾建洪,盛卫坚,等.杂环类甲型铜络合物的合成[J].浙江工业大学学报,2010,38(3):308-311.
[2]董华青,贾建洪,高建荣.双偶氮含氟活性染料的合成[J].浙江工业大学学报,2014,42(1):88-92.
[3]夏姚姚,贾建洪,高建荣,等.甲臜型铁络合染料的合成研究[J].浙江工业大学学报,2011,39(2):154-157.
[4]穆振义.吡咯并吡咯二酮(DPP)类颜料及苯腈取代衍生物(二)[J].上海染料,2004,32(6):21-26.
[5]周春隆.有机染料化学结构特性极其发展(二)[J].精细与专用化学品.2007,15(22):12-16.
[6]沈永嘉.DPP颜料的化学性能、应用与市场分析(一)[J].上海染料,2011,39(1):16-21.
[7]孙丽,范高超,洪芳,等.一种新型吡咯并吡咯二酮衍生物的设计与合成[J].精细化工,2012,29(7):625-631.
[8]ZHU Y, RABINDRANATH A R, BEYERLEIN T, et al. Highly luminescent 1,4-diketo-3,6-diphenylpyrrolo[3,4-c]pyrrole-(dpp-) based conjugated polymers prepared upon suzuki coupling[J]. Macromolecules,2007,40(19):6981-6989.
[9]ZHOU E J, WEI Q S, YAMAKAWA S, et al. Diketopyrrolopyrrole-based semiconducting polymer for photovoltaic device with photocurrent response wavelengths up to 1.1 μm[J].Macromoleclules,2010,43(2):821-826.
[10]SONAR P, SINGH S P, LI Y, et al. A low-band gap diketopyrrolopyrrole-benzothiadiazole-based copolymer for high-mobility ambipolar organic thin-film transistors[J]. Advanced Material,2010,22(47),5409-5413.
[11]LI Y N, SONAR P, SINGH S P, et al. Annealing-free high-mobility diketopyrrolopyrrole quaterthiophene copolymer for solution-processed organic thin film transistors[J]. Journal of the American Chemical Society,2011,133(7):2198-2204.
[12]ZOU Y P, GENDRON D, NEAGU-PLESU R, et al. Synthesis and characterization of new low-band gap diketopyrrolopyrrole-based copolymers[J]. Macromolecules,2009,42(17):6361-6365.
[13]BIJLEVELD J C, GEVAERTS V S, Di Nuzzo D, et al. Efficient solar cells based on an easily accessible diketopy- rrolopyrrole polymer[J].Advanced Material,2010,22(35): 242-246.
[14]FARNUM D G, METHA G, MOORE G I, et al. Attempted reformatskii reaction of benzonitrile, 1,4-diketo-3,6- diphenylpyrrolo[3,4-c]pyrrole-lactam analog of pentalene[J].Tetrahedrom Letters,1974,29:2549-2552.
[15]GLOSS F, GOMPPER R.2,5-diazapentalen[J]. Angewandte Chemie International Edition,1987,99(6):564-567.
[16]ROCHAT A C, CASSAR L. IQBAL A.Preparation of pyrrolo-(3,4-c)pyrroles: EP,94911 [P]. 1983:11-23.
(责任编辑:陈石平)
Synthesis of alkylated derivatives of DPP
HAN Liang, WANG Bin, TANG Liangbin
(College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China)
Abstract:p-Bromophenyl substituted DPP derivatives were synthesized with dimethyl succinate and 4-bromobenzonitrile and the reaction conditions were optimized. Through the investigation of the effects of the reactant ratio, catalyst, reaction time on yield, the optimal process conditions were obtained. 4-Bromobenzonitrile reacted with 2.4 equiv. dimethyl succinate in t-amyl alcohol at 110 ℃ for 5 h in the presence of 5 equivalents of potassium t-butoxide to give the optimal yield 68.5%. Based on the optimal process conditions, thiophene substituted DPP was synthesized with 2-thiophene carbonitrile and dimethyl succinate. Five N-alkylated DPP derivatives were further synthesized with the introduction of methyl, butyl and octyl group. The target products were characterized with1H NMR and their UV absorption and fluorescence spectra were measured. The UV maximum absorption of N-alkylated DPP derivatives located at 460~550 nm, and the fluorescence emission peaks mainly appeared at 520~560 nm.
Keywords:pyrrolopyrroledione; alkylation; synthesis; UV spectra; fluorescence spectra
文章编号:1006-4303(2015)04-0369-05
中图分类号:O629.11+3
文献标志码:A
作者简介:韩亮(1977—),女,湖南湘潭人,副教授,研究方向为精细有机合成,E-mail:hanliang814@163.com.
基金项目:国家自然科学基金资助项目( 21176223,21406202 );浙江省自然科学基金资助项目(13B020012)
收稿日期:2015-01-16