gp96、Mcl-1在肝硬化和肝癌组织中表达及意义
2016-01-20黄东凤
李 峰, 魏 群, 黄东凤, 张 弘
(南通大学附属医院消化病研究室,江苏 南通 226001)
摘要:目的 通过研究gp96、髓样细胞白血病-1(Mcl-1)蛋白在肝硬化和肝癌组织中的表达及临床病理学意义,初步探讨其与肝硬化和肝癌发生、发展的关系。方法 采用免疫组织化学ENVISION法分别检测19例肝硬化组织(癌旁肝硬化组织)、32例肝癌组织和21例对照肝组织(癌旁非硬化肝组织)中gp96、Mcl-1的表达,并分析其各自表达与肝癌临床病理学特征的关系。取来源于同一患者的肝癌组织、癌旁肝硬化组织或癌旁非肝硬化组织,分别配对检测gp96、Mcl-1,比较两者的阳性表达率。结果 对照组、肝硬化组和肝癌组gp96阳性表达率逐渐递增,差异有统计学意义(P<0.05);gp96的阳性表达与肿瘤有无包膜、TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤大小、血清甲胎蛋白(AFP)值、组织学分级及临床分期无关(P>0.05)。肝癌组和肝硬化组Mcl-1阳性表达率明显高于对照组(P<0.05),但肝癌组和肝硬化组之间差异无统计学意义(P>0.05);Mcl-1阳性表达与肿瘤有无坏死和TNM分期有关(P<0.05)。肝癌组gp96阳性表达率明显高于配对癌旁肝硬化组及配对癌旁非肝硬化组(P均<0.05);而肝癌组Mcl-1阳性表达率明显高于配对癌旁非肝硬化组,与配对癌旁肝硬化组比较差异无统计学意义(P>0.05)。结论 gp96、Mcl-1过表达可能与肝癌的发生、发展有关。gp96可能参与了肝硬化的发生、发展及向肝癌的恶性转化,有助于判断肝癌患者的预后。
关键词:gp96;髓样细胞白血病-1;肝细胞癌;肝硬化
中图分类号:
gp96、Mcl-1在肝硬化和肝癌组织中表达及意义
李峰,魏群,黄东凤,张弘
(南通大学附属医院消化病研究室,江苏 南通 226001)

摘要:目的通过研究gp96、髓样细胞白血病-1(Mcl-1)蛋白在肝硬化和肝癌组织中的表达及临床病理学意义,初步探讨其与肝硬化和肝癌发生、发展的关系。方法采用免疫组织化学ENVISION法分别检测19例肝硬化组织(癌旁肝硬化组织)、32例肝癌组织和21例对照肝组织(癌旁非硬化肝组织)中gp96、Mcl-1的表达,并分析其各自表达与肝癌临床病理学特征的关系。取来源于同一患者的肝癌组织、癌旁肝硬化组织或癌旁非肝硬化组织,分别配对检测gp96、Mcl-1,比较两者的阳性表达率。结果对照组、肝硬化组和肝癌组gp96阳性表达率逐渐递增,差异有统计学意义(P<0.05);gp96的阳性表达与肿瘤有无包膜、TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤大小、血清甲胎蛋白(AFP)值、组织学分级及临床分期无关(P>0.05)。肝癌组和肝硬化组Mcl-1阳性表达率明显高于对照组(P<0.05),但肝癌组和肝硬化组之间差异无统计学意义(P>0.05);Mcl-1阳性表达与肿瘤有无坏死和TNM分期有关(P<0.05)。肝癌组gp96阳性表达率明显高于配对癌旁肝硬化组及配对癌旁非肝硬化组(P均<0.05);而肝癌组Mcl-1阳性表达率明显高于配对癌旁非肝硬化组,与配对癌旁肝硬化组比较差异无统计学意义(P>0.05)。结论gp96、Mcl-1过表达可能与肝癌的发生、发展有关。gp96可能参与了肝硬化的发生、发展及向肝癌的恶性转化,有助于判断肝癌患者的预后。
关键词:gp96;髓样细胞白血病-1;肝细胞癌;肝硬化
中图分类号:
文章编号:1673-8640(2015)02-0185-06R446.1
文献标志码:码:A
DOI:10.3969/j.issn.1673-8640.2015.02.020
作者简介:李峰,男,1977年生,硕士,主要从事消化系统肿瘤的研究。
通讯作者:张弘,联系电话:0513-85052461。
Abstract:ObjectiveTo investigate the expressions and clinical pathological significance of gp96 and myeloid cell leukemia-1(Mcl-1) in liver cirrhosis and hepatocellular carcinoma tissues to study preliminarily their relationships with the genesis and progression development of liver cirrhosis and hepatocellular carcinoma. MethodsThe expressions of gp96 and Mcl-1 were detected respectively by ENVISION immunohistochemistry in 19 liver cirrhosis tissues (liver cirrhosis tissues beside hepatocellular carcinoma), 32 hepatocellular carcinoma tissues and 21 control tissues (non-liver cirrhosis tissues beside hepatocellular carcinoma). Their relationships of expressions with clinical pathological characteristics of hepatocellular carcinoma were investigated. The expressions of gp96 and Mcl-1 of liver cirrhosis tissues beside hepatocellular carcinoma, hepatocellular carcinoma tissues and non-liver cirrhosis tissues beside hepatocellular carcinoma from one patient were detected, and the positive expression rates were compared. ResultsThe positive expression rate of gp96 increased gradually from control, liver cirrhosis to hepatocellular carcinoma groups, which showed significantly different (P<0.05). The positive expression of gp96 had relationships with tumor envelope and TNM staging(P<0.05), and there was no relationship with sex, age, tumor size, serum alpha-fetoprotein (AFP), histological grading and clinical staging (P>0.05). Mcl-1 positive expression in hepatocellular carcinoma and liver cirrhosis groups markedly increased compared to control group, respectively(P<0.05), and there was no statistical significance between liver cirrhosis and hepatocellular carcinoma groups (P>0.05). The positive expression of Mcl-1 had relationships with tumor necrosis and TNM staging(P<0.05). The positive expression rate of gp96 in hepatocellular carcinoma group was significantly higher than those in liver cirrhosis and control groups (P<0.05). The positive expression rate of Mcl-1 in hepatocellular carcinoma group was higher than that in control group, and had no statistical significance with that in liver cirrhosis group (P>0.05). ConclusionsThe overexpressions of gp96 and Mcl-1 are related to the genesis and progression of hepatocellular carcinoma. The gp96 may implicate in the formation and development of liver cirrhosis as well as its subsequent malignant transformation, and may be used as a prognostic biomarker for hepatocellular carcinoma.
收稿日期:(2014-04-22)
Expressions and significance of gp96 and Mcl-1 in liver cirrhosis and hepatocellular carcinoma tissuesLIFeng,WEIQun,HUANGDongfeng,ZHANGHong.(DepartmentofGastroenterology,theAffiliatedHospitalofNantongUniversity,JiangsuNantong226001,China)
Key words: gp96; Myeloid cell leukemia sequence-1;Hepatocellular carcinoma;Liver cirrhosis
肝硬化是一种常见的慢性肝脏疾病,是由各种原因所致的肝纤维化进一步发展而来的不可逆性病变,其发病机制复杂。肝细胞癌(简称肝癌)是世界上最常见、恶性程度最高的肿瘤之一,位居全球恶性肿瘤发病率的第5位、死因的第3位[1]。在我国,肝癌的死亡率仅次于肺癌[2]。流行病学调查显示,肝硬化尤其是乙型肝炎后肝硬化是肝癌发生最重要的一个危险因素[3],也是肝癌手术切除的一个主要限制因素。因此,阻断肝硬化的发生、发展及早期预测癌变具有重要的临床意义。gp96是存在于真核生物细胞内质网中的相对分子质量为96 000的热休克蛋白(heat shock protein,HSP),属HSP90家族。髓样细胞白血病-1(myeloid cell leukemia-1,Mcl-1)是Bcl-2家族成员,因其半衰期短以及能被快速诱导表达和降解而在Bcl-2家族中具有独特性。近年来,gp96、Mcl-1在肿瘤发生、发展和肿瘤治疗中的作用越来越受到重视[4-5]。我们利用免疫组织化学方法(简称免疫组化)检测gp96、Mcl-1蛋白在肝硬化和肝癌组织中表达,初步探讨其与肝硬化和肝癌发生、发展以及与肝癌临床病理学特点的关系。
材料和方法
一、一般资料
收集2010年5月至2012年5月南通大学附属医院病理科原发性肝癌组织石蜡包埋标本32例,均为肝细胞癌,其中男25例,女7例,平均年龄(51±15)岁,所有肝癌患者术前均未接受任何全身化疗、放射治疗、肝动脉栓塞和无水酒精注射等治疗;肝硬化组织石蜡包埋标本19例(癌旁肝硬化组织),其中男12例,女7例,平均年龄(50±11)岁;同时选取癌旁非硬化肝组织石蜡包埋标本21例作为对照组,其中男10例,女11例,平均年龄(45±14)岁。
二、方法
1.实验方法大鼠抗人gp96单克隆抗体(1∶100)及小鼠抗人Mcl-1单克隆抗体(1∶50)为美国NeoMarkers公司产品。多聚-L-赖氨酸购自福州迈新生物技术开发公司;DAB试剂盒购自北京中山生物技术有限公司。免疫组织化学操作方法采用ENVISION法,4 μm石蜡切片,微波加热法抗原修复,采用已知阳性细胞作阳性对照,采用磷酸盐缓冲液(phosphate buffered saline,PBS)代替一抗作为阴性对照。
2.结果判断免疫组化染色的结果判断经两名高年资病理医师采用双盲法阅片,以获得统一结果为准。参照文献[6]的标准,在200倍光学显微镜下随机计数5个视野,统计阳性细胞所占百分比。统计计分从两个方面进行评价。(1)染色阳性细胞数:<4%为0分,5%~24%为1分,25%~49%为2分,≥50%为3分;(2)染色强度:无细胞着色计0分,呈淡黄色着色计1分,呈棕黄色着色计2分,呈深褐色着色计3分。将每一例两项得分相加即为该肿瘤细胞阳性表达得分。最低得分为0分,最高得分为6分;≤2分为阴性或弱表达,3~4分为中度阳性,5~6分为强阳性。 阳性表达包括中度阳性及强阳性。取来源于同一患者的肝癌组织、癌旁肝硬化组织或癌旁非肝硬化组织分别配对检测gp96、mcl-1的阳性表达度。
三、统计学方法
采用SPSS 13.0软件进行统计分析。率的比较采用χ2检验或确切概率法,相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
结果
一、肝癌组、肝硬化组和对照组gp96、Mcl-1的表达
gp96阳性表达物呈棕黄色颗粒,多数呈弥漫性分布于细胞浆内,少数定位于胞核,见图1。对照组、肝硬化组和肝癌组gp96阳性表达率逐渐递增,各组间差异有统计学意义(P<0.05)。见表1。
Mcl-1阳性表达物呈棕黄色颗粒,部分呈弥漫性分布于细胞浆内,部分定位于胞核,见图2。肝癌组和肝硬化组Mcl-1阳性表达率明显高于对照组(P<0.05),但肝癌组和肝硬化组之间差异无统计学意义(P>0.05)。见表1。
肝癌组织与配对癌旁肝硬化组织、配对癌旁非肝硬化组织gp96、Mcl-1表达的比较见表2、表3。
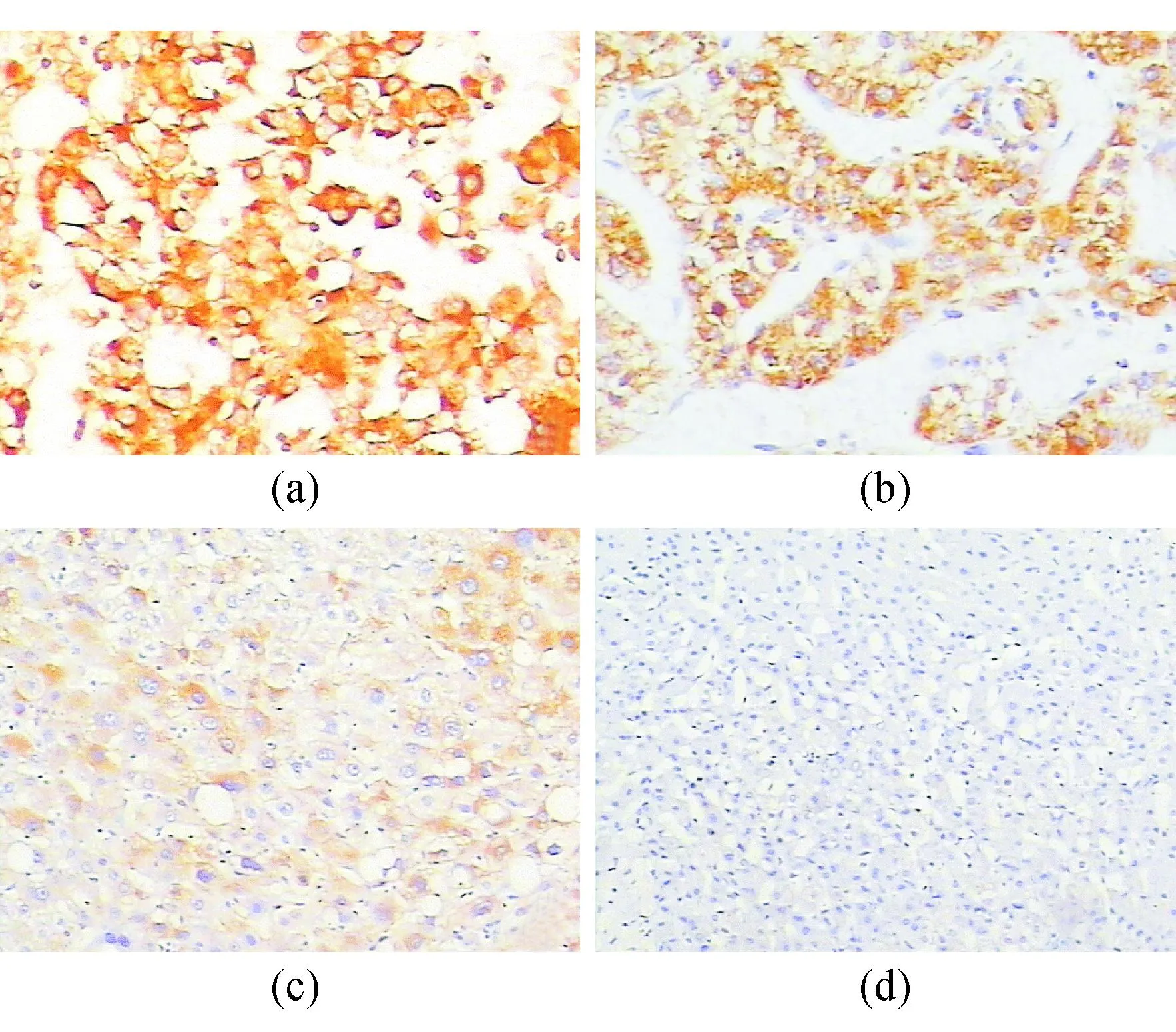
注:(a)低分化肝癌组织中gp96的表达(×200);(b)高分化肝癌组织中gp96的表达(×200);(c)肝硬化组织中gp96的表达(×200);(d)对照组gp96的表达(×100)
图1肝癌组、肝硬化组和对照组gp96的表达
二、gp96、Mcl-1的表达与肝癌临床病理学特征的关系
gp96的阳性表达与肿瘤有无包膜、TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤大小、血清甲胎蛋白(α-fetoprotein,AFP)值、组织学分级、临床分期、乙型肝炎病毒(hepatitis B virus,HBV)感染[即乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)阳性]及肝硬化与否无关(P>0.05);Mcl-1阳性表达与肿瘤有无坏死和TNM分期有关(P<0.05),与患者的性别、年龄、肿瘤大小、肿瘤有无包膜、门静脉有无癌栓、血清AFP值、组织学分级、肿瘤临床分期、HBV感染以及肝硬化与否均无关(P>0.05)。见表4。
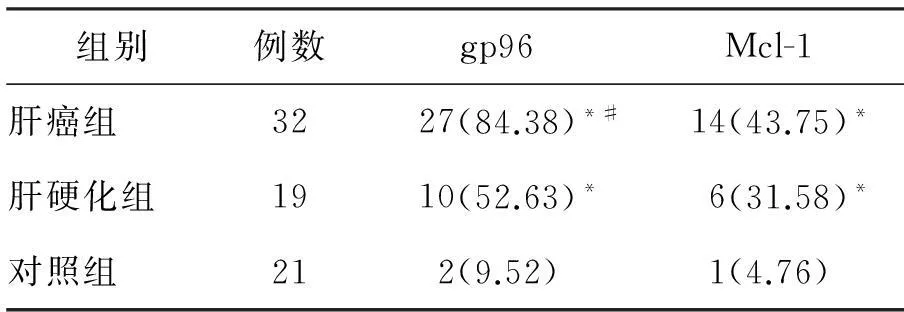
表1 肝癌组、肝硬化组和对照组gp96、Mcl-1阳性表达率 [例(%)]
注:与对照组比较,*P<0.05;与肝硬化组比较,#P<0.05
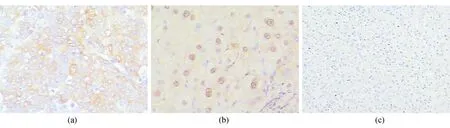
注:(a)低分化肝癌组织中Mcl-1的表达(×200);(b)肝硬化组织中Mcl-1的表达(×200);(c)对照肝组织中Mcl-1的表达(×100)
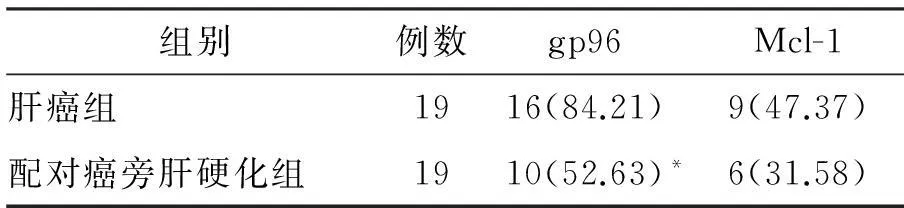
图2 肝癌组、肝硬化组和对照组Mcl-1的表达
注:与肝癌组比较,*P<0.05

表3 肝癌与配对癌旁非肝硬化组织中gp96、Mcl-1
注:与肝癌组比较,*P<0.05

表4 gp96、Mcl-1表达与肝癌临床病理学特征的关系
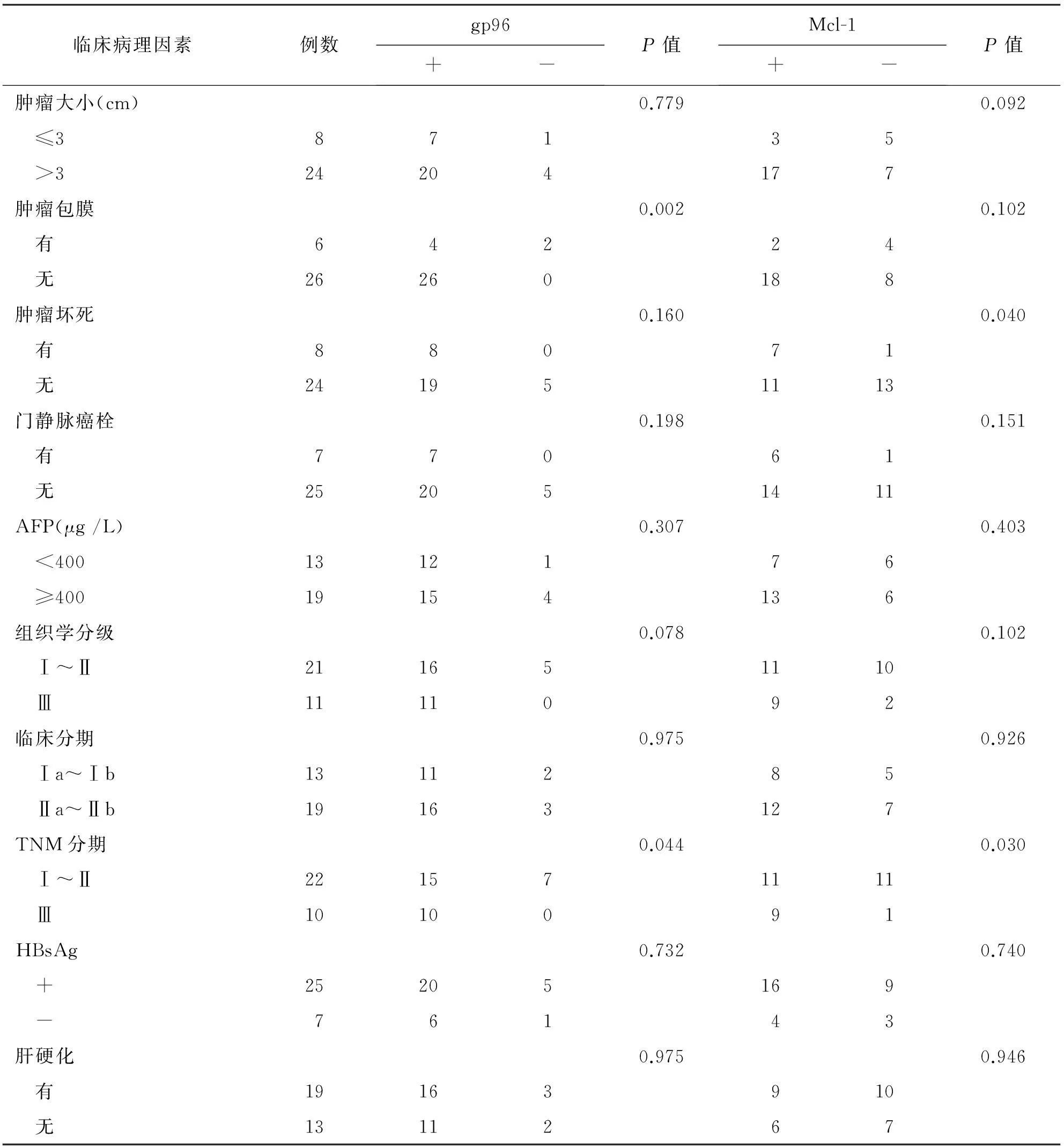
续表4
讨论
肝硬化与肝癌的发生密切相关,两者之间的关系长期以来一直受到重视,人们将肝硬化看作是肝癌的癌前病变。肝硬化尤其是乙型肝炎后肝硬化是肝癌发生最重要的一个危险因素[3]。
正常细胞中gp96的表达受细胞周期调控。但在肿瘤细胞中gp96呈持续的高诱导表达,而且是不需要应激的,突变的或不正常的蛋白质的存在刺激了gp96的合成。有学者认为gp96高表达可促进肿瘤的发生[7-8]。也有报道认为gp96的表达能增强机体对肿瘤的免疫反应[9]。由于其具有的分子伴侣功能,gp96与肿瘤抗原肽相结合,使其被抗原提呈细菌高效摄取,进而通过主要组织相容性复合体-I类分子限制性途径激活细胞毒性T淋巴细胞,引发特异性抗肿瘤免疫应答。gp96自体肿瘤疫苗对于黑色素瘤和结肠癌的治疗作用已经进入了临床Ⅰ/Ⅱ期评价[10-11]。本研究发现对照组、肝硬化组和肝癌组gp96阳性表达率逐渐递增,且各组间差异有统计学意义(P<0.05)。由此推测gp96可能参与了肝硬化的发生、发展及向肝癌的恶性转化过程。此外,大分子HBV表面蛋白可以活化gp96的转录增强子,诱导gp96表达升高[12]。本研究中绝大部分肝硬化和肝癌患者的血清HBsAg为阳性,这有可能是造成gp96高表达的另一个原因。
本研究结果显示gp96的阳性表达与肿瘤有无包膜、TNM分期有关(P<0.05)。肿瘤包膜可以阻止肿瘤细胞向外周扩散,对肿瘤患者的预后是一种积极的因素,而肿瘤TNM分期高是肝癌患者术后易复发和预后不良的重要因素[13]。由此可见,gp96的表达与肝癌的生物学行为有关,其过表达可能是造成肝癌扩散、浸润和转移的原因,是肝癌患者预后不良的重要因素。
目前对于小肝癌的诊断主要是依据AFP和影像学检查。肝癌患者的血清AFP浓度与肿瘤大小大体上呈正相关。本研究显示gp96的表达与肿瘤大小和血清AFP值无关。肝癌≤3 cm组和>3 cm组之间、AFP<400 μg /L组和AFP≥400 μg /L组之间gp96的阳性表达率差异均无统计学意义(P均>0.05),提示gp96对小肝癌也具有一定的诊断价值。
Mcl-1广泛表达于人类多种正常组织中。最近的研究[14]证实Mcl-1的亚细胞定位与细胞的生长状态密切相关:在成指数幂生长的细胞中,Mcl-1主要定位于线粒体;在处于静止期的细胞中,Mcl-1主要定位于细胞核。Mcl-1可以被快速地诱导表达和降解。当细胞内出现死亡信号,如紫外线照射、病毒感染时,Mcl-1可被迅速降解;而当生存信号和分化信号,如细胞因子和生长因子出现时则被迅速诱导表达。提示Mcl-1在细胞的生存和死亡调节中发挥重要作用。越来越多的研究表明Mcl-1在人类多种肿瘤组织中过表达,如非小细胞肺癌[15]、宫颈癌[16]等。FLEISCHER等[17]通过免疫组化和免疫印迹法发现,Mcl-1在肝癌组织中的表达显著高于邻近的癌旁组织,且其表达与肿瘤大小、肿瘤分级以及肝移植术前接受的治疗无关。SEIGHART等[18]通过反义寡核苷酸技术干扰肝细胞癌细胞株Mcl-1的表达,发现肝细胞癌细胞的凋亡增加,且对化疗药物的治疗反应增加。
本研究结果显示,Mcl-1阳性颗粒主要位于细胞浆,少数见于胞核。本研究结果显示肝癌组和肝硬化组Mcl-1阳性表达率明显高于对照组(P<0.05),但肝癌组和肝硬化组之间差异无统计学意义(P>0.05)。Mcl-1的表达与肝癌患者的性别、年龄、肿瘤有无包膜、门静脉有无癌栓、是否HBV感染以及血清AFP值无关,与肿瘤大小也无关。肝癌≤3 cm组和>3 cm组之间Mcl-1阳性表达率差异无统计学意义。提示Mcl-1对小肝癌也具有一定的诊断价值。发生坏死的肝癌组织Mcl-1的表达强度高于无坏死的肝癌组织。肿瘤组织由于代谢旺盛,局部缺血、缺氧和酸性代谢产物的积聚,引起肿瘤细胞坏死,坏死局部炎症反应强烈,产生大量的细胞因子,而细胞因子可以迅速诱导Mcl-1的表达升高[19]。同时,Mcl-1的高表达可以保护中性粒细胞免于凋亡,延长其寿命,进而参与炎症反应[20]。
Mcl-1在肝癌组织中的表达高于对照肝组织,提示Mcl-1作为一种抗凋亡蛋白,通过保护肝癌细胞免受凋亡,增加肝癌细胞的生存力,使其得以不断增生,在肝癌的发生、发展过程中发挥着重要的作用。阻断Mcl-1的表达或调节Mcl-1表达的信号通路可能有助于阻止肝癌的发生。
综上所述,肝癌组、肝硬化组和对照组gp96、Mcl-1的表达存在差异,其过表达可能与肝癌的发生、发展有关。gp96可能参与了肝硬化的发生、发展及向肝癌的恶性转化,有助于判断肝癌患者的预后。
本研究的不足之处:首先由于作为正常对照的正常肝组织难以获得,我们因而选择了有可能存在癌前改变的癌旁非肝硬化组织替代。因此,对所得研究结果应谨慎对待。其次,本研究方法仅采用单一的半定量免疫组化量化分析,存在一定缺陷。后续我们将从基因水平逆转录聚合酶链反应及蛋白水平(免疫组化+免疫印迹法),同时扩大样本量进行深入研究,以期能增加结果的可信度。
参考文献
[1]PARKIN DM,BRAY F,FERLAY J,et al. Global cancer statistics, 2002[J]. CA Cancer J Clin,2005,55(2):74-108.
[2]YANG L,PARKIN DM,FERLAY J,et al. Estimates of cancer incidence in China for 2000 and projections for 2005 [J]. Cancer Epidemiol Biolmarkers Prev,2005,14(1):243-250.
[3]LUO RH,ZHAO ZX,ZHOU XY,et al. Risk factors for primary liver carcinoma in Chinese population [J]. World J Gastroenterol,2005,11(28):4431-4434.
[4]HUA Y, WHITE-GILBERTSON S, KELLNER J, et al. Molecular chaperone gp96 is a novel therapeutic target of multiple myeloma [J]. Clin Cancer Res,2013,19(22):6242-6251.
[5]SANO M, NAKANISHI Y, YAGASAKI H, et al. Overexpression of anti-apoptotic Mcl-1 in testicular germ cell tumours [J]. Histopathology,2005,46(5):532-539.
[6]邢传平,刘斌,董亮. 免疫组织化学标记结果的判断方法[J].中华病理学杂志,2001,30(4):318.
[7]FU Y,LEE AS. Glucose regulated proteins in cancer progression,drug resistance and immunotherapy[J]. Cancer Biol Ther,2006,5(7):741-744.
[8]WANG Q,HE Z,ZHANG J,et al. Overexpression of endoplasmic reticulum molecular chaperone GRP94 and GRP78 in human lung cancer tissues and its significance[J]. Cancer Detect Prev,2005,29(6):544-551.
[9]SINGH-JASUJA H,SCHERER HU,HILF N,et al. The heat shock protein gp96 induces maturation of dendritic cells and down-regulation of its receptor[J]. Eur J Immunol,2000, 30(8):2211-2215.
[10]BELLI F,TESTORI A,RIVOLTINI L,et al. Vaccination of metastatic melanoma patients with autologous tumor-derived heat shock protein gp96-peptide complexes: clinical and immunologic findings[J]. J Clin Oncol,2002,20(20):4169-4180.
[11]MAZZAFERRO V,COPPA J,CARRABBA MG,et al. Vaccination with autologous tumor-derived heat-shock protein gp96 after liver resection for metastatic colorectal cancer[J]. Clin Cancer Res,2003,9(9):3235-3245.
[12]XU Z,JENSEN G,YEN TS. Activation of hepatitis B virus S promoter by the viral large surface protein via induction of stress in the endoplasmic reticulum[J]. J Virol,1997,71(10):7387-7392.
[13]KIM YS,LIM HK,RHIM H,et al. Recurrence of hepatocellular carcinoma after liver transplantation: patterns and prognostic factors based on clinical and radiologic features[J]. AJR AM J Roentgenol,2007,189(2):352-358.
[14]LIU H,PENG HW,CHENG YS,et al. Stabilization and enhancement of the antiapoptotic activity of mcl-1 by TCTP[J]. Mol Cell Biol,2005, 25(8):3117-3126.
[15]SONG L,COPPOLA D,LIVINGSTON S,et al. Mcl-1 regulates survival and sensitivity to diverse apoptotic stimuli in human non-small cell lung cancer cells[J]. Cancer Biol Ther,2005,4(3):267-276.
[16]CHUNG TK,CHEUNG TH,LO WK,et al. Expression of apoptotic regulators and their significance in cervical cancer[J]. Cancer Lett,2002,180(1):63-68.
[17]FLEISCHER B,SCHULZE-BERGKAMEN H,SCHUCHMANN M,et al. Mcl-1 is an anti-apoptotic factor for human hepatocellular carcinoma[J]. Int J Oncol,2006,28(1):25-32.
[18]SIEGHART W,LOSERT D,STROMMER S,et al. Mcl-1 overexpression in hepatocellular carcinoma: a potential target for antisense therapy[J]. J Hepatol,2006,44(1):151-157.
[19]CRAIG RW. MCL1 provides a window on the role of the BCL2 family in cell proliferation,differentiation and tumorigenesis[J]. Leukemia,2002,16(4):444-454.
[20]EDWARDS SW, DEROUET M, HOWSE M, et al. Regulation of neutrophil apoptosis by Mcl-1[J]. Biochem Soc Trans,2004,32(Pt3):489-492.
(本文编辑:龚晓霖)
