胸腺基质淋巴细胞生成素对效应T细胞分化功能的影响
2016-01-20林静李秀红梁磊王毅陈海潮杨征酉鹏华陕西省人民医院西安710068
林静,李秀红,梁磊,王毅,陈海潮,杨征,酉鹏华(陕西省人民医院,西安710068)
胸腺基质淋巴细胞生成素对效应T细胞分化功能的影响
林静,李秀红,梁磊,王毅,陈海潮,杨征,酉鹏华
(陕西省人民医院,西安710068)
摘要:目的探讨体外氧化型低密度脂蛋白( ox-LDL)诱导人血管平滑肌细胞产生的胸腺基质淋巴细胞生成素( TSLP)对效应T细胞分化功能的影响。方法分离并培养人血管平滑肌细胞、人树突状细胞( DC)、初始T细胞,随机分为4组,每组设5个样本。对照组、实验组人血管平滑肌细胞分别经PBS、ox-LDL处理后,取其上清液与DC、初始T细胞共培养; TSLP中和抗体组、中和抗体对照组在实验组的基础上分别加入TSLP中和抗体、TSLP非特异性中和抗体与DC、初始T细胞共培养。采用ELISA法检测各组细胞培养上清液中TSLP及Th17细胞因子IL-17、IL-22、TNF-α水平,流式细胞术检测Th17细胞构成比。结果与对照组比较,实验组培养上清液TSLP、IL-17、IL-22、TNF-α水平及Th17细胞构成比升高( P均<0.01)。与实验组、中和抗体对照组比较,TSLP中和抗体组TSLP、IL-17、IL-22、TNF-α水平及Th17细胞构成比降低( P均<0.01)。结论Ox-LDL体外诱导人血管平滑肌细胞产生的TSLP可促进T细胞向Th17细胞分化。
关键词:胸腺基质淋巴细胞生产素;树突状细胞; T细胞; Th17细胞;动脉粥样硬化
Influence of thymic stromal lymphopoietin on differentiation of effector T cells
LIN Jing,LI Xiu-hong,LIANG Lei,WANG Yi,CHEN Hai-chao,YANG Zheng,YOU Peng-hua
( Shaanxi Provincial People's Hospital,Xi'an 710068,China)
Abstract:Objective To investigate the influence of thymic stromal lymphopoietin ( TSLP) produced by oxidized-low density lipoprotein ( ox-LDL) -induced human vascular smooth muscle cells in vitro on differentiation of effector T cells.Methods Human vascular smooth muscle cells,human dendritic cells ( DCs) andT cells were isolated and cultured.Then we divided them into 4 groups,and 5 samples in each group.The control group and the experimental group were separately simulated with PBS and ox-LDL.The supernatant was incubated with DCs andT cells.TSLP neutralizing antibody group and neutralizing antibody control group were added with TSLP neutralizing antibody,TSLP non-specific neutralizing antibody,then were co-cultured with DC andT cells.The levels of TSLP and Th17cytokines including IL-17,IL-22 and TNF-α were detected by ELISA,and the flow cytometry was used to detect the proportion of Th17 cells.Results Compared with the control group,the levels of TSLP,IL-17,IL-22,TNF-α and the proportion of Th17 cells were increased in the experimental group ( all P<0.01).Compared with the neutralizing antibody control group,the levels of TSLP,IL-17,IL-22,TNF-α and the proportion of Th17 cells were decreased in the TSLP neutralizing antibody group ( all P<0.01).Conclusion TSLP produced by ox-LDL-induced human vascular smooth muscle cells in vitro could promoteT cells differentiating into Th17 cells.
Key words:thymic stromal lymphopoietin; dendritic cells; T cells; Th17cells; atherosclerosis
TSLP受体结合,在效应性T细胞的分化中起重要作用。但其具体作用机制尚不明确。2013年2月~2014年12月,我们对氧化型低密度脂蛋白( ox-LDL)诱导人血管平滑肌细胞产生的TSLP在效应性T细胞分化中的作用进行了探讨。
1 材料与方法
1.1材料淋巴细胞分离液购自上海试剂二厂。重组人粒细胞-巨噬细胞刺激因子( GM-CSF)、重组人IL-4、重组人TNF-α、人TSLP、IL-17、IL-22及TNF-α ELISA试剂盒购自eBiosience公司。FITC-抗人CD11c抗体、PE-抗人CD4抗体、FITC-抗人IL-17抗体、IgG同型对照抗体、TSLP中和抗体、对照中和抗体、抗人CD3单克隆抗体、抗人CD28单克隆抗体购自Santa Cruz。T细胞分选试剂盒购自Miltenyi Biotec公司。
1.2人血管平滑肌细胞的培养将人血管平滑肌细胞株(购自中国医学科学院细胞中心)复苏后,于37℃、饱和空气湿度、5% CO2培养箱中培养;待细胞生长至80%~90%融合时,用0.25%的胰蛋白酶+0.01%EDTA消化传代。以1.0×105/mL接种细胞至直径25 cm2培养瓶中进行后续试验。
1.4实验分组及处理①对照组: PBS与人血管平滑肌细胞共培养24 h,去除细胞,取其上清液与DC共培养24 h,与初始T细胞共培养5 d。②实验组: ox-LDL( 50 μg/mL)与人血管平滑肌细胞共培养24 h,去除细胞,取其上清液与DC共培养24 h。去除上清液,PBS冲洗3次,与初始T细胞共培养5 d。③TSLP中和抗体组: ox-LDL( 50 μg/mL)与人血管平滑肌细胞共培养24 h,去除细胞,取其上清液与DC共培养24 h。去除上清液,PBS冲洗3次,在加入TSLP中和抗体( 1 ng/mL)的培养基中与初始T细胞共培养5 d。④中和抗体对照组: ox-LDL ( 50 μg/mL)与人血管平滑肌细胞共培养24 h,去除细胞,取其上清液与DC共培养24 h。去除上清液,PBS冲洗3次,在加入TSLP非特异性中和抗体的培养基中与初始T细胞共培养5 d。每组设5个样本,5 d后,各组共培养系统中加入抗人CD3抗体( 5 μg/mL)及抗人CD28抗体( 5 μg/mL)孵育24 h。
1.5培养上清液中TSLP、Th17细胞因子( IL-17、IL-22及TNF-α)水平检测采用ELISA法。各组细胞培养结束后,收集培养上清液,按照试剂盒的操作步骤检测培养上清液中TSLP、IL-17、IL-22及TNF-α。实验设双复孔,重复3次。
1.7统计学方法采用SPSS13.0统计软件。计量资料用珋x±s表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1四组人平滑肌细胞TSLP水平比较对照组、实验组、TSLP中和抗体组、中和抗体对照组TSLP水平分别为( 1.83±0.25)、( 28.83±6.54)、( 3.87± 1.02)、( 24.55±2.95) pg/mL。与对照组比较,实验组上清液TSLP水平升高( P<0.01) ;与实验组比较,TSLP中和抗体组TSLP水平降低( P<0.01) ;与中和抗体对照组比较,TSLP中和抗体组TSLP水平降低( P<0.01)。
2.2四组培养上清液IL-17、IL-22、TNF-α水平比较见表1。
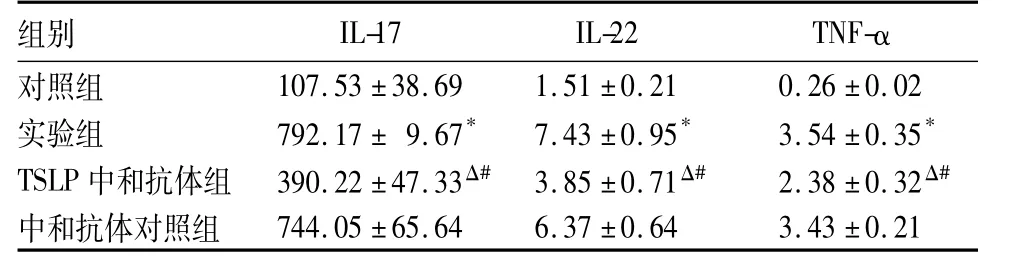
表1 四组培养上清液IL-17、IL-22、TNF-α水平比较( pg/mL,珔x±s)
2.3四组Th17细胞构成比比较对照组、实验组、TSLP中和抗体组、中和抗体对照组Th17细胞构成比分别为( 0.87±0.22) %、( 9.88±2.16) %、( 3.42 ±1.15) %、( 9.25±1.83) %。与对照组比较,实验组Th17细胞构成比明显升高( P<0.01) ;与实验组比较,TSLP中和抗体组Th17细胞构成比下降( P<0.01) ;与中和抗体对照组比较,TSLP中和抗体组Th17细胞构成比明显降低( P<0.01)。
3 讨论
Th17是近年来发现的T细胞亚群,其分泌的细胞因子主要有IL-17、IL-6、TNF-α及IL-22[4]。研究显示,Th17细胞及相关细胞因子在AS患者斑块局部及循环血中大量表达[5]。AS小鼠伴随着Th17炎症反应的激活,而敲除IL-17基因可明显抑制小鼠AS斑块形成[6,7]。Th17炎症反应对AS发生有促进作用,而并非是AS炎症反应的结果或其“伴随效应”。
研究表明,微生物、Toll样受体( TLR)配体以及某些细胞因子如IL-1β均可通过NF-κB途径诱导上皮细胞、纤维细胞、角质细胞及内皮细胞产生诱导型TSLP[8]。不同细胞类型产生的诱导型TSLP所需的刺激原不同[9]。在人气管上皮细胞,单独的TNF-α 或IL-1β刺激可以诱导细胞产生诱导型TSLP[10];而在小气道上皮细胞中,只有TNF-α及IL-1β联合才可导致诱导型TSLP的产生[11]。因此,不同细胞类型能否诱导产生诱导型TSLP,由细胞所处局部微环境决定。本研究发现,ox-LDL刺激人平滑肌细胞产生TSLP,表明人血管平滑肌细胞所处的ox-LDL微环境是产生诱导型TSLP的决定性因素。TSLP一直被认为是Th2炎症反应的“总开关”,在特异性皮炎、过敏性哮喘等以Th2炎症反应为主的自身免疫性疾病中起主要作用。然而近期研究表明,TSLP也可诱导向Th17细胞亚群分化。Tanaka等[12]研究发现,单独刺激可诱导DC导致效应性T细胞向T2分化,但是TSLP与TLR配体联合共同刺激诱导DC导致效应性T细胞向Th17分化。本研究发现,ox-LDL诱导产生的诱导型TSLP能够激活DC,导致Th17细胞分化、Th17细胞因子表达增加,其可能机制为ox-LDL可作为配体与TLR结合,与TSLP联合共同刺激促使初始T细胞向Th17分化。
本研究发现,与对照组比较,实验组上清液TSLP水平升高,表明ox-LDL可诱导人平滑肌细胞产生TSLP;抗体中和试验发现,TSLP中和抗体可显著降低培养上清液TSLP、IL-17、IL-22水平及Th17细胞构成比,从而阻止DC诱导的Th17细胞分化,进一步表明TSLP在DC诱导的Th17细胞亚群分化机制中发挥重要作用。
综上所述,ox-LDL诱导人平滑肌细胞产生的TSLP可作用于DC,导致效应性T细胞向Th17分化。结合我们前期研究发现的AS斑块中TSLP表达升高及Th17在AS中的重要作用,认为TSLP在AS中的重要作用之一可能为促使T细胞分化,具体作用及分子机制尚需进一步研究。
参考文献:
[1]Ross R.Atherosclerosis-an inflammatory disease[J].N Engl J Med,1999,340( 2) :115-126.
[2]Stemme S,Holm J,Hansson GK.T lymphocytes in human atherosclerotic plaques are memory cells expressing CD45RO and the integrin VLA-1[J].Arterioscler Thromb,1992,12( 2) : 206-211.
[3]Liu X,Li H,Ren X.Signaling cascades initiated by tslp-mediated signals in different cell types[J].Cell Immunol,2012,279: 174-179.
[4]Kolls JK,Lindén A.Interleukin-17 family members and inflammation[J].Immunity,2004,21( 4) : 467-476.
[5]Liu Z,Lu F,Pan H,et al.Correlation of peripheral th17 cells and th17-associated cytokines to the severity of carotid artery plaque and its clinical implication[J].Atherosclerosis,2012,221( 1) : 232-241.
[6]Usui F,Kimura H,Ohshiro T,et al.Interleukin-17 deficiency reduced vascular inflammation and development of atherosclerosis in western diet-induced apoe-deficient mice[J].Biochem Biophys Res Commun,2012,420( 1) : 72-77.
[7]Gao Q,Jiang Y,Ma T,et al.A critical function of th17 proinflammatory cells in the development of atherosclerotic plaque in mice[J].J Immunol,2010,185( 10) : 5820-5827.
[8]Takai T.Tslp expression: Cellular sources,triggers,and regulatory mechanisms[J].Allergol Int,2012,61( 1) : 613-617.
[9]Zhao H,Li M,Wang L,et al.Angiotensin ii induces tslp via an at1 receptor/nf-kappab pathway,promoting th17 differentiation [J].Cell Physiol Biochem,2012,30( 6) : 1383-1397.
[10]Haro H,Komori H,Okawa A,et al.Sequential dynamics of monocyte chemotactic protein-1 expression in herniated nucleus pulposus resorption[J].J Orthop Res,1997,15( 5) : 734-741
[11]Kanamaru Y,Sumiyoshi K,Ushio H,et al.Smad3 deficiency in mast cells provides efficient host protection against acute septic peritonitis[J].J Immunol,2005,174( 7) : 4193-4197.
[12]Tanaka J,Watanabe N,Kido M,et al.Human tslp and tlr3 ligands promote differentiation of th17 cells with a central memory phenotype under th2-polarizing conditions[J].Clin Exp Allergy,2009,39( 1) : 89-100.
收稿日期:( 2015-06-05)
通信作者简介:梁磊( 1974-),男,主任医师,博士,主要研究方向为动脉粥样硬化分子生物学机制。E-mail: ll008@163.com
作者简介:第一林静( 1979-),女,主治医师,博士,主要研究方向为动脉粥样硬化发病机制。E-mail: linjing.123456789@163.com
基金项目:国家自然科学基金资助项目( 81400333)。
文章编号:1002-266X( 2015)29-0004-03
文献标志码:A
中图分类号:R311.1+44
doi:10.3969/j.issn.1002-266X.2015.29.002
