鼻咽癌组织中转录因子FOXO3a、HIF-1α蛋白及mRNA表达及意义
2016-01-20寿铸何丹重庆市渝北区人民医院重庆400重庆市第三人民医院
寿铸,何丹( 重庆市渝北区人民医院,重庆400;重庆市第三人民医院)
鼻咽癌组织中转录因子FOXO3a、HIF-1α蛋白及mRNA表达及意义
寿铸1,何丹2
( 1重庆市渝北区人民医院,重庆401120;2重庆市第三人民医院)
摘要:目的观察鼻咽癌( NPC)组织中转录因子FOXO3a、缺氧诱导因子1α( HIF-1α)蛋白及mRNA的表达,并探讨其意义。方法选择NPC患者48例,均留取NPC活检组织( NPC组) ;健康体检者15例,均留取正常鼻咽黏膜组织(对照组)。采用免疫组织化学方法观察两组转录因子FOXO3a、HIF-1α蛋白阳性表达,RT-PCR方法检测FOXO3a、HIF-1α mRNA相对表达量,分析FOXO3a、HIF-1α阳性表达与NPC患者临床病理参数之间的关系。结果NPC组、对照组FOXO3a蛋白阳性表达率分别为50.0%、80.0% ( P<0.05),HIF-1α蛋白阳性表达率分别为75.0%、33.3%( P<0.05)。NPC组FOXO3a mRNA、HIF-1α mRNA相对表达量分别为0.47±0.07、0.61±0.12,对照组分别为0.56±0.06、0.69±0.09;两组比较,P均>0.05。FOXO3a阳性表达与NPC患者临床分期、T分期、淋巴结转移和远处转移有关( P均<0.05),HIF-1α阳性表达与NPC患者淋巴结转移和远处转移有关( P均<0.05)。结论NPC组织中HIF-1α蛋白阳性表达率增加、FOXO3a蛋白阳性表达率降低,二者表达变化可能与NPC的发生、发展有关。
关键词:鼻咽肿瘤;鼻咽癌;转录因子FOXO3a;缺氧诱导因子-1α
鼻咽癌( NPC)是中国南方地区最常见的恶性肿瘤之一,其发生与EB病毒、遗传因素、多种癌基因和抑癌基因的相互作用以及环境和饮食等因素有关。FOXO3a是Forkhead转录因子家族中的一员,与细胞代谢、细胞周期、凋亡调控、肿瘤发生等相关。缺氧诱导因子1α( HIF-1α)高表达在人体恶性肿瘤中广泛存在。本研究观察NPC组织中转录因子FOXO3a、HIF-1α蛋白及mRNA表达,并探讨其意义。
1 资料与方法
1.1临床资料选择2012年6月~2014年7月重庆市渝北区人民医院五官科与重庆市第三人民医院耳鼻咽喉头颈外科收治NPC患者48例,均留取NPC活检组织( NPC组),病理检查均证实为低分化鳞状细胞癌,均未接受过任何放疗和化疗,均有完整的临床和病理资料。其中男33例,女15例;年龄31~67岁,中位年龄47岁;参照“NPC 2008分期标准”进行临床分期:Ⅰ期7例,Ⅱ期7例,Ⅲ期14例,Ⅳ期20例。健康体检者15例,均留取正常鼻咽黏膜组织标本作为对照组,男10例,女5例;年龄34~63岁,中位年龄44岁。两组性别、年龄具有可比性。
1.2 FOXO3a与HIF-1α蛋白表达检测采用免疫组织化学方法检测两组FOXO3a、HIF-1α表达,步骤参照试剂盒说明书。已知阳性切片作为阳性对照,PBS代替一抗作为阴性对照。FOXO3a蛋白表达定位于细胞核或细胞质,HIF-1α蛋白定位于细胞核,阳性表达均呈棕黄色。无阳性细胞为-,阳性细胞比例<25%为+,阳性细胞比例25%~75%为++,阳性细胞数比例>75%为+ + +。+、+ +、+ + +均记为阳性表达。
1.3 FOXO3a、HIF-1α mRNA相对表达量检测采用RT-PCR方法。使用Primer Premier5.0软件设计引物: FOXO3a上游引物为5'-CTTCAAGGATAAGGGCGACAG-3',下游引物为5'-CGTCCTGGACTTCATCCAAC-3',扩增产物为437 bp; HIF-1α上游引物为5'-TATGACCTGCTTGGTGCTGA-3',下游引物为5'-GGGAGAAAATCAAGTCGTGC-3',扩增大小为413 bp。内参GAPDH上游引物为5'-ATGACCCCTTCATTGACCTCA-3',下游引物为5'-GAGATGATGACCCTTTTGGCT-3',扩增大小为265 bp。使用RT-PCR试剂盒(宝生物工程有限公司)进行反转录及PCR扩增。扩增条件为: 95℃预变性5 min; 95℃变性45 s,57℃退火50 s,72℃延伸1 min,40个
循环; 72℃延伸7 min。取5 μL PCR产物行1.5%琼脂糖凝胶电泳,采用凝胶成像仪分析图像。表达量以相对表达水平表示,即目的基因条带光密度值与相应GAPDH条带光密度值的比值。
1.4统计学方法采用SPSS15.0统计软件。计量资料以珋x±s表示,比较采用方差分析;等级资料比较采用Mann-Whitney U检验;相关分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果
2.1两组FOXO3a、HIF-1α蛋白阳性表达比较对照组FOXO3a阳性表达主要定位于细胞核,NPC组主要定位于细胞质;两组HIF-1α阳性表达均主要定位于细胞核(插页Ⅰ图5)。NPC组、对照组FOXO3a蛋白阳性表达率分别为50.0%、80.0% ( P <0.05),HIF-1α蛋白阳性表达率分别为75.0%、33.3%( P<0.05)。
2.2 FOXO3a、HIF-1α阳性表达与NPC患者临床病理参数的关系FOXO3a阳性表达与NPC患者临床分期、T分期、淋巴结转移和远处转移有关( P均<0.05),与性别、年龄无关( P均>0.05) ; HIF-1α阳性表达与NPC患者淋巴结转移和远处转移有关( P均<0.05),与性别、年龄、临床分期和T分期无关( P均>0.05)。见表1。
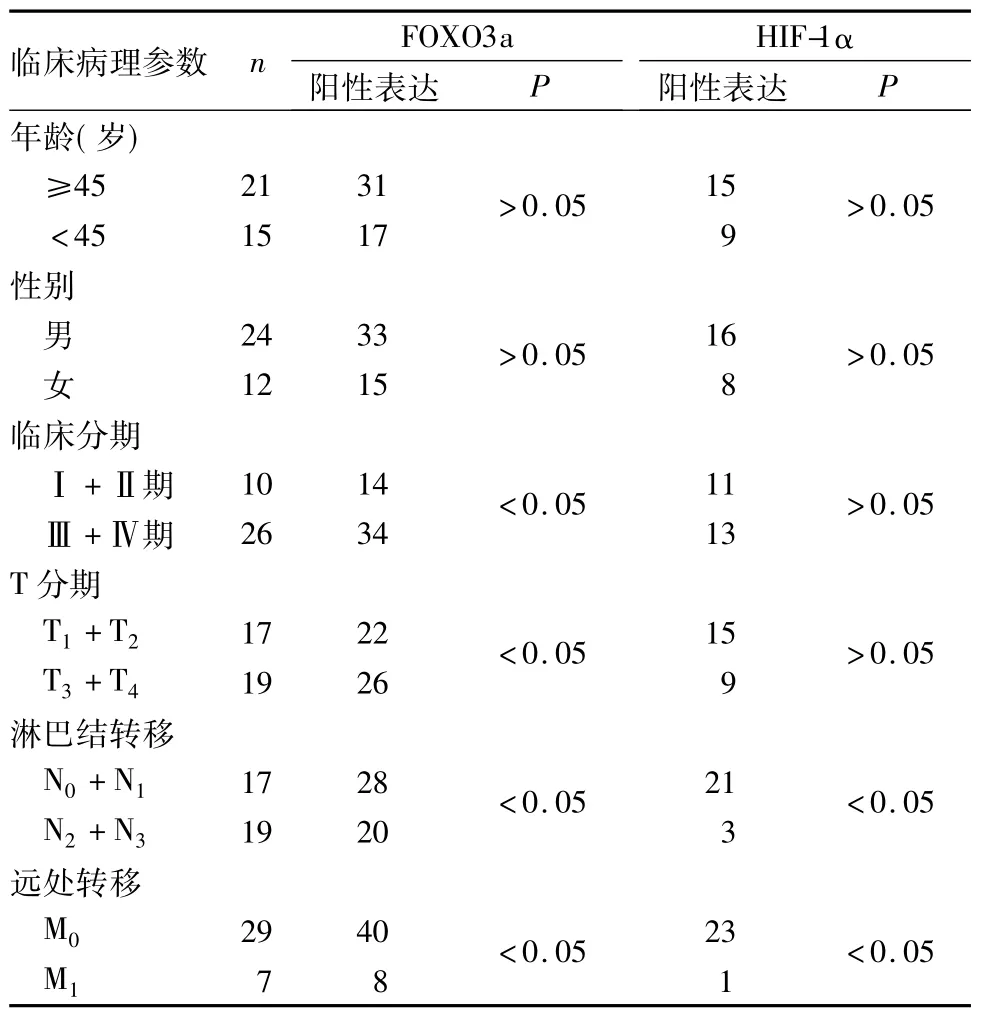
表1 FOXO3a、HIF-1α阳性表达与NPC患者临床病理参数的关系(例)
2.3两组FOXO3a mRNA、HIF-1α mRNA相对表达量比较NPC组FOXO3a mRNA相对表达量为0.47 ±0.07,对照组为0.56±0.06;两组比较,P>0.05。NPC组HIF-1α mRNA相对表达量为0.61±0.12,对照组为0.69±0.09;两组比较,P>0.05。
2.4 NPC组织中FOXO3a与HIF-1α蛋白阳性表达的关系NPC组织中FOXO3a与HIF-1α蛋白阳性表达呈负相关( r =-0.667,P<0.01)。
3 讨论
FOXO3a是Forkhead转录因子家族中的重要一员,与细胞凋亡、周期调控,肿瘤的发生发展及血管生成等密切相关[1~3]。FOXO3a在正常情况下定位于细胞核内,在生长因子等各种刺激下,FOXO3a可发生磷酸化,促使其从细胞核移位至细胞质,导致FOXO3a转录活性受到抑制[4]。研究发现,许多人类肿瘤中普遍存在FOXO3a活性缺失[5]。FOXO3a在卵巢肿瘤中呈低表达[6],在前列腺癌细胞中主要存在于细胞质,高等级前列腺癌组织中FOXO3a表达水平明显低于低等级前列腺癌组织[7];通过FOXO3a-siRNA干扰下调乳腺癌MDAMB细胞系FOXO3a表达,可引起癌细胞增殖和裸鼠肿瘤生成[4];在口腔鳞状细胞癌中转染FOXO3a可导致细胞生长G1期阻滞和凋亡[8]。本研究显示,FOXO3a在正常鼻咽黏膜组织主要定位于细胞核,在NPC组织中主要定位于细胞质,NPC组织中FOXO3a阳性表达率低于正常鼻咽黏膜组织,由此推测FOXO3a细胞内转位及表达下调可能促进NPC的发生。但是,本研究中NPC和鼻咽正常黏膜组织中FOXO3a mRNA表达比较差异无统计学意义,推测NPC发生过程中FOXO3a在转录水平无明显变化,其主要在蛋白质水平对细胞的生物学功能发挥调控作用。研究表明,FOXO3a的活性调节主要通过磷酸化、乙酰化、泛素化等转录后修饰,蛋白质水平是其主要调节路径,而其基因水平并无明显变化[1~3]。但是,Karger等[9]发现,甲状腺癌组织FOXO3a mRNA水平较正常对照组织降低;可能与肿瘤类型及样本量不同有关。Fei等[6]研究发现,卵巢组织中FOXO3a表达与肿瘤等级、淋巴结转移明显相关。本研究结果显示,FOXO3a表达与NPC临床分期、T分期、淋巴结转移、远处转移密切相关;提示FOXO3a可能与NPC的发生、发展有一定联系。
细胞缺氧已经被证明与肿瘤的侵袭、转移、预后密切相关。缺氧诱导因子1( HIF-1)由HIF-1α、HIF-1α亚基组成,其中HIF-1α为结构亚基,持续表达; HIF-1α是调节亚基,受氧的调节,决定HIF-1活性[10]。研究发现,HIF-1α是一些肿瘤相关基因的重要调控点[11]。本研究发现,HIF-1α蛋白在NPC组织中表达高于正常鼻咽黏膜组织,与其他研究结果一致[12,13];此外,HIF-1α mRNA在NPC组织与正
常鼻咽黏膜组织中的表达比较无统计学差异;可能原因为HIF-1α的维持和降解由泛素蛋白酶体系统控制,蛋白质水平是其主要调控方式[14]。研究指出,HIF-1α表达与NPC临床分期、T分期和淋巴结转移无明显相关[13]。但本研究发现,HIF-1α阳性表达与NPC淋巴结转移和远处转移相关。造成结果差异的原因可能是标本获取方式或免疫组化分析方法不同。
Bakker等[15]发现,FOXO3a可通过刺激CITED2,抑制HIF-1α引导的凋亡; Emerling等[16]研究结果显示,PTEN缺失可通过抑制FOXO3a活性,增加HIF-1α转录活性;抑制P38α可以通过调节FOXO3a、HIF-1α表达而抑制结肠癌的肿瘤生成[17]。本研究观察到NPC组织中FOXO3a与HIF-1α表达呈负相关,但二者相关的具体机制还不清楚。
总之,NPC组织中HIF-1α蛋白阳性表达率升高、FOXO3a蛋白阳性表达率降低,二者表达变化可能与NPC的发生、发展有关。
参考文献:
[1]Kaestner KH,Knochel W,Martinez DE.Unified nomenclature for the winged helix/forkhead transcription factors[J].Genes Dev,2000,14( 2) : 142-146.
[2]Greer EL,Brunet A.FOXO transcription factors at the interface between longevity and tumor suppression[J].Oncogene,2005,24 ( 50) : 7410-7425.
[3]Potente M,Urbich C,Sasaki K,et al.Involvement of Foxo transcription factors in angiogenesis and postnatal neovascularization [J].J Clin Invest,2005,115( 9) : 2382-2392.
[4]Hu MC,Lee DF,Xia W,et al.IkappaB kinase promotes tumorigenesis through inhibition of forkhead FOXO3a[J].Cell,2004,117( 2) : 225-237.
[5]Accili D,Arden KC.FoxOs at the crossroads of cellular metabolism,differentiation,and transformation[J].Cell,2004,117 ( 4) : 421-426.
[6]Fei M,Zhao Y,Wang Y,et al.Low expression of Foxo3α is associated with poor prognosis in ovarian cancer patients[J].Cancer Invest,2009,27( 1) : 52-59.
[7]Shukla S,Shukla M,Maclennan GT,et al.Deregulation of FOXO3a during prostate cancer progression[J].Int J Oncol, 2009,34( 6) : 1613-1620.
[8]Fang L,Wang H,Zhou L,et al.Akt-FOXO3a signaling axis dysregulation in human oral squamous cell carcinoma and potent efficacy of FOXO3a-targeted gene therapy[J].Oral Oncol,2011,47 ( 1) : 16-21.
[9]Karger S,Weidinger C,Krause K,et al.FOXO3a: a novel player in thyroid carcinogenesis[J].Endocrine Related Cancer,2008,16 ( 1) : 189-199.
[10]Semenza GL,Wang GL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12( 12) : 5447-5454.
[11]Semenza GL.Hypoxia,clonal selection,and the role of HIF-1 in tumor progression[J].Crit Rev Biochem Mol Biol,2000,35( 2) : 71-103.
[12]Hui EP,Chan AT,Pezzella F,et al.Coexpression of hypoxia-inducible factors 1alpha and 2alpha,carbonic anhydrase IX,and vascular endothelial growth factor in nasopharyngeal carcinoma and relationship to survival[J].Clin Cancer Res,2002,8( 8) :2595-2604.
[13]Xueguan L,Xiaoshen W,Yongsheng Z,et al.Hypoxia inducible factor-1 alpha and vascular endothelial growth factor expression are associated with a poor prognosis in patients with nasopharyngeal carcinoma receiving radiotherapy with carbogen and nicotinamide [J].Clin Oncol ( R Coll Radiol),2008,20( 8) : 606-612.
[14]Salceda S,Caro J.Hypoxia-inducible factor 1alpha ( HIF-1alpha) protein is rapidly degraded by the ubiquitin-proteasome system under normoxic conditions.Its stabilization by hypoxia depends on redox-induced changes[J].J Biol Chem,1997,272 ( 36 ) : 22642-22647.
[15]Bakker WJ,Harris IS,Mak TW.FOXO3a is activated in response to hypoxic stress and inhibits HIF1-induced apoptosis via regulation of CITED2[J].Mol Cell,2007,28( 6) : 941-953.
[16]Emerling BM,Weinberg F,Liu JL,et al.PTEN regulates p300-dependent hypoxia-inducible factor 1 transcriptional activity through Forkhead transcription factor 3a ( FOXO3a)[J].Proc Natl Acad Sci U S A,2008,105( 7) : 2622-2627.
[17]Chiacchiera F,Matrone A,Ferrari E,et al.p38alpha blockade inhibits colorectal cancer growth in vivo by inducing a switch from HIF1alpha-to FoxO-dependent transcription[J].Cell Death Differ,2009,16( 9) : 1203-1214.
收稿日期:( 2014-11-04)
通信作者:何丹,E-mail: 414011266@ qq.com
文章编号:1002-266X( 2015) 28-0073-03
文献标志码:B
中图分类号:R739.63
doi:10.3969/j.issn.1002-266X.2015.28.031
