Sclerostin对骨形态发生蛋白2诱导的人骨髓间充质干细胞成骨分化的影响
2016-01-20张尧何耀华上海市第六人民医院上海200233
张尧,何耀华(上海市第六人民医院,上海200233)
Sclerostin对骨形态发生蛋白2诱导的人骨髓间充质干细胞成骨分化的影响
张尧,何耀华
(上海市第六人民医院,上海200233)
摘要:目的探讨Sclerostin对骨形态发生蛋白2( BMP-2)诱导的人骨髓间充质干细胞( BMSCs)成骨分化的影响。方法取两位男性车祸伤致截肢患者的骨髓组织进行体外人BMSCs培养。将培养细胞随机分为三组,1组未做转染( Mock),2组转染对照siRNA,3组转染Sclerostin(骨形态发生蛋白抑制剂) siRNA,均采用含有0.1 μg/mL BMP-2的成骨诱导培养基培养。分别在诱导培养的第0、3、7天,采用CCK-8法检测各组细胞活性,采用CyQUANT细胞增殖检测试剂盒检测DNA含量。在培养的第14天,采用RT-PCR方法检测骨相关基因骨钙素( OCN)、骨钙蛋白( OC)及骨桥蛋白( OPN),采用碱性磷酸酶( ALP)分析试剂盒进行ALP活性分析,采用BCA蛋白检测试剂盒检测细胞蛋白含量。结果在诱导培养的第3、7天,3组细胞增殖活性、DNA含量均高于1、2组( P均<0.05)。在诱导培养的第14天,3组OCN、OC、OPN mRNA相对表达量及蛋白含量均高于1、2组( P均<0.05) ; 1、2、3组ALP活性分别为1.00%±0.08%、1.12%±0.09%、2.50%±0.03%,3组高于1、2组( P均<0.05)。结论抑制Sclerostin表达可以促进BMP-2诱导的人BMSCs的活性及成骨分化能力。
关键词:成骨分化;人骨髓间充质干细胞;骨形态发生蛋白2; Sclerostin;碱性磷酸酶
Effect of Sclerostin on BMP-2-induced osteogenesis of human mesenchymal stem cells
ZHANG Yao,HE Yao-hua
( The Sixth People's Hospital of Shanghai,Shanghai 200233,China)
Abstract:Objective To investigate the influence of Sclerostin on bone morphogenetic protein 2 ( BMP-2) -induced osteogenic differentiation of human bone marrow-derived mesenchymal stem cells ( BMSCs).Methods The bone marrow tissues taken from two males receiving amputation because of traffic accident were used to culture the human BMSCs in vitro.The cultured cells were randomly divided into three groups: groups 1,2 and 3.The cells in the group 1 did not receive transfection ( Mock),the cells in the group 2 were transfected with control siRNA,and the cells in the group 3 were transfected with Sclerostin siRNA ( BMPs inhibitor).Meanwhile,the osteoblasts were cultured with 0.1 μg/mL BMP-2.CCK-8 assay was used to detect the activities of the cells on the 0,3rd and 7th day of induction,and the content of DNA was detected by CyQUANT cell proliferation assay kit.On the 14th day of culture,the expression levels of osteocalcin ( OCN),osteocalcin ( OC) and osteopontin ( OPN) were detected by using RT-PCR,the alkaline phosphatase ( ALP) analysis kit was used to analyze the activity of ALP,and the BCA protein assay reagent kit was used to analyze the cell protein content.Results On the 3rd and 7th day of culture,the proliferation activity and total DNA content of group 3 were higher than those of the groups 1 and 2 ( all P<0.05).On the 14th day of culture,the relative expression levels of OCN,OC and OPN mRNA and total protein content were higher than those of the groups 1 and 2 ( all P<0.05).The activities of ALP in the groups 1,2 and 3 were respectively 1.00%±0.08%,1.12%±0.09% and 2.50%±0.03%,and group 3 was higher than group 1 and group 2 ( all P<0.05).Conclusion Inhibiting the Sclerostin expression may increase the cell viability of human BMSCs and osteogenic differentiation.
Key words:osteogenesis; human mesenchymal stem cells; bone morphogenetic protein 2; Sclerostin; alkaline phosphatase
骨形态发生蛋白( BMP)参与机体的形态发育和器官形成,刺激成骨细胞分化。骨折时骨髓间充质干细胞( BMSCs)在多种因子的诱导作用下迁移到骨折处,分化为成骨细胞,合成骨组织以修复受损的骨骼[1~4]。BMP可以诱导BMSCs向成骨细胞方向分化[5~9],其诱导作用受到细胞外BMP抑制剂的调节[10,11]。Sclerostin为BMP抑制剂,通过竞争性与BMP受体结合,下调BMP活性,进而抑制成骨分化过程[12]。但是,Sclerostin对人BMSCs成骨分化的影响尚不明确。本研究探讨Sclerostin对骨形态发生蛋白2( BMP-2)诱导的人BMSCs成骨分化的影响。
1 资料与方法
1.1临床资料选择2014年4~6月上海市第六人民医院收治的两位男性车祸伤致截肢患者,年龄分别为38、46岁,均取其骨髓样本。患者对本研究均知情同意,并通过本院伦理委员会批准。
1.2人BMSCs的分离及培养将新鲜的骨髓组织加入到含10%胎牛血清( FBS)的DMEM培养基中,吹打并制成单细胞悬液,分装至2个25 mL培养瓶中。置于37℃、5% CO2的恒温培养箱中培养。5 d后首次半量换液,以后每2~3 d全量换液1次。待培养第10~14天贴壁细胞长至90%时,采用0.25%胰蛋白酶和1 mL/L EDTA的混合液( 1∶2)消化传代。取第2代细胞消化、分离,移至离心管低速离心,计数并调整细胞密度为3×106个/mL,备用。
1.3 Sclerostin siRNA制备及验证设计并合成有效siRNA,用来靶向人Sclerostin( Gene ID: 50964) mRNA(中国Qiagen)。siRNA序列正义链为5'-ACGUCUUUGGUCUCAAAGGGG-3',反义链为5'-CCUUUGAGACCAAAGACGUGU-3'。以BLOCK-iT si-RNA(美国Invitrogen)作为对照siRNA(不与体内任何基因序列结合),正义链为5'-UUCUCCGAAGUCACG-3',反义链为5'-ACGUGACACGUUCGGAGAA-3'。采用Lipofectamine(美国life)将对照siRNA和Sclerostin特异性siRNA转染进入人BMSCs,转染24 h后,在基础培养基中加入0.1 μg/mL BMP-2;培养72 h后,抽离总RNA,采用Real-time PCR检测Sclerostin mRNA相对表达量。结果显示,转染Sclerostin siRNA的人BMSCs中Sclerostin mRNA表达水平显著降低,未转染细胞和转染对照siRNA细胞中Sclerostin mRNA表达水平未有明显变化;说明制备Sclerostin siRNA成功,可用于以下研究。
1.4人BMSCs分组及处理将培养细胞随机分为三组,1组未做转染( Mock),2组转染对照siRNA,3组转染Sclerostin siRNA,转染24 h后,三组均给予含有0.1 μg/mL BMP-2的成骨诱导培养基培养,以诱导人BMSCs成骨分化。
1.5观察方法各组细胞分别在诱导培养的第0、3、7天采用CCK-8法检测人BMSCs活性;采用CyQUANT细胞增殖检测试剂盒(美国Invitrogen)测定细胞DNA含量。在诱导培养的第14天,采用RT-PCR方法检测成骨相关基因骨钙素( OCN)、骨钙蛋白( OC)及骨桥蛋白( OPN),以GAPDH作为内参基因;采用碱性磷酸酶( ALP)分析试剂盒(美国BioAssay Systems)进行ALP活性分析;采用BCA蛋白检测试剂盒检测细胞蛋白含量(美国Thermo)。检测结果均用与对照组相比后的相对量表示。
1.6统计学方法采用PASW Statistics19.0统计软件。计量资料采用珋x±s表示,比较采用t检验或one-way ANOVA方差分析。P<0.05为差异有统计学意义。
2 结果
在诱导培养的第3、7天,3组细胞活性、DNA含量均高于1、2组( P均<0.05),见表1、2。在诱导培养的第14天,1、2、3组ALP活性分别为1.00%± 0.08%、1.12%±0.09%、2.50%±0.03%,3组高于1、2组( P均<0.05) ;细胞蛋白含量分别为1.00%± 0.03%、0.99%±0.22%、2.05%±0.14%,3组高于1、2组( P均<0.05) ;3组OCN、OC、OPN mRNA相对表达量均高于1、2组( P均<0.05),见表3。
表1 各组细胞活性比较( %,±s)

表1 各组细胞活性比较( %,±s)
注:与相同培养时间时1组比较,*P<0.05;与相同培养时间时2组比较,△P<0.05。
组别 细胞活性第0天 第3天 第7天1组1.00±0.08 1.50±0.11 2.48±0.23 2组 0.99±0.08 1.52±0.12 2.50±0.32 3组 1.01±0.04 2.12±0.18*△ 4.02±0.43*△
表2 各组细胞DNA含量比较( %,±s)
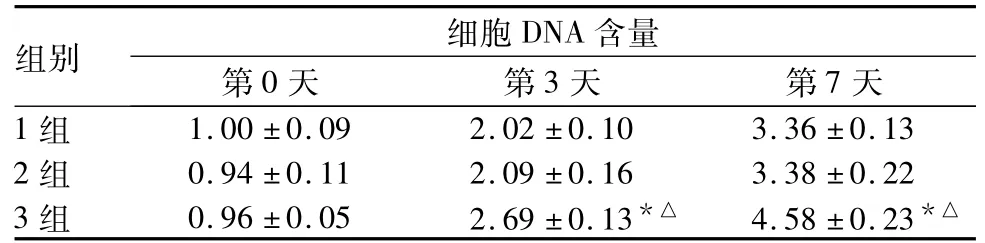
表2 各组细胞DNA含量比较( %,±s)
注:与相同培养时间时1组比较,*P<0.05;与相同培养时间时2组比较,△P<0.05。
组别 细胞DNA 含量第0天 第3天 第7天1组1.00±0.09 2.02±0.10 3.36±0.13 2组 0.94±0.11 2.09±0.16 3.38±0.22 3组 0.96±0.05 2.69±0.13*△ 4.58±0.23*△
表3 各组细胞OCN、OC、OPN mRNA表达比较( %,±s)

表3 各组细胞OCN、OC、OPN mRNA表达比较( %,±s)
注:与1组比较,*P<0.05;与2组比较,△P<0.05。
组别OCN OC OPN 1组1.00±0.02 1.00±0.03 1.00±0.11 2组 1.01±0.22 0.98±0.01 1.08±0.08 3组 2.30±0.13*△ 2.60±0.13*△ 2.70±0.16*△
3 讨论
BMP诱导的成骨分化受到细胞外BMP抑制剂
的密切调节,此类抑制剂包括noggin、chordin、gremlin、Sclerostin等[10,11]。BMP抑制剂通过与BMP结合,阻止BMP与细胞膜上的相应受体结合,从而阻碍BMP下游信号通路的激活,同时BMP抑制剂也可以直接作用于细胞膜上的受体。每种BMP抑制剂都与BMP超家族中的成员具有不同程度的亲和力。BMP抑制剂均具有“胱氨酸结”结构,可以作为配体与多种质膜受体结合[13]。Avsian-Kretchmer等[14]根据所包含“胱氨酸结”的大小,将BMP抑制剂分成3个次级家族,即CAN、twisted gastrulation、chordin和noggin,其中Sclerostin、DAN、cerberus属于CAN家族。研究发现,CAN家族对BMP-2、BMP-4、BMP-7均有抑制作用[11]。Sutherland等[15]通过对人成骨细胞的研究发现,BMP-2、BMP-4、BMP-6可介导Sclerostin的表达,该作用具有时间和剂量依赖性,并可被视黄酸和1,25( OH)2D3增强,被地塞米松完全抑制。但是,BMP-2、BMP-4、BMP-6 对noggin和gremlin的表达影响较小。上述结果提示,Sclerostin是不同于其他BMP抑制剂的一种新的BMP抑制物,有其自身独特的配基特异性。研究发现,Sclerostin可以抑制成骨细胞的发育,包括成骨细胞的增殖以及早期和晚期分化[16]。Sclerostin可以增加成骨细胞内Caspase活性,诱导成骨细胞凋亡,这可能是Sclerostin抑制骨形成的机制之一。此外,被新矿化的基质包埋的骨细胞可以分泌Sclerostin,并运送到骨表面的成骨细胞,进而在各个阶段抑制成骨细胞的发育,最终导致骨形成的抑制。
BMP-2在促进人BMSCs向成骨方向分化方面具有至关重要的作用,其在一定浓度范围内可以诱导人BMSCs表达一些成骨标志性因子,如OCN、OC、OPN等。本课题组前期研究结果表明,BMP-2可以诱导BMSCs表达Sclerostin,这种诱导作用具有时间和剂量依赖性。当BMP-2浓度为0.1 μg/mL时,Sclerotin的表达量最高,因此采用此浓度进行本次研究。在Sclerotin表达抑制的初期,BMSCs的活力会受到一定的影响。本研究结果显示,在Sclerotin表达抑制的第3、7天BMSCs活力明显增强,同时DNA含量升高;在成骨诱导的第14天,成骨分化的早期标准物ALP活性增强,成骨分化的标志性基因OCN、OC、OPN表达水平明显提高,总蛋白含量升高;以上结果说明,Sclerotin表达抑制可以促进BMP-2诱导的BMSCs成骨分化。
参考文献:
[1]Zigdon-Giladi H,Bick T,Lewinson D,et al.Mesenchymal stem cells and endothelial progenitor cells stimulate bone regeneration and mineral density[J].J Periodontol,2014,85( 7) : 984-990.
[2]Xu FF,Zhu H,Li XM,et al.Intercellular adhesion molecule-1 inhibits osteogenic differentiation of mesenchymal stem cells and impairs bio-scaffold-mediated bone regeneration in vivo[J].Tissue Eng Part A,2014,20( 19-20) : 2768-2782.
[3]Clough BH,McCarley MR,Krause U,et al.Bone regeneration with osteogenically enhanced mesenchymal stem cells and their extracellular matrix proteins[J].J Bone Miner Res,2015,30( 1) : 83-94.
[4]Qin Y,Guan J,Zhang C.Mesenchymal stem cells: mechanisms and role in bone regeneration[J].Postgrad Med J,2014,90 ( 1069) : 643-647.
[5]Koussoulakou DS,Margaritis LH,Koussoulakos SL.Antagonists of retinoic acid and BMP4 affect fetal mouse osteogenesis and odontoblast differentiation[J].Pathophysiology,2011,18( 2) : 103-109.
[6]Gozo MC,Aspuria PJ,Cheon DJ,et al.Foxc2 induces Wnt4 and Bmp4 expression during muscle regeneration and osteogenesis[J].Cell Death Differ,2013,20( 8) : 1031-1042.
[7]Luo W,Friedman MS,Hankenson KD,et al.Time series gene expression profiling and temporal regulatory pathway analysis of BMP6 induced osteoblast differentiation and mineralization[J].BMC Syst Biol,2011,( 5) : 82.
[8]Zhu L,Chen FG,Liu W,et al.Effect of adeno-BMP7 transfection on osteogenesis of BMSCs[J].Zhonghua Zheng Xing Wai Ke Za Zhi,2006,22( 1) : 59-62.
[9]Lamplot JD,Qin J,Nan G,et al.BMP9 signaling in stem cell differentiation and osteogenesis[J].Am J Stem Cells,2013,2( 1) :1-21.
[10]Dudaric L,Cvek SZ,Cvijanovic O,et al.Expression of the BMP-2,-4 and -7 and their antagonists gremlin,chordin,noggin and follistatin during ectopic osteogenesis[J].Coll Antropol,2013,37 ( 4) : 1291-1298.
[11]Wan DC,Pomerantz JH,Brunet LJ,et al.Noggin suppression enhances in vitro osteogenesis and accelerates in vivo bone formation [J].J Biol Chem,2007,282( 36) : 26450-26459.
[12]Winkler DG,Sutherland MK,Geoghegan JC,et al.Osteocyte control of bone formation via sclerostin,a novel BMP antagonist[J].EMBO J,2003,22( 23) : 6267-6276.
[13]Wang X,Oyane A,Tsurushima H,et al.BMP-2 and ALP gene expression induced by a BMP-2 gene-fibronectin-apatite composite layer[J].Biomed Mater,2011,6( 4) : 045004.
[14]Avsian-Kretchmer O,Hsueh AJ.Comparative genomic analysis of the eight-membered ring cystine knot-containing bone morphogenetic protein antagonists[J].Mol Endocrinol,2004,18( 1) : 1-12.
[15]Sutherland MK,Geoghegan JC,Yu C,et al.Sclerostin promotes the apoptosis of human osteoblastic cells: a novel regulation of bone formation[J].Bone,2004,35( 4) : 828-835.
[16]Brunkow ME,Gardner JC,Van Ness J,et al.Bone dysplasia sclerosteosis results from loss of the SOST gene product,a novel cystine knot-containing protein[J].Am J Hum Genet,2001,68 ( 3) : 577-589.
收稿日期:( 2015-04-01)
通信作者简介:何耀华( 1972-),男,主任医师,主要研究方向为运动医学与生物材料。E-mail: heyaohua@ vip.126.com
作者简介:第一张尧( 1989-),男,硕士,主要研究方向为生物材料与骨软骨组织工程。E-mail: dsyz138@163.com
基金项目:国家自然科学基金资助项目( 81271961)。
文章编号:1002-266X( 2015) 28-0005-03
文献标志码:A
中图分类号:R336
doi:10.3969/j.issn.1002-266X.2015.28.002
