检测癫痫大鼠脑组织中Glu、Gly、GABA含量的异硫氰酸苯酯柱前衍生HPLC技术的建立
2016-01-20李敏潘群皖王海华王烈成皖南医学院安徽芜湖400安徽医科大学
李敏,潘群皖,王海华,王烈成( 皖南医学院,安徽芜湖400;安徽医科大学)
检测癫痫大鼠脑组织中Glu、Gly、GABA含量的异硫氰酸苯酯柱前衍生HPLC技术的建立
李敏1,潘群皖1,王海华1,王烈成2
( 1皖南医学院,安徽芜湖241002;2安徽医科大学)
摘要:目的建立检测癫痫大鼠脑组织谷氨酸( Glu)、γ-氨基丁酸( GABA)、甘氨酸( Gly)含量的异硫氰酸苯酯( PITC)柱前衍生高效液相色谱( HPLC)技术,并验证其检测效果。方法将海人藻酸( KA)或等量生理盐水注射入大鼠海马CA3区建立癫痫模型或对照,2周后分别取其海马和皮层组织,采用PITC柱前衍生法处理样品,采用醋酸钠缓冲液和乙腈梯度洗脱,Venusil-AA氨基酸分析柱结合紫外检测器检测,计算Glu、GABA、Gly含量。结果在30 min内3种氨基酸完全出峰。在0.20~12.50 mg/L范围内Glu线性关系良好,相关系数为0.999 3,日内精密度为1.46%,日间精密度为1.84%,加样回收率为97.12%±2.98%;在0.01~6.25 mg/L范围内Gly线性关系良好,相关系数为0.998 4,日内精密度为1.17%,日间精密度为1.62%,加样回收率为96.63%±1.28%;在0.10~6.25 mg/L范围内GABA线性关系良好,相关系数为0.999 4,日内精密度为1.00%,日间精密度为1.53%,加样回收率为99.25%±2.98%。模型组海马和皮层中Glu含量均高于对照组相应组织( P均<0.05)。结论成功建立了检测癫痫大鼠脑组织Glu、Gly、GABA含量的PITC柱前衍生HPLC技术检测效果较好。
关键词:癫痫;高效液相色谱;异硫氰酸苯酯;柱前衍生;谷氨酸;甘氨酸;γ-氨基丁酸;大鼠
Establishment of HPLC technology of precolumn derivatization with PITC in determining contents of Glu,Gly and GABA in brain tissues of rats with epilepsy
LI Min1,PAN Qun-wan,WANG Hai-hua,WANG Lie-cheng
( 1 Wannan Medical College,Wuhu 241002,China)
Abstract:Objective To establish high-performance liquid chromatography ( HPLC) technology of precolumn derivatization with phenyl isothiocyanate ( PITC) to determine the contents of glutamic acid ( Glu),glycine ( Gly) and γ-aminobutyric acid ( GABA) in the brain tissues of rats with epilepsy,and to verify the results.Methods Kainic acid ( KA) was injected into the hippocampus CA3 region of rats to make the epilepsy models.Two weeks later,we obtained the hippocampus and cortex tissues,respectively.The diluted samples were precolumn derivatizated with PITC.The mobile phase consisted of sodium acetate and acetonitrile gradient elution.We calculated the contents of Glu,Gly and GABA in hippocampus and cortex by venusil-AA column combined with UV detector.Results The amino acids were separated within 30 min.A good linearity was obtained from ( 0.20-12.50) mg/L of Glu,the correlation coefficient was 0.999 3,the intraday RSD was 1.46%,interday RSD was 1.84%,and the average recovery rate was 97.12%±2.98%.A good linearity was obtained from ( 0.01-6.25) mg/L of Gly,the correlation coefficient was 0.998 4,the intraday RSD was 1.17%,interday RSD was 1.62%,and the average recovery rate was 96.63%±1.28%.A good linearity was obtained from ( 0.10-6.25) mg/L of GABA,the correlation coefficient was 0.999 4,the intraday RSD was 1.00%,interday RSD was 1.53%,and the average recovery rate was 99.25%±2.98%.Conclusion The HPLC technology of precolumn derivatization with PITC in determining the contents of Glu,Gly and GABA in the brain tissues of rats with epilepsy is successfully established.
Key words:epilepsy; high-performance liquid chromatography; phenyl isothiocyanate; precolumn derivatization; glutamic acid; glycine;γ-aminobutyric acid; rats
癫痫是临床常见的一种难治性中枢神经系统疾病,中枢神经系统内兴奋性氨基酸和抑制性氨基酸含量的变化,特别是两者比例的失衡可能是导致癫痫反复发作的直接原因[1]。因此,快速精准地测定脑内氨基酸类递质含量,对癫痫的临床诊断和防治具有重要意义。目前,通常采用柱前衍生结合高效液相色谱( HPLC)技术进行氨基酸测定,邻苯二甲醛( OPA)、丹磺酰氯( Dansyl-Cl)、氯甲酸芴甲酯( FMOC-Cl)、2,4-二硝基氟苯( DNFB)是常用的柱前衍生试剂[2~5]。OPA衍生反应迅速,灵敏度高,但其衍生产物极不稳定,且不与二级氨基酸反应; Dansyl-Cl虽衍生产物稳定,但需要在加热条件下衍生,时间较长,生成1、2代衍生混合物会干扰分析; FMOC-Cl几乎可以和所有氨基酸迅速反应,衍生产物稳定性高,但过量FMOC与其水解产物会干扰测定; DNFB属剧毒易爆物质,有强致癌性,且极易损坏色谱柱。因此,建立一种安全、高效、高灵敏度的脑内氨基酸递质检测方法尤为重要。异硫氰酸苯酯( PITC)衍生产物单一稳定,紫外吸收强度大,检测限可达10-9mol[6]。本研究拟建立检测癫痫大鼠脑组织氨基酸含量的PITC柱前衍生HPLC技术,并验证其检测效果。
1 材料与方法
1.1材料雄性Wistar大鼠16只,220~260 g,清洁级,南京医科大学实验动物中心提供[SCXK(苏) 2002-0031]。谷氨酸( Glu)、γ-氨基丁酸( GABA)、甘氨酸( Gly)、PITC均购自Sigma公司。Agilent 1100 HPLC仪(美国Agilent公司),FSH-Ⅱ型电动匀浆器(江苏金坛国胜实验仪器厂),TGL-18R高速冷冻离心机(珠海Hema医学仪器有限公司),FLexi-DryTM冷冻干燥机(美国FTS系统公司),MODEL 828 pH计(美国ORION公司),SK5200HP超声波清洗器(上海欢奥科贸有限公司)。
1.2色谱条件及试剂配制色谱条件:①色谱柱: Venusil-AA氨基酸分析柱( 4.6 mm×250 mm,5 μm) ;②流动相A为50 mmol/L乙酸钠( pH 5.5,含5%甲醇),流动相B为100%乙腈,进样量为50 μL,流速为1 mL/min,柱温为40℃,最大压力为250 bar,紫外检测波长为254 nm;③梯度洗脱程序:流动相A在0、20、30、40、40.01、50.00、50.01 min时分别为100%、90%、82%、70%、0%、0%、100%,流动相B分别为0、10%、18%、30%、100%、100%、0。试剂配制:①三乙胺乙腈溶液:三乙胺1.4 mL,乙腈8.6 mL,混匀,避光保存于4℃冰箱;②PITC乙腈溶液: PITC 25 μL,乙腈2 mL,混匀,充氮密封于-20℃冰箱;③氨基酸标准溶液配制:精密称取Glu、 Gly、GABA粉末各10 mg,用2 mL 100 mmol/L HCl充分溶解,稀释成浓度为5×10-2mg/mL储备液,于-20℃冰箱保存备用。
1.3癫痫模型建立及脑组织样品预处理大鼠经水合氯醛( 350 mg/kg)腹腔麻醉后,固定于立体定位仪上,暴露颅骨,依据大鼠立体定位图谱[7]确定右侧海马CA3中心区为注射靶点( AP:-4.0 mm,ML: 4.40 mm,DV:3.8 mm)。将2.5 μL海人藻酸( KA,0.4 μg/μL)注射入海马CA3区,术后缝合头皮,建立癫痫大鼠模型(模型组,n =8)[8,9]。另取8只大鼠采用同样方法注射生理盐水,作为对照组。2周后,将两组迅速断头取脑,冰上快速分离海马和皮层,称质量;加入预冷的生理盐水,冰上电动匀浆( 25 000 r/min 10 s) ;匀浆液经4℃离心( 12 000 r/min、20 min),取上清; 加3倍体积乙腈,混匀,4℃离心( 12 000 r/min、10 min),取上清;经冷冻干燥后,流动相A液充分溶解,4℃离心( 12 000 r/min、10 min),取上清,流动相A液稀释,保存于4℃冰箱。
1.4大鼠脑组织中Glu、Gly、GABA含量检测采用PITC柱前衍生HPLC技术检测脑组织中Glu、Gly、GABA含量。具体步骤:①衍生化反应:取混合氨基酸标准溶液或稀释脑组织样品200 μL,置于1 mL离心管中,加入三乙胺乙腈溶液100 μL,PITC乙腈溶液100 μL,混匀,室温放置1 h;加入正己烷400 μL,振摇后放置10 min,将上层正己烷去除;再加入400 μL正己烷,振摇后放置10 min,取下层溶液,经0.45 μm滤膜过滤后,收集在进样管中,待测。②Glu、Gly、GABA标准曲线的建立:精确量取混合氨基酸标准溶液储备液1 mL,采用倍比稀释法配制以下浓度的标准溶液( mg/mL) : 2.50×10-2、1.25× 10-2、6.25×10-3、3.13×10-3、1.56×10-3、7.81× 10-4、3.90×10-4、1.95×10-4、9.77×10-5、4.88× 10-5、2.44×10-5、1.22×10-5、0.61×10-6。衍生化后,依据1.2色谱条件进样分析,以峰面积对标准溶液浓度( X)进行线性回归。③衍生产物稳定性测定:已知浓度的混合氨基酸标准溶液( 1.56×10-3mg/mL)衍生化后于第0、2、4、8、12、24、48、72小时进样分析,计算Glu、Gly及GABA衍生产物峰面积的日内相对标准偏差和日间相对标准偏差。④精密度测定:已知浓度的混合氨基酸标准溶液( 1.56× 10-3mg/mL)衍生化后同日内平行进样5次,测定Glu、Gly及GABA峰面积,同时计算其日内相对标准偏差;混合氨基酸标准溶液分5 d、5次衍生化后进样,测定Glu、Gly及GABA峰面积,同时计算其日间相对标准偏差。⑤加样回收率测定:各取1份预
处理后的已测定浓度的癫痫大鼠海马和皮层样品,分成3份,分别加入等体积0.78、1.56、3.13 μg/mL混合氨基酸标准溶液,衍生化后进样分析,分别计算Glu、Gly及GABA加样回收率。
1.5统计学方法采用SPSS16.0统计软件。计量资料以珋x±s表示,比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PITC柱前衍生HPLC色谱检测结果空白试剂色谱图中可见除杂质峰外,无其他色谱峰;氨基酸混合标准溶液色谱图中Glu的保留时间为16.58 min、Gly为19.52 min、GAGA为29.70 min;大鼠海马组织样品氨基酸分离色谱图的杂质峰和试剂峰与Glu、Gly、GABA峰完全分离。见图1。
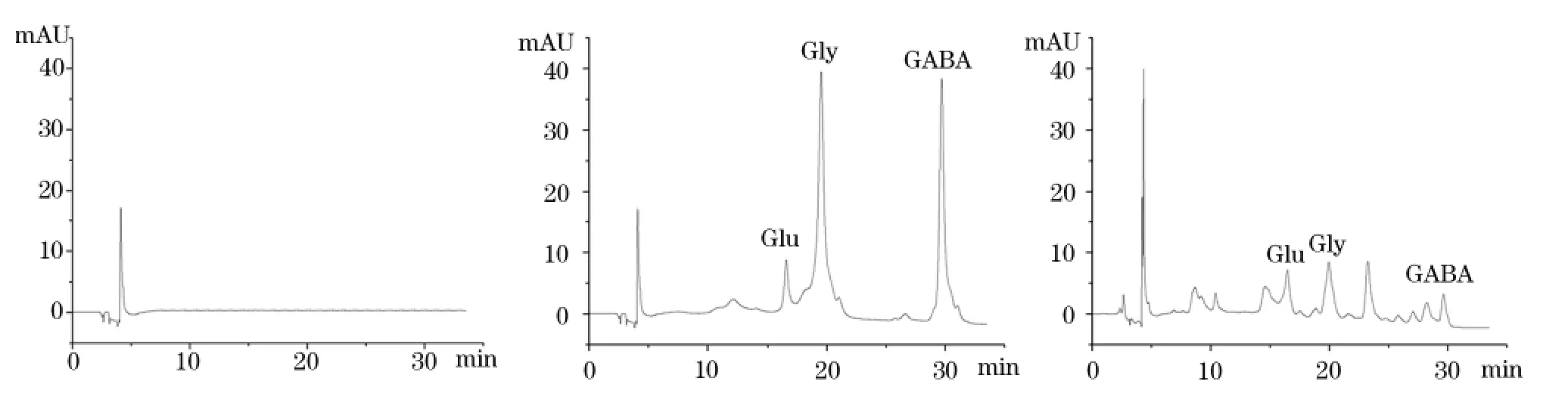
图1 PITC柱前衍生HPLC色谱检测结果
2.2线性范围和最低检测限在0.20~12.50 mg/L范围内,Glu标准溶液线性方程为Y = 1.5× 104X +2.7×103( r =0.999 3) ;在0.01~6.25 mg/L范围内,Gly标准溶液线性方程为Y =1.0×105X + 1.6×103( r = 0.998 4) ;在0.10~6.25 mg/L范围内,GABA标准溶液线性方程为Y = 1.1×105X-6.1×103( r =0.999 4)。在上述条件下,Glu的最低检测浓度为0.012 mg/L,Gly为0.006 mg/L,GABA 为0.006 mg/L。
2.3衍生产物的稳定性测得同一混合标准溶液中Glu、Gly、GABA衍生产物色谱峰峰面积的日内相对标准偏差分别为2.64%、2.48%、1.52%,日间相对标准偏差分别为4.38%、5.03%、3.71%。
2.4精密度和加样回收率同一混合标准溶液中Glu、Gly、GABA保留时间的相对标准偏差均<1%,峰面积的相对标准偏差均<2%。Glu加样回收率为97.12%±2.98%,Gly为96.63%±1.28%,GABA为99.25%±2.98%。
2.5两组大鼠海马和皮层Glu、Gly、GABA含量模型组海马和皮层中Glu含量均高于对照组相应组织( P均<0.05),Gly、GABA组间比较差异不明显( P均>0.05)。见表1。
3 讨论
柱前衍生HPLC技术是检测脑内氨基酸含量的常用方法。但是,氨基酸不具有紫外和荧光吸收基团,并且脑内含量很低;此外,脑组织中除了氨基酸类递质外还存在许多其他复杂的成分。因此,若要实现癫痫患者或动物脑组织中氨基酸含量的快速精
表1 两组大鼠海马和皮层组织中Glu、Gly、GABA含量( mg/g,±s)

表1 两组大鼠海马和皮层组织中Glu、Gly、GABA含量( mg/g,±s)
注:与对照组同组织比较,*P<0.05。
组别 n Glu Gly GABA模型组8海马 1.19±0.35* 0.14±0.02 0.07±0.01皮层 1.11±0.19* 0.13±0.01 0.07±0.01对照组 8海马 0.28±0.04 0.09±0.02 0.03±0.01皮层0.12±0.02 0.07±0.01 0.02±0.00
准检测,同时保证其有足够的分离度,选择合适的色谱条件、优化的衍生反应、合理的样品预处理是关键。
3.1色谱条件的选择本实验流动相A选用醋酸钠缓冲液,考察不同浓度( 100、75、50、25 mmol/L)醋酸钠缓冲液对氨基酸分离的影响。结果发现,随着缓冲液浓度的增大,氨基酸分离度有所增大,但过高浓度会破坏色谱柱键合相的稳定性,降低柱效[10]。综合考虑,选择缓冲液浓度为50 mmol/L。PITC氨基酸衍生物分离通常采用pH 5.0~7.0醋酸盐缓冲液。本实验考察了不同pH条件( 5.0、5.5、6.0、6.5、7.0)对氨基酸分离效果的影响,结果发现,pH为7.0时分离度较差;随pH减小,保留时间延长,但分离度有所改善。综合考虑,选择pH为5.5。但单纯采用醋酸钠缓冲液3种氨基酸未能得到良好的分离,因此,本实验在流动相A中加入有机溶剂甲醇( 5%),对比使用甲醇前后的色谱图,发现加入甲醇后氨基酸分离度明显提高。在此基础上对色谱分离的洗脱梯度进行分析,最终确定洗脱梯度。提高柱温能缩短保留时间,但过高的柱温会降低分离度,使GABA与其他色谱峰重合。因此,实
际操作时柱温保持在40℃为最佳。在梯度洗脱过程中,100%乙腈冲洗10 min后,若色谱柱平衡时间较短,连续进样则会影响保留时间,故每次进样后设定色谱柱平衡30 min后再次进样。
3.2衍生反应的优化衍生反应是决定氨基酸重现性和检测效果的决定步骤。PITC作为衍生试剂在测定氨基酸含量时在室温进行,具有稳定、不易发生水解反应、不形成多级衍生产物的优点[11],但有时过量试剂会使色谱柱填料过早老化,连续使用会导致柱效显著下降[12]。本实验在衍生反应中重复两次用正己烷萃取去除过量衍生试剂,同时,在柱前增加1根具有C18填料的保护柱,以延长色谱柱的使用寿命,为准确分析近500个样品提供了可能性。
在衍生产物稳定性检测过程中发现,PITC氨基酸衍生产物至少在24 h内保持较高的稳定性。其稳定性主要受温度及pH影响,室温下衍生产物在pH 5.0~7.5比较稳定,在pH 7.5时稳定性最高;过高的pH会使色谱柱受到损害;而酸性状态下衍生产物极易分解[13]。本实验事先采用盐酸溶液处理标准品,然后在衍生体系中加入适量三乙胺乙腈溶液,利用三乙胺的碱性来保证衍生化反应的顺利进行,同时维持衍生产物在一定时间内保持较高的稳定性,为精准测定提供了可能。
3.3样品预处理的改良为避免活性下降,处理癫痫大鼠脑组织时应快速、准确,取样、匀浆、离心都要在0~4℃进行,样品-80℃冷冻保存。样品预处理的好坏与分析结果的准确性与重现性关系很大,测定氨基酸含量时,为了将更多的氨基酸游离出来,蛋白质的去除很关键。去除蛋白的方法包括无机酸或有机溶剂沉降法,血浆、尿液标本常采用磺基水杨酸沉淀蛋白,组织标本则常用高氯酸、三氯乙酸和苦味酸;有机溶剂主要是70%~90%甲醇(或乙腈)[14]。本研究中脑组织样品中蛋白的去除以100%乙腈效果最为理想。此外,为了防止溶液中微小颗粒阻塞色谱柱导致柱效下降,各种溶液在使用前都要进行纯化处理。采用超纯水,现配现用,并用0.22 μm滤膜过滤;每次检测完成后要及时彻底冲洗整个系统。本研究欠妥之处在于,回收率测定时未选用内标进行样本萃取回收实验,而是利用外标法直接进样定量测定,可能会存在一定误差,在以后的实验中进一步改进。
本实验选择了合适的流动相缓冲液及pH值,设定了合理的梯度洗脱程序,调整了衍生反应体系pH,优化了样品预处理的过程,癫痫大鼠脑组织中Glu、Gly、GABA在上述分离条件下分离效果良好,其标准曲线相关系数分别为0.999 3、0.998 4及0.999 4,平均回收率均>95%; Glu含量较对照组增加,Gly、GABA含量与对照组差异不显著,与早期研究结果一致[9]。以上结果说明,本研究成功建立了检测癫痫大鼠脑组织氨基酸含量的PITC柱前衍生HPLC技术。
参考文献:
[1]Albrecht J,Sidoryk-Wgrzynowicz M,Zielińska M,et al.Roles of glutamine in neurotransmission[J].Neuron Glia Biol,2010,6 ( 4) : 263-276.
[2]Dai Z,Wu Z,Jia S,et al.Analysis of amino acid composition in proteins of animal tissues and foods as pre-column o-phthaldialdehyde derivatives by HPLC with fluorescence detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2014,964 ( 1 ) : 116-127.
[3]丁雅韵,谢孟峡,邓志威.丹磺酰氯作为氨基酸柱前衍生试剂衍生条件的研究[J].北京师范大学学报(自然科学版),2001,37 ( 4) : 526-529.
[4]陆明,孙黛妮,汪杨,等.OPA-FMOC联用柱前衍生化法测定复方氨基酸注射液中氨基酸的含量[J].药物分析杂志,2010,30 ( 12) : 2323-2327.
[5]吕莹果,张晖,孟祥勇,等.2,4-二硝基氟苯柱前衍生法测定植物中谷氨酸脱羧酶的活力[J].分析化学,2009,37 ( 3) : 347-350.
[6]Wilson SF,James CA,Zhu X,et al.Development of a method for the determination of glycine in human cerebrospinal fluid using precolumn derivatization and LC-MS/MS[J].J Pharmaceut Biomed Anal,2011,56( 2) : 315-323.
[7]Watson C,Paxinos G.The Rat Brain in stereotaxic coordinates [M].Imprint: Academic Press,2007: 145-146.
[8]Wu Z,Xu Q,Qian RB,et al.Temporal lobe epilepsy animal model established by stereotaxic microinjection of kainic acid[J].Neural Regen Res,2008,3( 4) : 436-440.
[9]李敏,孔德虎,许奇,等.颞叶癫痫大鼠不同时期海马和皮层氨基酸类递质的变化[J].安徽医科大学学报,2010,45 ( 2) : 135-138.
[10]涂星,郜红利,卢映,等.荧光高效液相色谱法测定三种失眠模型大鼠脑组织氨基酸类神经递质的含量[J].中国实验动物学报,2013,21( 5) : 74-77.
[11]Checa-Moreno R,Manzano E,Mirón G,et al.Revisitation of the phenylisothiocyanate-derivatives procedure for amino acid determination by HPLC-UV[J].J Sep Sci,2008,31( 22) : 3817-3828.
[12]王媛,王海龙,金高娃,等.PITC柱前衍生HPLC复方氨基酸注射液中18种氨基酸的含量[J].世界科学技术-中医药现代化,2014,16( 6) : 1347-1352.
[13]桂莉,田洪,郑健,等.高效液相色谱荧光法同时测定小鼠脑组织中4中氨基酸类神经递质[J].第三军医大学学报,2009,31 ( 8) : 675-678.
[14]俞军龄,陈再兴,毛小元,等.HPLC法测定tremor大鼠脑组织中谷氨酸和GABA含量[J].中国药理学通报,2009,25( 11) : 1530-1533.
收稿日期:( 2015-03-29)
通信作者简介:王烈成( 1969-),男,教授,主要研究方向为神经电生理。E-mail: wangliecheng@ ahmu.edu.cn
作者简介:第一李敏( 1985-),女,助教,主要研究方向为神经电生理与药理。E-mail: limin851022@163.com
基金项目:国家自然科学基金面上项目( 81071075) ;安徽省自然科学基金资助项目( 090413096) ;皖南医学院中青年科研基金资助项目( WK201201)。
文章编号:1002-266X( 2015) 28-0008-04
文献标志码:A
中图分类号:O657.72; R338.2
doi:10.3969/j.issn.1002-266X.2015.28.003
