卵巢癌组织中miRNA-204表达变化及其对细胞株SKOV3凋亡的影响
2016-01-20张伟熙李家福周春武汉大学中南医院武汉430071
张伟熙,李家福,周春(武汉大学中南医院,武汉430071)
卵巢癌组织中miRNA-204表达变化及其对细胞株SKOV3凋亡的影响
张伟熙,李家福,周春
(武汉大学中南医院,武汉430071)
摘要:目的观察卵巢癌组织中微小RNA-204( miR-204)表达变化,以及miR-204对卵巢癌SKOV3细胞凋亡的影响。方法选择卵巢癌患者50例,分别取其卵巢癌及相应癌旁组织;体外培养卵巢癌SKOV3细胞,随机分为1、2、3组,分别加入转染试剂、阴性对照载体、化学合成的双链miRNA-204表达载体;采用实时荧光定量PCR( qRTPCR)法检测组织及细胞中miRNA-204相对表达量;观察miRNA表达与卵巢癌患者临床病理特征的关系;采用流式细胞仪检测卵巢癌SKOV3细胞凋亡情况。结果卵巢癌组织中miR-204 mRNA相对表达量低于癌旁组织( P<0.01) ; miR-204 mRNA表达与FIGO分期、淋巴结转移、CA125水平相关( P均<0.05)。1、2、3组miRNA-204 mRNA相对表达量分别为2.35±0.67、2.01±0.45、5.32±0.88,3组较1、2组增加( P均<0.05) ;细胞凋亡率分别为7.32%±1.40%、5.14%±1.90%、52.4%±9.10%,3组较1、2组增加( P均<0.05)。结论卵巢癌组织中miRNA-204表达下调,且与病情进展相关; miRNA-204促进卵巢癌细胞凋亡,这可能是其发挥抑癌作用的机制之一。
关键词:卵巢肿瘤;卵巢癌;卵巢癌SKOV3细胞株;微小RNA-204;细胞凋亡
卵巢癌是女性生殖系统病死率最高的恶性肿瘤,早期无症状,缺乏有效的筛查手段,近70%的卵巢癌患者确诊时已属晚期,5年生存率低于30%[1]。CA125是目前卵巢癌诊断和预后判断最常用的血清标志物,但是CA125仅在50%的早期和70%~90%的晚期卵巢癌患者血清中增高,缺乏诊断特异性和敏感性[2]。微小RNA( microRNA)在肿瘤组织中性质稳定、功能广泛。研究发现,microRNA-204 ( miR-204)在子宫内膜样腺癌[3]、鼻咽癌[4]等肿瘤组织中表达明显降低,并与临床病理特征及预后相关;上调肿瘤细胞中miR-204,可以促进肿瘤细胞凋亡、抑制迁移、增加对化疗药物的敏感性。但是,miR-204与卵巢癌的关系尚无相关报道。本研究观察卵巢癌组织中miR-204表达变化,以及miR-204对卵巢癌SKOV3细胞凋亡的影响。
1 资料与方法
1.1临床资料选择2006年1月~2008年1月武汉大学中南医院收治的卵巢癌患者50例,年龄32 ~75岁、平均54岁;均行手术治疗,均未接受化疗或放疗;分别取其卵巢癌组织和相应的癌旁组织。手术切除标本立即放入液氮中保存,随后转入-80℃冰箱保存。
1.2细胞培养及分组卵巢癌SKOV3细胞株(上海细胞研究所)培养在37℃、5% CO2培养箱中,细胞培养液为含100 mg/mL链霉素、10%小牛血清、100 U/mL青霉素的RPMI 1640培养基,每隔2 d更换1次培养液。收集对数生长期SKOV3细胞,PBS冲洗3次,1 mL RPMI 1640培养液重悬细胞,调整细胞密度为4×104/mL,转移细胞至24孔板继续培养10~12 h后,随机分为1、2、3组,分别加入转染试剂、阴性对照载体、化学合成的双链miRNA-204表达载体,继续培养4 h后换原培养液继续培养。
1.3卵巢癌组织及细胞中miRNA-204 mRNA检测
采用实时荧光定量PCR法。取冻存卵巢癌及其癌旁正常组织和三组转染后培养48 h的SKOV3细胞,加入TRIzol抽提RNA,按照Prime-ScriptTM逆转录试剂盒( TaKaRa公司)说明书逆转录成cDNA;取cDNA进行qRT-PCR检测。反应条件: 95℃预变性20 s; 95℃10 s,60℃20 s,共40个循环; 70℃延伸10 s。引物序列[4]: miRNA-204: (正义) 5'-AACCUGAUCCCGUCUGAGAUUG-3',(反义) 5'-CCGGAUCAAGAUUAGUUCGGUU-3';内参β-actin: (正义) 5'-AGCGGGTCTGACGTAAAGCGA-3',(反义) 5'-GTGGACGGGAGAGGACTGG-3'。采用2-ΔΔCt方法检测miRNA-204 mRNA相对表达量。卵巢癌组织中miRNA-204 mRNA相对表达量<2.34为低表达,≥
2.34为高表达。
1.4细胞凋亡情况检测三组SKOV3细胞转染后培养48 h,分别取5×104~10×104重悬细胞,1 000 g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。随后加入5 μL Annexin VFITC,混匀,4℃避光孵育15 min。加入5 μL碘化丙啶染色液,混匀,4℃避光孵育5 min。采用流式细胞仪检测细胞凋亡情况,计算凋亡率。
1.5统计学方法采用SPSS16.0统计软件。计量资料以珋x±s表示,比较采用Student's t检验或单因素方差分析。P<0.05为差异有统计学意义。
2 结果
卵巢癌组织中miR-204 mRNA相对表达量为2.34±0.92,癌旁组织为5.74±1.59;两者比较,P <0.01。miR-204 mRNA表达水平与卵巢癌FIGO分期、淋巴结转移、CA125水平相关( P均<0.05),与年龄、组织学分级、有无腹腔积液无关( P均>0.05),见表1。1、2、3组miRNA-204 mRNA相对表达量分别为2.35±0.67、2.01±0.45、5.32±0.88,3组较1、2组增加( P均<0.05) ;细胞凋亡率分别为7.32%±1.40%、5.14%±1.90%、52.4%± 9.10%,3组较1、2组增加( P均<0.05)。
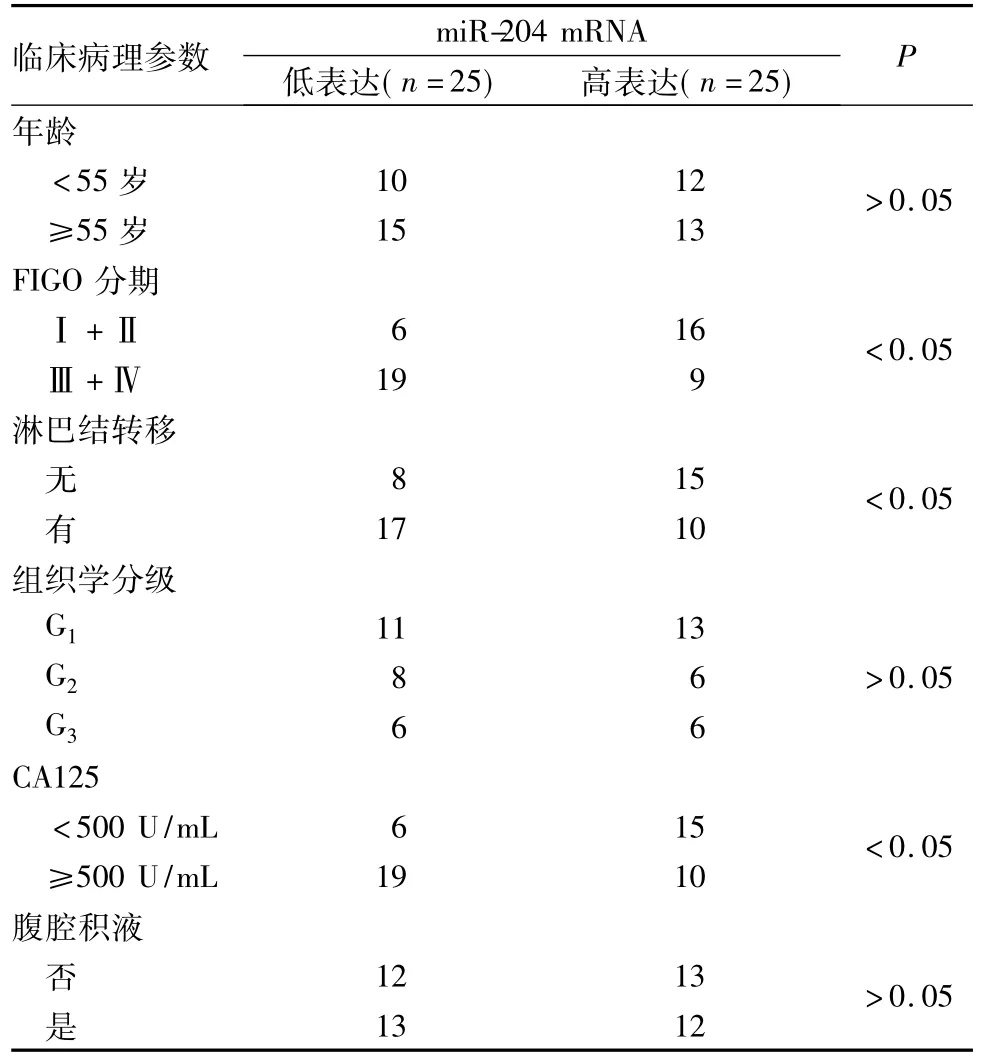
表1 miR-204 mRNA相对表达与卵巢癌患者临床病理特征的关系(例)
3 讨论
尽管卵巢癌的发病机制在蛋白及基因水平得到深入认识,手术、放化疗等为主的综合治疗有了长足的发展,但卵巢癌的早期诊断和预后没有明显进展。microRNA是一种长18~25个核苷酸的小分子单链RNA,可与靶信使RNA的3'非翻译区( 3'UTR)结合,通过诱导的沉默复合物抑制或降解靶信使RNA的翻译,负性调节靶基因转录后水平[5,6]。研究证实,microRNA参与卵巢癌的发生、发展过程[7,8];有多种microRNA在卵巢细胞及组织中表达上调或下调,可作为卵巢癌的癌基因或抑癌基因,在卵巢癌细胞生长、分化、浸润及转移过程中发挥中至关重要的作用[9~11]。
miR-204作为一种新的抑癌或致癌基因,在不同肿瘤细胞中功能不同,其主要通过诱导靶mRNA降解或抑制靶mRNA翻译,调控相关靶基因表达,参与多种肿瘤的发生、发展等过程[12]。miR-204在前列腺癌中作为一种癌基因,在肿瘤组织或细胞中高表达,促进癌细胞增殖、转移;肿瘤组织中的miR-204与临床分期及预后明显相关,其高表达是提示预后差的独立影响因素;通过小干扰RNA沉默miR-204的表达可以促进前列腺癌细胞的凋亡[13]。在子宫内膜癌组织中miR-204表达下调,作为抑癌基因抑制肿瘤的发生、发展,与临床病理特征和预后相关[3]。通过转染上调miR-204在头颈部鳞状上皮细胞癌细胞株中的表达,可以抑制癌细胞的增殖和转移[14]。但是,miR-204在卵巢癌中的表达、功能目前尚不明确。
本研究发现,卵巢癌组织miR-204相对表达量低于癌旁组织,提示miR-204可能作为一种抑癌基因参与卵巢癌的发生、发展。进一步对卵巢癌患者临床病理参数分析发现,miR-204表达与FIGO分期、淋巴结转移、CA125水平相关。从细胞水平对miR-204在卵巢癌中的功能或作用机制进一步研究发现,转染miR-204至卵巢癌SKOV3细胞后,上调miR-204可以促进细胞凋亡。但是,miR-204通过何种机制促进细胞凋亡,还需要进一步研究。
参考文献:
[1]Colombo N,Peiretti M,Parma G,et al.Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21( Suppl 5) : 23-30.
[2]Suh KS,Park SW,Castro A,et al.Ovarian cancer biomarkers for molecular biosensors and translational medicine[J].Expert Rev Mol Diagn,2010,10( 8) : 1069-1083.
[3]Chung TK,Lau TS,Cheung TH,et al.Dysregulation of microRNA-204 mediates migration and invasion of endometrial cancer by regulating FOXC1[J].Int J Cancer,2012,130( 5) : 1036-1045.
[4]Ma L,Deng X,Wu M,et al.Down-regulation of miRNA-204 by LMP-1 enhances CDC42 activity and facilitates invasion of EBV-associated nasopharyngeal carcinoma cells[J].FEBS Lett,2014,588( 9) : 1562-1570.
[5]Singh RP,Massachi I,Manickavel S,et al.The role of miRNA in inflammation and autoimmunity[J].Autoimmun Rev,2013,12 ( 12) : 1160-1165.
[6]Hafsi S,Pezzino FM,Candido S.Gene alterations in the PI3K/PTEN/AKT pathway as a mechanism of drug-resistance[J].Int J Oncol,2012,40( 3) : 639-644.
[7]秦天生,黄建梅,甄洁玉,等.MicroRNA与卵巢癌的研究进展[J].中国妇幼保健,2013,3( 28) : 560-561.
[8]王磊,单良,高旭.MicroRNA与卵巢癌关系的研究进展[J].国际免疫学杂志,2012,35( 3) : 205-208.
[9]Li SD,Zhang JR,Wang YQ,et al.The role of microRNAs in ovarian cancer initiation and progression[J].J Cell Mol Med,2010,14( 9) : 2240-2249.
[10]赵天,李月峰,刘庆,等.miR-21转染对卵巢癌细胞株A2780/Taxol紫杉醇耐药性的影响及机制探讨[J].山东医药,2013,53 ( 23) : 39-41.
[11]Pan X,Wang ZX,Wang R.MicroRNA-21: a novel therapeutic target in human cancer[J].Cancer Biol Ther,2011,10( 12) : 1224-1232.
[12]李楠.小鼠巨噬细胞S100A9/NF-κB/SAA3/miR-204环路在炎症相关性结肠癌发展中的作用[D].中南大学,2013.
[13]Turner DP,Findlay VJ,Moussa O,et al.Mechanisms and functional consequences of PDEF protein expression loss during prostate cancer progression[J].Prostate,2011,71( 16) : 1723-1735.
[14]Abou-Elhamd KE,Habib TN,Moussa AE,et al.The role of genetic susceptibility in head and neck squamous cell carcinoma[J].Eur Arch Otorhinolaryngol,2008,265( 2) : 217-222.
收稿日期:( 2014-10-23)
通信作者:周春,E-mail: zhouchun6@126.com
文章编号:1002-266X( 2015) 28-0055-03
文献标志码:B
中图分类号:R737.31
doi:10.3969/j.issn.1002-266X.2015.28.024
