胃癌组织中MCM2、PCNA mRNA表达变化及意义
2016-01-20黄克楠刘冬艳王爱民白志超崔保栓殷培培马良中国人民解放军第二五二医院河北保定071000
黄克楠,刘冬艳,王爱民,白志超,崔保栓,殷培培,马良(中国人民解放军第二五二医院,河北保定071000)
胃癌组织中MCM2、PCNA mRNA表达变化及意义
黄克楠,刘冬艳,王爱民,白志超,崔保栓,殷培培,马良
(中国人民解放军第二五二医院,河北保定071000)
摘要:目的观察胃癌组织中微小染色体维持蛋白2( MCM2) mRNA和增殖细胞核抗原( PCNA) mRNA的表达变化。方法应用实时定量PCR检测48例份胃癌组织(观察组)及其相应癌旁组织(对照组)中MCM2、PCNA mRNA,分析胃癌组织中两者的表达与临床病理参数的关系。结果观察组、对照组MCM2 mRNA相对表达量分别为16.27±0.368、5.32±0.401,PCNA mRNA相对表达量分别为22.12±0.289、7.88±0.374,两组比较,P均<0.05。不同分化程度、临床分期、T分期、淋巴结转移肿瘤组织中MCM2、PCNA mRNA表达比较,P均<0.05。胃癌组织中MCM2 mRNA与PCNA mRNA的表达呈正相关( r = 0.531,P<0.01)。结论胃癌组织中MCM2、PCNA mRNA的表达增多,两者可能与胃癌的发生发展有关。
关键词:胃肿瘤;微小染色体维持蛋白2;增殖细胞核抗原
胃癌是临床最常见恶性肿瘤之一,尽管近年来在世界范围内的发病率有所下降,但其病死率在肿瘤中位居第二位[1]。胃癌的发生发展是一个多基因、多因素、多阶段的动态顺序演变过程,涉及到多种癌基因的激活、抑癌基因的失活以及由此引起的细胞周期的改变等。目前,我国首次就诊的胃癌患者中有超过一半的患者已为中晚期。肿瘤的浸润和转移是胃癌治疗后复发或进展的主要原因,因此,如何早期发现并诊断胃癌显得尤为重要。微小染色体维持蛋白( MCM)为真核生物DNA复制的主要调控因子之一,其成员MCM2在静止期细胞中不表达,在增殖细胞中过度表达,可以准确反映细胞的增殖活性,可作为细胞增殖标记物来标记细胞所处的状态[2]。研究[3]表明,MCM2的细胞表达阳性率与细胞的增殖能力和进入细胞周期的细胞数成正相关,且与细胞发育异常的严重程度有关。增殖细胞核抗原( PCNA)是一种非组蛋白性的核蛋白,与细胞增殖和DNA合成有关,可反映细胞增殖程度和所处周期。本研究观察了胃癌组织MCM2、PCNA mRNA的表达变化,并探讨其意义。
1 资料与方法
1.1临床资料选择2010年1月~2011年10月经病理确诊的48例胃癌患者,其中男31例、女17例,年龄26~81岁,中位年龄60岁。临床分期中Ⅰ期3例,Ⅱ期13例,Ⅲ期31例,Ⅳ期(大网膜浸润) 1 例;肿瘤直径>5 cm 23例,≤5 cm 25例;高分化腺癌12例,低分化腺癌25例,中分化腺癌11例; T分期中T1期6例,T2期16例,T3期21例,T4期5例。所有患者术前均未行放化疗,手术切除胃癌组织作为观察组,并选取其对应的距胃癌边缘3 cm的癌周组织及阴性切缘组织作为对照组。
1.2 MCM2、PCNA mRNA检测方法采用实时定量PCR。两组组织标本离体后立即置于液氮罐冷冻,后转移至-80℃(冰箱)下保存待检。采用TRIzol(康为世纪生物工程有限公司)一步法抽提组织总RNA。实验步骤严格按照试剂盒说明书进行。紫外分光光度仪测定RNA的量,琼脂糖凝胶电泳法检测RNA的完整性。所提取RNA于-80℃冷冻保存。使用SuperRT cDNA第一链合成试剂盒(康为世纪生物工程有限公司)进行逆转录反应。取总RNA提取物2 μL,dNTP Mix 4 μL( 2.5 mmol/L Each),Primer Mix 2 μL,5×RT Buffer 4 μL,SuperRT 酶1 μL( 200 U/μL),RNase-Free Water 7 μL。反应体系共20 μL,混匀,42℃35 min,85℃5 min,反应产物置于-20℃长期保持。引物由北京天一辉远生物科技有限公司合成。MCM2基因引物序列:上游为5'-CACATCGAGTCCATGATCC-3',下游为5'-CAAAAGTCTTGCGCATGCT-3',基因片段长度为113 bp; PCNA基因引物序列:上游为5'-GGAAATGGAAACATTTTAAATTGTCAC-3',下游为5'-GAGTGGCTTTTGTAAAGAAGTTCAG-3',基因片段长度为133 bp; GAPDH引物序列:上游为5'-AGCCT-
CAAGATCATCAGCAATGCC-3',下游为5'-TGTGGTCATGAGTCCTTCCACGAT-3',基因片段长度为293 bp。样品在ABI7500型荧光PCR仪上进行扩增。采用相对定量法,在测定目的基因的同时测定内源性看家基因GAPDH,用以标准化标本。取cDNA 0.5 μL,依次加入2×Buffer 12.5 μL,Super Enzyme Mix 0.5 μL,上下引物各0.5 μL,反应体系为25 μL。反应条件为45℃10 min; 95℃5 min; 95℃15 s,60℃30 s,72℃30 s,40个循环;每一例样本反应结束后由计算机自动计算并读出定量结果Ct值。以GAPDH为参照基因,检测各模板的Ct值,阴性对照不加模板。溶解曲线为单峰表示基因特异性扩增。目的基因mRNA的相对表达量以2ΔCt表示。
1.3统计学方法采用SPSS17.0统计软件。计量资料以珋x±s表示,组间比较用t检验;两变量间的相关性检验采用Spearman等级相关分析法。P<0.05为差异有统计学意义。
2 结果
观察组、对照组MCM2 mRNA相对表达量分别为16.27±0.368、5.32±0.401,PCNA mRNA相对表达量分别为22.12±0.289、7.88±0.374,两组比较,P均<0.05。MCM2、PCNA mRNA表达与胃癌患者临床病理因素的关系见表1。不同分化程度、临床分期、T分期、淋巴结转移肿瘤组织中MCM2、PCNA mRNA表达比较,P均<0.05。胃癌组织中MCM2 mRNA与PCNA mRNA的表达呈正相关( r = 0.531,P<0.01)。
表1 MCM2、PCNA mRNA表达与胃癌临床病理参数的关系(±s)
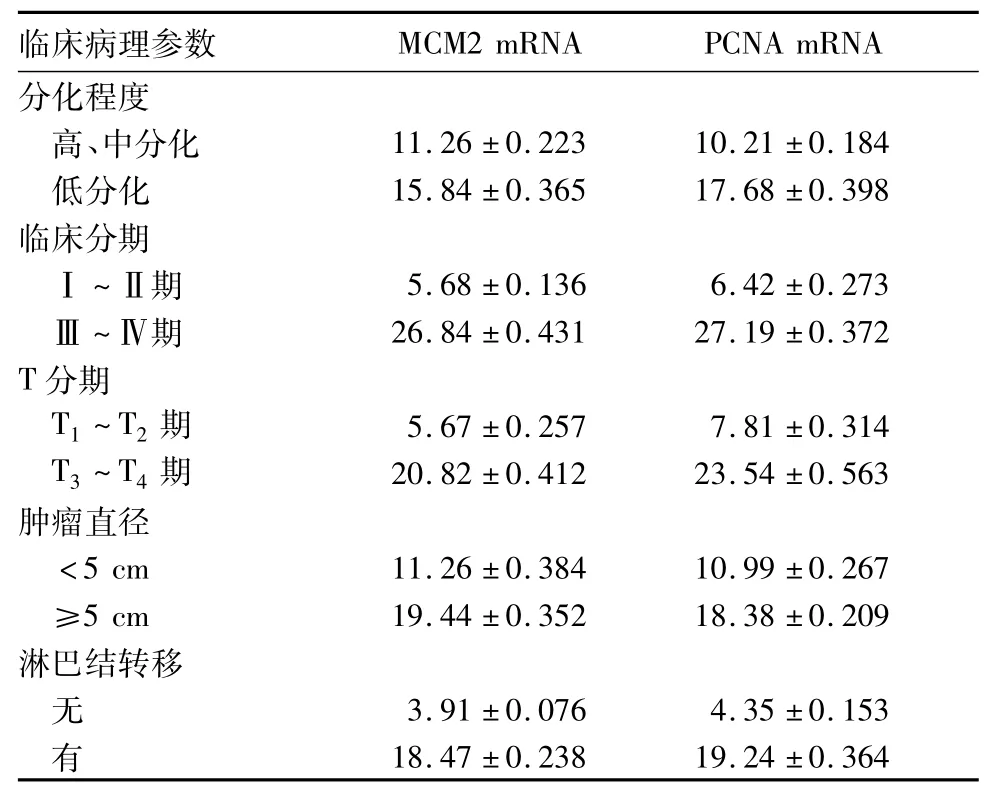
表1 MCM2、PCNA mRNA表达与胃癌临床病理参数的关系(±s)
临床病理参数MCM2 mRNA PCNA mRNA分化程度高、中分化 11.26±0.223 10.21±0.184低分化 15.84±0.365 17.68±0.398临床分期Ⅰ~Ⅱ期 5.68±0.136 6.42±0.273Ⅲ~Ⅳ期 26.84±0.431 27.19±0.372 T分期T1~T2期 5.67±0.257 7.81±0.314 T3~T4期 20.82±0.412 23.54±0.563肿瘤直径<5 cm 11.26±0.384 10.99±0.267 ≥5 cm 19.44±0.352 18.38±0.209淋巴结转移无3.91±0.076 4.35±0.153 有18.47±0.238 19.24±0.364
3 讨论
MCM是1998年发现的微小染色体支持蛋白,由6个亚基构成的六聚体环状蛋白质,即MCM2~7,由cdc基因编码。目前一致认为,它们是一组在序列上高度同源,功能上密切相关的蛋白。MCM是真核生物DNA复制的必需因子,是DNA复制许可因子,在DNA复制起始与延伸中起关键作用,能确保DNA的复制在每个细胞周期中仅发生一次[4]。在G1期,MCM结合到DNA形成复制前复合体,MCM2是该复合体中的一种。MCM2在静止期细胞中含量极少,在正常增殖细胞和转化细胞中的含量在G1期开始增加,S期早期达到高峰,并与染色质结合,在S期至有丝分裂期是游离的,在G2期与M期时降低。MCM2与细胞周期变化相一致,为细胞S期的标志物,是特异性增殖相关因子,被认为是癌前标记,广泛应用于肿瘤早期诊断[5]。
MCM2在多种肿瘤组织中均有不同表达,且MCM2高表达与肿瘤的分化、分期、预后相关。Wojnar等[6]发现MCM2表达与乳腺癌组织分化程度有关,肿瘤分化越差,MCM2阳性率越高。Saeb-Parsy等[7]对497例膀胱癌患者尿液脱落细胞进行了研究,认为免疫组化法检测MCM2可作为诊断膀胱癌可重复使用的方法。Rosamilia等[8]研究发现,MCM2蛋白在正常宫颈上皮、CINⅠ、CINⅡ、CINⅢ中的阳性表达率逐渐增加。Negri等[9]用免疫组化法检测15例宫颈腺癌及29例宫颈原位腺癌的MCM2蛋白,发现检测MCM2有助于诊断宫颈腺癌。
本研究结果显示,MCM2 mRNA在胃癌组织中的表达高于其对应的癌旁组织,且MCM2 mRNA在不同肿瘤分化程度、临床分期、T分期、淋巴结转移中的表达具有差异性,提示MCM2 mRNA可作为胃癌早期诊断及预后判断的重要指标。本实验还同时检测了相应组织中PCNA mRNA的表达,结果显示MCM2 mRNA与PCNA mRNA在胃癌组织中的表达呈正相关。提示两者在细胞周期调控中共同参与了胃癌的发生、发展。
综上所述,胃癌组织中MCM2、PCNA mRNA的表达增多,两者可能与胃癌的发生发展有关,两者联合检测可用于辅助胃癌早期诊断、病情评估及预后判断。
参考文献:
[1]Jarosz M,Sekula W,Rychlik E,et al.Impact of diet on long-term decline in gastric cancer incidence in Poland[J].World J Gastroenterol,2011,17( 1) : 89-97.
[2]Kang YH,Galal WC,Farina A,et al.Properties of the human Cdc45/Mcm2-7/GINS helicase complex and its action with DNA polymerase epsilon in rolling circle DNA synthesis[J].Proc Natl Acad Sci USA,2012,109( 16) : 6042-6047.
[3]Giaginis C,Giagini A,Tsourouflis G,et al.MCM-2 and MCM-5 expression in gastric adenocarcinoma: clinical significance and comparison with Ki-67 proliferative marker[J].Dig Dis Sci,2011,56( 3) : 777-785.
[4]Takisawa H,Mimura S,Kubota Y.Eukaryotic DNA replication: from pre-replication complex to initiation complex[J].Curr Opin Cell Biol,2000,12( 6) : 690-696.
[5]Shomori K,Nishihara K,Tamura T,et al.Geminin,Ki67,and minichromosome maintenance 2 in gastric hyperplastic polyps,adenomas,and intestinal-typecarcinomas: pathobiological significance [J].Gastric Cancer,2010,13( 3) : 177-185.
[6]Wojnar A,Pula B,Piotrowska A,et al.Correlation of intensity of MT-Ⅰ/Ⅱexpression with Ki-67 and MCM-2 proteins in invasive ductal breast carcinoma[J].Anticancer Res,2011,31( 9) :3027-3033.
[7]Saeb-Parsy K,Wilson A,Scarpini C,et al.Diagnosis of bladder cancer by immunocytochemical detection of minichromosome maintenance protein-2 incells retrieved from urine[J].Br J Cancer,2012,107( 8) : 1384-1391.
[8]Rosamilia C,Feichter G,Tzankov A,et al.Diagnosis and grading of cervical intraepithelial neoplasias[J].Pathologe,2012,33( 2) : 118-123.
[9]Negri G,Bellisano G,Carico E,et al.Usefulness of p16ink4a,ProEX C.and Ki-67 for the diagnosis of glandular dysplasia and adenocarcinoma of the cervix uteri[J].Int J Gynecol Pathol,2011,30( 4) : 407-413.
收稿日期:( 2015-05-13)
文章编号:1002-266X( 2015) 31-0069-03
文献标志码:B
中图分类号:R735.2
doi:10.3969/j.issn.1002-266X.2015.31.028
