不同浓度LBH589对人前列腺癌PC3细胞增殖、EZH2 mRNA及蛋白表达的影响
2016-01-20韦士勤李常颖李保国李建民王丽丽王海涛天津医科大学肿瘤医院国家肿瘤临床医学研究中心天津市肿瘤防治重点实验室天津300060天津医科大学第二附属医院天津泌尿外科研究所
韦士勤,李常颖,李保国,李建民,王丽丽,王海涛( 天津医科大学肿瘤医院,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津300060;天津医科大学第二附属医院,天津泌尿外科研究所)
不同浓度LBH589对人前列腺癌PC3细胞增殖、EZH2 mRNA及蛋白表达的影响
韦士勤1,李常颖2,李保国1,李建民2,王丽丽1,王海涛1
( 1天津医科大学肿瘤医院,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津300060;2天津医科大学第二附属医院,天津泌尿外科研究所)
摘要:目的观察不同浓度组蛋白去乙酰化酶抑制剂LBH589对人前列腺癌PC3细胞增殖、EZH2 mRNA及蛋白表达的影响。方法选择1、10、100 nmol/L的LBH589处理PC3细胞,采用MTT法测算细胞增殖抑制率,实时定量PCR、Western blotting法分别检测细胞EZH2的mRNA和蛋白。结果随着浓度和时间的增加,LBH589对PC3细胞的抑制作用呈现明显的时间-剂量关系( P均<0.05)。相同时间时,随着LBH589浓度的增加,PC3细胞EZH2的mRNA、蛋白表达逐渐降低( P均<0.05) ;相同浓度时,随着时间的延长,PC3细胞EZH2的mRNA、蛋白表达逐渐降低( P均<0.05)。结论LBH589可抑制PC3细胞的增殖,同时可使细胞EZH2的mRNA及蛋白表达降低,且随着浓度的增加作用增强。
关键词:前列腺肿瘤;去乙酰化酶抑制剂;细胞增殖;多梳蛋白zeste基因增强子类同源物2
组蛋白乙酰化/去乙酰化修饰是基因转录调控的关键机制,与肿瘤的发生发展关系密切。组蛋白
乙酰化状态由组蛋白乙酰化酶( HATs)和组蛋白去乙酰化酶( HDACs)调节[1]。多梳蛋白zeste基因增强子类同源物2( EZH2)是多梳抑制复合物( PRC2)的催化亚基,是一种高度保守的组蛋白甲基转移酶,能使组蛋白3第27位赖氨酸( H3K27)三甲基化[2]。EZH2在转移性前列腺癌中呈现高表达[2],并且EZH2的高表达可以抑制多种肿瘤抑制基因的表达从而促进肿瘤的增殖、侵袭和转移。目前EZH2抑制剂的研究在转移性前列腺癌方面尚处于临床前研究阶段。PRC2与HDACs在结构和功能上具有联系[3],因此是否可以通过HDACs抑制剂的作用来抑制EZH2的活性有待研究。LBH589是一种新型的广谱HDACs抑制剂,本研究观察了不同浓度LBH589对人前列腺癌PC3细胞增殖及EZH2表达的影响。
1 材料与方法
1.1细胞与试剂人前列腺癌细胞系PC3由天津医科大学第二附属医院泌尿研究所提供。胎牛血清、DMEM培养基购自Gibico公司;四甲基偶氮唑盐( MTT)、LBH589购自Sigma公司(将LBH589溶解于DMSO,稀释为10 μmol/L备用)。兔抗人EZH2多克隆抗体。
1.2 PC3细胞培养和传代将PC3细胞置于10%胎牛血清+ DMEM +双抗(青霉素100 U/mL、链霉素100 μg/mL)完全培养基中,37℃、5% CO2、饱和湿度孵箱培养。0.25%胰酶消化,2~3 d传代1次。
1.3 PC3细胞增殖抑制率检测采用MTT法。取培养至对数生长期的PC3细胞以5×103/mL的密度接种于96孔板,每孔200 μL,每组设3个复孔,置于37℃、5% CO2、饱和湿度孵箱中培养。待24 h细胞贴壁后,弃去培养液,实验组加入LBH589使其终浓度分别为1、10、100 nmol/L,并设对照组和调零孔。各组分别作用24、48、72 h后,每孔加入20 μL MTT( 5 mg/mL),继续孵育4 h。吸出上清液,每孔加入150 μL二甲基亚砜( DMSO)。在平板摇床摇10 min待紫色结晶溶解后,全波长扫描多功能读数仪检测各组490 nm波长处每孔的光密度( OD)值。按下列公式计算细胞增殖抑制率:细胞增殖抑制率= ( 1-实验组OD平均值/对照组OD平均值)×100%。实验重复3次,取平均值。
1.4 PC3细胞EZH2 mRNA检测方法采用实时定量PCR。取对数生长期PC3细胞,实验组分别加入终浓度为1、10、100 nmol/L的LBH589继续培养24、48 h。同时设立空白对照组。取实验组及空白对照组PC3细胞。按照TRIzol RNA提取说明书操作法提取总RNA。经紫外分光光度法鉴定、定量后,分别取总RNA 1 μg,按逆转录试剂盒说明书操作,逆转录反应合成cDNA。以反应所得cDNA进行SYBR实时定量PCR扩增。GAPDH上游引物: 5'-CTACAATGAGCTGCGTGTGGC-3',下游引物: 5'-CAGGTCCAGACGCAGGATGGC-3'。EZH2上游引物: 5'-AGGACGGCTCCTCTAACCAT-3',下游引物: 5'-CTTGGTGTTGCACTGTGCTT-3'。扩增条件为94℃预变性3 min,94℃变性30 s,58℃退火30 s,72℃延伸1 min,72℃继续延伸5 min,共30个循环。溶解曲线为单一峰,mRNA相对表达量结果以2-ΔΔCt表示。
1.5 PC3细胞EZH2蛋白检测方法采用Western blotting法。取上述实验组及空白对照组PC3细胞,胰酶消化,离心收集细胞,PBS洗涤2次,加入高效RIPA细胞裂解液和蛋白酶抑制剂( PMSF) ( 10∶1),冰上裂解1 h,每隔15 min振荡器上震荡1次,12 000 g离心10 min后收集上清,BCA法行蛋白定量,取20 μg蛋白于10%的十二烷基硫酸钠聚丙烯酰胺凝胶( SDS-PAGE)电泳分离,蛋白质转移至PVDF膜,5%牛奶室温封闭1 h,TBST洗膜5 min× 3次,加入EZH2一抗、鼠抗人β-actin工作浓度1∶1 000,4℃孵育过夜; TBST漂洗,加入1∶10 000辣根过氧化物酶( HRP)标记的二抗羊抗兔IgGHRP,HRP标记的二抗羊抗鼠IgG-HRP,室温摇床孵育1 h,TBST洗5次,每次10 min。最后用ECL化学发光试剂和胶曝光机曝光,以GAPDH为内参对照,计算各组细胞EZH2蛋白相对表达量。
1.6统计学方法采用SPSS18.0统计软件。计量资料以珋x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
随着浓度和时间的增加,LBH589对PC3细胞的抑制作用呈现明显的时间-剂量关系( P均<0.05),结果见表1。各组PC3细胞EZH2 mRNA、蛋白表达比较见表2。相同时间时,随着LBH589浓度的增加,PC3细胞EZH2的mRNA、蛋白表达逐渐降低( P均<0.05) ;相同浓度时,随着时间的延长,PC3细胞EZH2的mRNA、蛋白表达逐渐降低( P均<0.05)。
3 讨论
前列腺癌是男性生殖系统常见的恶性肿瘤之一,在欧美地区其发病率居男性恶性肿瘤首位,近年来我国前列腺癌发病率呈逐年上升的趋势[4]。目
表1 不同浓度LBH589对PC3细胞增殖的抑制作用(±s)
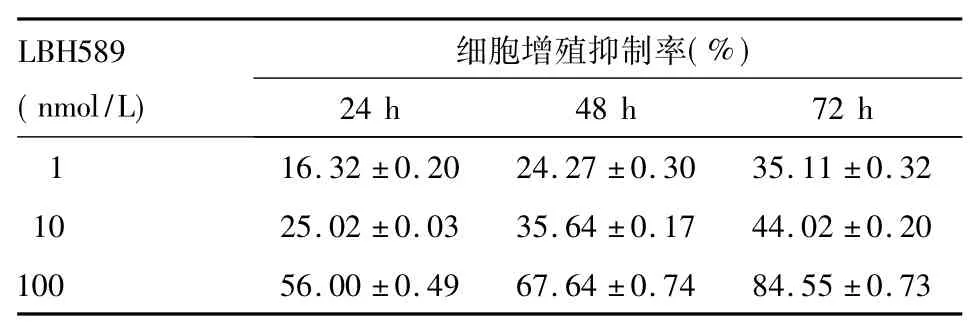
表1 不同浓度LBH589对PC3细胞增殖的抑制作用(±s)
LBH589 ( nmol/L)细胞增殖抑制率( %) 24 h 48 h 72 h 1 16.32±0.20 24.27±0.30 35.11±0.32 10 25.02±0.03 35.64±0.17 44.02±0.20 100 56.00±0.49 67.64±0.74 84.55±0.73
表2 各组PC3细胞HDAC1、HDAC2、EZH2 mRNA及蛋白表达比较(±s)
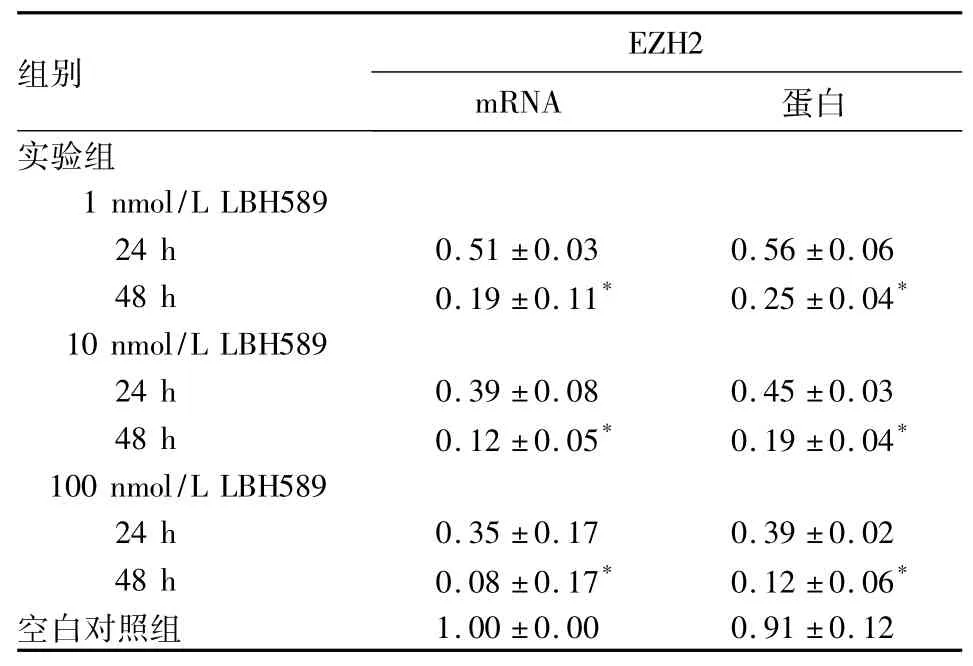
表2 各组PC3细胞HDAC1、HDAC2、EZH2 mRNA及蛋白表达比较(±s)
注:与空白对照组比较,*P<0.05。
组别EZH2 mRNA 蛋白实验组1 nmol/L LBH589 24 h 0.51±0.03 0.56±0.06 48 h 0.19±0.11* 0.25±0.04*10 nmol/L LBH589 24 h 0.39±0.08 0.45±0.03 48 h 0.12±0.05* 0.19±0.04*100 nmol/L LBH589 24 h 0.35±0.17 0.39±0.02 48 h 0.08±0.17* 0.12±0.06*空白对照组1.00±0.00 0.91±0.12
前前列腺癌的治疗包括手术切除、内分泌治疗及辅助治疗,其中中晚期前列腺癌以内分泌治疗为主。我国大多数前列腺癌在诊断时已处于中晚期,虽然内分泌治疗可以使大多数患者的病情得到控制和改善,但在经过中位时间为18~24个月的缓解期后,绝大多数患者会发展为去势难治性前列腺癌( CRPC)。CRPC患者预后极差,对传统治疗的有效率仅为10%~20%,因此迫切需要寻找新的治疗靶点。
近年来研究发现,表观遗传调控因子PcG蛋白表达异常与肿瘤的发生、发展密切相关,而其核心成分EZH2也受到更多的关注。EZH2主要起组蛋白甲基转移酶的作用,能使H3K27侧链上的ε氨基发生三甲基化。H3K27三甲基化被认为是在PcG沉默机制中起作用的主要存在形式。三甲基化后的H3K27能将PRC1复合物招募到特定基因位点,从而沉默与细胞分化、抑制增殖在内的基因,导致肿瘤的发生。EZH2在前列腺癌、乳腺癌、胶质瘤等一系列的肿瘤组织中高表达[5],在良性前列腺肿瘤、局限性前列腺癌无表达或弱表达,而在转移性前列腺癌中高表达[6]。EZH2的高表达可以抑制多种肿瘤抑制基因的表达从而促进肿瘤的增殖、侵袭和转移[7]。目前EZH2抑制剂有竞争性的S-腺苷同型半胱氨酸水解酶抑制剂DZNep和EZH2竞争性抑制剂GSK126、UNC1999等[8]。EZH2抑制剂目前主要用于淋巴瘤的研究[9],在前列腺癌的治疗中尚处于临床前研究阶段。Kirk等[10]发现依托泊苷联合EZH2抑制剂GSK126或DZNep可明显促进鼠前列腺癌细胞凋亡,但尚不能满足于临床治疗。
PRC2与HDACs在结构和功能上具有联系[11],PRC2有组蛋白乙酰转移酶活性,在人类细胞中PRC2的结构与HDAC1和HDAC2相关联。虽然大量生化研究证明HDAC不是组成PRC2的核心元件,但两者之间短暂的相互作用可影响相关的转录酶表达。本研究结果发现,LBH589对PC3细胞具有明显的增殖抑制效应,抑制作用有明显的时间-剂量依赖性。且实时定量PCR及Western blotting结果显示,不同浓度LBH589可以明显降低EZH2的表达,且有明显的时间-剂量依赖性。
综上所述,LBH589可抑制PC3细胞的增殖,同时可使细胞EZH2表达降低,且随着浓度的增加作用增强。
参考文献:
[1]Mahlknecht U,Hoelzer D.Histone acetylation modifiers in the pathogenesis of malignant disease[J].Mol Med,2000,6( 8) : 623-644.
[2]Vlkel P,Dupret B,Le Bourhis X,et al.Diverse involvement of EZH2 in cancer epigenetics[J].Am J Transl Res,2015,7( 2) :175-193.
[3]Tonini T,Bagella L,D'Andrilli G,et al.Ezh2 reduces the ability of HDAC1-dependent pRb2/p130 transcriptional repression of cyclin A[J].Oncogene,2004,23( 28) : 4930-4937.
[4]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65( 1) : 5-29.
[5]Bachmann IM,Halvorsen OJ,Collett K,et al.EZH2 expression is associated with high proliferation rate and aggressive tumor subgroups in cutaneousmelanoma and cancers of the endometrium,prostate,and breast[J].J Clin Oncol,2006,24( 2) : 268-273.
[6]Cardoso C,Mignon C,Hetet G,et al.The human EZH2 gene: genomic organisation and revised mapping in 7q35 within the critical region for malignantmyeloid disorders[J].Eur J Hum Genet,2000,8( 3) : 174-180.
[7]Verma SK.Inhibition of the histone lysine methyltransferase EZH2 for the treatment of cancer[J].Curr Top Med Chem,2015,15 ( 8) : 714-719.
[8]McCabe MT,Creasy CL.EZH2 as a potential target in cancer therapy[J].Epigenomics,2014,6( 3) : 341-351.
[9]McCabe MT,Ott HM,Ganji G,et al.EZH2 inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations[J].Nature,2012,492( 7427) : 108-112.
[10]Kirk JS,Schaarschuch K,Dalimov Z,et al.Top2a identifies and provides epigenetic rationale for novel combination therapeutic strategies for aggressiveprostate cancer[J].Oncotarget,2015,6 ( 5) : 3136-3146.
[11]Volkel P,Dupret B,Le Bourhis X,et al.Diverse involvement of EZH2 in cancer epigenetics[J].Am J Transl Res,2015,7( 2) : 175-193.
收稿日期:( 2015-05-21)
文章编号:1002-266X( 2015)31-0032-03
文献标志码:A
中图分类号:R737.25
doi:10.3969/j.issn.1002-266X.2015.31.012
通信作者:王海涛
基金项目:国家自然科学基金资助项目( 81301949) ;天津市卫生行业重大公关项目( 14KG141) ;天津市科技计划项目( 13ZCZCSY20300)。
