端粒酶催化亚基hTERT调控乳腺癌细胞自我更新能力的探讨
2016-01-20朱英华李晶晶郭倩囡
朱英华 李晶晶 郭倩囡
端粒酶催化亚基hTERT调控乳腺癌细胞自我更新能力的探讨
朱英华 李晶晶 郭倩囡
【摘要】目的球囊培养富集乳腺癌干性样细胞并检测hTERT的表达,进一步通过RNA干扰的方法探讨其对乳腺癌细胞自我更新能力的影响。方法 球囊培养富集乳腺癌干性样细胞,检测乳腺癌干性细胞与分化细胞中hTERTmRNA及蛋白的表达,小分子RNA干扰敲低hTERT的蛋白表达水平。结果 乳腺癌干性细胞中hTERT表达升高,敲低其表达后乳腺癌细胞自我能力下降。结论 高表达的hTERT促进了乳腺癌细胞的自我更新能力。
【关键词】端粒酶催化亚基hTERT;乳腺癌干性细胞
作者单位: 510120 广东省广州市中山大学孙逸仙纪念医院医学研究中心基金项目:国家自然科学基金项目(编号:c002015010)
High Expressed hTERT Regulating the Self-renewal Ability of Breast Cancer Stem Cell
ZHU Yinghua LI Jingjing GUO Qiannan, Medical Research Center, Sun Yat-Sen Memorial Hospital Affiliated to Sun Yat-Sen University, Guangzhou 510120, China
[Abstract]Objective To investigate the expression of hTERT and the effect of hTERT on the self-renewal ability of breast cancer stem cell. Methods Detecting the expression of hTERT by RT- PCR and Western Blot. Knockdown the expression of hTERT by RNA interference. Results We finded out that hTERT is high expressed in breast cancer stem cell, and reduced the expression of hTERT suppressed the self-renewal ability of breast cancer cell. Conclusion High expressed hTERT enhanced the selfrenewal ability of breast cancer stem cell.
[Key words]hTERT, Breast cancer stem cell
乳腺癌是女性常见的恶性肿瘤之一,近年来已成为威胁女性健康的头号杀手,乳腺癌的传统治疗方法包括外科手术摘除肿瘤、放疗、化疗、内分泌治疗等方法。虽然大多数乳腺癌患者从以上治疗中获益,但仍有不少的乳腺癌病人出现复发转移[1]。大量研究证实了乳腺癌干细胞的存在,研究表明乳腺癌干细胞具有较强的自我更新能力、多向分化潜能以及多药耐药和放化疗抵抗特性[2-4]。大量文献已证明端粒酶在肿瘤的发生发展中发挥了重要作用[5-7]。因此,我们推测乳腺癌干细胞的存在是乳腺癌治疗失败的主要原因之一,而乳腺癌干细胞的发生形成机制并没有研究透彻,本研究重点探讨了端粒酶催化亚基hTERT对乳腺癌干细胞自我更新能力的影响,为乳腺肿瘤的临床治疗提供新的方向。
[1]薛宏宇. 凋亡通路蛋白表达对过氧化氢诱导PC12多细胞凋亡的影响[J]. 宿州学院学报,2011(5):12-35.
[2] 焦凤有. 左旋多巴联合地昔帕明治疗帕金森患者抑郁症状的效果研究[J]. 热带医学杂志,2012(11):8-13.
[3] Jean-Francois Trempe, Edward A. Fon. Structure and function of Parkin, PINK1, and DJ-1, the three musketeers of neuroprotection[J]. Frontiers in neurology,2013(4):1-11.
[4] 李冬梅,卢幸明,丛志强. 多巴胺受体激动剂治帕金森病的临床研究进展[J]. 国外医学神经病学神经外科学分册,2004(6):16-20.
1 材料与方法
1.1材料
MCF7细胞使用DMEM完全培养基培养;siRNA由吉玛公司合成;RT-PCR kit购自invitrogen公司;转染试剂购自invitrogen公司;hTERT抗体购买自ABCAM公司,GAPDH抗体购自PTG公司。
1.2球囊培养
将MCF7细胞胰酶消化成单细胞悬液并计数,然后将细胞种入球囊培养基中,最终细胞密度为1 000/毫升,悬浮状态下培养两周收获球囊。
1.3RNA干扰实验
转染前24小时,将MCF7细胞铺入培养板中,24小时后细胞密度达到50%,按照转染试剂说明将转染试剂和siRNA混合后静置15分钟后,将混合物转入细胞中,6小时换新鲜培养基,48小时后收获细胞。
1.4RT-PCR
Trizol法提取细胞总RNA,逆转录试剂盒将RNA反转为cDNA,反应条件参照试剂盒说明书,然后于PCR方法检测基因表达并以GAPDH作为内参进行相对定量。
2 结果
2.1hTERT在乳腺癌球囊细胞中高表达
将乳腺癌细胞MCF7贴壁细胞进行悬浮球囊培养后,分别抽提mRNA和蛋白,利用半定量PCR及免疫印迹法检测hTERT在贴壁细胞及球囊细胞中的表达。实验结果显示乳腺癌球囊细胞中hTERT在mRNA水平(图1, A)和蛋白水平(图1, B)均有升高。
2.2降低hTERT的表达影响了乳腺癌细胞的球囊形成能力
本研究利用RNA干扰的方法敲低hTERT的表达进而研究其对球囊形成能力的影响。MCF7细胞中hTERT的表达被敲低后(图2, A),其球囊形成能力明显下调(图2, B),这提示hTERT可能参与调控了乳腺癌细胞的球囊形成能力。
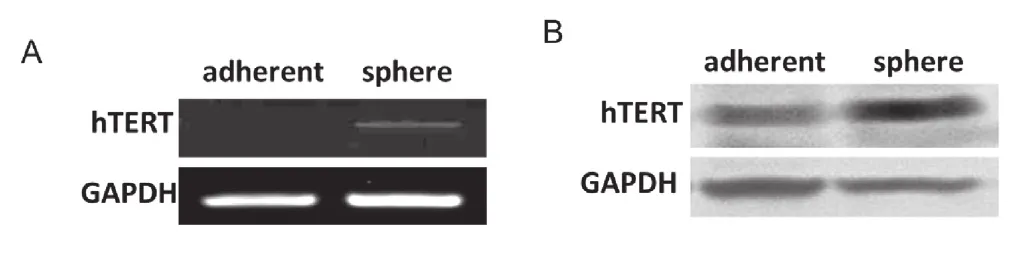
图1 RT-PCR和western 检测乳腺癌细胞中hTERT的表达情况
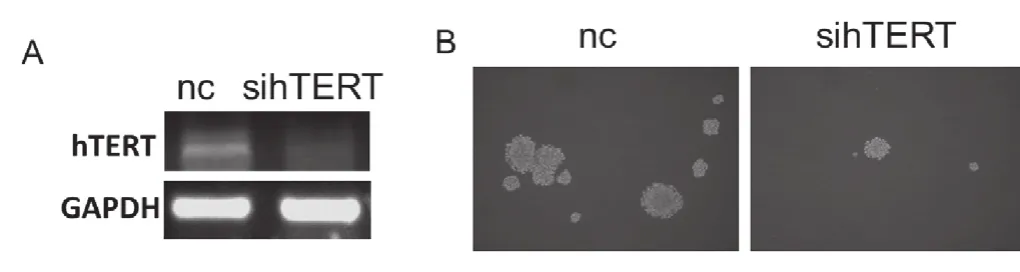
图2 hTERT调控了乳腺癌细胞的球囊形成能力
3 讨论
端粒酶主要由端粒酶RNA组分(telomerase RNA, TR),端粒酶相关蛋白和端粒酶催化亚基(telomerase reverse transcriptase, TERT)三部分组成,其主要功能是通过防止染色体复制时端粒的丢失进而维护细胞的有丝分裂增殖能力[8-10]。正常人体细胞在体外培养过程中由于染色体不完全复制,染色体末端端粒序列随着有丝分裂次数的增加逐渐缩短,直到某个临界点,端粒不能保护染色体末端的重组和降解,细胞退出增殖周期以至衰老。而端粒酶最主要的功能便是防止染色体复制导致的端粒丢失进而维持细胞的有丝分裂增殖能力。近年来,大量研究证实了肿瘤干细胞的存在,肿瘤干细胞像正常干细胞一样通过相同的调控因子调控细胞的自我更新功能和多向分化潜能,肿瘤干细胞的存在被认为是肿瘤复发、转移以及放化疗失败的因素之一。因此,探讨端粒酶在乳腺癌干细胞中的作用机制显得尤为必要。在本研究中,我们通过球囊培养的方法富集乳腺癌干细胞,发现乳腺干细胞中端粒酶催化亚基hTERT高表达,敲除hTERT后球囊形成能力明显下降。这提示端粒酶调控了乳腺癌干细胞的自我更新功能,为乳腺癌的临床治疗提供了新的靶标。
参考文献
[1]隋晓英. 乳腺癌临床病理资料分析[J]. 中国继续医学教育,2015,7(4):172-173.
[2] YuanY,ShenH,FranklinDS,et al. Invivosel-frenewing divisions of haematopoietic stem cells are increased in the absence of the early G1-phase inhibitor p18INK4C[J]. Nature Cell Biology, 2004(6):436-442.
[3] Yang YM, ChangJW. Current status and issues in cancer stem study[J]. Cancer Investigation, 2008(26):741-755.
[4] Soltysova A,A ltanerova V,A ltaner C. Cancer stem cells[J]. Neoplasma,2005,52(6):435-440.
[5] Pooley KA,Sandhu MS,Tyrer J,Shah M,Driver KE Luben RN,et al. Telomere length in prospective and retrospective cancer case-control studies[J]. Cancer Res,2010,70(8):3170-3176.
[6] Jones AM,Beggs AD,Carvajal-Carmona L,Farrington S,Tenesa A,Walker M,et al. TERC polymorphisms are associated both with susceptibility to colorectal cancer and with longer telomeres[J]. Gut,2012,61(2):248-254.
[7] Engelhardt M,Drullinsky P,Guillem J,Moore MA. Telomerase and telomere length in the development and progression of premalignant lesions to colorectal cancer[J]. Clin Cancer Res,1997,3(11):1931-1941.
[8] Meeker AK,Hicks JL,Iacobuzio-Donahue CA,Montgomery EA,Westra WH,Chan TY,et al. Telomere length abnormalities occur early in the initiation of epithelial carcinogenesis[J]. Clin Cancer Res,2004,10(10):3317-3326.
[9] Pampalona J,Soler D,Genesca A,Tusell L. Whole chromosome loss is promoted by telomere dysfunction in primary cells[J]. Genes Chromosomes Cancer ,2010,49(4):368-378.
[10] Zou Y,Misri S,Shay JW,Pandita TK,Wright WE. Altered states of telomere deprotection and the two-stage mechanism of replicative aging[J]. Mol Cell Biol,2009,29(9):2390-2397.
doi:10.3969/j.issn.1674-9308.2015.25.043
【文章编号】1674-9308(2015)25-0063-02
【文献标识码】B
【中图分类号】R737.9
