一测多评法测定杜麻颗粒中5种成分的含量
2016-01-19杨东亮,马桂芝,王娟等
·药物分析·
一测多评法测定杜麻颗粒中5种成分的含量
杨东亮1,马桂芝2,王 娟2,岳佳琪2,滕 亮1*,于富生3
(1.新疆医科大学第一附属医院药学部,乌鲁木齐 830054;2.新疆医科大学药学院,乌鲁木齐830011;3.新疆华圣元医药科技有限公司,乌鲁木齐830011)
摘要:目的建立杜麻颗粒中香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素5种成分一测多评的含量测定方法。方法以绿原酸为指标,建立该成分与香豆酸、金丝桃苷、异槲皮素、香豆素的相对校正因子,通过相对校正因子计算各成分的质量浓度,同时对10批杜麻颗粒一测多评计算值与外标法实测值进行比较。结果建立了杜麻颗粒中5种成分一测多评法的含量测定方法,10批样品中各成分计算值与实测值之间无显著性差异(P>0.05)。结论同时测定杜麻颗粒中5种成分的一测多评法方法可靠,结果准确,可用于控制杜麻颗粒的质量。
关键词:绿原酸;一测多评;相对校正因子;杜麻颗粒
doi:10.3969/j.issn.1004-2407.2015.03.009
中图分类号:R927.2
文献标志码:A
文章编号:1004-2407(2015)03-0247-05
Abstract:ObjectiveTo establish a quantitative analysis method of multi-components by single marker (QAMS) for determination of the components in Duma Granules, a traditional Chinese medicine preparation. Methods Chlorogenic acid was selected as an index, chlorogenic acid relative correction factors (RCF) of coumaric acid, hyperin, isoquercetin and coumarin were calculated under the chromatographic condition for determination of the five components in Duma Granules. The accuracy of the new method was evaluated by comparing the calculated contents with the contents which were determined by external reference method. Results The analysis method was established and it has no significant difference between the calculated contents and the contents which were determined by external reference method in 10 batches of samples. Conclusion The QAMS method is feasible and accurate to evaluate the contents of the 5 constituents in Duma Granules.
作者简介:杨东亮,男,药师,硕士
收稿日期:(2014-11-14)
Quantitative analysis of multi-components with single marker for determination of components in Duma Granules
YANG Dongliang1, MA Guizhi2, WANG Juan2, YUE Jiaqi2, TENG Liang1*, YU Fusheng3(1.Department of Pharmacy, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China; 2.College of Pharmacy, Xinjiang Medical University, Urumqi 830011, China; 3.Xinjiang Huashengyuan Medical Technology Limited Company, Urumqi 830011,China)
Key words: chlorogenic acid;quantitative analysis multi-components by single marker (QAMS); related correction factor (RCF); Duma Granules
*通信作者:滕亮,男,博士,教授
中药复方以其多成分、多靶点的特点,决定了单一成分难以代表中药复方的质量,多成分同步质量控制、指纹图谱等方法应运而生。然而,对照品供需矛盾和多指标质量控制的检测成本限制了多成分质量控制模式在实际生产、科研和质量监督中的应用。在传统的多成分质量控制模式中,需要用足够的化学对照品来完成质量评价。但由于中药的化学对照品分离难度大,或单体不稳定,或供应价格过高,使得中药制剂中的单组分测定尚存在一定的难度,多组分的质量控制更是难以进行[1]。王智民[2]提出了一测多评的方法,即只测定一个成分,来实现多个成分的同步测定。本文尝试将一测多评法首次应用于中药复方制剂杜麻颗粒的质量控制中。
杜麻颗粒由杜仲、罗布麻叶等药材组成,用于治疗高脂血症。课题组根据临床实践与文献调研结果,采用均匀设计优选了处方中罗布麻与杜仲的用量配比[3]。在此基础上优选了其制剂工艺,将其研发成利于临床用药、便于携带的颗粒剂。颗粒中的香豆酸、绿原酸[4]、金丝桃苷、异槲皮素、香豆素等均为活性成分,其中绿原酸对照品较易得到,且稳定性高,在样品中含量较高。本文以绿原酸对照品为指标成分,建立杜麻颗粒中该成分与香豆酸、金丝桃苷、异槲皮素、香豆素的相对校正因子,用相对校正因子计算这4种成分的含量,同时对一测多评法得到的计算值与外标法得到的测定值进行比较。在此基础上,对不同品牌色谱柱和仪器、流速、温度进行了考察,以评价该测定方法的准确性和科学性,为该制剂的质量控制奠定实验基础。
1仪器与试药
1.1仪器高效液相色谱仪(LC-20AB,岛津;1525,Waters;e2695,Waters)。电子天平(BS110S,北京赛多利斯天平有限公司,d=0.01 mg)。
1.2试药乙腈为色谱纯(Fisher公司);水为超纯水;其他试剂均为分析纯;绿原酸对照品(132-101018,质量分数≥99.0%)、异槲皮素对照品(Y32-110518,质量分数≥99.0%)、金丝桃苷对照品(1157-091208,质量分数≥99.0%)、香豆素对照品(X11-111012,质量分数≥99.0%),均购自中国固体制剂制造技术国家工程研究中心;香豆酸对照品(Sigma公司,MKBD9024V,质量分数≥99.0%);杜麻颗粒由新疆华圣元医药科技有限公司提供(批号分别为20131209,20131210,20131211,20131212,20131213,20131214,20131215,20131216,20131217,20131218)。
2方法与结果
2.1色谱条件分析柱 Agilent TC-C18(250 mm×4.6 mm,5 μm);保护柱Shim-pack GVP-ODS(10 mm×4.6 mm);流速为1.0 mL·min-1;流动相A:乙腈;流动相B:2 mL·L-1磷酸溶液,梯度洗脱,洗脱程序为:0~5 min,95%~90%A;5~25 min,90%~82%A;25~55 min,82%~82%A;55~60 min,82%~95%A;柱温40 ℃;检测波长256 nm;进样量10 μL。
2.2混合对照品溶液的制备精密称取各对照品适量,用甲醇溶解,制成含香豆酸38.440 μg·mL-1、绿原酸658.80 μg·mL-1、金丝桃苷270.80 μg·mL-1、异槲皮素213.20 μg·mL-1、香豆素47.20 μg·mL-1的混合对照品溶液,4 ℃冰箱保存。
2.3供试品溶液的制备取颗粒适量,研细,称取约0.5 g,精密称定,置于50 mL量瓶中,加入体积分数40%乙醇适量,超声处理(功率250 W,频率33 kHz)40 min,放冷,定容至刻度,摇匀,微孔滤膜滤过,取续滤液,即得。
2.4阴性样品溶液的制备按照处方比例称取除去罗布麻叶外的其他药材适量,按照杜麻颗粒的制法和供试品溶液的制备方法制备阴性样品溶液,即得。色谱图显示,阴性样品在金丝桃苷、异槲皮素、香豆素各指标成分相对应的保留时间无干扰,绿原酸、香豆酸为罗布麻叶和杜仲共有峰,测定的是颗粒中绿原酸与香豆酸总含量,见图1。
2.5标准曲线及线性范围分别精密移取混合对照品溶液0.25,0.5,1.0,2.0,4.0,6.0,8.0和10.0 mL,甲醇定容至10.0 mL,即得到质量浓度分别为:香豆酸0.961,1.922,3.844,7.688,15.376,23.064,30.752和38.440 μg·mL-1,绿原酸16.47,32.94,65.88,131.76,263.52,395.28,527.04和658.80 μg·mL-1,金丝桃苷6.77,13.54,27.08,54.16,108.32,162.48,216.64和270.80 μg·mL-1,异槲皮素5.33,10.66,21.32,42.64,85.28,127.92,170.56和213.20 μg·mL-1,香豆素1.18,2.36,4.72,9.44,18.88,28.32,37.76和47.20 μg·mL-1系列标准溶液,按2.1色谱条件进行HPLC分析。以峰面积X和质量浓度Y进行回归,香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素线性回归方程见表1。


图1HPLC图
A.混合对照品色谱图;B.样品溶液色谱图;C.罗布麻叶阴性色谱图;1.香豆酸;2.绿原酸;3.金丝桃苷;4.异槲皮素;5.香豆素
Fig.1 HPLC chromatograms
A.mixture of reference substances; B.sample; C.negative sample;1. coumaric acid; 2. chlorogenic acid; 3. hyperin; 4. isoquercetin; 5. coumarin
表1香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素的标准曲线
Tab.1 Standard curve of coumaric acid, chlorogenic acid, hyperin, isoquercetin and coumarin

成分标准曲线线性范围/μg·mL-1r香豆酸Y=4.1964×10-5X-0.04460.961~38.4400.9998绿原酸Y=1.0362×10-4X-1.000916.47~658.800.9999金丝桃苷Y=4.0245×10-5X-0.65636.77~270.800.9999异槲皮素Y=3.6018×10-5X-0.53305.33~213.200.9999香豆素Y=5.5171×10-5X-0.14811.18~47.200.9999
2.6精密度实验精密吸取同一质量浓度对照品溶液,重复进样6次,记录峰面积,计算香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素峰面积的RSD分别为1.42%,1.26%,1.24%,1.21%和1.23%。结果表明精密度实验结果良好。
2.7重复性实验取同一批号(批号20131209)样品6份,每份0.50 g,精密称定,按2.3项下平行制备样品,进样测定,记录峰面积,计算香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素峰面积的RSD分别为1.12%,1.76%,1.65%,1.43%和1.54%。
2.8稳定性实验精密吸取同一供试品溶液,室温放置。分别于配制后的0,2,4,8,12,24和48 h 测定并记录香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素峰面积,并计算其RSD,分别为0.98%,0.76%,1.69%,1.35%和0.95%,表明处理后的供试品溶液在 48 h 内稳定。
2.9加样回收率实验取已知含量的供试品6份,分别加入含香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆酸的对照溶液5 mL,按上述供试品制备方法和色谱条件,制备加样回收供试品溶液并注入液相色谱仪,测定,计算香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素回收率,结果见表2。
表25种成分的加样回收率
Tab.2 The recoveries of 5 components

成分原有量/mg加入量/mg测得量/mg回收率/%x/%RSD/%香豆酸0.04250.037450.0788997.20.04250.037450.0788497.00.04270.037450.0794298.10.04260.037450.0794398.30.04270.037450.0794698.20.04240.037450.0789897.797.70.55绿原酸0.85590.74691.59098.30.85580.74691.60199.80.85990.74691.616101.20.85800.74691.60399.80.85990.74691.58396.80.85390.74691.59298.899.11.52金丝桃苷0.24900.26730.507796.80.24900.26730.506596.30.25020.26730.508196.50.24960.26730.509997.40.25020.26730.508496.60.24840.26730.513199.097.11.04异槲皮素0.24190.21060.4527100.10.24190.21060.4581102.70.24300.21060.4553100.80.24240.21060.4633104.90.24300.21060.4616103.80.24130.21060.4565102.2102.41.75香豆素0.033830.036670.07073100.60.033830.036510.0696498.10.033990.036510.0707100.50.033910.036510.07093101.40.033990.036510.07171103.30.033750.036510.07031100.1100.71.69
2.10校正因子的计算以绿原酸为内标物,按公式:fs/k=(Ws×Ak)/(Wk×As)计算内标绿原酸与香豆酸、金丝桃苷、异槲皮素、香豆素之间的相对校正因子(RCF)。fs/k为内标绿原酸与组分k之间的RCF,As为内标绿原酸的峰面积,Ws为内标绿原酸的质量(或质量浓度),Ak为组分k的峰面积,Wk为组分k的质量(或质量浓度)[5]。

以绿原酸为内标物,按公式fs/k=(Ws×Ak)/(Wk×As)计算内标绿原酸与香豆酸、金丝桃苷、异槲皮素、香豆素之间的相对校正因子(RCF)[6],结果见表3。
表3样品中4种组分的RCF
Tab. 3 The relative correction factor of 4 components in samples
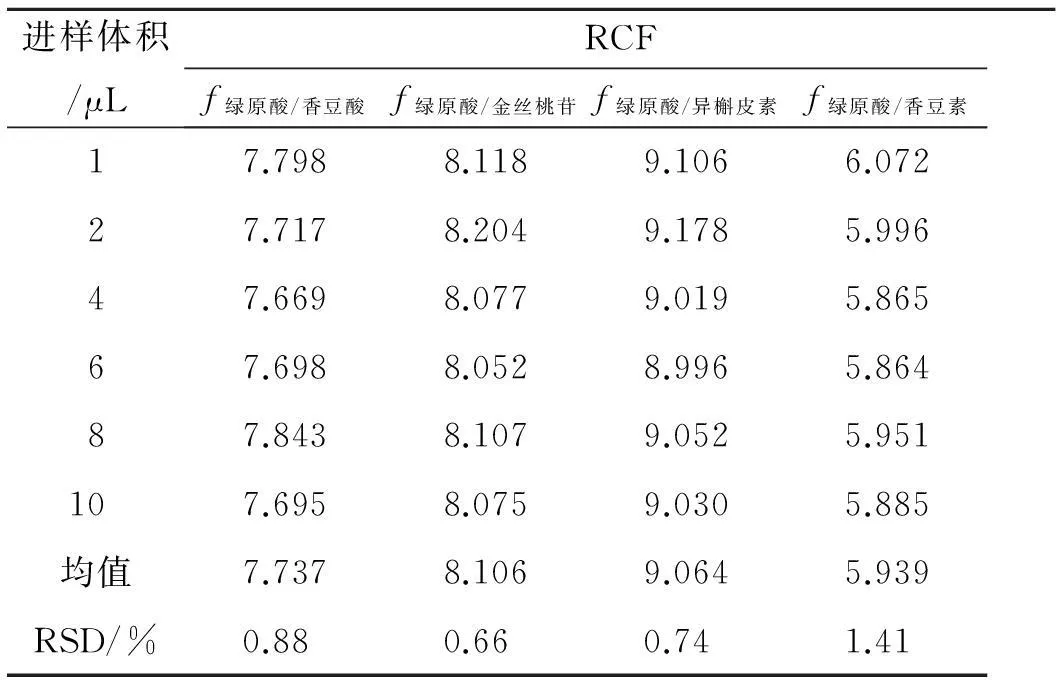
进样体积/μLRCFf绿原酸/香豆酸f绿原酸/金丝桃苷f绿原酸/异槲皮素f绿原酸/香豆素17.7988.1189.1066.07227.7178.2049.1785.99647.6698.0779.0195.86567.6988.0528.9965.86487.8438.1079.0525.951107.6958.0759.0305.885均值7.7378.1069.0645.939RSD/%0.880.660.741.41
2.11相对校正因子耐用性和系统适用性考察
2.11.1高效液相色谱仪和色谱柱对相对校正因子的影响分别考察3种色谱仪和3种色谱柱对绿原酸相对校正因子的影响[7],按2.1项下色谱条件操作,得到相对校正因子重复性良好,RSD小于2%,结果见表4。
2.11.2流速对相对校正因子的影响采用岛津LC-20AB高效液相色谱仪和Kromasil C18色谱柱,柱温40 ℃,分别考察流速0.9,1.0和1.1 mL·min-1对相对校正因子的影响,重复性良好,RSD小于2%,结果见表5。
表4色谱仪和色谱柱对RCF的影响
Tab.4 The influence of chromatographic column and chromatograph on the relative correction factors

仪器色谱柱RCFf绿原酸/香豆酸f绿原酸/ 金丝桃苷f绿原酸/ 异槲皮素f绿原酸/香豆素岛津 LC-20ABAgilentTC-C187.7808.1669.0356.088KromasilC187.7958.1669.1446.078AmethystC187.8088.1679.0825.921Waters1525AgilentTC-C187.8108.1649.0496.094KromasilC187.8178.1679.0186.044AmethystC187.8098.1659.0396.096Waterse2695AgilentTC-C187.8188.1639.0166.042KromasilC187.8188.1669.1026.042AmethystC187.8178.1669.0426.039均值7.8088.1669.0586.050RSD(%)0.160.020.051.00
表5流速对RCF的影响
Tab.5 The influence of flow rate on the relative correction factor

进样体积/mL·min-1RCFf绿原酸/香豆酸f绿原酸/金丝桃苷f绿原酸/异槲皮素f绿原酸/香豆素0.97.7848.1589.0386.2311.07.7998.1748.7886.2181.17.8088.1669.0586.050均值7.7978.1668.9616.166RSD/%0.150.091.681.64
2.11.3柱温对相对校正因子的影响采用岛津LC-20AB高效液相色谱仪和Kromasil C18色谱柱,流速1.0 mL·min-1,分别考察温度30,35和40 ℃对相对校正因子的影响,结果重复性良好,RSD小于2%,结果见表6。
表6柱温对RCF的影响
Tab. 6 The influence of column temperature on the relative correction factor

柱温/℃RCFf绿原酸/香豆酸f绿原酸/金丝桃苷f绿原酸/异槲皮素f绿原酸/香豆素307.7968.1689.1086.254357.7958.1649.0236.240407.8088.1669.0586.050均值7.8008.1669.0636.181RSD/%0.090.030.461.84
2.12外标法和一测多评法结果比较分别精密吸取不同批次样品10 μL,测定。采用外标法和一测多评法计算样品中香豆酸、绿原酸、金丝桃苷、异槲皮素、香豆素的含量,结果见表7。结果表明一测多评法和外标法测定结果并无显著性差异(P>0.05),表明一测多评法可以用于杜麻颗粒中5种成分的含量测定。
表7外标法和一测多评法测定样品中目标成分的含量
Tab.7 Contents of target compound by QAMS and external reference method(mg·mL-1)

编号香豆酸绿原酸金丝桃苷异槲皮素香豆素ABAABABAB10.52820.528946.484.9474.9524.9134.9110.26700.267220.51030.510445.864.8674.8824.8794.8820.26370.263530.51160.511347.955.1375.1415.1035.1010.26880.270841.52901.529026.45010.84010.8308.5308.5261.8781.871052.3142.314039.8716.3116.2912.8412.8302.8362.830063.1233.123052.8021.7221.7117.0117.0803.8053.798070.52910.528846.404.9384.9374.9824.9800.26730.268280.52980.530547.704.9875.0014.9915.0020.25980.260390.74900.749112.875.3465.3554.2134.2180.93070.9310100.51950.519646.734.8774.8834.8874.8900.25680.2572
注:A.外标法实测含量;B.一测多评法测得含量。
3讨论
利用一测多评法可以实现通过测定一个成分的含量达到多指标控制的目的。目前,一测多评法的研究思路已成功应用于一些药材和中药复方制剂的质量评价,包括白木通、人参、三七、黄芩、双黄连、双青咽喉片、麦贞花颗粒、芩暴红止咳胶囊等[8-13]。在本文中,绿原酸是杜麻方的主要活性成分,含量高,且该对照品价廉易得、稳定,因此重点考察了绿原酸的含量。但是绿原酸在忍冬科、菊科植物中普遍存在,提取纯化方法较为成熟,若在工艺中非法添加,能很容易满足质量监管部门的检查要求[14],因此仅控制绿原酸的含量,无法真实地控制杜麻颗粒的内在质量。而本实验采用一测多评的方法,仅使用绿原酸一种对照品就能够同时测定5种成分的含量,能够较全面真实地评价杜麻颗粒的质量。验证实验结果表明,一测多评所得含量与外标法所得的各成分之间含量并无显著性差异(P>0.05)。在不同的实验条件下,各成分之间的相对校正因子重复性好,说明在对照品缺乏的条件下,一测多评法可以作为一种快捷、准确的方法来评价杜麻颗粒的质量。
在色谱条件的优化中,所建立的含量测定方法应该具有普遍适用性。本文考察了3种型号的高效液相色谱仪和3种型号的色谱柱对绿原酸相对校正因子的影响,结果显示,样品溶液5种成分在不同型号的仪器和色谱柱上分离效果较好,对难以分离的绿原酸杂质峰分离度均大于1.5,各成分的理论板数均高于3 000,校正因子重复性良好,在一定范围内,流速与柱温对校正因子影响不大,提示该方法具有较好的耐用性。
本文采用绿原酸作为内标进行一测多评,是由于绿原酸是杜麻方的主要有效成分,且该对照品廉价易得、稳定。香豆酸、香豆素具有抗菌、降脂和抗凝作用,高血压患者常伴有高血脂,故将其纳入含量测定的指标之一。而绿原酸、金丝桃苷、异槲皮素是杜麻方的主要有效物质,而且在药材中含量较高,因此选择其作为杜麻颗粒质量评价的指标成分。
致谢:感谢新疆华圣元医药科技有限公司对本课题的资助与支持。
参考文献:
[1]何兵,刘艳,杨试艳,等.HPLC一测多评法同时测定双青咽喉片中10种成分[J].中草药,2013,44(8):974-981.
[2]王智民,高慧敏,付雪涛,等. “一测多评”法中药质量评价模式方法学研究[ J].中国中药杂志,2006,31(23):1925-1928.
[3]杨东亮,马桂芝,滕亮,等.均匀设计法优化杜麻方最佳配伍研究[J].西北药学杂志,2013,28(3):46-47.
[4]何希瑞,李永生,杨芳,等. 不同采收时间及干燥方法对杜仲叶中绿原酸含量的影响[ J].西北药学杂志,2013,28(2):130-132.
[5]吴迪,臧忠良,王德勤,等.一测多评法测定复方丹参片中4种丹参酮类成分的含量[J].中国药学杂志,2012,47(18):1509-1514.
[6]郑荣,郏征伟,王珂,等.金银花提取物中6种有机酸类成分的测定[J].中成药,2013,35(3):560-564.
[7]何凤成,李守信,赵志全,等.一测多评法测定五味子中4种木脂素类成分的含量[J].药学学报,2012,47(7):930-933.
[8]于霄,宋静,熊志立,等.一测多评法测定淫羊藿中朝霍定A、朝霍定B、朝霍定C及淫羊藿苷的含量[J].中国中药杂志,2010,24(35):3310-3313.
[9]陆兔林,石上梅,蔡宝昌,等.基于一测多评的中药多成分定量研究进展[J].中草药,2012,43(12):2525-2529.
[10]朱晶晶,王智民,匡艳辉,等.一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J].药学学报,2008,43(12):1211-1216.
[11]冯伟红,杨菲,王智民,等.一测多评法与外标法测定双黄连制剂中黄酮类成分含量的比较分析[J].中国药学杂志,2012,47(20):1665-1669.
[12]刘志辉,顾伟,常星洁,等.“一测多评”法测定麦贞花颗粒中不同类型成分的含量[J].中成药,2012,34(12):2342-2347.
[13]张志勇,宋晓宁,茅向军.芩暴红止咳胶囊中紫丁香苷、杜鹃素、黄芩苷含量的高效液相色谱测定[J].时珍国医国药,2013,24(11):2603-2604.
[14]吉丽娜,冯伟红,王智民,等.“一测多评”法与外标法测定三黄片中4种黄芩黄酮类成分[J].中成药,2012,34(11):2128-2133.
