肱动脉内皮依赖性舒张功能障碍与非心源性缺血性卒中复发关系研究
2016-01-19李沛张俊霞唐莉张蓉华国勇胡全忠侯倩
李沛,张俊霞,唐莉,张蓉,华国勇,胡全忠,侯倩
我国缺血性卒中(ischemic stroke,IS)患者逐渐增加[1],且卒中年复发率高达16%~29%[2]。研究显示,发生心脑血管事件的危险性与血管内皮功能失衡有关[3]。血管内皮细胞功能障碍不仅可以存在于大血管,也可存在于外周血管[4]。肱动脉血流介导的舒张功能(flow mediated dilation,FMD)作为评估外周血管内皮功能状态的无创性手段,已逐渐被应用于心血管疾病及外周血管功能评估[5-6],而FMD对于卒中复发的预判价值鲜有报道。本文研究外周血管FMD功能障碍与非心源性缺血性卒中复发之间的关系,探讨FMD预测非心源性卒中复发的价值。
1 对象与方法
1.1 研究对象 本研究为前瞻性研究,连续入组2010年1月-2013年12月在青海省人民医院神经内科住院治疗的初发非心源性缺血性卒中急性期患者。入组标准:①年龄40~85岁;②首次发病,非心源性缺血性卒中的诊断符合欧洲卒中协会(European Stroke Initiative,EUSI)指南的诊断标准[7],并经颅脑计算机断层扫描(computed tomography,CT)或磁共振成像(magnetic resonance image,MRI)检查证实;③发病2周内,Glasgow昏迷量表(Glasgow Coma Scale,GCS)评分>14分;④随访期间能规律服用抗血小板聚集药物、降压药、调脂药及降糖药等。排除标准:①既往短暂性脑缺血发作(transient ischemic attack,TIA)、缺血性及出血性卒中病史者;②心源性卒中;③严重的心、肺、肝、肾功能不全者;④合并有胰腺、肾上腺或甲状腺等内分泌疾病者;⑤随访期间不规律用药或不能合作完成实验室、影像学、心脏超声等检查者;⑥肿瘤患者;⑦不同意参加随访者。
1.2 研究方法
1.2.1 一般资料 收集患者的基线资料,包括性别、年龄、体重指数(body mass index,BMI),糖尿病史[8]、血脂异常病史[9]、心血管疾病病史[10]、既往外周血管病/心血管病病史[10]、吸烟史、入院时美国国立卫生院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分等。
1.2.2 FMD测定和分组 患者于首次发病2周内采集肱动脉FMD数据。参照美国血管超声评价肱动脉内皮依赖性舒张功能的应用指南[11],方法为受试者取仰卧位,右上肢外展15°,于肘窝上2~5 cm进行肱动脉超声检查,取直纵切面,在舒张末期测肱动脉内径,取3个心动周期的平均值为基础肱动脉内径(D0),然后将水银柱血压计的袖带放在受试者肱动脉的远端,充气加压到250 mmHg,维持5 min后袖带快速放气,于放气后60~90 s测肱动脉最大内径(D1),以加压前后肱动脉内径的变化率作为评价内皮依赖性血管舒张功能的指标,即FMD=[(D1-D0)]/D0×100%。
根据FMD水平进行分组,分别为非心源性缺血性卒中合并重度FMD受损组(FMD<4.5%)、非心源性缺血性卒中合并轻度FMD受损组(4.5%≤FMD<10%)和非心源性缺血性卒中外周FMD功能正常组(10%≤FMD<20%)[12]。
1.2.3 实验室检测 患者于首次发病2周内抽取空腹静脉血标本,3 h内分离血清,-70℃冷冻。检测血清纤维蛋白原(fibrinogen,FIB)、同型半胱氨酸(homocysteine,Hcy)、C反应蛋白(C-reactive protein,CRP)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平。检测标本按试剂盒说明同批次操作完成。
1.2.4 随访 入组12个月±2周后通过门诊面对面随访缺血性卒中复发情况。其中,卒中复发标准[13]:①原有的神经功能缺失症状和体征好转或消失后,再出现新的同侧或对侧的神经功能缺失症状和体征;②首发的症状和体征加重,并排除进展性卒中;③上述情况经头颅CT或MRI证实≥2个病灶。所有复发卒中患者均复查了头颅影像学,随访者通过全面评价患者在青海省人民医院和其他医院所有可得到的记录,包括诊疗记录,死亡证明和患者的临床表现等后确定。1.3 统计学方法 应用SPSS 17.0软件包行统计处理。正态分布的计量资料以表示,组间比较采用独立样本t检验;偏态分布的计量资料以中位数和四分位数间距表示,组间比较采用秩和检验;计数资料以频数和百分率表示,组间比较采用χ2检验。应用Logistic回归分析筛选卒中复发的独立危险因素,并计算比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)。P<0.05为有统计学意义。
2 结果
2.1 一般资料 研究期间共入组126例患者,其中男性61例,女性65例,年龄40~85岁,平均年龄(60.69±10.20)岁。重度FMD受损组、轻度FMD受损组和FMD功能正常组分别有26例、54例和46例。入组12月后随访,3例失访,分别为重度FMD受损组失访1例(女性1例),轻度FMD受损组失访2例(男1例,女1例),被剔除,余123例患者资料完整获得。
3组患者在年龄、性别、体重指数、首次发病时NIHSS分值、糖尿病、高血压、血脂异常、凝血功能、吸烟、心血管疾病等卒中危险因素方面差异均无显著性(表1)。
2.2 缺血性卒中事件复发情况 随访12个月,3组患者卒中复发率分别为8例(32.0%)、12例(23.1%)、4例(8.7%),组间存在显著性差异(χ2=6.552,P=0.033)。进一步两两比较结果显示:重度FMD受损组复发率显著高于FMD正常组(P=0.016);重度FMD受损组与轻度FMD受损组、轻度FMD受损组与FMD正常组复发率差异均无显著性。
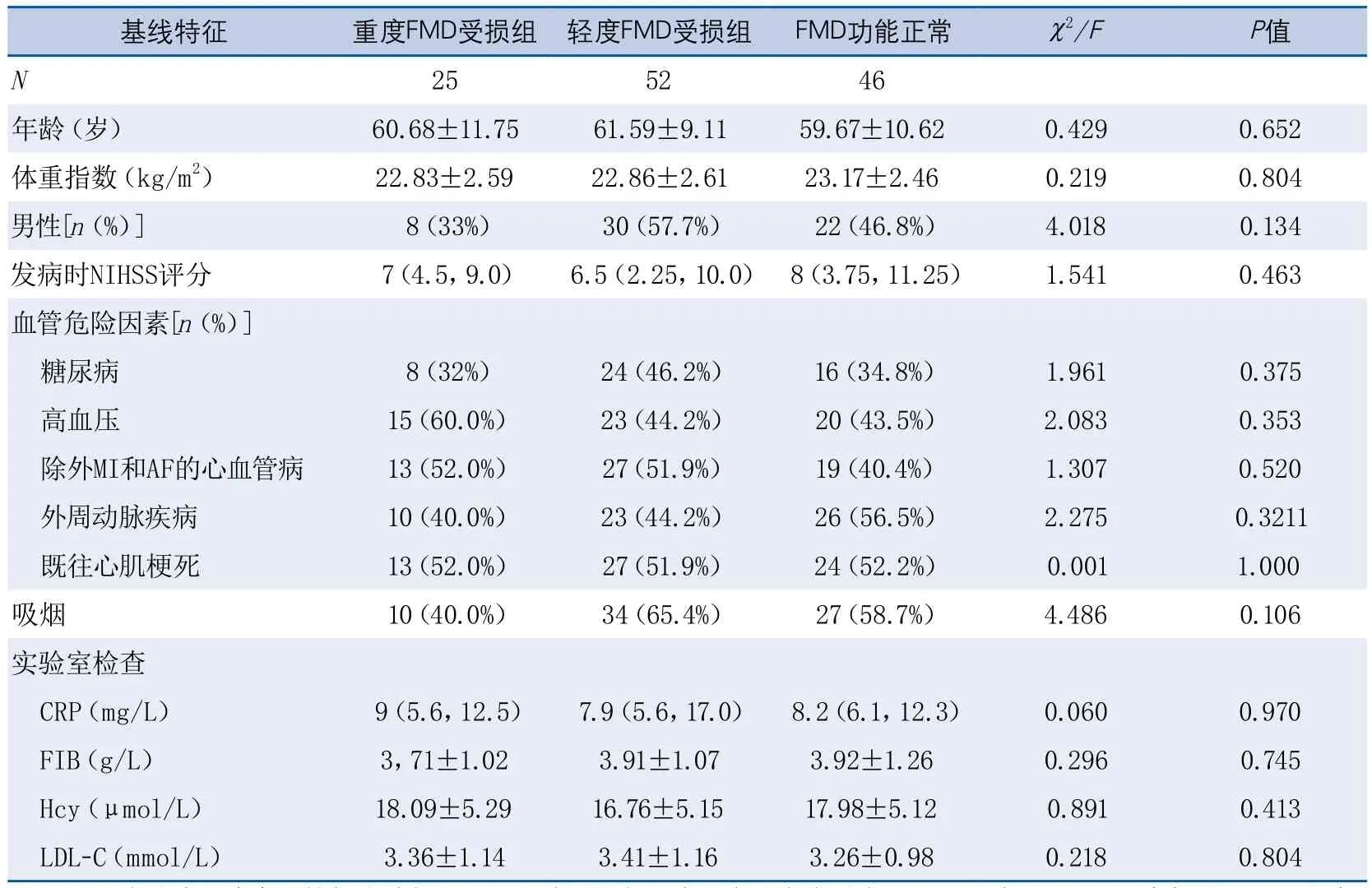
表1 3组临床、影像基线特征及实验室指标的比较
2.3 缺血性卒中复发危险因素分析 随访1年,有24例(19.5%)患者发生卒中复发。对复发组和无复发组进行单因素分析显示:复发组合并糖尿病(P=0.002)、高血压(P=0.002)、FMD功能障碍(P=0.033)、CRP值升高(P=0.004)均显著高于非复发组(表2)。将单因素分析中P<0.1的变量纳入多变量Logistic回归分析,结果显示糖尿病(OR3.657,95%CI1.135~11.777,P=0.030),高血压(OR3.286,95%CI1.069~10.104,P=0.038),FMD重度受损(OR6.155,95%CI1.333~28.420,P=0.020),CRP(OR1.053,95%CI1.001~1.107,P=0.045)是非心源性缺血性卒中患者一年缺血性卒中事件复发的危险因素。
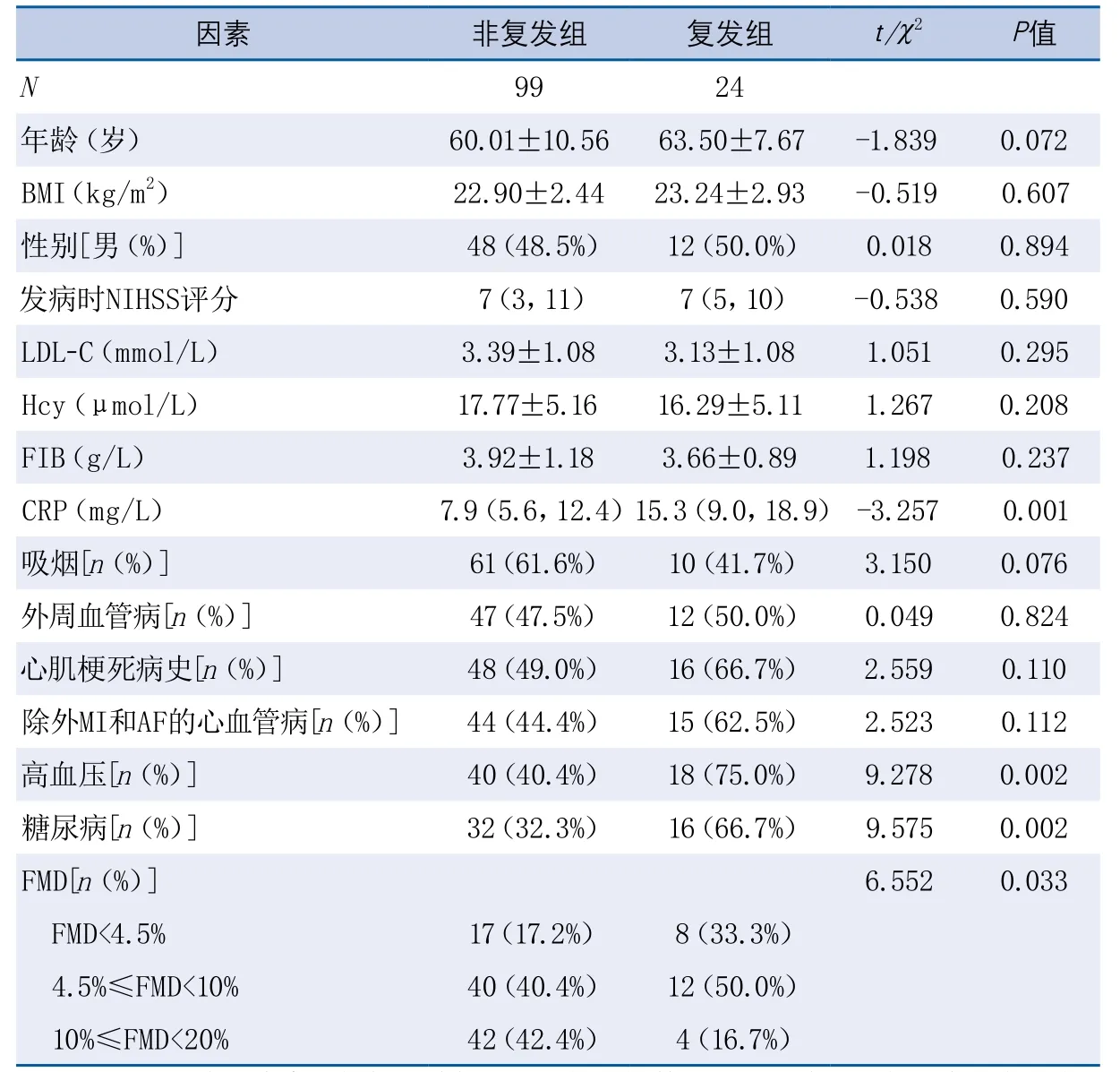
表2 缺血性卒中复发组与非复发组的单因素比较
3 讨论
缺血性卒中是卒中发病频率最多的一型[14]。在导致非心源性缺血性卒中众多的危险因素中,血管内皮功能障碍越来越受到关注。内皮功能障碍是动脉硬化(atherosclerosis,AS)启动的先兆,同形态学改变相比,敏感性更高[15],识别血管内皮功能异常对临床治疗十分重要。
以往用来评估血管内皮功能的方法包括颈动脉内-中膜厚度,但其局限于反映血管形态的改变[16],而血管造影检查由于具有创伤性和经济学原因,在临床特别是基层医院的应用有局限性。
高分辨率超声测量肱动脉FMD技术是近年发展起来的一项无创、便捷、可重复的定量检测技术,通过无创的超声检查完成,其原理为通过外周血管内反应性充血,剪切力增高,诱导内皮细胞内一氧化氮(nitric oxide,NO)释放[17-19],出现血流介导的内皮依赖性的血管扩张,以血管加压前后内径变化率作为评价内皮依赖性血管舒张功能的指标。正常人肱动脉阻断5 min后,FMD值波动于10%~20%之间,而内皮功能障碍者扩张率明显减少或无扩张。Celermajer等[12]于1992年第一次应用这种方法评估血管内皮细胞功能,后吴康智等[20]用体外超声显像技术证实冠状动脉粥样硬化性心脏病患者存在肱动脉血管内皮损伤,随后的试验进一步表明FMD受损及其后发生的早期动脉粥样硬化增加了心血管事件的风险[21],且肱动脉FMD受损程度可能与心血管病血管病变程度相关[22],并可用于评估糖尿病患者发生心血管事件的风险[23-24]。但是目前国内外对缺血性卒中合并不同程度FMD功能障碍患者的预后研究鲜见报道,现仅有证据表明FMD可能与脑微出血灶、陈旧性缺血性卒中相关[25]。
本研究探讨了FMD与非心源性缺血性卒中复发之间的关系,发现FMD重度功能障碍是非心源性缺血性卒中复发的独立危险因素。结合国外研究结果,亦支持FMD<4.5%是缺血性卒中复发的独立预测因子[26-27],原因可能是血管舒张功能受损,血管痉挛,同时慢性间断缺血、缺氧可激活炎症途径,动脉粥样硬化形成加速,引起缺血性卒中的复发。本研究中FMD轻度受损与卒中复发之间未表现独立相关性,可能是由于FMD轻度受损尚未造成血流动力学损害,患者尚有一定的血流储备功能。
与既往研究相似,本研究同样显示糖尿病、高血压及CRP与卒中复发独立相关[28-31]。此外单变量分析提示吸烟与卒中复发存在临界相关性,校正其他混杂因素并无独立相关性,但结合既往研究显示吸烟易致血管内皮功能失调,进而引起动脉粥样硬化[32],考虑到本研究病例数有限,吸烟在卒中复发中的作用有待进一步大样本研究澄清。
本研究由于病例数较少、随访时间较短,并未对FMD功能异常患者行干预治疗。应进一步针对非心源性缺血性卒中患者FMD进行治疗干预研究,为规范卒中二级预防提供有力证据,降低卒中的复发率。
1 Wang YL,Liao XL,Zhao XQ,et al. Using recombinant tissue plasminogen activator to treat acute ischemic stroke in China:analysis of the results from the Chinese National Stroke Registry (CNSR)[J].Stroke,2011,42:1658-1664.
2 Roger VL,Go AS,Lloyd-Jones DM,et al. Heart disease and stroke statistics—2011 update:a report from the American Heart Association[J]. Circulation,2011,123:e18-e209.
3 Bonetti PO,Lerman LO,Lerman A. Endothelial dysfunction:a marker of atherosclerotic risk[J].Arterioscler,Thromb,Vasc Biol,2003,23:168-175.
4 Bonetti PO,Pumper GM,Higano ST,et al.Noninvasive identification of patients with early coronary atherosclerosis by assessment of digital reactive hyperemia[J]. J Am Coll Cardiol,2004,44:2137-2141.
5 Thijssen DH,Black MA,Pyke KE,et al.Assessment of flow-mediated dilation in humans:a methodological and physiological guideline[J]. Am J Physiol Heart Circ Physiol,2011,300:H2-12.
6 高宇,王建华,黄晓玲,等. 超声对短期胰岛素泵治疗改善2 型糖尿病血管功能的临床观察[J]. 中国超声医学杂志,2011,27:920-922.
7 European Stroke Initiative Executive Committee,EUSI Writing Committee,Olsen TS,et al. European Stroke Initiative recommendations for stroke management-update 2003[J]. Cerebrovasc Dis,2003,16:311-337.
8 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华糖尿病杂志,2014,6:447-498.
9 Keevil JG,Cullen MW,Gangnon R,et al. Implications of cardiac risk and low-density lipoprotein cholesterol distributions in the United States for the diagnosis and treatment of dyslipidemia:data from National Health and Nutrition Examination Survey 1999 to 2002[J].Circulation,2007,115:1363-1370.
10 Becker RC,Meade TW,Berger PB,et al. The primary and secondary prevention of coronary artery disease:American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition)[J]. Chest,2008,133(6 Suppl):776S-814S.
11 Corretti MC,Anderson TJ,Benjamin EJ,et al. Guidelines for the ultrasound assessment of endothelial dependent flow mediated vosodilation of the brachial artery:a report of the International Brachial Artery Reactivity Task Force[J]. J Am Coll Cardiol,2002,39:2572265.
12 Celermajer DS,SorensenKE,Gooch VM,et al.Non-invasive detection of endothelial dysfuntion in children and adults at risk of atherosclerosis[J].Lancet,1992,340(8828):1111-1115.
13 中华医学会神经科分会. 各类脑血管病诊断要点[J].中华神经科杂志,1996,29:379-380.
14 Worthmann H,Chen S,Martens-Lobenhoffer J,et al.High plasma dimethylarginine levels are associated with adverse clinical outcome after stroke[J]. J Atheroscler Thromb,2011,18:753-761.
15 Vita JA,Treasure GB,Nabel EG,et al. Coronary vasomotor response to actylcholine relates to risk factors for coronary artery disease[J]. Cirulation,1990,81:491-497.
16 Goff DC Jr,Lloyd-Jones DM,Bennett G,et al.2013 ACC/AHA guideline on the assessment of cardiovascular risk:A report of the American College of Cardiology/American Heart Association task force on practice guidelines[J]. Circulation,2014,129(25 Suppl 2):S49-73.
17 Joannides R,Haefeli WE,Linder L,et al. Nitric oxide is responsible for flow-dependent dilatation of human peripheral conduit arteries in vivo[J].Circulation,1995,91:1314-1319.
18 Lieberman EH,Gerhard MD,Uehata A,et al.Flow-induced vasodilation of the human brachial artery is impaired in patients <40 years of age with coronary artery disease[J]. Am J Cardiol,1996,78:1210-1214.
19 Joannides R,Richard V,Haefeli WE,et al. Role of basal and stimulated release of nitric oxide in the regulation of radial artery caliber in humans[J].Hypertension,1995,26:327-331.
20 吴康智,尚虎虎,章银环,等. 颈动脉粥样硬化、血管内皮功能与冠心病的相关性研究[J]. 武警医学院学报,2010,19:783-785.
20 Nilsson PM,Boutouyrie P,Cunha P,et al. Early vascular ageing in translation:from laboratory investigations to clinical applications in cardiovascular prevention[J]. J Hypertens,2013,31:1517-1526.
21 陈旭东. 彩色高频超声探查肱动脉内皮舒张功能与冠心病患者颈动脉内-中膜厚度的临床意义[J]. 中国实用医药,2012,7:65-66.
22 Mai XL,Teng GJ. Characteristic of endothelial progenitor cell and it's roles in the diseases of atheroselerosis[J]. Zhonghua Xinxueguanbing Zazhi,2007,35(8):775-777.
23 van Bussel FCG. A control systems approach to quantify wall shear stress normalization by flowmediated dilation in the brachial artery[J]. PLoS One,2015,10:e0115977.
24 Bruno RM,Ghiadoni L. Vascular smooth muscle function:def i ning the diabetic vascular phenotype[J].Diabetologia,2013,56:2107-2109.
25 Flammer AJ,Anderson T,Celermajer DS,et al. The assessment of endothelial function:from research into clinical practice[J]. Circulation,2012,126:753-767.
26 Peng Q,Huang Y,Sun W,et al. Association among cerebral microbleeds,cerebral large-artery disease and endothelial dysfunction[J]. Chin Med J(Engl),2014,127:3204-3208.
27 Santos-García D1,Blanco M,Serena J,et al.Impaired brachial flow-mediated dilation is a predictor of a new-onset vascular event after stroke[J].Cerebrovasc Dis,2011,32:155-162.
28 肖艳,张晓莺. 缺血性脑卒中复发的危险因素分析[J]. 实用医院临床杂志,2010,7:49-51.
29 陈明,胡申江,张健,等. 不同危险度的高血压病人血管内皮功能[J]. 高血压杂志,2006,14:257-260.
30 Yavuz D,Koc M,Toprak A,et al. Effects of ACE inhibition and AT1 receptor antagonism on endothelial function and insulin sensitivity in essential hypertensive patients[J]. J Renin Angiotens in Aldosterone System,2003,4:197-203.
31 Anderson JL,Carlquist JF,Muhlestein JB,et al.Evaluation of C-reactive protein,an inflammation maker,and infectious serology as risk factors for coronary artery disease and myocardial infarction[J].J Am Coll Cardiol,1998,32:35-41.
32 Herman AG,Moncada S. Therapeutic potential of nitric oxide donors in the prevention and treatment of atherosclerosis[J]. Eur Heart J,2005,26:1945-1955.
