丝素蛋白在生物医药工程中的应用
2016-01-18肖阳杨琼李庆荣邢东旭罗国庆叶明强
肖阳 杨琼 李庆荣 邢东旭 罗国庆 叶明强*
(广东省农业科学院蚕业与农产品加工研究所,广东广州 510610)
蚕丝蛋白主要由丝素蛋白(Silk Fibroin,SF)和丝胶蛋白两部分组成,其中的丝素蛋白约占蚕丝蛋白总质量的70%-80%,为蚕丝蛋白的主要组成部分,主要由甘氨酸、丙氨酸和丝氨酸等18种氨基酸以多缩氨键连接而成。长时间以来蚕丝的用途局限于高端纺织纤维,但由于丝素蛋白具有良好的生物相容性和降解性,且无毒、无污染、无刺激性,可通过制备不同形态结构的丝素蛋白来调控其降解速度[1-2],近年来已经被广泛应用于生物和医学工程领域。
1 丝素蛋白在医疗保健中的应用
1.1 降血糖作用
中国古代已有将蚕茧煮食用于糖尿病治疗的记载。近年来,研究人员将丝素蛋白的水解产物喂食动物或作用于细胞,在糖尿病治疗方面取得了不错的效果。Hyun[3]等通过将不同制剂的丝素蛋白水解产物作用于3T3-L1细胞系,发现丝素蛋白可加速葡萄糖代谢和不依赖于胰岛素的糖原更替。此外,蚕丝蛋白调节葡萄糖转运蛋白1(GLUT),增加其在细胞表面的表达和增强GLUT4易位,从而提示糖尿病患者在丝素蛋白作用下体内高血糖症状得以改善。此外Jun Hong Park[4]等发现,由高浓度葡萄糖引起细胞死亡的胰腺β细胞(HIT-T15),在经过50 mg/mL的丝素蛋白处理后其细胞死亡有所缓解。同时,丝素蛋白处理还降低了细胞活性氧(ROS)水平,提高了增殖细胞核抗原(PCNA)的免疫反应性。通过TUNEL检测还发现丝素蛋白保护HIT-T15细胞免于葡萄糖诱导的细胞凋亡,提示丝素蛋白可能通过降低细胞的ROS水平来使细胞免于死亡。将丝素蛋白作为糖尿病或高血糖症的候选治疗剂,不仅可以降低血糖值、缓解糖尿病和其他并发症的症状,还可以避免某些糖尿病药物带来的不良反应,是具有较好生物医药前景的天然材料[5]。
1.2 抑菌作用
将丝素蛋白水解成丝素肽,置于自然环境中数小时,可观察到菌落数目比对照有不同程度地减少,表明丝素肽具有一定的抑菌作用[6]。将丝素水解液加入到辣泡菜中,发现其可明显抑制乳酸菌的生长。根据其较好的抑菌特性,可开发相应的抗菌药物加以利用[7]。
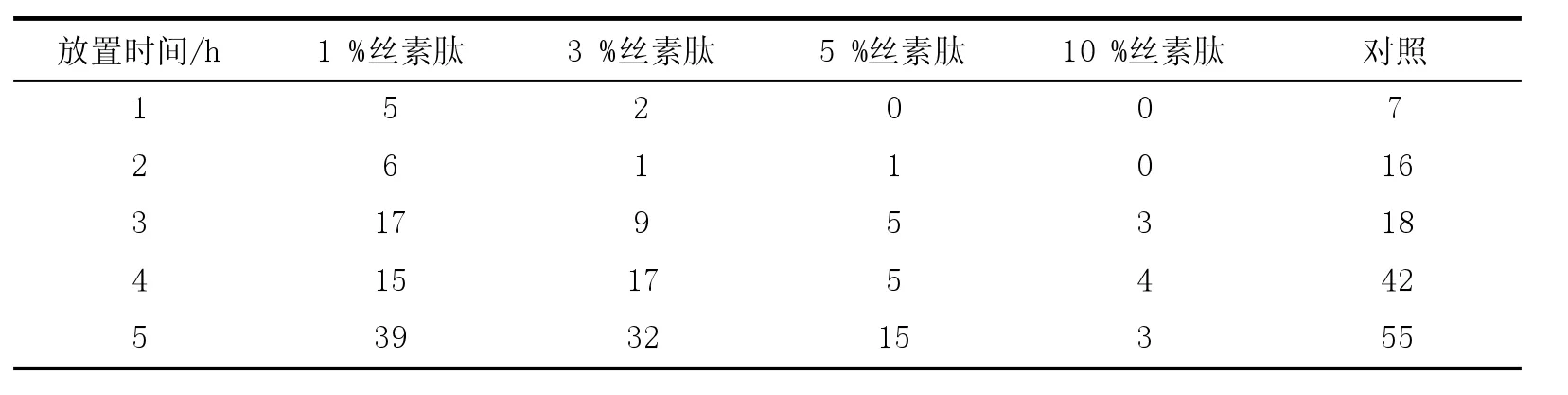
表1 不同浓度的丝素肽对空气中杂菌的抑制效果比较(菌落数目)
2 丝素蛋白在生物医药工程中的应用
2.1 药物缓释
由于丝素蛋白具有生物降解较缓慢、对生物体无毒害作用、生物相容性良好等特点,并且有独特的力学性能和独特的氨基酸组成,可以通过某些氨基酸的氨基或侧链的化学修饰改变蛋白的表面性能,随着药物缓释生物材料的发展与趋势,丝素蛋白已成为医用药物缓释载体研究的热点。丝素蛋白作为药物缓释载体,可以减少药物摄入体内时的暴释现象,有效放慢经皮肤吸收药物的药物释放速度,使药物在体内的作用趋于平稳,减少药物浪费,并抑制某些挥发性成分的蒸发损失,从而较大程度地提高药物效果。
以丝素蛋白作为缓释载体材料,目前主要有水凝胶、薄膜衣、微粒子、纳米粒子、通道、支架以及药片等几种物理形式,可根据药物分子量大小及释放快慢要求,制成不同规格的药物载体[8-9]。泰国的Lerdchai K[10]等将抗癌物姜黄素和DHA封装在丝素蛋白/明胶(SF/G)海绵中作为宫颈癌治疗的药物缓释系统,该SF/G海绵对正常细胞无毒性,通过SF/G海绵控制姜黄素和DHA的缓慢释放,提高了对癌细胞生长的抑制效果。
2.2 止血功能
目前医学上常用的止血材料主要包括止血纱布、止血绷带和止血纤维,在使用过程中这些材料存在止血时间较长、易造成过敏、易粘连伤口、对创口感染的抑制率较低等缺点。丝素蛋白由于具有无毒且炎症反应低的优点,近年来已有开发成新型止血材料的研究报道。许亚阳等利用[11]CaCl2-乙醇-水三元体系在48℃的温度条件下水解丝素蛋白,获得平均分子量大小为30 kD的丝素肽。通过对大鼠肝脏止血模型进行实验,发现用30 kD丝素肽处理后的大鼠出血量少、止血时间较短,止血效果与临床常用的止血粉Arista相近,而丝素肽具有较好的抑菌效果,且无细胞毒性,因此在开发快速止血材料方面具有广阔的前景。
2.3 伤口愈合
丝素蛋白具有促进皮肤组织再生和伤口愈合的作用,经过丝素蛋白涂抹处理的皮肤伤口,其愈合的速度比生理盐水处理的更快速[12]。创伤的发生容易引起微生物感染,因此具有良好密封性、抗菌性以及保湿性的创面敷料对伤口的愈合起着重要的作用。丝素蛋白透气、保湿性强,形态易塑且安全无毒的特点使其成为制备皮肤创伤敷料的候选材料[13-15]。目前开发的丝素蛋白创伤敷料主要有丝素膜[15-16]、丝素凝胶[17]、丝素海绵[13.18]、丝素纳米纤维以及负载生长因子[22]、负载植物活性成分[23]的丝素创伤敷料等类型,可满足多种不同需求的创伤治疗[24]。
2.4 组织工程支架
近年来随着丝素蛋白在生物医用领域的研究成为热点,人工血管、人造软骨及骨组织、皮肤及神经组织修复相关产品陆续被开发出来,这些材料为组织修复提供了细胞生长的良好支架[25-28]。
2.4.1 人工血管
丝素蛋白能促进细胞增殖,有着良好的组织相容性及较好的机械性能,降解速率慢,是开发人工血管的候选材料[25]。朱晨辉等[29]将类人胶原蛋白与丝素蛋白以质量比7:3混合,获得类人胶原蛋白-丝素蛋白管状支架,该支架具有均匀的多孔结构,孔径为(60±5)μm,孔隙率达到85%以上;具有较理想的力学性能,应变为50%±5%,应力为(332±16)kPa;降解速率较慢,提高了细胞的黏附与增殖,具有良好的生物相容性。陈杰等采用软印刷技术制备了4种不同微观形貌的丝素蛋白膜,研究其对人脐静脉血管内皮细胞的生长、形态、排布、增殖功能等一系列生物学行为的影响,发现丝素蛋白覆膜材料能支持血管内皮细胞的正常生长和增殖,并可以通过丝素蛋白膜表面的微观形貌影响血管内皮细胞的形态及生物学行为。
2.4.2 骨组织
近年来,将成骨种子细胞和丝素蛋白结合起来制备具有骨修复能力的丝素蛋白材料已有不少报道,材料中的丝素蛋白可为骨细胞生长、粘附和分化提供所需的空间及环境。Yashi Jin[31]报道了一种骨修复效果较好的3 D类骨生物材料的制备方法,就是利用3D丝素蛋白水凝胶通过离子扩散法来调节羟磷灰石晶体的成核和生长。Bhardwaj等[32]在丝素蛋白-壳聚糖三维支架上植入牛软骨细胞,发现比例为1:1的丝素/壳聚糖复合支架最利于软骨细胞的形成。目前用于骨修复的丝素蛋白生物材料,主要有丝素膜[33]、丝素纳米纤维[34]、丝素水凝胶[31,35]和丝素支架[36-37]等几种形式[38]。这些丝素蛋白生物材料可以经过适当的化学修饰以及负载生长因子和复合无机物等,使其在体外具有促进成骨细胞增殖分化的功能,在体内具有诱导新骨形成的功能,然而丝素蛋白生物材料能否完全模拟骨组织的内部结构并在临床医学上广泛应用还有待于深入研究。
2.4.3 皮肤组织
丝素蛋白由于其保湿、美白等特点使其早已广泛应用于化妆品中。由于具有吸水性、透气性以及其他相关生物活性,丝素蛋白制备的敷料表现出加速皮肤再生的能力,使其在医学美容领域逐渐成为研究和产品开发的热门材料。Sheng[39]等制备了负载维生素E的丝素蛋白纳米纤维垫,这种纳米纤维垫防水性能优越,负载的维生素E可以稳定释放,将老鼠皮肤纤维母细胞在该纤维垫上进行体外培养,发现细胞的生长和增殖比在玻片上要好得多。Guan[27]等通过冷冻干燥法制备了丝素蛋白多孔支架(PSFSs),将PSFSs植入体内18天后便发现新组织已经在支架上形成,其组织结构几乎与正常皮肤相同,按比例分配的功能性血管也可以找到,而侵入PSFSs中的炎症细胞在7天内就消失了(常用的海绵支架在植入18天后仍可见炎症细胞和纤维包膜),从而表明丝素蛋白多孔支架能够促进受损皮肤的恢复,并表现出突出的组织相容性。
2.4.4 神经
应用丝素蛋白制备的神经导管可为神经再生提供有利的局部微环境,作为桥接结构起到引导和促进神经再生的作用,从而修复神经的缺损[40]。Lorenz Uebersax[28]等用丝素蛋白膜负载神经生长因子,控制生长因子在神经细胞生长过程中逐渐释放,从而能持续提供细胞分化所需,促进神经再生。Yun Gu[41]等制备了基于壳聚糖/丝素蛋白的细胞外基质修饰支架,用于桥接10 mm的大鼠坐骨神经间隙,血液和组织病理学分析结果证明了该支架的安全性,同时桥接后大鼠神经再生的效果良好。
3 丝素蛋白在生物医学材料中的应用
3.1 手术缝合线
长期以来医学上主要使用羊肠线作为可吸收手术缝合线,但羊肠线具有柔韧性不好、组织反应大、吸水后打结性能差等缺点。丝素蛋白具有良好的打结性能,且柔韧性好、扩张强度低,不易引起组织撕裂,适于应用到黏膜组织或擦伤区域[42]。日本蚕丝昆虫研究所在蚕丝表面覆盖有机硅后编织成软质绢丝手术缝合线,对机体组织不产生任何污染,是一种安全的医用手术缝合线[43]。近年来随着美容整容行业的兴起,美容用手术缝合线使用量大大增加,它要求缝线细、匀而结实,细纤度高级蚕丝的丝素蛋白成为了它的主要原料[44]。
3.2 固定化酶载体
丝素蛋白是天然的高分子蛋白,具有独特的分子结构、优异的机械性能、良好的吸湿、保温和抗菌性能,是制备固定化酶载体的理想材料[45]。丝素蛋白作为固定化酶载体的应用可以追溯到上世纪70年代,Grasset等通过重氮化和吸附、交联等方法将碱性磷酸酶固定在丝素纤维上。Chen[47]等将酯酶固定在平均纤维直径180 nm、厚度60μm的电纺丝素蛋白纳米纤维膜(SF NFMs)上,用于通过酯交换反应催化生产丁酸香叶酯,这种SF NFMs可以负载10.7%的酶量,相对酶活性可达到无固定化酯酶的120%。除磷酸酶和酯酶外,葡萄糖氧化酶、超氧化物酶、天冬酰胺酶、中性蛋白酶、胰岛素等多种酶以及肽均能通过生物偶联方式固定于丝素蛋白纳米颗粒上[48]。
4 结语
长期以来,我国的蚕桑业沿袭种桑养蚕、结茧缫丝的传统老路,终端产品单一,产业链受国际生丝价格波动的影响较大。传统产业链的劣势随着经济社会的发展日益凸显,传统蚕桑业规模趋于萎缩。21世纪逐渐发展起来的蚕桑多元化利用,已在食品、药用保健、化工等多方面取得突破性进展,研发出一系列产品,大大拓展了蚕、桑资源的应用领域,取得了明显的经济效益。
家蚕丝素蛋白产量大,可为医药保健、组织工程提供大量的天然蛋白原料。丝素具有优良的生物和机械性能,在生物医药领域有着广阔的应用前景,可单独或与其他材料(如丝素蛋白/多聚物材料等)相结合,开发高附加值的生物新材料和医用产品。一方面可提高居民的医疗健康水平和生活质量;另一方面,新拓展的产业链受生丝价格等因素的影响小,可保持稳定可持续的蚕茧需求,在企业获利的同时也能带动蚕农的积极性,产生显著的经济、社会效益。
[1]LD Koh,Y Cheng,CP Teng,et al.Structures,mechanical properties and applications of silk?fibroin?materials[J].Progress in Polymer Science,2015,46(7):86-110.
[2]H Mori,M Tsukada.New silk protein:Modification of silk protein by gene engineering for production of biomaterials[J].Journal of Biotechnology,2000,74(2):95-103.
[3]CK Hyun,IY Kim,SC Frost.Soluble fibroin enhances insulin sensitivity and glucose metabolism in 3T3-L1 adipocytes[J].Journal of Nutrition,2005,134(12):3257-3263.
[4]JH Park,YY Nam,SY Park,et al.Silk fibroin has a protective effect against high glucose induced apoptosis in HIT-T15 cells[J].Journal of Biochem ical& Molecular Toxicology,2011,25(4):238-243.
[5]金洹宇,刘星,银华,等.丝素蛋白在生物医用领域中的应用[J].生物医学工程学杂志,2014,31(1):228-232.
[6]李亚洁,王林华,石理鑫,等.柞蚕和家蚕丝肽抗菌作用的研究[J].辽宁丝绸,2005(3):7-9.
[7]Takeuchi,Shigeru.Enzym ic manufacture of low-mole cular weight silk fibroin peptides[J].Jpn.Kokai Tokkyo Koho JP,1995(7):670-686.
[8]曹阳,王伯初,迟少萍,等.基于丝素蛋白的药物缓释材料[J].中国组织工程研究与临床康复,2009,13(8):1533-1536.
[9]E Wenk,HP Merkle,L Meinel.Silk fibroin as a vehicle fordrug delivery applications [J].J Control Release,2010,150(2):128-141.
[10]K Lerdchai,J Kitsongserm thon,J Ratanavaraporn,et al.Thai silk fibroin/gelatindponges for thedual controlled release of curcumin anddocosahexaenoic acid for anticancer treatment[J].Journal of Pharmaceutical Sciences,2015,105(1):221-230.
[11]许亚阳,沈锦玉,朱海霖,等.不同分子质量丝素肽的形貌结构与止血性能[J].蚕业科学,2015,41(2):354-360.
[12]朱丽兵,董立,韩素梅.丝素在医药卫生领域中的开发应用[J].泰山卫生,2001,25(6):33.
[13]S M in,X Gao,C Han,et al.Preparation of a silk fibroin spongy wounddressing and its therapeutic efficiency in skindefects[J].Journal of Biomaterials Science Polymer Edition,2012,23(1-4):97-110.
[14]A Vasconcelos,AC Gomes,A Cavaco-Paulo.Novel silk fibroin/elastin wounddressings[J].Acta Biomaterialia,2012,8(8):3049-3060.
[15]Z Gu,HX Xie,C Huang,et al.Preparation of chitosan/silk fibroin blending membrane fixed w ith alginatedialdehyde for wounddressing[J].International Journal of Biological Macromolecules,2013,58(7):121-126.
[16]张剑,窦懿,廖镇江.应用丝素膜真皮支架对创面愈合过程中成纤维细胞功能的影响[J].感染、炎症、修复,2015,16(4):195-198.
[17]R Okabayashi,M Nakamura,T Okabayashi,et al.Efficacy of polarized hydroxyapatite and silk fibroin composite dressing gel on epidermal recovery from full-thickness skin wounds[J].Journal of Biomedical Materials Research Part B Applied Biomaterials,2009,90(2):641-646.
[18]DH Roh,SY Kang,JY Kim,et al.Wound healing effect of silk fibroin /alginate-blended sponge in full thickness skindefect of rat[J].Journal of Materials Science Materials in Medicine,2006,17(6):547-552.
[19]HW Ju,OJ Lee,JM Lee,et al.Wound healing effect of electrospun silk fibroin nanomatrix in burn-model[J].International Journal of Biological Macromolecules,2016,85:29-39.
[20]SE Wharram,X Zhang,DL Kaplan,et al.Electrospun silk material systems for wound healing[J].Macromolecular Bioscience,2010,10(3):246-257.
[21]Cai Z X,Mo X M,Zhang K H,et al.Fabrication of chitosan/silk fibroin composite nanofibers for wound-dressing applications[J].International Journal of Molecular Sciences,2010,11(9):3529-3539.
[22]Schneider A,Wang X Y,Kaplan D L,et al.Biofunctionalized electrospun silk mats as a topical bioactivedressing for accelerated wound healing[J].Acta Biomaterialia,2009,5(7):2570-2578.
[23]Inpanya P,Faikrua A,Ounaroon A,et al.Effects of the blended fibroin /aloe gel film on wound healing in treptozotocin-induced diabetic rats [J].Biomed Mater,2012,7(3):35-38.
[24]许宗溥,杨明英,潘彩霞.等.丝素创伤敷料的制备与应用研究进展[J].蚕业科学,2015,41(2):376-380.
[25]孙浩,闫玉生,陈群清,等.丝素蛋白在小口径人工血管中的应用[J].中国组织工程研究,2014,18(16):2576-2581.
[26]施李杨,杨明英,NAM ITA Mandal,等.丝素蛋白生物材料在骨修复中的应用研究进展 [J].蚕业科学,2013,39(4):812-819.
[27]Guan G,Bai L,Zuo B,et al.Promoteddermis healing from full-thickness skindefect by porous silk fibroin scaffolds (PSFSs)[J].Bio-medical materials and engineering,2010,20(5):295-308.
[28]Uebersax L,Mattotti M,Papaloizos M,et al.Silk fibroin matrices for the controlled release of nerve grow th factor (NGF) [J].Biomaterial,2007,28 (30):4449-4460.
[29]朱晨辉,范代娣,马晓轩,等.类人胶原蛋白-丝素蛋白血管支架的制备及性能表征 [J].生物工程学报,2009,25(8):1225-1233.
[30]陈杰,文建川,史伟浩,等.丝素蛋白表面微观形貌对血管内皮细胞增殖功能的影响 [J].中国临床医学,2013,20(3):267-269.
[31]Yashi Jin,Banani Kundu,Yurong Cai,et al.Bio-inspired m ineralization of hydroxyapatite in 3D silk fibroin hydrogel for bone tissue engineering[J].Colloids and Surfaces B:Biointerfaces,2015,134:339-345.
[32]Bhardwaj N,Nguyen Q T,Chen A C,et al.Potential of 3-D tissue constructs engineered from bovine chondrocytes/silk fibroin-chitosan for in vitro cartilage tissue engineering[J].Biomaterials,2011,32(25):5773-5781.
[33]Sofia S,M cCarthy M B,Gronow icz G,et al.Functionalized silkbased biomaterials for bone formation[J].J Biomed Mater Res,2000,54(1):139-148.
[34]Meechaisue C,Wutticharoenmongkol P,Waraput R,et al.Preparation of electrospun silk fibroin fiber mats as bone scaffolds:a preliminary study[J].Biomed Mater,2007,2(3):181-188
[35]Zhang W J,Wang X L,Wang S Y,et al.The use of injectable sonication-induced silk hydrogel for VEGF165 and BMP-2delivery for elevation of the maxillary sinus floor[J].Biomaterials,2011,32(35):9415-9424
[36]Meinel L,Fajardo R,Hofmann S,et al.Silk implants for the healing of critical size bonedefects[J].Bone,2005,37(5):688-698
[37]Hua Liu,Guo Wei Xu,Ya Fei Wang,et al.Composite scaffolds of nano-hydroxyapatite and silk fibroin enhance mesenchymal stem cell-based bone regeneration via the interleukin 1 alpha autocrine/paracrine signaling loop[J].Biomaterials,2015,49:103-112
[38]Johanna Melke,Swati M idha,Sourabh Ghosh,et al.Silk fibroin as biomaterial for bone tissue engineering,Acta Biomaterialia,2016,31:1-16
[39]Xiaoyue Sheng,Linpeng Fan,Chuanglong He,et al.Vitam in E-loaded silk fibroin nanofibrous mats fabricated by green process for skin care application[J].International Journal of Biological Macromolecules,2013,56:49-56
[40]蔡江瑜,汪春阳,范存义.含丝素蛋白的神经导管在神经组织工程中的研究进展 [J].国际骨科学杂志,2015,36(6):394-396.
[41]Yun Gu,Jianbin Zhu,Chengbin Xue,et al.Chitosan/silk fibroin-based,Schwann cell-derived extracellular matrix-modified scaffolds for bridging rat sciatic nerve gaps[J].Biomaterials,2014,35:2253-2263.
[42]R.S.Kumar,S.Sundaresan,宫庆双.手术缝合线[J].国际纺织导报,2014,42(11):46-48.
[43]琢田益裕.蚕丝新利用[J].日本农林水产技术研究杂志,1991,14(11):3-28.
[44]王玉军,柳学广,徐世清.家蚕丝蛋白生物材料新功能的开发及应用[J].丝绸,2006(6):44-48+50.
[45]张雨青.家蚕丝素蛋白——一种天然的固定化酶载体[J].江苏蚕业,1999,21(2):1-4.
[46]Grasset L,Cordier D,Ville A.Woven silk as a carrier for the immobilization of enzyme[J].Biotech Bioeng,1977,19(4):611-618.
[47]Jyh-Ping Chen,Chang-Ho Yang.Lipase immobilized on silk fibroin nanofibrous membrane for flavor ester synthesis[J].Journal of Biotechnology,2008,136(4):394
[48]Fei W,Zhang Y Q.Chapter Eight–Bioconjugation of Silk Fibroin Nanoparticles w ith Enzyme and Peptide and Their Characterization[J].Advances in Protein Chemistry&Structural Biology,2015,98:263-91.
